Top-Fragen
Zeitleiste
Chat
Kontext
Nitrile
Organische Stoffgruppe mit dreifach gebundenem Stickstoffatom Aus Wikipedia, der freien Enzyklopädie
Remove ads
Nitrile sind eine Gruppe chemischer Verbindungen mit der allgemeinen Formel R–C≡N. Die charakteristische funktionelle Gruppe der Nitrile ist die Nitril- oder Cyanogruppe –C≡N. Die Stoffgruppe leitet sich vom Cyanwasserstoff (Blausäure, H–C≡N) ab. Ein Beispiel hierfür ist das Acetonitril, H3C–C≡N, bei dem R eine Methylgruppe ist.

Nitrile sind polare Verbindungen und können eine Vielzahl von Reaktionen eingehen, weshalb sie eine große Bedeutung in der chemischen Synthese haben, auch im industriellen Bereich. Typische Reaktionen sind die Umsetzung zu Carbonsäuren (Hydrolyse) und die Reduktion zu Aminen oder Aldehyden. Über das Stickstoffatom können Nitrile an Metallatome koordinieren und so Komplexe bilden. Hergestellt werden Nitrile oft durch Dehydratisierung (Wasserabspaltung) aus Carbonsäureamiden und Oximen oder durch die Einführung einer Cyanogruppe mit Cyanidsalzen wie Kaliumcyanid.
Nitrile kommen in vielen Pflanzen und Tieren natürlich vor. Eine besonders wichtige Gruppe sind die cyanogenen Glycoside, die Blausäure freisetzen können und für die Giftigkeit vieler Pflanzen verantwortlich sind, darunter Aprikosenkerne und Bittermandeln. Bei Tieren kommen Nitrile inklusive cyanogener Glycoside vor allem bei Insekten und Tausendfüßern vor und dienen oft der Verteidigung. Nitrile kommen auch bei Bakterien, Pilzen und im Weltraum vor.
Nitrile sind wichtige Intermediate und Reagenzien für die Chemie und kommen als Zwischenstufe bei der Strecker-Synthese von Aminosäuren vor. Verbindungen wie Methylmethacrylat und Adiponitril werden großtechnisch aus Cyanwasserstoff hergestellt. Wichtige industrielle Produkte, bei denen es sich um Nitrile handelt, sind Acrylfasern, Sekundenkleber, die oft auf Cyanacrylaten basieren, und Nitrilkautschuk, der für medizinische Handschuhe verwendet wird. Acetonitril ist ein wichtiges Lösungsmittel. Einige Nitrile werden als Duftstoffe und Schädlingsbekämpfungsmittel eingesetzt. Durch ihre charakteristischen physikalischen und geometrischen Eigenschaften spielt die Nitrilgruppe außerdem eine wichtige Rolle beim zielgerichteten Design pharmazeutischer Wirkstoffe.
Inwieweit Cyanwasserstoff selbst den Nitrilen zuzurechnen ist, ist umstritten. Zumindest formal lässt es sich als Nitril der Ameisensäure auffassen, andererseits ist es ein Grenzfall, was die Einordnung von Verbindungen in die organische oder anorganische Chemie anbelangt und wird oft als anorganisch betrachtet, während die Stoffgruppe der Nitrile klar der organischen Chemie angehört.
Remove ads
Geschichte
Zusammenfassung
Kontext

Die ersten Synthesen von Nitrilen stammen aus dem 19. Jahrhundert. Bereits im Jahr 1815 stellte Joseph Louis Gay-Lussac Dicyan unter Verwendung von Silbercyanid her.[1] 1832 synthetisierten Friedrich Wöhler und Justus von Liebig gezielt Benzoylcyanid aus Benzoylchlorid. Weiterhin erhielten sie durch Dehydratisierung von Benzamid mit Bariumoxid einen „ölartigen Körper mit süßlich aromatischem Geruch“,[2] der erst später den Namen Benzonitril erhielt. Zwei Jahre später stellte Théophile-Jules Pelouze zum ersten Mal Propionitril her und bediente sich dabei einer klassischen Substitutionsreaktion. Die Prägung des Begriffs Nitrile für die Verbindungsgruppe wird Hermann Fehling zugeschrieben, um das Jahr 1844.[3] 1903 untersuchte Arthur Lapworth die Bildung von Cyanhydrinen durch Addition von Blausäure an Aldehyde und Ketone und entdeckte, dass das eigentliche Nucleophil das Cyanid-Ion ist, sodass Zusatz einer Base die Reaktionsgeschwindigkeit erhöht. Dabei handelte es sich um eine der ersten Untersuchungen eines organischen Reaktionsmechanismus.[4][5]
Lange Zeit waren Nitrile von primär akademischem Interesse. Zwischen dem Ersten und Zweiten Weltkrieg nahm der Umfang der Forschung aber deutlich zu.[3] Bis in die zweite Hälfte des 20. Jahrhunderts wurden mehrere großtechnische industrielle Prozesse entwickelt, bei denen Nitrile hergestellt oder verwendet werden. Ein wichtiges Beispiel ist die Entwicklung von Nylon (Polyamid 6.6) in den 1930er-Jahren, da Adiponitril ein Schlüssel-Intermediat bei dessen Herstellung ist, das selbst wiederum durch Hydrocyanierung von Butadien mit Cyanwasserstoff hergestellt wird.[6][7] Acrylnitril-Polymere sind etwa seit den 1920er-Jahren bekannt, erlangten aber erst gegen Ende der 1940er-Jahre eine größere Bedeutung in der Verwendung als synthetische Fasern.[8] Sekundenkleber auf Basis von Cyanacrylaten gibt es ebenfalls seit Ende der 1940er-Jahre.[9]
Remove ads
Nomenklatur
Zusammenfassung
Kontext

nach IUPAC: Butannitril (blau markiertes C-Atom zählt zur Hauptkette),
formal auch Propancarbonitril (blau markiertes C-Atom zählt zum Substituenten)
Die funktionelle Gruppe der Nitrile mit der C≡N-Dreifachbindung wird als Nitril- oder Cyanogruppe bezeichnet.[10] Ist das Nitril die funktionelle Gruppe höchster Rangordnung, so wird die Endung -nitril an den Namen der Ausgangsverbindung angehängt. Das dreifach gebundene Kohlenstoffatom wird, wie immer, für die Benennung des Grundgerüsts mitgezählt.[11] Alternativ kann (analog zu -carbonsäure) die Endung -carbonitril verwendet werden, dann wird das Kohlenstoffatom nicht zum Grundgerüst gezählt.[12] Diese Endung muss verwendet werden, wenn die Nitrilgruppe an einen Ring gebunden ist (wie beim Cyclopentancarbonitril) oder wenn nicht alle Gruppen Teil des Grundgerüsts sind, was immer der Fall ist, wenn mehr als zwei Nitrilgruppen vorkommen, da diese nur am Kettenende stehen können.[13] Entsprechend ihrer Verwandtschaft mit den Carbonsäuren (der Nitrilkohlenstoff hat die gleiche Oxidationsstufe wie der Carboxylkohlenstoff) werden Trivialnamen oft aus dem Namen der Carbonsäuren mit der Endung -onitril abgeleitet (zum Beispiel Benzoesäure zu Benzonitril).[14] Ist die Nitrilfunktion nicht von höchster Rangordnung im Molekül, so wird die Vorsilbe Cyan- mit entsprechender Positionsbezeichnung verwendet. Auch hier wird das dreifach gebundene Kohlenstoffatom nicht zum Grundgerüst gezählt.[13]
Abgrenzung zu verwandten Verbindungen

Nitrile sind isomer zu Isocyaniden (Isonitrilen). Diese tragen ebenfalls eine C≡N-Dreifachbindung, allerdings ist der zugehörige Rest über das Stickstoffatom gebunden, weshalb es sich um Zwitterionen handelt.[15]
Verbindungen, bei denen an das Kohlenstoffatom einer C≡N-Gruppe ein Sauerstoffatom anschließt, werden als Cyanate bezeichnet.[16] Handelt es sich statt dem Sauerstoffatom um ein Schwefel- oder Selenatom, spricht man von Thiocyanaten und Selenocyanaten.[17][18] Ist die Cyanogruppe an ein Stickstoffatom gebunden, spricht man von einem Cyanamid.[19]
Neben den Nitrilen sind weitere Verbindungsklassen bekannt, die über C≡N-Dreifachbindung verfügen, wobei das Stickstoffatom eine vierte Bindung trägt, sodass es positiv geladen ist. Bei den Nitriloxiden ist zusätzlich ein Sauerstoffatom an das Stickstoffatom gebunden.[20] Handelt es sich stattdessen um ein Schwefel- oder um ein weiteres Stickstoffatom, spricht man von einem Nitrilsulfid oder einem Nitrilimid.[21][22] Ist das Stickstoffatom des Nitrils protoniert oder trägt einen weiteren organischen Rest, handelt es sich um ein Nitriliumion.[23] Trägt das Stickstoffatom einen organischen Rest mit einem negativ geladenen Kohlenstoffatom, handelt es sich um ein Nitril-Ylid, eine Form von Yliden.[24]
Remove ads
Vertreter und Eigenschaften
Zusammenfassung
Kontext
Beide Atome der Nitrilgruppe sind sp-hybridisiert. Die Struktur der Nitrilgruppe ähnelt der C≡C-Dreifachbindung in Ethinylgruppen.[14] Die C≡N-Dreifachbindung ist im Vergleich zu anderen Verbindungen kurz. Im Acetonitril und Propionitril beträgt die Bindungslänge beispielsweise jeweils knapp 116 pm während die daran anschließende C-C-Einfachbindung jeweils etwa 147 pm lang ist.[25] Durch die Elektronegativitätsdifferenz zwischen Kohlenstoff und Stickstoff weisen Nitrile ein erhebliches Dipolmoment auf. Aus dem gleichen Grund liegen ihre Siedepunkte etwa 60 °C höher als die von Alkinen analoger Struktur oder vergleichbarer Molmasse.[26] Nitrile sind allgemein gute Lösungsmittel sowohl für polare als auch für unpolare Stoffe. Acetonitril und Propionitril sind mit Wasser mischbar, bei den längeren aliphatischen Nitrilen nimmt die Wasserlöslichkeit aber deutlich ab.[27]
Acidität
Durch die stark elektronenziehenden Eigenschaften der Nitrilgruppe weisen die Verbindungen eine relevante CH-Acidität auf und können in α-Position (am Kohlenstoffatom neben der Nitrilgruppe) vergleichsweise leicht deprotoniert werden.[28] Neben der Elektronegativität des Stickstoffs spielt auch die Delokalisierung von Elektronen durch Mesomerie eine Rolle. So kann für ein α-deprotoniertes Nitril eine Grenzformel formuliert werden, bei der die negative Ladung auf dem Stickstoff liegt.[29] Malonitril mit zwei Nitrilgruppen hat einen pKs-Wert von etwa 11.[30] Cyanoform mit drei Nitrilgruppen gehört mit einem pKs-Wert von −5,1 zu den stärksten organischen Säuren überhaupt[31] und ist saurer als Schwefelsäure (pKs-Wert −3,0) oder Salpetersäure (pKs-Wert −1,5).[32] Weitere Beispiele für Nitrile mit sehr niedrigem pKs-Wert sind die Cyanoderivate von Cyclopentadien, so hat Pentacyanocyclopentadien einen geschätzten pKs-Wert von −11.[33]
Spektroskopische Eigenschaften
In der IR-Spektroskopie tritt durch die Streckschwingung der C≡N-Dreifachbindung eine deutliche Bande bei einer Wellenzahl von etwa 2250 cm−1 auf. Ist die Nitrilgruppe mit einer Alkendoppelbindung konjugiert, tritt die Bande bei etwa 2225 cm−1 auf. Ist die Nitrilgruppe an einen aromatischen Ring gebunden, liegt die Bande meist zwischen den beiden Werten.[34] Im 1H-NMR treten Protonen, die α zur Nitrilgruppe stehen bei etwa 2 ppm (1,98 ppm in Acetonitril) auf, bei einer ähnlichen Verschiebung wie Protonen, die α zu anderen Carbonsäurederivaten stehen (Carbonsäure oder Carbonsäureamid). Das Kohlenstoffatom der Nitrilfunktion tritt im 13C-NMR bei etwa 112–126 ppm auf.[14]
Vertreter
Eine Auswahl einfacher Nitrile ist in der folgenden Tabelle mit Schmelz- und Siedepunkten angegeben. Das einfachste Nitril ist Acetonitril. Die Alkannitrile mit bis zu vierzehn Kohlenstoffatomen, das heißt bis einschließlich Tetradecannitril, sind alle bei Raumtemperatur flüssig.[27] Das Gleiche gilt auch für das einfachste α,β-ungesättigte Nitril, Acrylnitril und das einfachste aromatische Nitril, Benzonitril. Die einfachsten Dinitrile sind Dicyan und Malonitril. Acetoncyanhydrin ist ein wichtiger Vertreter der Cyanhydrine. Im Vergleich dazu ist Cyanwasserstoff leicht flüchtig, da sein Siedepunkt etwa bei Raumtemperatur (26 °C) liegt.[35]
Toxikologie
Die Aufnahme von Cyanwasserstoff führt selbst bei kleinen Mengen leicht zur Cyanidvergiftung.[45] Für die Toxizität vieler Nitrile spielt die Freisetzung von Cyanwasserstoff eine Rolle, sie ist jedoch nicht allein dafür verantwortlich.[27][46] Aliphatische Nitrile können beim Einatmen über die Lunge aufgenommen werden und sie durchdringen Haut und Schleimhäute.[27] Malonitril setzt im Metabolismus besonders viel Cyanwasserstoff frei, Acetonitril besonders wenig. Malonitril kann außerdem, ebenso wie das Cyanidion, die Cytochrom-c-Oxidase hemmen. Bei ungesättigten Nitrilen wie Allylcyanid und Acrylnitril steht eine cholinerge Symptomatik im Vordergrund. Während bei ihnen die Freisetzung von Cyanwasserstoff nur eine untergeordnete Rolle spielt, vermögen sie mit Thiolgruppen, wie sie in Proteinen des Körpergewebes vorkommen, zu reagieren und dadurch gesundheitsschädliche Auswirkungen zu zeitigen.[46] Viele Nitrile verursachen neurologische Symptome, die vermutlich auf die Freisetzung von Cyanwasserstoff zurückzuführen sind. Weitere Symptome, die vermutlich nicht mit der HCN-Freisetzung zusammenhängen, sind Reizungen von Atemwegen und Verdauungstrakt, Übelkeit sowie Leber- und Nierenschäden.[27]
Während die Freisetzung von Cyanwasserstoff bei den meisten Nitrilen von untergeordneter Bedeutung ist, basiert die Giftigkeit der cyanogenen Glycoside direkt auf der Bildung von Cyanwasserstoff beziehungsweise Cyanid. Diese sind auch für die mögliche Giftigkeit verschiedener Speisepflanzen verantwortlich, darunter Maniok, Aprikosenkerne und Leinsamen.[47] Cyanid als Anion des Cyanwasserstoffs bindet in den Mitochondrien an Eisen-Cofactoren der Cytochrom-c-Oxidase, was den Sauerstoff-Umsatz und die ATP-Produktion in den Zellen verhindert, unabhängig von der Verfügbarkeit von Sauerstoff. Dies führt zunächst zu Symptomen wie erhöhtem Blutdruck, Hyperventilation, Herzrasen und Kopfschmerzen und schließlich zu Stupor, Krämpfen und Atemstillstand.[45]
Remove ads
Vorkommen
Zusammenfassung
Kontext
Schon in den 90er-Jahren waren über 100 natürlich vorkommende Nitrile bekannt,[48] inzwischen sind mehrere hundert bekannt.[49] Die Verbindungen kommen in Bakterien, Pilzen, Pflanzen sowie Gliederfüßern und Schwämmen vor.[48][49] Die Biosynthese natürlich vorkommender Nitrile geht oft von Aminosäuren aus. Deren N-Hydroxylierung und Decarboxylierung (Abspaltung der Carbonsäuregruppe als Kohlenstoffdioxid) ergibt Aldoxime, die die direkten Vorläufer der Nitrile sind.[48]
Vorkommen in Pflanzen
Viele Nitrile kommen als Sekundärmetaboliten in Pflanzen vor.
Im Wunderbaum (Ricinus communis) kommt neben dem hochgiftigen Protein Ricin auch das Alkaloid Ricinin vor, das eine Nitrilfunktion trägt.[50] Das strukturell eng verwandte Nudiflorin kommt in Trevia nudiflora (Familie Wolfsmilchgewächse) vor.[51] In braunem Senf kommt Indolacetonitril vor, das aus Indolacetaldoxim gebildet wird und vermutlich zur Verteidigung gegen pathogene Pilze dient.[52] In Jojoba kommt neben anderen Nitrilen Simmondsin vor, ein Glycosid mit einem α,β-ungesättigten Nitril im Aglycon.[53] Eine ähnliche Verbindung, das Menisdaurin, kommt in der Gewöhnlichen Stechpalme (Ilex aquifolium) vor.[54] Auch in mehreren Arten der Gattung Acacia kommen α,β-ungesättigte Nitrile vor, darunter das Sutherlandin und das Acacipetalin.[55][56] Im Meerrettichbaum (Moringa oleifera) kommt Niazirin vor, ein Glycosid von 4-Hydroxyphenylacetonitril.[57] Die Duftende Platterbse (Lathyrus odoratus) verursacht die Krankheit Lathyrismus, wofür N-Glutamyl-3-aminopropionitril[S 1] und sein Abbauprodukt 3-Aminopropionitril verantwortlich sind.[58][59] Das ätherische Öl von Heracleum transcaucasicum (Gattung Bärenklau) enthält Geranylnitril.[60] Pyridin-3-carbonitril kommt im Einjährigen Bingelkraut vor.[61] Cyanolipide sind eine Klasse von Lipiden, die ausschließlich in Seifenbaumgewächsen (Sapindaceae) vorkommen. Die Alkoholkomponente ist bei diesen ein ungesättigtes Nitril mit fünf Kohlenstoffatomen und ein oder zwei Hydroxygruppen, im Gegensatz zum Glycerin in den Glyceriden. Zu den Seifenbaumgewächsen, die Cyanolipide enthalten, gehören Waschnussbaum und Guaraná.[62][63] Cyanwasserstoff wird von vielen Pflanzen freigesetzt, die entsprechende cyanogene Verbindungen enthalten, vor allem cyanogene Glycoside und Cyanolipide.[64] In Pflanzen wirkt Cyanwasserstoff auch als Signalmolekül.[65]
- Ricinuspflanze
- Ricinin
- Guaraná, ein Seifenbaumgewächs, enthält Cyanolipide
- Eine Alkoholkomponente von Cyanolipiden, die zum Beispiel in Guaraná vorkommt
Nitrile aus Glucosinolaten in Kreuzblütlern
Eine Gruppe von Naturstoffen, die als Vorläufer von Nitrilen auftreten, sind die Glucosinolate (Senfölglycoside), die ähnlich wie bei der direkten Biosynthese von Nitrilen über ein Aldoxim gebildet werden.[48] Die Glucosinolate sind eine wichtige Gruppe von Sekundärmetaboliten, die Pflanzen der Familie der Kreuzblütler (Brassicaceae) zur Verteidigung gegen Fressfeinde und Mikroorganismen dienen. Glucosinolate werden durch Myrosinase im Normalfall zu Isothiocyanaten abgebaut; in Gegenwart eines zusätzlichen Proteins (epithio specifier protein) jedoch unter anderem zu Nitrilen.[66][67] Sinigrin kommt vor allem in Meerrettich, Wasabi und braunem Senf vor, aber auch in Kopfkohl, Grünkohl, Blumenkohl und Rosenkohl, und wird neben Allylisothiocyanat unter anderem zu Allylcyanid (3-Butennitril) abgebaut.[68][69] Glucotropaeolin, das in Gartenkresse vorkommt, wird unter anderem zu Phenylacetonitril abgebaut, Gluconasturtiin, das in Brunnenkresse vorkommt, unter anderem zu Phenylpropionitril.[70] Sinalbin, das in Pfeilkresse vorkommt, kann analog zu 4-Hydroxyphenylacetonitril abgebaut werden.[71]
- Brunnenkresse
- Struktur des Gluconasturtiins
- Struktur des Phenylpropionitrils
Cyanhydrine und cyanogene Glycoside
Cyanhydrine und deren Glycoside, die als cyanogene Glycoside bezeichnet werden, sind in der Natur weitverbreitet und kommen in mehreren Tausend Pflanzenarten vor.[5][49] Über einhundert natürlich vorkommende cyanogene Glycoside sind bekannt.[49] Cyanogene Glycoside dienen Pflanzen zur Verteidigung, aber möglicherweise auch als Speicherform für Stickstoff. Sie werden ausgehend von einer kleinen Zahl Aminosäuren und diversen Zuckern gebildet.[5] Bei Beschädigung der Pflanze kommen die Glycoside mit Enzymen (β-Glucosidasen und α-Hydroxynitrillyasen) in Kontakt, die zuerst das Aglycon (ein Cyanhydrin) freisetzen und dieses dann zu einer Carbonylverbindung und giftiger Blausäure abbauen. Amygdalin ist ein Glycosid des Mandelonitrils und eines der am weitesten verbreiteten cyanogenen Glycoside und kommt insbesondere in den Samen der Rosengewächse (Rosaceae) vor, darunter Apfel, Aprikose, Pfirsich, Pflaume, Kirsche und Mandel.[72] Während Amygdalin nur in Kernen von Pfirsichen vorkommt, enthalten die sonstigen Teile der Pflanze vorwiegend Prunasin.[73] Prunasin ist ebenfalls ein Glycosid des Mandelonitrils, allerdings ist die Zuckereinheit ein Monosaccharid (kein Disaccharid wie bei Amygdalin). Prunasin kommt als biosynthetischer Vorläufer von Amygdalin in Mandeln und Bittermandeln vor.[74] Prunasin kommt außerdem in Kirschlorbeer vor.[75] In Passionsfrüchten kommen Prunasin und Sambunigrin sowie einige andere cyanogene Glycoside vor; in Papaya hauptsächlich Prunasin.[76][77] Sambunigrin, ebenfalls ein Glycosid von Mandelonitril, kommt auch in mehreren Arten der Gattung Holunder (Sambucus) vor, unter anderem im Schwarzen Holunder und im Kanadischen Holunder,[78][79] sowie in Ximenia americana.[80] Vicianin, ein weiteres Glycosid des Mandelonitrils, kommt in Farnen der Gattung Davellia (Familie Davelliaceae) vor.[81] Dhurrin ist ein cyanogenes Glycosid des 4-Hydroxymandelonitrils, das in Sorghumhirse und anderen Arten der Gattung Sorghum vorkommt, darunter in Sorghum halepense.[82][83] Linamarin (mit dem Aglycon Acetoncyanhydrin) und Lotaustralin (mit dem Agylcon Butanoncyanhydrin) treten in den Gattungen Linum (zum Beispiel in Flachs) und Lotus sowie in der Gartenbohne gemeinsam auf.[84] Auch in Maniok kommen beide Verbindungen vor.[85] In der Mistelart Loranthus micranthus (Gattung Loranthus) kommt Linamaringallat vor, ein Derivat bei dem Linamarin zusätzlich mit Gallussäure verestert ist.[86] Der Kautschukbaum enthält ebenfalls Linamarin und Studien haben ergeben, dass die Verbindung in diesem Fall wahrscheinlich auch eine wichtige Speichersubstanz ist und nicht nur der Verteidigung dient. Die Samen enthalten besonders große Mengen der Verbindung, die bei der Entwicklung der Keimlinge umgewandelt wird, ohne dass Blausäure freigesetzt wird, was darauf hindeutet, dass das Linamarin für andere biosynthetische Prozesse verwendet wird.[87]
- Pfirsichbaum
- Struktur des Amygdalins
- Struktur des Prunasins
- Mandelonitril, das Aglycon von Amygdalin und Prunasin
Vorkommen in Tieren
In vielen Gliederfüßern (Arthropoda) kommen cyanogene (Blausäure freisetzende) Nitrilverbindungen vor, unter anderem in Hundertfüßern (Chilopoda), Doppelfüßern (Diplopoda), Schnabelkerfen (Hemiptera), Käfern (Coleoptera) und Schmetterlingen (Lepidoptera).[88] Im Stachelbeerspanner (Abraxas grossulariata) kommt ein nitrilhaltiges Glycosid, Sarmentosin, vor, das vermutlich der Verteidigung dient.[89] Sarmentosin kommt außerdem in mehreren Arten der Gattung Parnassius vor.[90] Mehrere Arten der Glasflügelwanzen (unter anderem Jadera haematoloma) enthalten Cyanolipide beziehungsweise Cardiospermin, die sie möglicherweise aus ihren Nahrungspflanzen sequestrieren, das heißt aufnehmen und einlagern.[88][91][92] Sechsfleck-Widderchen sind Schmetterlinge, die die cyanogenen Glycoside Linamarin und Lotaustralin sowohl aus ihren Nahrungspflanzen sequestrieren als auch selbst synthetisieren können.[93] Auch andere Arten aus der gleichen Gattung (Zygaena) wie das Sumpfhornklee-Widderchen enthalten cyanogene Glycoside.[94] Das Wehrsekret des Hundertfüßers Himantarium gabrielis enthält Benzoylcyanid, Phenylacetonitril, Mandelonitril (Benzaldehydcyanhydrin) und Mandelonitrilbenzoat.[95] Phenylacetonitril kommt auch als Hormon bei der Wüstenheuschrecke (Schistocerca gregaria) vor.[96] Bei verschiedenen Bandfüßern (Polydesmida) enthält das Wehrsekret ebenfalls Benzoylcyanid.[97] In der Milbenart Oribatula tibialis (Ordnung Hornmilben, Oribatida) kommt Mandelonitrilhexanoat vor.[98] Als Abbauprodukt der cyanogenen Verbindungen kommt in Gliederfüßern auch Cyanwasserstoff vor.[65]
- Stachelbeerspanner
- Wüstenheuschrecke
- Himantarium gabrielis
- Benzoylcyanid kommt in den Wehrsekreten verschiedener Arthropoda vor
Neben den Arthropoda enthalten auch Meerestiere Nitrilverbindungen. Dazu gehören das Bursatellin aus Seehasen der Gattung Bursatella[99] und die aus Schwämmen isolierten Calyculine.[100] Bei den Albanitrilen aus Schwämmen der Gattung Mycale handelt es sich um lineare Verbindungen (Kettenlänge 16 bis 18), die an einem oder beiden Enden eine Nitrilfunktion und zusätzlich mehrere C≡C-Dreifachbindungen aufweisen.[101]
Vorkommen in Pilzen
Viele Pilze bilden Cyanwasserstoff aus Glycin. Dazu gehören Vertreter der Gattungen Trichterlinge (Clitocybe), Schwindlinge (Marasmius), Stielporlinge (Polyporus) und Ritterlinge (Tricholoma).[102] Die Epurpurine sind eine Gruppe gelber Phenolfarbstoffe, die jeweils zwei Nitrilgruppen tragen und in Emericella purpurea vorkommen.[103] Diatretin II kommt im Fleischfalben Trichterling (Clitocybe diatreta)[104] und dem violetten Rötelritterling vor.[105] Im Nelken-Schwindling kommt das Cyanhydrin der Glyoxalsäure vor, das aus zwei Molekülen Glycin gebildet wird und bei Beschädigung des Pilzes Blausäure freisetzt.[106]
Vorkommen in Bakterien
Cyanwasserstoff wird von diversen Bodenbakterien gebildet, darunter Cyanobakterien und Vertreter der Gattungen Aeromonas, Bacillus und Pseudomonas. Die Biosynthese erfolgt ausgehend von Glycin.[107] Aus Pseudomonas veronii wurde eine Gruppen von Alkannitrilen isoliert: Dodecannitril, Tridecannitril, Tetradecannitril, Pentadecannitril und Hexadecannitril, außerdem Verbindungen mit ähnlicher Kettenlänge, die aber eine Doppelbindung aufweisen. Aus Micromonospora echinospora wurden ebenfalls Verbindungen mit ähnlicher Kettenlänge isoliert, die aber eine Methylverzweigung am Kettenende, eine Doppelbindung, oder beides aufweisen.[108] Aus Streptomyces regensis ist ein Cyanhydrin bekannt, das zusätzlich eine Phosphonsäuregruppe aufweist.[109] Das Aethokthonotoxin aus dem Cyanobakterium Aetokthonos hydrillicola ist ein bromiertes Indolderivat, das zusätzlich eine Nitrilgruppe trägt. Es ist ein Neurotoxin, das oft zum Tod von Weißkopfseeadlern führt, die es über die Nahrung aufnehmen.[110]
Vorkommen im Weltall
Nitrile gehören zu den häufigsten organischen Molekülen im Weltall und mehr als zehn Verbindungen wurden eindeutig nachgewiesen.[111] Cyanwasserstoff war eine der ersten mehratomigen Spezies, die im Weltall nachgewiesen wurde und kommt dort vergleichsweise häufig und in größeren Mengen vor.[112] Zu den im Weltall nachgewiesenen Nitrilen gehören außerdem Acetonitril und Aminoacetonitril,[111] sowie Isobutyronitril,[113] Cyanoacetylen und Cyanopolyine mit zwei bis fünf konjugierten Dreifachbindungen.[114] In der Atmosphäre des Saturnmondes Titan kommen Cyanwasserstoff, Cyanoacetylen und Dicyan vor.[115]
Bedeutung für die Entstehung des Lebens
Nitrile spielten möglicherweise eine wichtige Rolle bei der Entstehung des Lebens auf der Erde.[116][115] In mehreren Experimenten konnte gezeigt werden, dass es viele mögliche Umgebungsbedingungen gibt unter denen Cyanwasserstoff entstehen kann. Ausgangsprodukte können Gasgemische aus Methan, Kohlenstoffdioxid, Stickstoff, Ammoniak und/oder Wasserstoff sein. Denkbar sind außerdem verschiedene Formen einer Energiezufuhr wie elektrische Entladungen oder UV-Strahlung. Aus Cyanwasserstoff wiederum bilden sich unter einfachen Bedingungen weitere Moleküle.[117] So werden Cyanwasserstoff und andere Nitrile wie Cyanoacetylen und Dicyan als Vorläufer der Nukleinbasen vermutet.[115][117] Aminonitrile wiederum sind wahrscheinliche Vorläufer der Aminosäuren und Peptide, zum Beispiel Aminoacetonitril von Glycin. Hierbei wird ein Prozess analog zur Strecker-Synthese vermutet, sodass sich zunächst aus Cyanid, Acetaldehyd und Ammoniak das α-Aminopropionitril bilden könnte, das anschließend zu Alanin hydrolysiert wird.[116][118][119]
Remove ads
Herstellung
Zusammenfassung
Kontext
Für die Herstellung von Nitrilen existiert eine große Anzahl an Methoden. Dazu gehören die Kolbe-Nitril-Synthese, die Dehydratisierung von Carbonsäureamiden und Aldoximen und die Oxidation primärer Amine.
Additions- und Substitutionsreaktionen mit Cyanidgruppen
Ein mögliches Herstellungsverfahren für Nitrile ist die Kolbe-Nitrilsynthese. Dabei entsteht in einer Substitutionsreaktion aus einem reaktionsfähigen Alkylhalogenid und einem Alkalicyanid (Natriumcyanid oder Kaliumcyanid) das Alkannitril und ein Alkalihalogenid. Die Reaktion eignet sich besonders gut zur Umsetzung primärer sowie allylischer und benzylischer Halogenide. Sekundäre Alkylhalogenide liefern schlechtere Ausbeuten, tertiäre reagieren stattdessen nur durch Eliminierung. Neben Halogeniden können auch andere Edukte mit guten Abgangsgruppen verwendet werden. Silbercyanid ist im Gegensatz zu Alkalicyaniden zur Herstellung von Nitrilen nicht als Reagenz geeignet, da mit diesem vorzugsweise Isonitrile gebildet werden.[120] Ein Beispiel für eine Kolbe-Nitrilsynthese ist die Reaktion von Methyliodid mit Natriumcyanid zu Acetonitril und Natriumiodid:[121]
Analog kann 1,3-Dibrompropan mit Natriumcyanid zu Pentandinitril umgesetzt werden[122] oder 1-Iodoctan mit Kaliumcyanid zu Nonannitril.[123] Mit Cyanwasserstoff / Triethylaluminium oder mit Diethylaluminiumcyanid können ebenfalls Cyanierungen durchgeführt werden, beispielsweise die Ringöffnung eines Epoxids zu einem β-Cyanhydrin oder die 1,4-Addition von Cyanid an ein Enon.[124][125] Trimethylsilylcyanid ist ein weiteres Cyanierungsreagenz mit dem Epoxide zu β-Cyanhydrinen geöffnet werden können. Dabei wird das Sauerstoffatom silyliert.[126] Mit Trimethylsilylcyanid gelingt außerdem die Substitution tertiärer Alkylhalogenide, die mit der Kolbe-Nitril-Synthese nicht möglich ist.[120]
Mit geeigneten Übergangsmetallkatalysatoren kann in einer Hydrocyanierung Cyanwasserstoff an die Mehrfachbindungen von Alkenen und Alkinen addiert werden, wodurch Nitrile erhalten werden. Hierzu werden meist Nickelkatalysatoren verwendet. Eine direkte Verwendung von Cyanwasserstoff ist oft nicht nötig, stattdessen eignen sich auch Syntheseäquivalente wie Acetoncyanhydrin oder Isovaleronitril.[127] Ein wichtiger industrieller Prozess ist außerdem die Hydrocyanierung von Butadien zu Adiponitril.[7]
Dehydratisierungsreaktionen

Carbonsäureamide und Aldoxime können durch Dehydratisierung (Abspaltung eines Wassermoleküls) zu Nitrilen umgesetzt werden, wofür eine große Zahl an Reagenzien und Methoden bekannt ist.[128][129][130] Auch für die Herstellung von Nitrilen durch die Dehydratisierung von Nitroalkanen sind Methoden bekannt.[131]
Ein Reagenz für die Dehydratisierung von Carbonsäureamiden, das schon Mitte des 19. Jahrhunderts bekannt war, ist Phosphorpentoxid.[128] Amide können außerdem durch Umsetzung mit dreiwertigen Phosphorreagenzien wie Phosphortrichlorid oder Triphenylphosphit dehydratisiert werden;[130] sowie mit Diethylchlorphosphat,[132] Thionylchlorid[133] oder Phosgen.[134] Bei Einsatz bestimmter Palladium-Komplexe oder eines anderen geeigneten Katalysators kann Acetonitril als Dehydratisierungsreagenz wirken, um ein Amid in ein Nitril zu überführen, wobei es selbst zu Acetamid reagiert. Analog kann auch Dichloracetonitril verwendet werden.[135][136] Ähnliche Methoden verwenden Eisen(II)-chlorid-Tetrahydrat, Zinktriflat oder Uranylnitrat-Hexahydrat als Katalysator und N-Methyl-N-trimethylsilyltrifluoracetamid als Dehydratisierungsreagenz.[137][138][139] Auch mittels eines Reaktionssystems aus Triphenylphosphin, Iod und N-Methylmorpholin können Carbonsäureamide dehydriert werden.[140] Eine weitere Methode stellt die Dehydratisierung bei hohen Temperaturen (220–240 °C) in Hexamethylphosphorsäuretrisamid (HMPT) dar.[141] Die Dehydratisierung von primären Amiden mit Zinkchlorid unter Einwirkung von Mikrowellen ist umkehrbar. In wässrigem Acetonitril kann ein Amid zum Nitril umgesetzt werden. In einem Wasser-THF-System mit Zusatz von Acetamid läuft hingegen die umgekehrte Reaktion von Nitril zu Amid ab.[142]
Sowohl Carbonsäureamide als auch Aldoxime können durch Umsetzung mit Aluminiumchlorid und Natriumiodid in Acetonitril dehydratisiert werden.[129] Ebenso können beide Verbindungsklassen mit Oxalylchlorid und einer katalytischen Menge Dimethylsulfoxid dehydratisiert werden, in einer Reaktion, die ähnlich einer Swern-Oxidation abläuft.[143] Auch die Umsetzung zu Nitrilen unter Katalyse mit siebenwertigem Rhenium (Perrheniumsäure oder Trimethylsilylperrhenat) gelingt sowohl mit Amiden als auch mit Aldoximen. Als Nebenprodukt anfallendes Wasser kann durch azeotrope Destillation entfernt werden.[144]
Aldoxime können außerdem mit Cyanurchlorid dehydratisiert werden,[145] mit dem Burgess-Reagenz,[146] sowie mit einer Kombination von Trifluormethansulfonsäureanhydrid und Triphenylphosphin, wobei letzteres zu Triphenylphosphinoxid oxidiert wird.[147] Auch eine katalytische Dehydrierung ist möglich, beispielsweise mit Eisen(III)-triflat,[148][S 2] mit Kupfer(II)-acetat,[149] mit einem gemischten Hydroxid von Zinn und Wolfram[150] oder mit einem bimetallischen Palladium-Mangan-Katalysator.[151] Schließlich ist auch die enzymatische Dehydratisierung von Aldoximen mit Aldoxim-Dehydratasen möglich. Dabei handelt es sich um Enzyme, die in Bakterien vorkommen, darunter Pseudomonas chlororaphis, und die schon verschiedentlich zur Synthese von Nitrilen verwendet wurden.[152]
Herstellung aus Aldehyden und Ketonen

Aldehyde können mit Hydroxylaminhydrochlorid in Oxime überführt und dann weiter zu Nitrilen dehydratisiert werden (beispielsweise mit Oxalylchlorid).[153] Auch direkte Umsetzungen von Aldehyden zu Nitrilen sind bekannt, möglich ist dies mittel Hydroxylamin-O-sulfonsäure[154] oder O-(4-Trifluormethylbenzoyl)hydroxylamin.[155][S 3] Eine solche Umsetzung ist auch mit Hydroxylamin möglich, wenn Titan(IV)-chlorid oder ein gemischtes Hydroxid von Zinn und Wolfram als Katalysator verwendet wird[150][156] oder wenn Sulfurylfluorid oder Selenoxid als zusätzliches Reagenz verwendet wird.[157][158] Tosylmethylisocyanid (auch Van-Leusen-Reagenz genannt) ermöglicht die direkte Umwandlung eines Ketons in ein Nitril, was als Van-Leusen-Reaktion bezeichnet wird. Dabei wird die gesamte Nitrilgruppe und damit auch ein zusätzliches Kohlenstoffatom eingeführt.[159][160][161]
Herstellung aus Aminen

Primäre Amine (R-CH2-NH2) können mittels verschiedener Methoden zu Nitrilen oxidiert werden. Es sind mehrere Verfahren bekannt, die Nitroxylradikale wie TEMPO und dessen Derivat 4-Acetamido-TEMPO als katalytisches Oxidationsmittel verwenden. Diese können durch Oxone als stöchiometrisches Oxidationsmittel regeneriert werden oder elektrochemisch durch Anlegen einer Spannung.[162][163] Eine andere Methode verwendet Kupfer(I)-chlorid oder Kupfer(II)-chlorid als Katalysator, Sauerstoff als stöchiometrisches Oxidationsmittel und zusätzlich ein Molsieb zum Abfangen des entstehenden Wassers.[164]
Ammoxidation
Die Ammoxidation ist eine heterogen katalysierte Gasphasenreaktion, in der aliphatische Verbindungen oder methylsubstituierte aromatische Verbindungen durch Umsetzung mit Sauerstoff (Luft) und Ammoniak zu Nitrilen umgesetzt werden, wobei Wasser als Nebenprodukt anfällt. Die Prozesstemperatur beträgt über 300 °C, als Katalysatoren kommen Oxide von Vanadium, Chrom oder Molybdän zum Einsatz.[165] Acrylnitril, ein wichtiger Ausgangsstoff zur Herstellung von Polymeren (siehe Abschnitt Verwendung), wird überwiegend durch Ammoxidation von Propylen hergestellt.[8] Das wichtigste Herstellungsverfahren für Cyanwasserstoff ist der Andrussow-Prozess, das heißt die Ammoxidation von Methan mit einem Platin-Katalysator. Eine erhebliche Menge des weltweit verwendeten Cyanwasserstoffs fällt allerdings auch bei der Herstellung von Acrylnitril als Nebenprodukt an.[166]
Sonstige Herstellungsverfahren
Durch die Carbocyanierung kann ein Nitril an eine Mehrfachbindung addiert werden, wobei ein weiteres Nitril erhalten wird. Arylnitrile können unter Katalyse mit Bis(cyclooctadien)nickel(0) und Trimethylphosphin an Alkine addiert werden, wodurch α,β-ungesättigte Nitrile erhalten werden. Mit gewissen Änderungen an den Reaktionsbedingungen wie der Verwendung eines anderen Phosphins oder Zusatz einer Lewis-Säure wie Trimethylaluminium oder Triphenylboran, können auch nichtaromatische Nitrile addiert werden, sowohl gesättigte als auch α,β-ungesättigte.[167] Es sind auch Carbocyanierungen bekannt, bei denen zwei Moleküle verbunden werden und zusätzlich eine Nitrilgruppe eingeführt wird. Dies funktioniert durch Einsatz von Hexabutyldistannan sowie von Tosylcyanid als Quelle der Cyanidgruppe.[168]
Carbonsäuren können durch Umsetzung mit Indium(III)-chlorid in Acetonitril bei 200 °C in die entsprechenden Nitrile überführt werden. Dabei wirkt Acetonitril sowohl als Lösungsmittel als auch als Quelle für Stickstoffatome und wird bei der Reaktion zu Essigsäure umgesetzt. Die Reaktion verläuft über mehrere Mumm-Umlagerungen.[169] Alkohole können durch eine Mitsunobu-Reaktion in Nitrile überführt werden. Dazu kann Cyanomethylidentrimethylphosphoran in Gegenwart von Acetoncyanhydrin verwendet werden.[170] N-Alkylamide können im Von-Braun-Abbau durch Umsetzung mit Phosphorpentachlorid in Nitrile umgewandelt werden.[171] Alternative Reagenzien sind Phosphorpentabromid und Carbonylbromid.[172]
Herstellung von aromatischen Nitrilen

Die Herstellung von Arylnitrilen gelingt unter anderem durch die Sandmeyer-Reaktion von Aryldiazoniumsalzen mit Kupfer(I)-cyanid)[173] und durch die Rosenmund-von Braun-Reaktion (direkte Umsetzung eines Arylbromids mit Kupfer(I)-cyanid).[174] Umsetzung von Metallthiocyanaten mit aromatischen Carbonsäuren wird als Letts-Nitrilsynthese bezeichnet. Dafür kann Kaliumthiocyanat verwendet werden, aber Bleithiocyanat ergibt bessere Ergebnisse.[3]
Aryliodide können unter Palladiumkatalyse mit Trimethylsilylcyanid zu aromatischen Nitrilen umgesetzt werden. So ergibt die Reaktion von Iodbenzol mit Trimethylsilylcyanid und Tetrakis(triphenylphosphin)palladium(0) (Pd(PPh3)4) als Produkt Benzonitril.[175] Eine weitere Synthesemöglichkeit, die ebenfalls auf Palladiumkatalyse beruht (auch hierfür kann Pd(PPh3)4 eingesetzt werden) ist die Decarbonylierung aromatischer Acylcyanide.[176] Auch die palladiumkatalysierte Cyanierung von Arylchloriden mit Kaliumcyanid[177] oder Kaliumhexacyanidoferrat(II)[178] ist bekannt. Chinone können mit Trimethylsilylcyanid zu silylierten Cyanhydrinen umgesetzt werden und anschließend mit Phosphortribromid aromatisiert werden.[179] Eine weitere mögliche Synthese von Arylnitrilen ist die Umsetzung von Arylgrignard-Verbindungen oder Aryllithium-Verbindungen mit Dimethylmalonitril.[180]
Herstellung von Cyanhydrinen

Cyanhydrine können durch Addition eines Alkalicyanids an einen Aldehyd oder ein Keton in Gegenwart von Essigsäure hergestellt werden. Für Substrate, die nach dieser Methode nicht reagieren, eignet sich Diethylaluminiumcyanid als Alternative. Eine andere Methode ist die Transhydrocyanierung, bei der Cyanwasserstoff von Acetoncyanhydrin auf ein Aldehyd oder Keton übertragen wird.[5] Als Katalysatoren für letztere Reaktion eignen sich Alkoholate von Lanthaniden wie Lanthan(III)-isopropanolat,[S 4] Cer(III)-isopropanolat,[S 5] Samarium(III)-isopropanolat[S 6] und Ytterbium(III)-isopropanolat.[181][S 7]
Bei der Addition von Trimethylsilylcyanid an Ketone oder Aldehyde entstehen Cyanhydrine als Trimethylsilylether.[182][183] Als Katalysatoren eignen sich Zinkiodid, Kaliumcyanid mit [18]Krone-6 oder Ytterbium(III)-cyanid.[5][S 8] Unter geeigneten Bedingungen können solche Reaktionen enantioselektiv erfolgen. Hierzu eignen sich Vanadium- oder Titankatalysatoren, die einen chiralen, Salen-ähnlichen Liganden tragen. Eine andere Möglichkeit ist die Verwendung von Titan(IV)-isopropanolat und einem chiralen Imin.[184][185]
Herstellung von Acylcyaniden
Acylcyanide beziehungsweise α-Oxonitrile können in einigen Fällen durch Umsetzung von Carbonsäurehalogeniden mit Übergangsmetallcyaniden (zum Beispiel Kupfercyanid oder Silbercyanid) hergestellt werden. Dies funktioniert besonders gut mit aromatischen Carbonsäurehalogeniden und mit Carbonsäurebromiden, während aliphatische Carbonsäurechloride gar nicht reagieren. Aliphatische Acylcyanide lassen sich durch Reaktion von Carbonsäurechloriden mit Trimethylsilylcyanid herstellen.[186]
Enantioselektive Synthese chiraler Nitrile
Unter Rückgriff auf Chiral-Pool-Verbindungen können durch enantioselektive Synthese α-chirale nitrilhaltige Wirkstoffe in eutomerer Form, wie Vildagliptin und Saxagliptin, erhalten werden. Dabei können standardmäßige Reaktionen zur Erzeugung der Nitrilfunktion angewandt werden. So kann ein enantiomerenreines Amid oder Oxim hergestellt werden, beispielsweise aus der natürlich enantiomerenrein vorkommenden Aminosäure Prolin, und dieses dehydratisiert werden. Wie zweckmäßig ein solches Verfahren ist, hängt allerdings vom jeweiligen Zielmolekül ab. Daneben sind auch asymmetrische Cyanierungsreaktionen bekannt.[187] Wichtig ist die asymmetrische Hydrocyanierung von Carbonylverbindungen, siehe hierzu den Abschnitt Herstellung von Cyanhydrinen. Daneben sind auch viele asymmetrische Hydrocyanierungen von Iminen bekannt, die zu enantiomerenreinen α-Aminonitrilen führen.[185]
Remove ads
Reaktionen
Zusammenfassung
Kontext
Die Nitrilfunktion hat eine große Bedeutung in der organischen Synthese, da sie einerseits über ein nucleophiles Stickstoffatom und ein elektrophiles Kohlenstoffatom verfügt, andererseits aber auch Komplexe bilden kann.[188]
Hydrolyse
Durch Hydrolyse von Nitrilen kann man Carbonsäuren[189] herstellen. Die Hydrolyse kann sowohl sauer als auch basisch erfolgen, in beiden Fällen sind aber in der Regel drastische Bedingungen erforderlich. Bei der basischen Hydrolyse addiert sich ein Hydroxidion an das Nitril und bildet eine Imidoverbindung. Bei der sauren Hydrolyse wird das Nitril zunächst protoniert und dann unter Addition von Wasser ebenfalls eine Imidoverbindung gebildet. Die Imidoverbindung lagert sich in beiden Fällen zu einem Carbonsäureamid um, das unter den jeweiligen Bedingungen zu einer Carbonsäure weiterreagieren kann.[14]
Es sind auch Enzyme bekannt, die als Nitrilasen bezeichnet werden und die direkte Hydrolyse von Nitrilen zu Carbonsäuren ohne Amide als Zwischenstufe katalysieren.[190] Nitrile treten auch als Zwischenstufe bei der Strecker-Synthese auf. Hierbei wird ein Aldehyd mit Ammoniak und Cyanid umgesetzt, wobei zunächst ein α-Aminonitril entsteht. Dessen Hydrolyse ergibt eine α-Aminosäure. Wegen der Bedeutung der Aminosäuren sowohl in der Natur als auch in der Industrie, hat die Strecker-Synthese eine enorme historische Bedeutung, ist aber auch heute noch wichtig.[191]
Nitrile können auch gezielt zu Amiden statt zu Carbonsäuren hydrolysiert werden, sowohl im Sauren als auch im Basischen. Dazu gehört die Hydrolyse mittels Trifluoressigsäure mit Schwefelsäure beziehungsweise Essigsäure mit Schwefelsäure,[192] die Hydrolyse mit Wasser und Trimethylsilylchlorid,[193] oder mit Bortrifluorid und wässriger Essigsäure.[194] Basisch (hydroxid-katalysiert) ist die wässrige Hydrolyse mit Rutheniumhydroxid auf Alumina als Katalysator möglich,[195] und die Umsetzung mit Natriumhydroxid in Isopropanol.[196] Die Enzyme, die die Hydrolyse von Nitrilen zu Amiden katalysieren, werden als Nitrilhydratasen bezeichnet.[197]
Reduktion
Nitrile können mit verschiedenen Reagenzien reduziert werden. Durch katalytische Hydrierung oder Umsetzung mit starken Hydridüberträgern wird so ein primäres Amin erhalten:
Ein konkretes Beispiel ist hier Lithiumaluminiumhydrid.[14] Weitere Reaktionssysteme, durch die Nitrile zu Aminen reduziert werden können, sind Raney-Nickel mit Kaliumborhydrid,[198] Raney-Nickel mit Hydraziniumformiat,[199] Raney-Cobalt,[200] Dimethoxyboran mit Dinickelborid[201] und Rhodium auf Aluminiumoxid.[202] Die Hydrierung von Adiponitril zu Hexamethylendiamin ist ein wichtiger industrieller Prozess.[203]
Mit bestimmten Reagenzien wie Diisobutylaluminiumhydrid läuft die Reaktion nur bis zum Imin, durch dessen Hydrolyse ein Aldehyd erhalten werden kann:[14]
Auch mittels der Stephen-Reduktion können aus Nitrilen Aldehyde erhalten werden. Dazu wird das Nitril mit Zinn(II)-chlorid und Chlorwasserstoff in Ether umgesetzt.[204]
Additionen von Kohlenstoff-Nucleophilen
Durch Addition von metallorganischen Verbindungen an Nitrile, darunter mit Grignard-Reagenzien, entstehen Iminoverbindungen, deren Hydrolyse Ketone ergibt.[14] Die Addition sterisch gehinderter Verbindungen an Nitrile kann durch Zusatz von Kupfer(I)-bromid deutlich beschleunigt werden. Ein Beispiel ist die Umsetzung von Benzonitril mit tert-Butylmagnesiumchlorid, die ohne einen solchen Zusatz praktisch keinen Umsatz ergibt, mit dem Zusatz jedoch über 90 % innerhalb weniger Stunden.[205] Bei der Blaise-Reaktion wird aus einem α-Bromester wie Ethylbromacetat ein Zinkenolat gebildet und dieses dann an ein Nitril addiert. Durch Hydrolyse wird ein β-Ketoester erhalten.[206]
Addition von O- und N-Nucleophilen
In der Pinner-Reaktion werden unter saurer Katalyse Alkohole an Nitrile addiert, wodurch nach Neutralisation Imidate erhalten werden.[207][208] Bei einer neueren Variante der Reaktion wird als Lösungsmittel Cyclopentylmethylether verwendet.[209] Eine wichtige Reaktion, bei der ein Sauerstoff-Nucleophil an ein Nitril addiert wird, ist das Trichloracetimidat-Verfahren. Hierbei wird ein Saccharid (Zuckermolekül) durch Addition an Trichloracetonitril in ein Trichloracetimidat überführt und so aktiviert, was die Synthese von Oligosacchariden ermöglicht.[210][211] Eine weitere wichtige Anwendung von Imidaten ist die Overman-Umlagerung, eine Variante der Claisen-Umlagerung. Dabei wird ein Allylalkohol an Trichloracetonitril oder Trifluoracetonitril addiert. Das gebildete Imidat wird zu einem N-Allylamid umgelagert.[212] Bei der Payne-Oxidation wird durch Addition eines Hydroperoxid-Ions (aus Wasserstoffperoxid) an ein Nitril, meist Acetonitril oder Benzonitril, eine Imidopersäure gebildet. Diese eignen sich für die Epoxidierung von Alkenen, analog zu anderen Persäuren, wie meta-Chlorperbenzoesäure.[213][214] Die Addition von Aminen an Nitrile ergibt Amidine. Eine solche Reaktion gelingt unter Katalyse mit Samarium(II)-iodid[215] oder mit Yttrium(III)-triflat, Lanthan(III)-triflat sowie Triflaten anderer Lanthanide.[216]
Deprotonierung und α-Funktionalisierung
Die elektronenziehenden Eigenschaften der Nitrilgruppe ermöglichen die Herstellung von Carbanionen-Nucleophilen durch α-Deprotonierung.[28] Diese können für Alkylierungs- und Acylierungsreaktionen verwendet werden, allerdings kann die Deprotonierung auch zur Racemisierung chiraler Verbindungen führen.[217] Die Selbstkondensation von Nitrilen in Gegenwart einer Base (zum Beispiel Lithiumbis(trimethylsilyl)amid) wird als Thorpe-Reaktion bezeichnet. Sie führt zu Cyanoenaminen (üblicherweise stereoselektiv zum (E)-Isomer) und eignet sich unter anderem auch zur Herstellung von cyclischen Molekülen.[218]
Reaktionen mit Aromaten
Die Nitrilgruppe von Arylnitrilen kann einen dirigierenden Effekt ausüben und die selektive Metallierung eines Aromaten in ortho-Position zum Nitril ermöglichen. Solche Arylmetallspezies können dann in Kupplungsreaktionen eingesetzt werden.[188]
Bei der Houben-Hoesch-Reaktion wird ein Aromat unter Säurekatalyse mit einem Nitril acyliert, ähnlich einer Friedel-Crafts-Acylierung. Nach hydrolytischer Aufarbeitung wird dabei ein Keton erhalten. Die Reaktion funktioniert insbesondere mit elektronenreichen Aromaten wie Phenol. Sie eignet sich auch für Cyclisierungen, wenn es sich um eine intramolekulare Reaktion handelt.[219]
Cyclisierungen
Nitrile können zu Triazinen trimerisiert werden. Bei Propionitril, Valeronitril oder Benzonitril, gelingt die Trimerisierung durch hohen Druck, bei 100–125 °C und etwa 7 bis 8,5 kbar in Methanol.[220] Derartige Trimerisierungen gelingen außerdem mittels Katalyse durch Samarium(II)-iodid,[221] Yttrium(III)-triflat oder einer Lewissäure (Zinkchlorid, Aluminiumchlorid oder Titanchlorid) auf Silica.[222] Durch Umsetzung von Cyanwasserstoff mit Chlor und anschließende Trimerisierung wird Cyanurchlorid hergestellt.[223] Mit Trifluormethansulfonsäureanhydrid können Triazine aus zwei verschiedenen Nitrileinheiten gebildet werden, von denen eine zweimal und eine einmal in den Ring eingebaut wird.[224] Die Polymerisation von Terephthalonitril (1,4-Dicyanobenzol) in flüssigem Zinkchlorid bei 400 °C ergibt ein zweidimensionales Netz aus Phenylen- und Triazinringen.[225]
[4+2]-Cycloaddition von Nitrilen mit Dienen sind kaum bekannt und von untergeordneter Bedeutung. Die [2+2+2]-Cycloaddition eines Nitrils mit zwei Alkinen wird durch Nickelverbindungen katalysiert und ermöglicht die Herstellung stark substituierter Pyridine.[188] Auch Reaktionen mit Cobalt und Zirconium als Katalysatoren sind bekannt.[226][227] Die [3+2]-Cycloaddition von Nitrilen mit Aziden beziehungsweise Stickstoffwasserstoffsäure ergibt Tetrazole.[188][228] Die Gewald-Reaktion ist eine Methode für die Herstellung von 2-Aminothiophenen. Hierzu wird ein Nitril mit einer zusätzlichen elektronenziehenden Gruppe (wie im Malonitril oder Methylcyanoacetat) mit elementarem Schwefel und einem Aldehyd oder Keton umgesetzt. Diese Reaktion wird für die Herstellung des Wirkstoffs Olanzapin verwendet.[229]
Weitere Reaktionen
Die reduktive Decyanierung ermöglicht die Entfernung einer Nitrilgruppe, wenn diese lediglich wegen ihrer dirigierenden oder elektronenziehenden Eigenschaften verwendet wurde. Die klassische Methode zur reduktiven Decyanierung ist die Verwendung von elementaren Alkalimetallen mit einem Protonendonator. Mögliche Kombinationen sind Natrium in Ammoniak oder Lithium in Ethylamin.[28] Ein weiteres Beispiel ist die Verwendung von Kalium auf Aluminiumoxid in Hexan.[230] Aromatische Nitrile können auch mit Übergangsmetallkatalysatoren auf der Basis von Nickel oder Cobalt defunktionialisiert werden.[28]
Bei der Ritter-Reaktion wird ein Alken oder ein tertiärer Alkohol mit einem Nitril und Schwefelsäure umgesetzt, wodurch ein N-Alkylamid gebildet wird, wobei das Alken oder der Alkohol den Substituenten am Stickstoff ergibt.[231]
Die Protonierung oder Alkylierung von Nitrilen ergibt Nitrilium-Ionen. Die Protonierung von Nitrilen ist ein Teilschritt der sauren Hydrolyse von Nitrilen.[14] Die N-Alkylierung von Nitrilen ergibt Alkylnitrilium-Verbindungen. Dies ist möglich durch Umsetzung mit Chlorameisensäureestern in Gegenwart von Antimon(V)-chlorid.[232] N-Ethylnitriliumverbindungen entstehen durch Umsetzung von Nitrilen mit Triethyloxoniumtetrafluoroborat.[233]
Nitrile als Komplexliganden

Nitrile bilden diverse Komplexe mit Übergangsmetallen. Sie sind dabei im Allgemeinen über das nichtbindende Elektronenpaar des Stickstoffatoms koordiniert, es sind aber auch einige Komplexe bekannt, bei denen die Koordination über die Dreifachbindung erfolgt. Viele als Feststoff isolierbare Komplexe sind von Kupfer bekannt.[234] Andere Metalle, die Nitrilkomplexe bilden, sind unter anderem Chrom, Mangan, Zink, Niob, Rhenium und Eisen. Typische Nitrilliganden sind Acetonitril oder Benzonitril.[234][235] Hergestellt werden können Nitrilkomplexe unter anderem durch Dehydratisierung eines Hydratsalzes mit dem gewünschten Gegenion des Komplexes. Dies funktioniert mit Tetrafluoroboraten von Mangan, Eisen, Cobalt, Nickel und Kupfer. Eine andere Möglichkeit ist die Oxidation elementarer Metalle mit einem Nitrosoniumsalz mit dem gewünschten Gegenion. Ein Beispiel hierfür ist die Umsetzung von Kupfer mit Nitrosoniumperchlorat[S 9] in Acetonitril zu Tetrakis(acetonitril)kupfer(II)-perchlorat, wobei Stickstoffmonoxid als Nebenprodukt entsteht.[235]
Nitrilliganden binden in der Regel nur schwach an das Zentralatom des Komplexes und können leicht ausgetauscht werden, um andere Komplexe herzustellen.[235] Ein Beispiel ist die Umsetzung von Tetrakis(acetonitril)kupfer(I)-tetrafluoroborat zu Tetrakis(methoxyisobutylisonitril)kupfer(I)-tetrafluoroborat, das im medizinischen Bereich verwendet wird.[236] Viele Nitril-Komplexe haben katalytische Eigenschaften in der Polymerisation von Cyclopentadien und anderen Reaktionen. Tetrakis(acetonitril)kupfer(I)-perchlorat katalysiert Michaeladditionen an Enone wie die Alkylierung von Cyclohexenon mit Diethylzink.[235]
Remove ads
Verwendung
Zusammenfassung
Kontext
Cyanwasserstoff wird in der chemischen Industrie in großer Menge als Intermediat zur Herstellung anderer Verbindungen eingesetzt. Acrylnitril ist ein wichtiger Ausgangsstoff zur Herstellung von Nitril-Polymeren. Acetonitril ist ein wichtiges Lösungsmittel. Weitere Nitrile werden als Duftstoffe, Pestizide und chemische Reagenzien eingesetzt. Außerdem spielt die Nitrilgruppe eine wichtige Rolle in der Entwicklung von pharmazeutischen Wirkstoffen.
Verwendung von Cyanwasserstoff

Cyanwasserstoff ist eine Massenchemikalie, die weltweite Produktion betrug 2001 etwa 2,6 Millionen Tonnen. Wichtige Folgeprodukte, die daraus hergestellt werden, sind insbesondere Adiponitril, Acetoncyanhydrin, Natriumcyanid und Cyanurchlorid.[166][223] Auch Chelatbildner werden ausgehend von Cyanwasserstoff produziert,[223] beispielsweise EDTA aus Formaldehyd, Ethylendiamin, Cyanwasserstoff und Natriumhydroxid.[237] Ein wichtiger industrieller Produktionsprozess für Aminosäuren ist die Strecker-Synthese, bei der Cyanwasserstoff als Edukt verwendet wird.[238] Eine mengenmäßig wichtige Aminosäure ist Methionin, das aus Acrolein, Cyanwasserstoff und Schwefelwasserstoff hergestellt und insbesondere in Tierfutter verwendet wird.[223][239]
Kunststoffherstellung
Einige weitverbreitete Polymere enthalten Acrylnitril als Monomer und weisen daher Nitrilgruppen auf. Reines Polyacrylnitril (PAN) lässt sich schlecht verarbeiten, weshalb bei der Herstellung von Polyacrylnitril neben 85 bis 99 % Acrylnitril fast immer kleine Mengen anderer Monomere zugesetzt werden.[8] Verwendet werden daneben auch Copolymere, die zwischen 35 und 85 % Acrylnitril als Monomer enthalten, neben anderen Monomeren wie Vinylacetat und Methylmethacrylat.[8][240] Die Nitril-Polymere sind neben Polyestern und Polyamiden eines der wichtigsten vollsynthetischen Materialien für Textilfasern.[8][241] Diese Fasern werden als Acrylfasern bezeichnet und in einer Größenordnung von mehreren Millionen Tonnen pro Jahr hergestellt. Im Jahr 2000 betrug die weltweite Produktion etwa 2,7 Millionen Tonnen.[8][242] Verwendet werden Acrylfasern unter anderem in Bekleidung (Socken und Pullover) sowie für Decken, Teppiche und Strickgarn.[8][243] PAN ist außerdem der wichtigste Ausgangsstoff zur Herstellung von Carbonfasern, die als extrem leichtes aber gleichzeitig stabiles Material beim Bau von Autos und Flugzeugen verwendet werden.[8][240][244][245] Die weltweite Produktionsmenge des Monomers Acrylnitril betrug 1988 etwa 3,2 Millionen Tonnen.[166]
Acrylnitril-Butadien-Copolymere werden als Nitrilkautschuk bezeichnet und haben verschiedene vorteilhafte Eigenschaften wie hohe Zugfestigkeit und Abriebfestigkeit sowie Beständigkeit gegen Kohlenwasserstoffe (Öl und Treibstoffe). Sie werden daher für Dichtungsringe und Öl- und Treibstoffschläuche verwendet.[8] Eine weitere wichtige Anwendung von Nitrilkautschuk sind Schutzhandschuhe, die oft statt Handschuhen aus Latex im Gesundheitswesen verwendet werden, da letztere regelmäßig Allergien verursachen.[246] Solche Handschuhe werden außerdem oft bei der Arbeit mit gefährlichen Chemikalien wie organischen Lösungsmitteln verwendet.[247]
Ein weiteres wichtiges Polymer ist das Terpolymer aus Acrylnitril, Butadien und Styrol (ABS). Dieses ist eines der wichtigsten Materialien für Außenhüllen von elektronischen Geräten (Computer, Bildschirme und Tastaturen).[248] Weitere Verwendungen sind Plastikteile von Autos (an Scheinwerfern und Spiegeln); Einsätze für Kühlschränke; Außenhüllen von Küchengeräten, Staubsaugern und Elektrowerkzeugen; sowie Koffer, Vesperdosen.[249] und Spielzeuge, darunter Lego-Steine.[250][251] Auch ABS wird in der Größenordnung von mehreren Millionen Tonnen pro Jahr produziert, beispielsweise etwa 2,7 Millionen Tonnen im Jahr 1992.[249]
Polyamid 6.6 (Nylon) ist kein Nitril, allerdings ist ein Schlüsselintermediat zu dessen Herstellung das Adiponitril. Adiponitril wird durch Hydrocyanierung von Butadien oder durch Dimerisierung von Acrylnitril hergestellt und durch katalytische Hydrierung zu Hexamethylendiamin umgesetzt, welches eines der Monomere für Nylon ist. Das zweite Monomer, Adipinsäure wird durch Oxidation von Cyclohexan gewonnen.[252][253] Acetoncyanhydrin ist ein wichtiges Intermediat zur Herstellung von Methylmethacrylat, welches wiederum zur Herstellung von Polymethylmethacrylat verwendet wird.[254]
- Polyacrylnitril wird in Strickgarn verwendet
- Carbonfasern werden oft aus Polyacrylnitril hergestellt
- Schutzhandschuhe aus Nitrilkautschuk
- Lego-Bausteine werden aus Acrylnitril-Butadien-Styrol-Copolymer (ABS) hergestellt
Chemisch-pharmazeutische Industrie und Labore
Acetonitril findet als Lösungsmittel Verwendung, insbesondere in der pharmazeutischen Industrie.[255] Im Jahr 2022 wurden laut einer Marktanalyse weltweit etwa 180.000 Tonnen Acetonitril produziert, wovon etwa 70 % in der pharmazeutischen Industrie verwendet wurden.[256] Es ist außerdem eines der wichtigsten Lösungsmittel für Analysen mittels HPLC.[255][257] Die Zersetzung von Azobisisobutyronitril (AIBN) und verwandten Verbindungen (zum Beispiel Azobiscyclohexancarbonitril) ergibt vergleichsweise stabile Radikale, weshalb diese Verbindungen als Radikalstarter für radikalische Reaktionen, insbesondere Polymerisationen, verwendet werden.[258] Das Chinon DDQ, das über zwei Nitrilgruppen verfügt, ist ein weitverbreitetes Oxidationsmittel, das auch in der pharmazeutischen Industrie verwendet wird.[259] Nitrilgruppen lassen sich als Sonde für infrarot-spektroskopische Untersuchungen in Biomoleküle einführen.[260] Einige Nitrile werden als Edukte für die Synthese von Pharmazeutika verwendet.[27] Ketoprofen ist ein in einigen EU-Ländern zugelassenes Antiphlogistikum, für dessen industrielle Synthese Propionitril verwendet wird.[261][262]
Nitrile in der Medizin
Nitrile finden sich in einem breiten Spektrum an Arzneistoffgruppen. Zwischen 2010 und 2020 wurde jedes Jahr mindestens ein Arzneistoff mit Nitrilfunktion von der amerikanischen Food and Drug Administration zugelassen. Die Nitrilgruppe hat charakteristische physikalische und chemische Eigenschaften, die für die Gestaltung von Wirkstoffen eine wichtige Rolle spielen. Als strukturelles Element weist diese Gruppe eine lineare Geometrie auf und beansprucht nur sehr wenig Raum, etwa ein Achtel im Vergleich zu einer Methylgruppe. Damit ist sie als Strukturbestandteil von Liganden gut geeignet, Hohlräume einer Bindungstasche eines Zielproteins aufzufüllen, die entsprechend schlank und tief sind und anderweitig kaum zu besetzen sind. Der Einbau einer Nitrilgruppe in ein Molekül führt im Allgemeinen zur Senkung seines Octanol-Wasser-Verteilungskoeffizienten bzw. zur Erhöhung seiner Wasserlöslichkeit. Dies wirkt sich bei an sich lipophileren Verbindungen in der Regel günstig auf die Bioverfügbarkeit, die Plasmahalbwertszeit und damit auf deren Wirkungsdauer aus. Die Nitrilgruppe in Arzneistoffen ist zumeist metabolisch sehr stabil.[263] Die Nitrilgruppe ist isoster zur Carbonylgruppe, der Hydroxylgruppe und zum Chloratom. Sie hat demnach ähnliche elektronische und sterische Eigenschaften wie diese und kann gegen diese ausgetauscht werden, um die Moleküleigenschaften leicht zu variieren.[264]
Die Wasserstoffbrückenbindung ist das wichtigste pharmakodynamische Bindungsmuster der Nitrilgruppe, die aufgrund der Elektronegativität ihres Stickstoffatoms, im Gegensatz zur Ethinylgruppe, als Protonenakzeptor fungiert.[265] So bildet beispielsweise die Nitrilgruppe des kompetitiven PDE3-Inhibitors Milrinon über einen an der Ligandenbindungsstelle dieser Phosphodiesterase befindlichen Histidin-Rest eine affinitätsrelevante Wasserstoffbrücke.[263] Nitrile sind fähig, eine koordinative Bindung mit Calciumkationen einzugehen, was für die Wirkung von Calciumkanalblockern des Verapamil-Typs essentiell ist. Diese hemmen den Calciumstrom, indem der Ligand-Calcium-Komplex eine Salzbrücke eingeht mit einem der Glutamatreste des Selektivitätsfilters in der Pore dieses ionotropen Rezeptors.[266][267] Eingesetzt wird Verapamil bei Herz-Kreislauf-Erkrankungen wie arterieller Hypertonie und Angina pectoris.[268]
Nitrilsubstituenten verringern durch starken Elektronenzug die Elektronendichte von Aromaten. Moduliert werden auf diese Weise π-π-Wechselwirkungen zwischen Wirkstoff und geeigneten Aminosäureresten eines Zielproteins, wie Phenylalanin, Tyrosin, Tryptophan und Histidin.[264] Eine solche π-π-Wechselwirkung wird beobachtet bei den Aromatasehemmern Letrozol und Anastrozol, die als Antiestrogene wirken und bei Brustkrebs eingesetzt werden.[269][270] Viele Androgenrezeptor-Antagonisten enthalten einen ausgeprägt elektronenarmen aromatischen Ring, der für die supramolekulare Rezeptorbindung von besonderer Bedeutung ist.[271] In Bicalutamid, Enzalutamid und weiteren Analoga, die zur Behandlung von Prostatakrebs eingesetzt werden, trägt eine Nitrilgruppe zu dieser Ladungsverschiebung bei.[272]
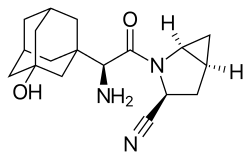
Einige Fälle sind bekannt, in denen Nitrile eine reversible, gleichwohl wirkungsrelevante kovalente Bindung zu einem Zielmolekül ausbilden.[264] Dabei addieren unter geeigneten Bedingungen Hydroxyl- oder Thiolgruppen von Serin- oder Cysteinresten der Zielproteine mit der Nitrilgruppe zu Oxo- oder Thioimidaten. Dies gilt für den bei Diabetes mellitus Typ II eingesetzten Dipeptidylpeptidase-4-Inhibitor Vildagliptin,[273] genauso wie für Saxagliptin.[274] Das antibakterielle Antibiotikum Cefmetazol[S 10] wirkt ebenfalls als kovalenter Inhibitor, in diesem Fall einer bakteriellen Protease.[275] Für den Calcium-Sensitizer Levosimendan wird eine Reaktion mit dem Proteinkomplex Troponin-C angenommen.[276] Eine solch reaktive Gruppe wird auch als Warhead (wörtlich übersetzt „Gefechtskopf“) bezeichnet.
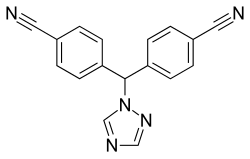
In einigen Fällen sind Nitrilgruppen hauptsächlich wegen ihrer Sterik (das heißt räumlichen Gestalt) relevant, indem sie Van-der-Waals-Kontakte mit Aminosäureresten ausbilden. Die trifft zu auf den Tyrosinkinase-Inhibitor Bosutinib, der bei Chronischer myeloischer Leukämie eingesetzt wird. Kristallstrukturen sind bekannt, in denen Bosutinib mit diversen Tyrosinkinasen komplexiert ist. Inhibitoren der Reversen Transkriptase, wie Etravirin und Rilpivirin, werden in Kombinationspräparaten gegen HIV eingesetzt. Die Acrylnitril-Teilstruktur des Rilpivirins taucht in einen aus Tyrosin, Phenylalanin und Tryptophan bestehenden aromatischen Käfig ein, wie die zugehörige Raumstruktur, die im Jahr 2008 veröffentlicht wurde, erkennen lässt.[277] Der Serotonin-Wiederaufnahmehemmer Citalopram, der gegen Depressionen eingesetzt wird, war im Jahr 2016 mit 290 Millionen definierten Tagesdosen das meist verschriebene Psychopharmakon in Deutschland. Die Nitrilgruppe des Escitaloprams zeichnet sich durch optimale Komplementarität gegenüber der zentralen und einer weiteren allosterischen Bindungsstelle des Transportmoleküls aus, wie es aus der Kristallstruktur hervorgeht.[278]
- Levosimendan
- Letrozol
- Saxagliptin
- Milrinon
- Cefmetazol
- Citalopram
- Rilpivirin
Sonstige Verwendungen

Eine zweistellige Anzahl an Nitrilen wird als Duftstoffe für Kosmetika verwendet. Dazu gehören unter anderem Zimtsäurenitril, Dodecannitril, Benzonitril und Geranylnitril.[279][280][281] Nitrile weisen zum Teil ähnliche Düfte auf wie entsprechende Aldehyde, sind aber deutlich stabiler, sodass sie sich als Ersatz eignen. So eignet sich Geranylnitril als Zitrusduft und ist im Gegensatz zum strukturanalogen Citral stabil gegen Oxidation.[282]
Diverse Nitrile finden als Pestizide Verwendung. Cyanogruppen sind in einigen Pyrethroid-Insektiziden enthalten. Pyrethroide sind Carbonsäureester und durch Verwendung von 3-Phenoxymandelonitril als Alkoholkomponenten, wie in Deltamethrin und Cypermethrin, wurde eine Gruppe besonders wirksamer Derivate entwickelt.[283] Azoxystrobin war schon 1999, wenige Jahre nach Einführung, mit über 400 Millionen Dollar Verkaufswert das meistverkaufte Agrar-Fungizid und hat seine Bedeutung auch mehr als 15 Jahre später noch behalten, sodass es auch 2016 noch das meistverkaufte Fungizid war.[284][285] Azoxystrobin wurde ausgehend von dem natürlich vorkommenden Strobilurin A entwickelt. Wichtige Unterschiede zwischen der Startverbindung und dem fertigen Wirkstoff sind der Austausch der Doppelbindungen gegen aromatische Ringe und die Einführung einer Cyanogruppe an dem Ring, der schon in der Ausgangsverbindung enthalten ist.[285] Ein viel genutztes Nitril-Insektizid ist Fipronil.[286]
Cyanacrylate werden als Sekundenkleber verwendet, da sie als Einkomponentenzubereitung schnell bei normalen Umgebungsbedingungen aushärten und viele Materialien kleben können. Die bei weitem meistgenutzte Verbindung in diesem Bereich ist Ethylcyanacrylat, in geringerem Maße werden Methylcyanacrylat und Allylcyanacrylat verwendet.[287] Cyanacrylatkleber werden auch im medizinischen Bereich verwendet, um Wunden zu verkleben, anstatt sie zu nähen. Da Ester mit kurzkettigen Alkylresten (wie Methylcyanacrylat) aber oft Nebenwirkungen, insbesondere Entzündungen, verursachen, werden hier andere Verbindungen verwendet als im technischen Bereich. So kommen vor allem Butylcyanacrylat und 2-Octylcyanacrylat zum Einsatz.[9]
Nitrile finden Verwendung als Elektrolytzusatzmittel in Lithiumbatterien. So bewirkt der Zusatz von 1,3,6-Hexantricarbonitril[S 11] eine signifikante Zunahme der Leistung gegenüber einer entsprechenden Batterie ohne Zusatz. Die Wirkweise der Nitrilzusätze ist noch nicht vollständig geklärt.[288][289]
Remove ads
Literatur
- David T. Mowry: The Preparation of Nitriles. In: Chemical Reviews. Band 42, Nr. 2, 1. April 1948, S. 189–283, doi:10.1021/cr60132a001.
- Camille Scotti, James W. Barlow: Natural Products Containing the Nitrile Functional Group and Their Biological Activities. In: Natural Product Communications. Band 17, Nr. 5, Mai 2022, doi:10.1177/1934578X221099973.
- Mohammed H. Al‐Huniti, Mitchell P. Croatt: Metal-Catalyzed Dehydration of Primary Amides to Nitriles. In: Asian Journal of Organic Chemistry. Band 8, Nr. 10, Oktober 2019, S. 1791–1799, doi:10.1002/ajoc.201900343.
- Bruce N. Storhoff, Huntley C. Lewis Jr.: Organonitrile complexes of transition metals. In: Coordination Chemistry Reviews. Band 23, Nr. 1, Juni 1977, S. 1–29, doi:10.1016/S0010-8545(00)80329-X.
- Xi Wang, Yuanxun Wang, Xuemin Li, Zhenyang Yu, Chun Song, Yunfei Du: Nitrile-containing pharmaceuticals: target, mechanism of action, and their SAR studies. In: RSC Medicinal Chemistry. Band 12, Nr. 10, 2021, S. 1650–1671, doi:10.1039/D1MD00131K, PMID 34778767, PMC 8528211 (freier Volltext).
Remove ads
Weblinks
Commons: Nitrile – Sammlung von Bildern, Videos und Audiodateien
Wiktionary: Nitril – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Einzelnachweise
Externe Links zu erwähnten Verbindungen
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




















![{\displaystyle \mathrm {{R\!\!-\!\!C\!\!\equiv \!\!N}+2~H_{2}O~~~{\overset {\Delta }{\xrightarrow[{OH^{-}}]{}}}~~~R\!\!-\!\!COOH+NH_{3}} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/72b662c8fcae0924a4dd1b2fc2d205d06ab05a54)


![{\displaystyle \mathrm {{R\!\!-\!\!C\!\!\equiv \!\!N}~~{\overset {\text{DIBAL}}{\xrightarrow {} }}~~R\!\!-\!\!CH\!\!=\!\!NH~~{\overset {\text{[H]}}{\xrightarrow {} }}~~R\!\!-\!\!CH\!\!=\!\!O} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/0fc02dd7075b8cf8e55f4777395665da842f0d06)