Top-Fragen
Zeitleiste
Chat
Kontext
Hydroxylamin-O-sulfonsäure
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
Hydroxylamin-O-sulfonsäure (HOSA) entsteht bei der Sulfonierung von Hydroxylamin und ist ein vielseitiges Reagenz zur Einführung von Aminogruppen, zur Umwandlung von Aldehyden in Nitrile, von alicyclischen Ketonen in Lactame und zur Bildung einer Vielzahl von stickstoffhaltigen Heterocyclen.[4] Die Säure liegt wegen der Anwesenheit der basischen Aminogruppe und der sauren Sulfogruppe als Zwitterion vor.[5]
Remove ads
Remove ads
Darstellung
Zusammenfassung
Kontext
Nach einer Laborvorschrift[6] kann Hydroxylamin-O-sulfonsäure durch Zugabe von Hydroxylaminsulfat zu 30-prozentiger rauchender Schwefelsäure (Oleum) bei Raumtemperatur und anschließendes Ausfällen der entstandenen Hydroxylamin-O-sulfonsäure mit Diethylether erhalten werden. Die Ausbeuten betragen 98–99 % mit Reinheiten bei 92–98 %.

In industriellem Maßstab kann in einer Eintopfreaktion zunächst in situ Hydroxylaminsulfat aus Nitromethan und 100-prozentiger Schwefeltrioxid erzeugt werden, das mit Schwefeltrioxid zu Hydroxylamin-O-sulfonsäure umgesetzt wird.[7]
Bei der Sulfonierung von Hydroxylaminsulfat mit Chlorsulfonsäure in Substanz wird HOSA in 95- bis 97-prozentiger Ausbeute und 96- bis 99-prozentiger Reinheit erhalten.[8] Die Sulfonierung von Hydroxylaminsulfat mit 27-prozentigem Oleum liefert in einem industriellen Prozess unter Rückführung des Oleumüberschusses HOSA in ca. 90-prozentiger Ausbeute und nach Waschen mit Eisessig in 99,9-prozentiger Reinheit.[9]
Eine Reaktionsvariante der Umsetzung von Hydroxylaminsulfat mit rauchender Schwefelsäure bei 110 °C für 6 Stunden und verzögerte Abkühlung auf Raumtemperatur über 8 Stunden erzeugt HOSA mit größeren und damit besser filtrierbaren Kristallen mit Ausbeuten von ca. 80 % und Reinheiten über 98 %.[10]
Remove ads
Eigenschaften
Hydroxylamin-O-sulfonsäure ist ein weißer bis beige-farbener hygroskopischer Feststoff mit stechendem Geruch, der sich sehr gut in Wasser, aber nicht in unpolaren Lösungsmitteln, wie z. B. Diethylether oder Chloroform, löst.[6] Die Substanz zersetzt sich im wässrigen Medium oberhalb von Raumtemperatur rasch zu ätzenden und korrosiven Lösungen. Hydroxylamin-O-sulfonsäure ist hygroskopisch, wärmeempfindlich und muss kühl sowie unter Feuchtigkeitsausschluss aufbewahrt werden.
Remove ads
Verwendung
Zusammenfassung
Kontext
Hydroxylamin-O-sulfonsäure reagiert im Basischen als Nucleophil und im Neutralen und Sauren als Elektrophil[11][4]

Aminierungsreaktionen
So reagiert Hydroxylamin-O-sulfonsäure mit primären und sekundären Aminen zu mono- und disubstituierten Hydrazinen, beispielsweise mit Piperidin in gepufferter wässriger Lösung in 96-prozentiger Ausbeute zu N-Aminopiperidin,[12]
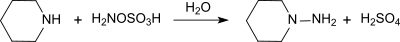
mit tertiären Aminen zu trisubstituierten Hydraziniumsalzen und mit Pyridin zum 1-Aminopyridiniumsalz,[13]

das nach Umkristallisieren in 63- bis 72-prozentiger Ausbeute als fast weiße Kristalle erhalten wird.
Aus 1-Aminopyridiniumsalzen sind durch Acylierung die photochemisch aktiven 1-N-Iminopyridiniumylide[14] zugänglich.

Die photochemische Umlagerung der erhaltenen 1-N-Iminipyridiniumylide führt in hohen Ausbeuten zu 1H-1,2-Diazepinen.[15]
N-Aminierung von 1H-Benzotriazol mit Hydroxylamin-O-sulfonsäure liefert ein Gemisch von 1-Aminobenztriazol (38 %) und 2-Aminobenztriazol (11 %) neben nicht umgesetztem 1H-Benztriazol.[16] Aus 1-Aminotriazol entsteht durch Oxidation mit Blei(IV)-acetat Dehydrobenzol in fast quantitativer Ausbeute, das in unpolaren Lösungsmitteln, wie z. B. Dichlormethan, bei 20 °C in 82-prozentiger Ausbeute rasch zu Biphenylen dimerisiert.

Elektronenarme Heterocyclen, wie z. B. Tetrazol, können mit Hydroxylamin-O-sulfonsäure N-aminiert werden, während noch elektronenärmere Verbindungen, wie z. B. 5-Nitrotetrazol nur mit stärkeren Aminierungsmitteln, wie O-Tosylhydroxylamin oder O-Mesitylensulfonylhydroxylamin, zu Aminoverbindungen reagieren, die als Sprengstoffe untersucht wurden.[17]

Bei der N-Aminierung des unsubstituierten Tetrazols fällt ein Gemisch von 1-Amino- und 2-Aminotetrazol an. Eine Aminierung von 5-Aminotetrazol führt zu einem Gemisch aus 1,5-Diaminotetrazol und 2,5-Diaminotetrazol.[18]
Auch Schwefelverbindungen, wie Thioether, können mit Hydroxylamin-O-sulfonsäure zu den mit Sulfoxiden isosteren (aber deutlich instabileren) Sulfiniminen

bzw. Phosphorverbindungen, wie Triphenylphosphin über die Zwischenstufe Aminotriphenylphosphonium-hydrogensulfat zu Phosphiniminen aminiert werden.[19]

Die Umsetzung von Hydroxylamin-O-sulfonsäure mit Metallsalzen von Sulfinsäuren in Natriumacetat-Lösung erzeugt primäre Sulfonamide in sehr guten Ausbeuten.[20]

Reduktionsreaktionen
Aus HOSA bzw. HOSA-Hydroxylaminsulfat-Gemischen entsteht im Alkalischen in situ Diimin, das selektiv konjugierte Mehrfachbindungen hydriert.[21]

Reaktionen mit Carbonylverbindungen
Mit Ketonen und Aldehyden reagiert bei Raumtemperatur und darunter Hydroxylamin-O-sulfonsäure als Nucleophil zu den entsprechenden Oxim-O-sulfonsäuren bzw. ihren Salzen.[22] Bei Temperaturen oberhalb Raumtemperatur reagieren die Oxim-O-sulfonsäuren von Aldehyden unter Abspaltung von Schwefelsäure in hohen Ausbeuten zu Nitrilen.[23]

Aliphatische Ketone liefern unter ähnlichen Bedingungen in sehr hohen Ausbeuten Oxime, Arylalkylketone reagieren unter Beckmann-Umlagerung zu Amiden.
Unter sauren Bedingungen, z. B. in Gegenwart von konzentrierter Ameisensäure, reagieren alicyclische Ketone bei Erhitzen unter Rückfluss für mehrere Stunden in hohen Ausbeuten zu Lactamen.[24]
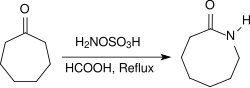
Unter basischen Bedingungen reagiert HOSA mit Aldehyden und Ketonen, wie z. B. Cyclohexanon,[25] in Gegenwart primärer Amine unter Bildung von Diaziridinen, die einfach zu den stabileren Diazirinen oxidiert werden können.

Die Reaktion liefert auch aus einfachen Aldehyden und Ketonen in hohen chemischen Ausbeuten und Diastereoselektivitäten substituierte Diaziridine.[26]

Durch nucleophilen Angriff der Hydroxylamin-O-sulfonsäure an die Carbonylgruppe des Salicylaldehyds und anschließende Cyclisierung entsteht 1,2-Benzisoxazol in 95-prozentiger Ausbeute.[27]

1,2-Benzisoxazol ist ein Strukturelement in den Antipsychotika Risperidon und Paliperidon, sowie dem Antikonvulsivum Zonisamid.
In einer Eintopfreaktion sind N-Aryl[3,4-d]pyrazolopyrimidine, ausgehend von einfach erhältlichem 4,6-Dichlorpyrimidin-5-carboxaldehyd, in guten Ausbeuten zugänglich,[28] die als Purinanaloga vielfältige diagnostische und therapeutische Anwendungen finden können.[29]

Weitere Reaktionen
Die Chemilumineszenz des Systems Luminol/Cobalt(II)-chlorid wird durch Zusatz von Hydroxylamin-O-sulfonsäure drastisch verstärkt.[30]
Remove ads
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads





