Sulfonsäuren
Organische Stoffgruppe, Säuren Aus Wikipedia, der freien Enzyklopädie
Sulfonsäuren sind organische Schwefelverbindungen mit der allgemeinen Struktur R–SO2–OH, wobei R ein organischer Rest ist. Ihre Salze und Ester mit der allgemeinen Struktur R–SO2–O− und R1–SO2–O–R2 heißen Sulfonate.
| Sulfonsäuren und Sulfonate |
|---|
 Sulfonsäure |
 Sulfonsäureester |
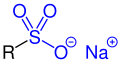 Sulfonsäuresalze |
| R, R1 und R2 sind Organylgruppen. Die funktionellen Gruppen sind blau markiert. |
Sulfonsäuren und die ihnen zugehörigen Salze und Ester werden in zwei Gruppen eingeteilt: die aliphatischen Sulfonsäuren bzw. Alkansulfonsäuren oder -sulfonate und die aromatischen Sulfonsäuren bzw. Arensulfonsäuren oder -sulfonate.
Vorkommen
Zusammenfassung
Kontext
Taurin ist als Aminosulfonsäure eine der wenigen natürlich vorkommenden Sulfonsäuren.
Sekundärmetaboliten

In den Wurzeln des Stachelbeerbaums (Phyllanthus acidus) wurden sechs Flavonoide mit Sulfonsäurefunktion nachgewiesen.[1] In den Wurzeln des Färberwaids kommen verschiedene Indolalkaloide mit Sulfonsäurefunktionen vor, die teilweise als Glucoside vorliegen. Eine dieser Verbindungen ist Indol-3-methansulfonsäure.[2]
In einem Hornkieselschwamm der Gattung Echinodictyum wurden die Echinosulfonsäure A sowie zwei strukturell verwandte Verbindungen nachgewiesen. Dabei handelt es sich um Verbindungen, die zwei Indol-Einheiten aufweisen.[3] Als Sekundärmetabolit einer Streptomyces-Art aus einer japanischen Boden-Probe ist das Sulfotanon bekannt.[4]
Atmosphärische Vorkommen
Methansulfonsäure kommt in geringen Konzentrationen verbreitet in der Atmosphäre vor. Sie entsteht als Oxidationsprodukt aus flüchtigen Organoschwefelverbindungen marinen Ursprungs, insbesondere Dimethylsulfid.[5] Die atmosphärische Konzentration der Methansulfonsäure liegt in der Größenordnung von 10⁶ bis 10⁷ Molekülen pro Kubikzentimeter und es wird vermutet, dass die Verbindung neben einigen weiteren zur atmosphärischen Aerosolbildung beiträgt.[6]
Gewinnung und Darstellung
Zusammenfassung
Kontext
Radikalische Reaktionen
Ein Gemisch aus Alkansulfonsäuren entsteht durch die Einwirkung von Schwefeldioxid und Sauerstoff auf höhere Alkane in Gegenwart von Radikalbildnern.[7]
Ausgehend von Alkenen können die Natriumsalze von Sulfonsäuren durch radikalische Addition von Natriumhydrogensulfit hergestellt werden.[8]
Oxidationen
Aliphatische und aromatische Sulfonsäuren können durch Oxidation von Thiolen (aus Alkylhalogenigen zugänglich) synthetisiert werden, beispielsweise mit Salpetersäure, Kaliumpermanganat oder mit Wasserstoffperoxid in Essigsäure.[7][8]
Eine weitere Methode ausgehend von Alkylhalogeniden ist die Umsetzung zu Thiocyanaten oder Disulfiden und anschließende Oxidation. Weiterhin ist die Addition einer Grignard-Verbindung an Schwefeldioxid und anschließende Oxidation möglich.[8]
Substitution mit Sulfit
Durch nucleophile Substitutionen werden aus Halogenalkanen (insbesondere Bromalkanen) und einem Alkalisulfit (zum Beispiel Natriumsulfit) oder Ammoniumsulfit die entsprechenden Sulfonsäuresalze dargestellt.[7][8]
Aromatische Sulfonsäuren
Arensulfonsäuren werden durch die Sulfonierung von Arenen hergestellt. Es findet eine elektrophile aromatische Substitution statt. Das elektrophile Reagens Schwefeltrioxid liegt in konzentrierter Schwefelsäure im Gleichgewicht vor.[7]
Weiter funktionalisierte Sulfonsäuren
Perfluoralkansulfonsäuren werden durch elektrochemische Fluorierung von Alkansulfonsäuren hergestellt. Dabei entsteht zunächst ein Säurefluorid, das durch Hydrolyse die Sulfonsäure ergibt.[8] 1-Hydroxyalkansulfonsäuren entstehen durch Addition von Natriumhydrogensulfit an Aldehyde (Bisulfit-Reaktion). Die Isethionsäure (2-Hydroxyethansulfonsäure) wird durch Reaktion von Ethylenoxid mit Natriumhydrogensulfit gewonnen.[8]
Eigenschaften
Zusammenfassung
Kontext
Alkansulfonsäuren sind im Allgemeinen viskose Flüssigkeiten, während Arensulfonsäuren hygroskopische Kristalle bilden. Diese lösen sich leicht in Wasser und können durch Natriumchlorid ausgesalzen werden. Einige Sulfonsäuren bilden stabile, kristalline Hydrate.[7] Der Schmelzpunkt von Methansulfonsäure beträgt 20 °C, der von Ethansulfonsäure −17 °C, die Schmelzpunkte der in der homologen Reihe folgenden Vertreter, Propansulfonsäure bis Hexansulfonsäure liegen zwischen diesen beiden Werten.[8]
Sulfonsäuren sind deutlich stärkere Säuren als Carbonsäuren und weisen in der Regel negative pKs-Werte auf. Die starke Säurewirkung beruht auf der Stabilität der korrespondierenden Base, des Sulfonatanions. Durch die gleichmäßige Delokalisierung der negativen Ladung auf die drei äquivalenten Sauerstoffe ist das Anion stark mesomeriestabilisiert. Trifluormethansulfonsäure ist sogar stärker sauer als Perchlorsäure und gehört damit zu der Gruppe der Supersäuren.[9] Die Vertreter der homologen Reihe einfacher Sulfonsäuren von Methansulfonsäure bis einschließlich Heptansulfonsäure sind in Wasser vollständig dissoziiert. Auch Benzolsulfonsäure und para-Toluolsulfonsäure sind starke Säuren. Die einfachste Disulfonsäure, Methandisulfonsäure, weist eine mit Schwefelsäure vergleichbare Säurestärke auf.[8]
Reaktionen
Nucleophile Substitution
Arensulfonate können bei Temperaturen von 200 bis 300 °C durch eine nucleophile Substitution in Amine, Phenole, Carbonsäuren oder Nitrile umgewandelt werden.[7]
Salzbildung
Sulfonsäuren sind wie Schwefelsäure starke Säuren, die mit Metallhydroxiden Salze bilden. Im Gegensatz zu den entsprechenden Sulfaten (Salze der Schwefelsäure) lösen sich aber Calcium-, Barium- und Blei(II)-sulfonate gut in Wasser.[7]
Desulfonierung von Arensulfonsäuren
Die Sulfonierung von Arenen zur Herstellung von Arensulfonsäuren ist eine reversible Reaktion. Die bei der Herstellung angegebene Benzolsulfonsäure wird beispielsweise durch verdünnte Salzsäure bei Temperaturen von 150 bis 200 °C zu Benzol hydrolysiert:[7]
Verwendung
Zusammenfassung
Kontext

Farbstoffe
Auch viele Farbstoffe tragen Sulfonatgruppen, um eine hohe Wasserlöslichkeit zu erreichen.
Tenside
Natriumsalze der Sulfonsäurederivate werden oft als anionische Tenside in Reinigungsmitteln eingesetzt.[10] Neben Seifen und Sulfaten sind verschiedene Sulfonatsalze, darunter die Alkylbenzolsulfonate, wichtige Tenside.[11]
- Tetrapropylenbenzolsulfonat (TBS)
- Natriumdodecylbenzolsulfonat, Beispiel aus dem Isomerengemisch.
- p-Toluolsulfonsäure ist ein wichtiges Reagenz in der organischen Synthese.
Chemische Synthese und Analytik
Kurzkettige Alkansulfonsäuren weisen eine große Säurestärke auf ohne oxidierend zu wirken. Insbesondere Methansulfonsäure wird daher als saurer Katalysator eingesetzt, beispielsweise für Veresterungen, Polymerisationen und für die Umsetzung von Carbonsäuren mit Wasserstoffperoxid zu Peroxycarbonsäuren.[8]
Ein wichtiges chemisches Intermediat ist die Isethionsäure. Sie dient zur industriellen Synthese von Taurin, N-Methyltaurin und von Tensiden (Isethionate). Weitere industriell wichtige Vertreter sind das Natriumhydroxymethansulfonat, das sich von der Hydroxymethansulfonsäure ableitet, sowie die Vinylsulfonsäure, die als Alkylierungsmittel eingesetzt und polymerisiert werden kann.[8]
Medizin
Des Weiteren sind Sulfonsäuren und ihre Derivate in Gerbstoffen und Arzneimitteln enthalten.[7]
Weitere Verwendungen
Eine spezielle Anwendung finden Polymere mit Sulfonatgruppen bei der Wasseraufbereitung, wo sie in Ionenaustauschern für Kationen eingesetzt werden.
Weblinks
Commons: Sulfonsäuren – Sammlung von Bildern, Videos und Audiodateien
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.








