Top-Fragen
Zeitleiste
Chat
Kontext
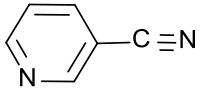
3-Cyanpyridin
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
3-Cyanpyridin ist eine wichtige Vorstufe für Nicotinaldehyd, Nicotinsäure (Niacin) und Nicotinsäureamid (Niacinamid), sowie für Pflanzenschutzmittel, wie z. B. das Insektizid Pymetrozin.
Remove ads
Remove ads
Vorkommen und Darstellung
Zusammenfassung
Kontext
Pyridin-3-sulfonsäure (aus Pyridin und Schwefeltrioxid in Gegenwart von Quecksilber(II)-sulfat bei 235 °C in Ausbeuten von >90 % erhältlich) reagiert nach Neutralisation mit Natronlauge als Natriumsalz beim Erhitzen mit Gemischen von Natriumcyanid und Kaliumcyanid in 45%iger Ausbeute zu 3-Cyanpyridin.[6][7]
Der nucleophile Austausch des Broms in 3-Brompyridin (durch Bromierung mit der ionischen Flüssigkeit N-Octylchinolinium-tribromid in 91%iger Ausbeute)[8] durch Cyanid aus Kupfer(I)-cyanid liefert Nicotinonitril in 67%iger Ausbeute.[9]
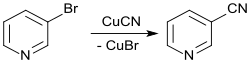
Wesentlich bessere Ausbeuten (93 %) erzielt die Umsetzung in Gegenwart der Organopalladiumverbindung Pd2(dba)3 [Tris(dibenzylidenaceton)dipalladium(0)], dem Phosphin t-Bu3P (Tri-tert. Butylphosphin) und Tributylzinnchlorid in Acetonitril bei 80 °C.[10]
Acrylnitril dimerisiert in einer Kopf-Schwanz-Anordnung z. B. in Gegenwart von Tricyclohexylphosphin PCy3 in 77%iger Ausbeute zu 2-Methylenglutarnitril (2,4-Dicyano-1-buten),[11] das nach Chlorierung zum 2-Chlor-2-chlormethylglutaronitril mit Lewis-Säuren, wie z. B. Zinn(IV)-chlorid oder Aluminiumchlorid zu 3-Cyanpyridin reagiert.[4]

Die oxidative Ammonolyse von Nikotin und seinen Nebenalkaloiden Nornikotin, Nicotyrin, Anabasin, Anatabin und Myosmin aus Tabakabfällen erzeugt mit Vanadium(V)-oxid/Titandioxid-Katalysatoren mit Ammoniak und Wasserstoffperoxid bei 420 °C Nicotinonitril in Ausbeuten bis 60 %.[12]

Die angegebenen Synthesewege eignen sich wegen teurer Edukte und Reagentien, geringen Ausbeuten und hohem apparativem Aufwand nicht für eine technische Synthese von 3-Cyanpyridin.
Durch Umsetzung von Nikotinsäure mit Diphosphortetraiodid/Ammoniumcarbonat kann Nicotinonitril in 88%iger Ausbeute,[13] mit Kupfer(I)-chlorid und dem Silylierungsmittel MSTFA (N-Methyl-N-(trimethylsilyl)trifluoracetamid) in 96%iger Ausbeute erhalten werden.[14]

Die Wasserabspaltung aus Nicotinsäureamid mittels Phosphorpentoxid erzeugt 3-CP in 83- bis 84%iger Ausbeute,[15] mit dem Schwefeltrioxid-Triethylamin-Komplex werden Ausbeuten von 95 % erzielt.[16]
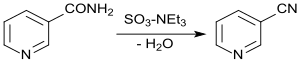
Auf dieser Reaktion beruht auch die ältere Variante der 3-Cyanpyridinsynthese der Lonza AG.[17]

In industriellem Maßstab hat sich neben der Dehydratisierung von Nicotinamid vor allem die Ammonoxidation von 3-Picolin in der Dampfphase[18] durchgesetzt. Dazu werden meist so genannte VPO-Katalysatoren, basierend auf Vanadium(V)-oxid und Phosphorpentoxid verwendet, die mit Übergangsmetalloxiden dotiert sind, wie z. B. Molybdän,[19][20] Titan,[21] mit Zusatz von Zirkon[22] oder Eisen.[23]

Die Ammonoxidation von 3-Methylpyridin ist hinsichtlich Katalysatorzusammensetzung, Reaktionszeit und Reaktionstemperatur (340–440 °C), Druck (Normaldruck) und der Zusammensetzung des Gemischs aus 3-Picolin, Ammoniak, Luft bzw. Sauerstoff und Wasser auf möglichst hohen Umsatz (bis 100 %), Selektivität (bis 100 %) und Ausbeute (>95 %) optimiert.
Eine moderne Syntheseroute startet mit 2-Methylpentan-1,5-diamin – einem Nebenprodukt der Adiponitrilsynthese (durch Hydrierung des durch Addition von HCN an die 2-Position von 1,3-Butadien statt an die erwünschte 1-Position erhaltenen sekundären Dinitrils), das zu 3-Methylpiperidin cyclisiert und zum 3-Methylpyridin dehydriert wird.[24][22]
Remove ads
Eigenschaften
3-Cyanpyridin ist ein weißer bis bernsteinfarbener Feststoff, der einen stechenden Geruch aufweist.[3] Die Verbindung löst sich in Wasser und in vielen organischen Lösungsmitteln und kann aus Petrolether zur Reinigung umkristallisiert werden.
Verwendung
Zusammenfassung
Kontext
Hydrierung von Nicotinonitril in verdünnter Essigsäure mit Raney-Nickel als Katalysator mit Reaktionsabbruch nach Aufnahme der theoretischen Menge an Wasserstoff liefert in 93%iger Ausbeute Nicotinaldehyd, eine Schlüsselkomponente für die Synthese des Insektizids Pymetrozin.[25]
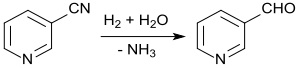
In einem neueren Verfahren wird Pymetrozin in einer Eintopfreaktion direkt aus 3-Cyanpyridin und dem Aminotriazinon bei der Hydrierung mit Raney-Nickel in Essigsäure mit 98%iger Ausbeute erhalten.[26]
Vollständige Hydrierung von Nicotinonitril in verdünnter Salzsäure mit Palladium auf Aktivkohle als Katalysator erzeugt 3-Aminomethylpyridin-hydrochlorid, das mit Ethylnitrit diazotiert und anschließend zum Nicotinylalkohol (3-Pyridinmethanol) verkocht werden kann.[27]

Bei der Umsetzung von Nicotinonitril mit der Grignard-Verbindung n-Propylmagnesiumbromid entsteht in 40%iger Ausbeute 3-Pyridyl-n-propylketon, das in einer Wolff-Kishner-Reaktion in 60%iger Ausbeute zum 3-n-Butylpyridin hydriert werden kann.[28]

Synthese der Vitamin B3-Formen Nicotinsäure (Niacin) und Nicotinamid (Niacinamid)
Die weitaus wichtigste Verwendung von Nicotinsäurenitril liegt in der Umsetzung zur Nicotinsäure und insbesondere zum Nicotinsäureamid.
Die vollständige chemische Hydrolyse von 3-Cyanpyridin mit konzentrierten Laugen führt zu Natriumnicotinat, aus dem mit Salzsäure die freie Nicotinsäure in 97%iger Ausbeute und in hoher Reinheit erhalten wird.[29]
Die enzymatische Hydrolyse mit Nitrilase liefert bei bis 100%igem Umsatz direkt reine Nicotinsäure aus Nicotinonitril.[30]
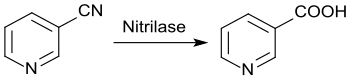
Die überwiegend industriell genutzten Alternativrouten zur chemischen Darstellung von Nicotinsäure[31] – die Oxidation von 3-Picolin mit konzentrierter Salpetersäure bzw. mit Sauerstoff an einem Vanadiumpentoxid-Kontakt oder die Oxidation von 2-Methyl-5-ethylpyridin (aus Acetaldehyd und Ammoniak) mit Salpetersäure – können von den Herstellern meist je nach Verfügbarkeit und Preis der Rohstoffe variiert werden.
Bei der partiellen chemischen Hydrolyse von 3-Cyanpyridin entsteht Nicotinsäureamid,[32] das aber meist 3–5 % Nicotinsäure als schwer abtrennbare Verunreinigung enthält, die bei der Gabe als Vitamin bei Nutztieren Durchfall verursachen kann, statt das Wachstum zu unterstützen.[33]
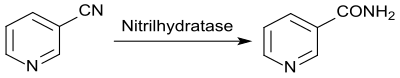
Dagegen liefert die enzymatische Hydrolyse mit der Nitrilhydratase von immobilisierten Zellen des Wildtyps Rhodococcus rhodochrous J1 als Biokatalysator in mehrstufigen Enzymreaktoren mit >99,3 % Selektivität bei 100%igem Umsatz hochreines Nicotinamid.[34] Dabei können Produktkonzentrationen von 1,465 g/l erzielt werden, wobei das feste Edukt Nicotinonitril bei der Hydrolyse allmählich solubilisiert wird und das Produkt (Nicotinamid) bei höheren Konzentrationen auskristallisiert, d. h. das Medium ist zu Beginn und Ende der Reaktion fest.[35]
Remove ads
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads