Loading AI tools
29. pierwiastek chemiczny Z Wikipedii, wolnej encyklopedii
Miedź (Cu, łac. cuprum) – pierwiastek chemiczny z grupy metali przejściowych. Nazwa łacińska (a za nią w innych językach, w tym angielskim) pochodzi od Cypru, gdzie w starożytności wydobywano miedź. Początkowo nazywano ją „metalem cypryjskim” (cyprum aes), a następnie cuprum. Ma 26 izotopów z przedziału mas 55–80. Trwałe są dwa: 63 i 65.
| nikiel ← miedź → cynk | |||||||||||||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||||||||||||
| czerwonobrunatny | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
Widmo emisyjne miedzi | |||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||
| Nazwa, symbol, l.a. |
miedź, Cu, 29 | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa, okres, blok | |||||||||||||||||||||||||||||||||||||||||||
| Stopień utlenienia |
0, I, II, III, IV | ||||||||||||||||||||||||||||||||||||||||||
| Właściwości metaliczne | |||||||||||||||||||||||||||||||||||||||||||
| Właściwości tlenków | |||||||||||||||||||||||||||||||||||||||||||
| Masa atomowa | |||||||||||||||||||||||||||||||||||||||||||
| Stan skupienia |
stały | ||||||||||||||||||||||||||||||||||||||||||
| Gęstość |
8920 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||
| Temperatura topnienia |
1084,62 °C[2] | ||||||||||||||||||||||||||||||||||||||||||
| Temperatura wrzenia |
2562 °C[2] | ||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą warunków normalnych (0 °C, 1013,25 hPa) | |||||||||||||||||||||||||||||||||||||||||||

Miedź ma gęstość 8,96 g/cm³ i temperaturę topnienia 1084,62 °C. Po wytopie i oczyszczeniu jest miękkim metalem o bardzo dobrym przewodnictwie cieplnym i elektrycznym. Miedź, srebro i złoto, leżąc w 11 grupie układu okresowego, mają pewne wspólne właściwości: mają jeden elektron na orbitalu s powłoki walencyjnej ponad zapełnioną powłoką elektronową d oraz odznaczają się wysoką plastycznością i przewodnictwem elektrycznym. Wypełnione powłoki d w tych pierwiastkach nie wnoszą zbyt dużego wkładu w oddziaływania międzyatomowe, które w wiązaniach metalicznych są zdominowane przez elektrony powłok s. W przeciwieństwie do metali z niepełnymi powłokami d, wiązanie metaliczne w miedzi nie ma charakteru kowalencyjnego i jest względnie słabe. Wyjaśnia to niską twardość i wysoką plastyczność kryształów miedzi[4]. Miedź można przerabiać plastycznie na zimno i na gorąco, ale w przypadku przeróbki na zimno następuje utwardzenie metalu (w wyniku zgniotu), które usuwa się przez wyżarzenie rekrystalizujące (w temp. 400–600 °C). Przeróbkę plastyczną na gorąco przeprowadza się w temp. 650–800 °C. W skali makroskopowej, wytworzenie podłużnych wad sieci krystalicznej, jak granice pomiędzy ziarnami czy zaburzenia przepływu pod przyłożoną siłą, zwiększa twardość miedzi. Z tego powodu miedź dostępna w handlu występuje w drobnoziarnistej polikrystalicznej formie, która ma większą odporność mechaniczną niż forma monokrystaliczna[5].
Niska twardość miedzi częściowo tłumaczy jej wysoką przewodność elektryczną (59,6⋅106 S/m) i przewodność cieplną, które są drugie pod względem wielkości wśród czystych metali w temperaturze pokojowej[6]. Jest to spowodowane tym, że oporność w przenoszeniu elektronów w metalach pochodzi głównie od rozpraszania elektronów na wibracjach cieplnych sieci krystalicznej, które w metalach miękkich są stosunkowo słabe[5]. Maksymalna dopuszczalna gęstość prądu dla miedzi w powietrzu wynosi w przybliżeniu 3,1⋅106 A/m² pola przekroju poprzecznego, powyżej tej wartości zaczyna się nadmiernie nagrzewać[7]. Tak jak w przypadku innych metali, jeśli miedź jest w kontakcie z innymi metalami, zachodzi korozja galwaniczna[8]. Wraz z osmem (niebieskawy), cezem (żółty) i złotem (żółty), miedź jest jednym z czterech metali, których naturalny kolor jest inny niż szary lub srebrny. Czysta miedź jest pomarańczowoczerwona, na powietrzu ciemnieje wskutek utleniania. Charakterystyczny kolor pochodzi od przejść elektronów z podpowłoki 3d na nie w pełni zapełnioną ostatnią podpowłokę 4s, dzięki energii fotonów z zakresu światła widzialnego, odpowiadającej barwie fioletowej i błękitnej – ich pochłonięcie powoduje powstanie obserwowanej wypadkowej czerwono-pomarańczowej barwy[4].


Czysta miedź zawiera 0,01–1,0% zanieczyszczeń[potrzebny przypis], zależnie od rodzaju wytwarzania, przetwarzania i oczyszczania. Za zanieczyszczenia uważa się Bi, Pb, Sb, As, Fe, Ni, Sn, Zn oraz S. Jest dość odporna chemicznie, zalicza się do metali półszlachetnych. Nie ulega działaniu kwasów w warunkach nieutleniających, natomiast w warunkach utleniających roztwarza się bez wydzielania wodoru[9]:
Miedź tworzy dużą różnorodność związków na I i II stopniu utlenienia (według dawnej nomenklatury nazywane odpowiednio miedziawymi lub miedziowymi)[10], znane są też nieliczne związki na stopniu utlenienia III (np. [CuF
6]3−
)[9][11] i IV (np. [CuF
6]2−
)[11]. Tworzy też nietrwałe kopleksy z tlenkiem węgla, w których występuje na 0 stopniu utlenienia (np. [Cu(CO)
3])[11]. Nie reaguje z wodą, ale na powietrzu pokrywa się cienką warstwą CuO, w wyniku czego ciemnieje i przybiera barwę określaną jako czerwona[12] lub czerwonobrązowa[13]. W przeciwieństwie do utleniania żelaza w wilgotnym powietrzu, utworzona warstwa tlenkowa zapobiega dalszej korozji. Zielona warstwa patyny (węglan hydroksomiedzi(II)) występuje na starych konstrukcjach miedzianych, jak dachy starych kościołów, czy na Statui Wolności, będącej największym na świecie pomnikiem stworzonym z udziałem techniki repusowania. Siarkowodór i siarczki reagują z miedzią, tworząc na powierzchni siarczki miedzi. Miedź może ulec korozji, jeśli narażona jest na kontakt z powietrzem zawierającym związki siarki[14]. Amoniakalne roztwory zawierające tlen dają rozpuszczalne w wodzie kompleksy miedzi, podobnie jak tlen i kwas solny, tworząc chlorki miedzi i zakwaszony nadtlenek wodoru, tworząc sole miedzi(II). Chlorek miedzi(II) i miedź ulegają komproporcjonowaniu, tworząc chlorek miedzi(I)[15].
Miedź metaliczna w postaci pyłu jest bardzo łatwopalna i szkodliwa dla środowiska[16].
Pięciowodny siarczan miedzi(II) CuSO
4·5H
2O (występujący naturalnie jako minerał chalkantyt) ma własności odkażające, a bezwodny jest higroskopijny i niekiedy stosowany jest do osuszania rozpuszczalników. Kompleksy miedzi są trwałe, jednak dość łatwo jest w nich zmieniać stopień utlenienia miedzi i dlatego są one często stosowane jak katalizatory reakcji redoks. Związki miedzi(I) są trudno rozpuszczalne w wodzie, natomiast wodne roztwory soli miedzi(II) z reguły mają barwę niebieską lub niebiesko-zieloną.

Występuje w skorupie ziemskiej w ilościach 55 ppm. W naturze występuje w postaci rud oraz w postaci czystej jako minerał – miedź rodzima. Miedź rodzima jest rzadko spotykana. Głównym źródłem tego metalu są minerały oznaczone jako rudne w poniższej tabeli.
| Nazwa minerału | Wzór chemiczny | Minerał rudny |
|---|---|---|
| Miedź rodzima | Cu | Tak |
| Kowelin | CuS | Tak |
| Chalkozyn | Cu 2S |
Tak |
| Chalkopiryt | CuFeS 2 |
Tak |
| Bornit | Cu 5FeS 4 |
Tak |
| Tenoryt | CuO | Nie |
| Kupryt | Cu 2O |
Nie |
| Malachit | Cu 2CO 3(OH) 2 |
Nie |
| Azuryt | Cu 3(CO 3) 2(OH) 2 |
Nie |
| Tennantyt | Cu 12As 4S 13 |
Nie |
| Tetraedryt | [Cu,Fe] 12Sb 4S 13 |
Nie |
| Chalkantyt | CuSO 4·5H 2O |
Nie |
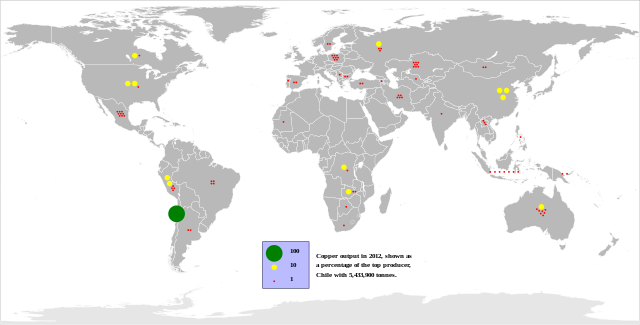

Ze względu na duże zapotrzebowanie i stosunkowo małe zasoby naturalne, miedź stanowi materiał strategiczny. Większość miedzi wydobywa się jako siarczek w kopalniach odkrywkowych ze złóż porfiru miedziowego zawierającego do 1% miedzi. W światowym wydobyciu rud miedzi w przeliczeniu na czysty składnik, wynoszącym w 2010 r. łącznie 16,2 mln ton, przodowały: Chile (5,52 mln ton), Peru (1,28 mln ton), Chiny (1,15 mln ton) USA (1,12 mln ton), Australia (900 tys. ton), Indonezja (840 tys. ton), Zambia (770 tys. ton), Rosja (750 tys. ton), Kanada (480 tys. ton), Polska (430 tys. ton) i Kazachstan (400 tys. ton)[17].
Do krajów posiadających największe szacowane zasoby miedzi należą: Chile (150 mln ton), Peru (90 mln ton), Australia (80 mln ton), Meksyk (38 mln ton), Stany Zjednoczone (35 mln ton), Chiny, Indonezja i Rosja (30 mln ton) oraz Polska, której znane zasoby są szacowane na 26 mln ton[17]. Głównym ośrodkiem przemysłu miedziowego w Polsce jest Legnicko-Głogowski Okręg Miedziowy.
Rudy miedzi zawierają nieznaczne ilości miedzi. W celu oddzielenia siarczków miedzi od skały płonnej, stosowana jest flotacja. Otrzymane w ten sposób koncentraty miedzi przerabiane są w piecach hutniczych (np. piec zawiesinowy), a produktem wytopu jest kamień miedziowy. Po procesie konwertorowania odlewane są anody miedziowe, poddawane elektrorafinacji. Produktem huty są katody, które w zależności od przeznaczenia przetapiane są na wlewki różnego kształtu i wielkości.
Miedź, tak jak aluminium, jest w 100% poddawana recyklingowi bez straty jakości. W objętości, miedź jest trzecim po żelazie i aluminium najczęściej odzyskiwanym metalem. Szacuje się, że w użyciu jest 80% kiedykolwiek wydobytej miedzi[18]. Recykling w latach 2002–2008 dostarczał około 35% zużywanej miedzi[19]. Ze względu na charakter surowca przewiduje się, że w ciągu następnych lat udział recyklingu w ogólnej produkcji miedzi będzie rósł. Proces odzyskiwania miedzi przebiega w ten sam sposób jak w procesie jej otrzymywania, wymaga jednak mniejszej liczby etapów. Wysokiej czystości złom jest topiony w piecu, a następnie redukowany i wylewany w postaci kęsów i sztabek; niskiej czystości złom jest poddawany elektrorafinacji w kąpieli kwasu siarkowego[20].

Miedź obok żelaza odegrała wyjątkową rolę w rozwoju cywilizacji ludzkiej. Pierwiastek ten znany jest od starożytności, od kiedy był podstawowym składnikiem brązów, od których nazwano epokę brązu. Głównym zastosowaniem miedzi jest produkcja przewodów elektrycznych (60%), pokryć dachów i instalacji wodociągowych (20%) oraz maszyn przemysłowych (15%). Miedź używana jest głównie jako czysty metal lub – gdy wymagana jest większa twardość – w postaci stopów z innymi metalami (5% całkowitego zużycia), takich jak brąz czy mosiądz[21]. Mała część miedzi jest używana w produkcji związków będących dodatkami do żywności i fungicydami, stosowanymi w rolnictwie[22][23], a także stosowana jako barwnik szkła czy katalizator.
W roku 2009 ogólnoświatowa konsumpcja miedzi wynosiła około 22,1 mln ton[19]. Źródłami miedzi była miedź wydobywana w kopalniach (w 2009 roku było to ponad 15 mln ton) oraz miedź pozyskiwana z recyklingu, który w 2008 roku dostarczył około 35% ogółu konsumowanej miedzi[19]. Do największych konsumentów miedzi należą (2009): Chiny (7,87 mln ton), Europa Zachodnia (3,13 mln ton), Ameryka Północna (2,47 mln ton), Japonia (1,22 mln ton), Indie (0,92 mln ton) oraz Korea Południowa (0,76 mln ton)[19]. Miedź jest używana w budownictwie (7,26 mln ton, w tym do budowy instalacji elektrycznych i wodociągowych, odpowiednio 5,27 i 1,33 mln ton), infrastrukturze (3,26 mln ton, w tym do budowy infrastruktury elektrycznej i telekomunikacyjnej, odpowiednio 2,54 i 0,72 mln ton) oraz budowie maszyn (11,57 mln ton, w tym maszyny przemysłowe, ogólnie pojętego transportu, chłodzące, urządzenia elektroniczne, odpowiednio 2,74; 2,56; 1,33; 0,77 mln ton)[19].
Właściwości elektryczne miedzi są wykorzystywane w przewodach miedzianych oraz budowanych w oparciu o nie urządzeniach takich jak transformatory, cewki czy elektromagnesy. W układach scalonych i obwodach drukowanych stosuje się ją ze względu na bardzo dobrą przewodność elektryczną. W radiatorach i wymiennikach ciepła korzysta się z niej ze względu na wyższe rozpraszanie ciepła w stosunku do powszechnie używanego aluminium. Miedź jest używana także do budowy lamp elektronowych, monitorów CRT i magnetronów jako falowodów promieniowania mikrofalowego[24].
Metal jest dodawany do wielu stopów, zarówno do stali, jak i do stopów aluminium. Jest też dodawany do srebra i złota, poprawiając znacznie ich własności mechaniczne. Miedź z cyną, molibdenem i innymi metalami przejściowymi tworzy cały zestaw stopów zwanych ogólnie brązami. W stopach z cynkiem i innymi dodatkami tworzy mosiądze, mające bardzo dobre własności mechaniczne oraz znaczną odporność na korozję i dzięki temu bardzo wszechstronne zastosowania. Stopów tych używa się do wyrobu kosztownej armatury i elementów precyzyjnych urządzeń mechanicznych. W jubilerstwie stosowany jest udający złoto tombak.
Ze względu na odporność metalu na wodę, miedź była używana już od czasów starożytnych jako materiał pokryć dachowych. Zielony kolor starszych budynków pochodzi od zachodzącej przez długi czas reakcji, w której miedź jest utleniana najpierw do tlenku miedzi(II), następnie przechodzi w siarczek miedzi(I) lub (II), by w końcu utworzyć hydroksowęglan miedzi(II), nazywany patyną, która jest wysoko odporna na korozję. Piorunochrony są wyrabiane z miedzi w celu skutecznego uziemiania piorunów. Miedź nadaje się do lutowania i spawania w łuku gazowo-metalowym[25].
Metaliczna miedź (podobnie jak metaliczne srebro) wykazuje właściwości antybakteryjne[26]. Od dawna jest używana jako biostatyczna powierzchnia pokrycia statków, chroniąca przed skorupiakami i omułkami. Pierwotnie była używana czysta miedź, lecz wyparł ją metal Muntza, będący formą mosiądzu o składzie 60% miedzi i 40% cynku. Podobne zastosowanie miedź znalazła w akwakulturze do konstrukcji sieci i innych elementów narażonych na obrastanie organizmami roślinnymi i zwierzęcymi[27]. Jej biostatyczne właściwości usprawiedliwiają użycie jako materiału do wyrobu klamek do drzwi (ograniczenie ilości przenoszonych bakterii) i rur wodociągowych[28]. Opublikowane w 2011 roku badania potwierdzają, że stosowanie powierzchni pokrywanych miedzią redukuje ilość patogenów znajdujących się na powierzchniach w salach OIOM o 97% (bakterie znajdujące się na salach OIOM są odpowiedzialne za 35–80% infekcji wśród pacjentów)[29].
Miedź występuje powszechnie w wielu organizmach roślinnych i zwierzęcych. Jako mikroelement jest niezbędna dla życia wielu organizmów, biorąc udział m.in. w fotosyntezie i oddychaniu, jednak niektóre giną już przy bardzo niskich jej stężeniach. Dotyczy to np. skrętnicy, choć inne glony też są stosunkowo wrażliwe na obecność jonów miedziowych w wodzie, przez co sole miedzi mogą być stosowane jako algicydy[30].
Miedź jest mikroelementem występującym w centrach aktywnych wielu enzymów, dzięki łatwości pobierania i oddawania elektronu w czasie zmiany stopnia utlenienia. Potrzebna jest do tworzenia się krwinek czerwonych, wchodzi w skład hemocyjaniny, wpływa pozytywnie na błonę otaczającą komórki nerwowe, bierze udział w przesyłaniu impulsów nerwowych. Wchodzi w skład dysmutazy ponadtlenkowej, enzymu o działaniu przeciwutleniającym, chroniącego błony komórkowe przed wolnymi rodnikami. Ponadto bierze udział w tworzeniu tkanki łącznej (wiązania poprzeczne w cząsteczkach kolagenu i elastyny katalizowane przez oksydazę lizylową) i syntezie prostaglandyn, związków zwanych hormonami miejscowymi, wpływających między innymi na czynność serca i ciśnienie tętnicze krwi. U fotoautotrofów wchodzi w skład plastocyjaniny.
Jej minimalne dzienne spożycie wynosi 0,5 ppm. Genetycznie uwarunkowany defekt metabolizmu miedzi prowadzi do wystąpienia schorzenia zwyrodnienia wątrobowo-soczewkowego – choroby Wilsona. Niedobór miedzi może stać się przyczyną niedokrwistości, ponieważ zbyt mała ilość tego pierwiastka powoduje gorsze wchłanianie żelaza i zmniejszenie liczby czerwonych krwinek.
Wchłanianie miedzi (podobnie jak jonów innych metali) w przewodzie pokarmowym jest blokowane przez białka mleka i jaj oraz warzywa kapustne (kapustowate) i amarylkowate zawierające duże ilości związków siarki (np. kapusta, cebula, por, czosnek, gorczyca). Spożywanie tych produktów łącznie z pokarmem o dużej zawartości miedzi znacząco zmniejsza wchłanianie tego pierwiastka przez organizm. Owoce morza obok miedzi zawierają bardzo dużo cynku, który całkowicie blokuje wchłanianie miedzi.
Spożywanie nadmiaru miedzi prowadzić może do zaburzeń pokarmowych i uszkodzenia wątroby. Może to mieć miejsce w przypadku spożywania wody pitnej o niskiej twardości lub niskim pH dostarczanej miedzianą instalacją wodociągową (woda taka wypłukuje miedź z instalacji)[31]. Szacuje się, że bezpieczne dzienne spożycie miedzi waha się w przedziale 2–3 mg, okazyjnie do 10 mg na dzień (dla dorosłych)[32]. Dawka śmiertelna odpowiada około 30 g siarczanu miedzi. Objawy zatrucia są podobne do zatrucia arszenikiem. W przypadku podejrzenia zatrucia podaje się albuminę w mleku lub białku jaj.

Innymi produktami spożywczymi o dużej zawartości miedzi są (RDA w 100 g produktu): ziarna soi (54% RDA), siemię lniane (61% RDA), grzyby shiitake (45% RDA), otręby pszenne (50% RDA), ziarna arbuza (34% RDA), suszone śliwki (31% RDA) i papryka (30% RDA)[33].
W wodzie z instalacji miedzianych większe ilości miedzi znajdują się w wodzie ciepłej niż w zimnej. Jest to istotne przy przygotowywaniu posiłków dla dzieci, dla których dzienne dawki miedzi są mniejsze niż dla dorosłych[32].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.