Loading AI tools
zagrażająca życiu dysfunkcja narządowa, wywołana reakcją organizmu na zakażenie Z Wikipedii, wolnej encyklopedii
Sepsa, posocznica, endotoksemia (łac. sepsis) – specyficzna reakcja organizmu na zakażenie. Sepsa nie jest samodzielną jednostką chorobową, a obecnie definiuje się ją jako zagrażającą życiu dysfunkcję narządową spowodowaną zaburzoną regulacją odpowiedzi ustroju na zakażenie[1].
| sepsis |
Dawniej sepsą nazywano zespół ogólnoustrojowej reakcji zapalnej (SIRS) wywołany zakażeniem.

W ujęciu historycznym utożsamiana była z zakażeniem krwi – bakteriemią. Aktualnie do rozpoznania sepsy nie jest niezbędne stwierdzenie obecności drobnoustrojów we krwi, aczkolwiek w większości przypadków dochodzi do rozsiewu drobnoustrojów drogą układu krwionośnego. Sepsa stanowi poważny problem epidemiologiczno-terapeutyczny, zwłaszcza na oddziałach intensywnej terapii, ale występuje także w warunkach pozaszpitalnych. Najczęściej przyczyną sepsy są infekcje w obrębie jamy brzusznej, zapalenie płuc, zapalenie opon mózgowo-rdzeniowych i infekcje układu moczowego, lecz u osób predysponowanych może ją wywołać każde inne zakażenie. Z bakteriologicznego punktu widzenia przyczyną sepsy może być każdy drobnoustrój, stosunkowo rzadko są to pasożyty, wirusy i bakterie atypowe (np. prątek gruźlicy). W warunkach szpitalnych sepsę wywołują najczęściej patogeny, które w normalnych warunkach nie są groźne (tzw. potencjalnie chorobotwórcze). Są to głównie bakterie Gram-ujemne – Acinetobacter baumannii, Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, ale również bakterie Gram-dodatnie – Staphylococcus aureus, paciorkowce. W warunkach pozaszpitalnych bakterią najczęściej kojarzoną z piorunującymi postaciami sepsy jest dwoinka zapalenia opon mózgowo-rdzeniowych (Neisseria meningitidis) i inne patogeny wywołujące zapalenie opon mózgowo-rdzeniowych.
Do sepsy najczęściej dochodzi w warunkach oddziału intensywnej terapii. Dzieje się tak ze względu na ciężki stan przebywających tam chorych oraz liczbę wykonywanych inwazyjnych procedur medycznych niezbędnych w procesie terapeutycznym. Poza szpitalem sepsa dotyka głównie dzieci i młodzież oraz osoby starsze i osłabione. Szczególnie narażone są osoby przebywające przez długi okres w dużych skupiskach ludzkich, takich jak żłobki, przedszkola, szkoły, koszary, więzienia itp.
Mechanizm sepsy jest skomplikowany, wielopłaszczyznowy i zachodzi na poziomie komórkowym oraz tkankowym. Sepsa jest reakcją organizmu na czynnik zakaźny (najczęściej jest to lipopolisacharyd). Rozwija się uogólniona reakcja zapalna, w której biorą udział liczne cytokiny i chemokiny. W trakcie rozwoju sepsy dochodzi również do zmian na poziomie narządowym, w wyniku których rozwija się ich niewydolność.
Rozpoznanie sepsy stawiano dawniej na podstawie stwierdzenia objawów SIRS. Obecnym kryterium rozpoznania sepsy jest nagła zmiana wyniku oceny w skali SOFA (Sepsis-related organ failure assessment score) o co najmniej 2 punkty, jeśli występuje podejrzenie zakażenia. Następnym etapem jest potwierdzenie obecności specyficznego patogenu w badaniach mikrobiologicznych.
Leczenie sepsy jest długotrwałe i obarczone dużym ryzykiem niepowodzenia. Powinno się odbywać na oddziałach intensywnej terapii. Stosuje się w nim antybiotykoterapię, płynoterapię, kortykosteroidy, leki obkurczające naczynia krwionośne i pobudzające kurczliwość mięśnia sercowego i inne. Nie istnieje szczepionka, która zabezpieczałaby przed wystąpieniem sepsy. Szczepienia mogą jedynie zmniejszyć częstość infekcji patogenami, które mogą doprowadzić do sepsy (np. szczepionka przeciwko Neisseria meningitidis wywołującej zapalenie opon mózgowo-rdzeniowych).
Istnieją kontrowersje odnośnie do właściwej polskiej nazwy schorzenia. Prof. Andrzej Szczeklik w swojej książce Choroby wewnętrzne[2] zaznacza tendencję do odchodzenia od nazwy „posocznica” na rzecz określenia – „sepsa”. Tym samym terminem posługuje się Polska Grupa Robocza ds. Sepsy przy Polskim Towarzystwie Anestezjologii i Intensywnej Terapii. Określenie sepsa zostało również użyte przy tłumaczeniu aktualnych wytycznych Surviving Sepsis Campaign odnośnie do postępowania w sepsie i wstrząsie septycznym, jako polskie określenie angielskiego terminu severe sepsis. Z drugiej strony prof. Jacek Juszczyk w monografii Posocznica[3] za poprawną polską nazwę uznaje posocznicę, termin sepsa zaś określa jako żargonowe spolszczenie nazwy łacińskiej. Z kolei prof. Zdzisław Kruszyński w książce Podstawy anestezjologii i intensywnej terapii[4] traktuje nazwy posocznica i sepsa jako równorzędne.
Termin posocznica pochodzi od słowa „posoka”, czyli „zepsuta krew”[5]. Łacińskim odpowiednikiem jest septicemia, obecnie nieużywany.
Jako „ciężką sepsę” (ciężka posocznica, zespół septyczny) określano dawniej sepsę z towarzyszącą niewydolnością wielonarządową. Wytyczne Surviving Sepsis Campaign (SSC) z 2016 roku wprowadziły nową definicję sepsy, która jest tożsama z pojęciem „ciężkiej sepsy”.
Wstrząs septyczny rozwija się w chwili, kiedy pomimo prawidłowego nawodnienia, dochodzi do uporczywego spadku ciśnienia tętniczego powodującego upośledzenie perfuzji narządowej (spadek przepływu tkankowego krwi). Jest to stan, który wymaga podawania leków obkurczających naczynia (wazopresorów).
Termin σήψις (sepsis) wprowadził Hipokrates w IV wieku p.n.e. i oznaczał on proces gnicia albo rozkładu materii organicznej. Określenia „gnicie krwi” dla chorób o ciężkim przebiegu połączonych z procesem ropnym użył Awicenna w XI wieku[6].
W 1892 r. Richard Pfeiffer odkrył, że ciężka reakcja septyczna podczas zakażenia przecinkowcem cholery była spowodowana endotoksyną[7]. Przez wiele lat używano niesprecyzowanego pojęcia sepsis, stopniowo ograniczając jego użycie do zakażeń ogólnoustrojowych.
Pierwszą klasyfikację obrazu klinicznego sepsy i ujednolicenie pojęć z nią związanych przyniosło opracowanie American College of Chest Physicians i Society of Critical Care Medicine (ACCP/SCCM) z 1991 roku[8]. Wytyczne postępowania w ciężkiej sepsie i we wstrząsie septycznym przedstawiła Surviving Sepsis Campaign w 2004 roku[9].
W 2016 roku opublikowane zostały nowe wytyczne leczenia sepsy Surviving Sepsis Campaign, w których zawarto zaktualizowane definicje sepsy SEPSIS-3[1].
Sepsa stanowi poważny problem kliniczny, zwłaszcza na oddziałach intensywnej terapii. W Stanach Zjednoczonych wykrywa się w ciągu roku około 750 000 nowych przypadków ciężkiej posocznicy[10]. Sepsa jest tam drugą, po chorobach układu krążenia, najczęstszą przyczyną zgonu na oddziałach intensywnej terapii. Według Centers for Disease Control and Prevention sepsa do 2000 roku stanowiła dziesiątą najczęstszą przyczynę zgonu w USA[11]. Występuje u 1–2% wszystkich hospitalizowanych pacjentów i u 25% pacjentów wymagających intensywnych zabiegów medycznych. W krajach Unii Europejskiej na ciężką sepsę umiera rocznie 146 000 pacjentów[10].
W Polsce dopiero od niedawna prowadzone są badania na temat sepsy. Częstość występowania sepsy na oddziałach intensywnej terapii wynosiła 34%, ciężkiej sepsy 16%, a wstrząsu septycznego 6%[12]. Rosnącą częstość występowania sepsy przypisuje się starzeniu populacji, występowaniu chorób przewlekłych, zaburzeń odporności, a także stosowaniu na szeroką skalę antybiotyków, glikokortykosteroidów, inwazyjnych zabiegów.

Do posocznicy najczęściej dochodzi w wyniku zakażenia bakteryjnego. Bakterie są odpowiedzialne za 75–85% przyczyn sepsy[13]. Jest poważnym problemem na oddziałach intensywnej terapii stanowiąc jedną z głównych przyczyn zgonów. Najczęstszymi patogenami na tych oddziałach są drobnoustroje, które w normalnych warunkach nie są groźne, określane są jako potencjalnie chorobotwórcze. Do nich należą głównie bakterie Gram-ujemne takie jak: Acinetobacter baumannii[14] Pseudomonas aeruginosa, pałeczka okrężnicy, Klebsiella pneumoniae[15], czy bakterie Gram-dodatnie – Staphylococcus aureus, paciorkowce. Z zakażeń grzybiczych najczęściej występuje infekcja Candida albicans.
W warunkach pozaszpitalnych za wystąpienie sepsy odpowiedzialne są głównie patogeny wywołujące zapalenie opon mózgowo-rdzeniowych, takie jak: Neisseria meningitidis, Haemophilus influenzae czy Streptococcus pneumoniae.

Obecnie uważa się, że do rozpoznania sepsy nie jest konieczne stwierdzenie obecności bakterii we krwi. Dodatnie posiewy są stwierdzane jedynie w 20–40% przypadkach ostrej sepsy[13] (40–70% w przypadku wstrząsu septycznego). Ogólnoustrojową reakcję zapalną wywołuje lokalne szerzenie się antygenów patogennych lub toksyn.
Zakażenie będące punktem wyjścia sepsy może mieć charakter jawny i dotyczyć różnych narządów, np. zapalenie otrzewnej, ostre zapalenie trzustki, odmiedniczkowe zapalenie nerek, zapalenie płuc, neuroinfekcje, jak i utajony – najczęściej infekcje zębów i tkanek okołozębowych, zatok przynosowych, migdałków czy pęcherzyka żółciowego. Zgodnie z badaniami przeprowadzonymi przez Polską Grupę Roboczą ds. Sepsy przy Polskim Towarzystwie Anestezjologii i Intensywnej Terapii najczęstszym punktem wyjścia zakażenia stanowiącego przyczynę umieszczenia w oddziałach intensywnej terapii były infekcje w obrębie jamy brzusznej.

Do czynników ryzyka wystąpienia posocznicy zalicza się:
W warunkach pozaszpitalnych sepsa dotyczy głównie dzieci, młodzieży i osób w wieku podeszłym, osób z obniżoną odpornością, osłabionych, zarówno psychicznie, jak i fizycznie, przebywających w dużych skupiskach ludzkich (szkoły, żłobki, przedszkola, koszary, więzienia).

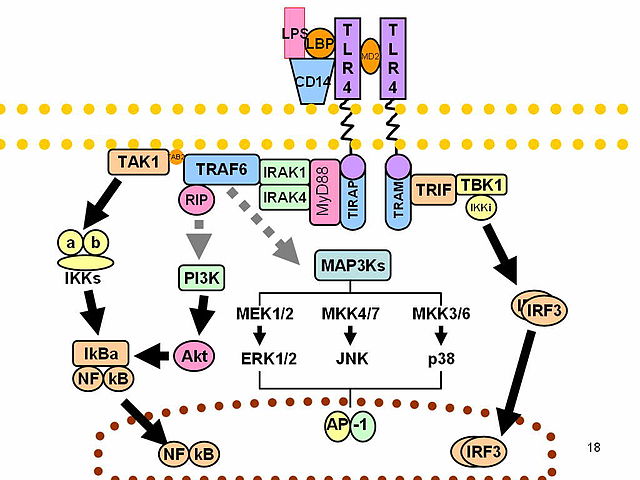
Za rozwój sepsy najczęściej odpowiedzialne są bakterie. Proces zapalny rozwija się w wyniku oddziaływania na organizm składników drobnoustrojów. Do najlepiej poznanych mechanizmów patogenetycznych należy mechanizm działania lipopolisacharydu[14]. Lipopolisacharyd (LPS) jest endotoksyną występującą w ścianie komórkowej większości bakterii Gram-ujemnych. Uwalniana jest ona w momencie zniszczenia komórki bakteryjnej, czy to przez naturalne mechanizmy odpornościowe, czy to chemioterapeutyki. Po przedostaniu się do krwiobiegu wiąże się ze specjalnymi białkami wiążącymi (LBP). Taki kompleks jest wychwytywany przez receptory CD 14 znajdujące się na powierzchni monocytów, makrofagów i neutrofilów, a także receptory wolno krążące w osoczu (są one później wychwytywane przez komórki śródbłonka). Po związaniu kompleksu LBP-lipopolisacharyd z CD 14 dochodzi do przekazania sygnału do wnętrza komórki przy pomocy receptorów TLR[16][17] (w przypadku LPS jest to TLR 2 i 4) oraz białka MD-2.
Przekazany sygnał powoduje odłączenie inhibitora od czynnika jądrowego NFκB, który, uaktywniony w ten sposób, wnika do jądra komórkowego i indukuje ekspresję genów kodujących mediatory reakcji zapalnej. W wyniku tego następuje wyrzut cytokin i chemokin prozapalnych takich jak: interleukina 1, interleukina 6, interleukina 12, interleukina 15, interleukina 18 oraz TNF-α. TNF-α jest jednym z głównych mediatorów reakcji septycznej, stymuluje leukocyty i komórki śródbłonka do wydzielania innych cytokin oraz samego siebie[18].
Poziom TNF-α jest wysoki u wszystkich pacjentów z ostrą sepsą. Również w badaniach doświadczalnych, jego dożylne podanie zwierzętom wywoływało objawy posocznicy. W efekcie dochodzi do rozwoju uogólnionej reakcji zapalnej, w której biorą udział również leukotrieny (silne mediatory niedokrwienia), prostaglandyny (PGE2 i prostacyklina rozszerzają naczynia obwodowe), tromboksany (zwęża naczynia i zwiększa zlepianie się trombocytów), białka ostrej fazy, ICAM, PAF (stymuluje agregację i degranulację neutrofilów oraz wzmaga zlepienia trombocytów), iNOS, rodniki tlenowe.
Istotnym objawem rozwijającej się reakcji septycznej jest rozsiane wykrzepianie wewnątrznaczyniowe. TNF-α pobudza monocyty do ekspresji czynnika tkankowego, który wiąże się z czynnikiem VIIa tworząc czynny kompleks, który z kolei aktywuje czynniki: X i IX. Następuje rozwinięcie kaskady krzepnięcia i zwiększone wytwarzanie włóknika. Dochodzi do zakrzepicy i krwotoków (efekt nasilają dodatkowo zaburzenia w obrębie białka C, antytrombiny III i PAI-1[19][20]).
Równocześnie do uogólnionej reakcji zapalnej (SIRS) zachodzą procesy przeciwzapalne (CARS – compensatory antiinflammatory response syndrome), w których biorą udział m.in. interleukina 4, interleukina 10 czy interleukina 13. We krwi podczas sepsy wzrasta również poziom TGF-β, kortyzolu, rozpuszczalnych receptorów TNF, które zmniejszają intensywność reakcji. Przy przewadze czynników przeciwzapalnych, jak to ma miejsce np. u osób osłabionych czy starszych, dochodzi do upośledzenia odporności i możliwości pogłębienia ciężkości sepsy[21].
Największą rolę w patogenezie sepsy i rozwoju niewydolności narządowej przypisuje się śródbłonkowi. Warunkuje on, po stymulacji mediatorami prozapalnymi, adhezję i migrację leukocytów do okolicznych tkanek. Rezultatem tego jest uszkodzenie zarówno śródbłonka, jak i tkanek.
Leukocyty gromadzą się na powierzchni śródbłonka przy pomocy selektyn (selektyny P i E na śródbłonku i selektyny L na limfocytach) po wzbudzeniu przez mediatory prozapalne. Następuje adhezja i rulonizacja, w których uczestniczą cząsteczki adhezji międzykomórkowej (ICAM). Odpowiednio silnie związane ze śródbłonkiem leukocyty migrują następnie do otaczających tkanek, głównie przez ściany żyłek postkapilarnych (w mniejszym stopniu przez włośniczki). Całość procesu prowadzi do uszkodzenia śródbłonka. Cytokiny prozapalne indukują apoptozę komórkową, na którą nakłada się działanie uaktywnionych neutrofilów prowadzące do wytworzenia rodników tlenowych.

Dużą rolę w rozwoju niewydolności wielonarządowej w patogenezie sepsy przypisuje się również tlenkowi azotu(II) (NO). Przy intensywnej stymulacji przez mediatory prozapalne dochodzi do zwiększonego wytwarzanie przez syntazę tlenkoazotową iNOS[22] NO, który wypiera z oksydazy mitochondrialnego cytochromu c (tzw. kompleks IV) O2. Następuje upośledzenie łańcucha oddechowego i zwiększone powstawanie rodników tlenowych takich jak, m.in., anion nadtlenkowo-azotynowy, który nieodwracalnie uszkadza kompleksy I i III, prowadząc do apoptozy. Jako że w sepsie dochodzi do zaburzeń mitochondrialnych na poziomie różnych tkanek, posocznica prowadzi do niewydolności wielonarządowej.
Do innych składników drobnoustrojów biorących udział w patogenezie sepsy zalicza się:
W trakcie rozwoju sepsy dochodzi również do zmian na poziomie narządowym.
Następuje nadmierne rozszerzenie łożyska naczyniowego na skutek nadmiernego wydzielania tlenku azotu[23]. (patrz wyżej). W prawidłowych warunkach NO po wytworzeniu w komórkach śródbłonka przechodzi do okolicznych tkanek wnikając do komórek mięśniowych gładkich i uaktywniając cyklazę guanylową. Dochodzi wtedy do zwiększenia poziomu cGMP i następczego spadku poziomu wolnego wapnia. Efektem tego jest relaksacja mięśnia. Przy patologicznie zwiększonym wytwarzaniu NO dochodzi do nadmiernego poszerzenia łożyska naczyniowego i nierównomiernej podaży tlenu.
W trakcie rozwoju sepsy dochodzi do zwolnienia szybkości skurczu i relaksacji serca. Może być to wynikiem zmniejszenia ilości kanałów wapniowych umieszczonych w sarkolemie (tzw. receptorów rianodynowych) na skutek działania tlenku azotu i TNF-α. Powoduje to spadek szybkości uwalniania jonów wapniowych z sarkolemy z jednoczesnym spowolnieniem wychwytu zwrotnego tych jonów z powrotem do siateczki sarkolemowej.
Zaburzenia hematologiczne występujące podczas sepsy sprowadzają się głównie do wystąpienia zespołu rozsianego wykrzepiania wewnątrznaczyniowego (DIC). Objawia się on wydłużeniem czasów krzepnięcia, spadkiem poziomu fibrynogenu oraz płytek krwi. Jest spowodowany pobudzeniem przez cytokiny zewnątrzpochodnego układu krzepnięcia oraz nieprawidłowym działaniem mechanizmów antykoagulacyjnych (antytrombina III, trombomodulina). Prowadzi to do powstawania licznych drobnych zakrzepów w naczyniach co dodatkowo jeszcze zaburza transport i wykorzystanie przez tkanki tlenu.
Negatywne oddziaływanie uogólnionego zakażenia na wątrobę skutkuje hiperbilirubinemią i zwiększeniem poziomu aminotransferaz. Niedotlenienie tego narządu jakie jest wynikiem sepsy prowadzi do zwiększonego przepływu krwi przez układ wrotny. Objawy niewydolności wątroby ujawniają się z chwilą niewystarczającego przepływu wątrobowego.

W płucach dochodzi do zaburzenia czynności śródbłonka w wyniku nacieczenia przez neutrofile, skutkującego wynaczynieniem płynu do tkanki śródmiąższowej i do wnętrza pęcherzyków płucnych. Prowadzi to do rozwoju zespołu ostrej niewydolności oddechowej (ARDS). Wynikiem tego jest zapadanie się pęcherzyków, przeciekanie nieutlenowanej krwi przez płuca, zmniejszenie podatności i czynnościowej pojemności zalegającej (FRC) oraz hipoksemia. Podczas sepsy dochodzi również do zwiększonego wytwarzania przez makrofagi płucne interleukiny 8 co ostatecznie pogłębia proces chorobowy.
W nerkach dochodzi do rozwoju ostrej niewydolności nerek w wyniku poszerzenia łożyska naczyniowego i niedostatecznej perfuzji narządu, a także na skutek działania różnych czynników takich jak np. endotelina, tromboksan A2, neutrofile czy czynniki krzepnięcia. Objawem niewydolności jest zazwyczaj oliguria, niemniej czasami dochodzi do rozwinięcia niewydolności nerek z towarzyszącą poliurią.
Zaburzenia metaboliczne w przebiegu sepsy są spowodowane nadmierną reakcją stresową organizmu, głodzeniem, a także upośledzonym metabolizmem tlenowym. Dochodzi do nadmiernego wytwarzania glukozy na skutek zwiększonego poziomu glukagonu i katecholamin z jednoczesnym wzrostem poziomu insuliny. W trakcie sepsy dochodzi do zaburzenia w obrębie uzyskiwania z glutaminy glukozy (przy zwiększonym zapotrzebowaniu energetycznym organizmu poziom glukozy jest uzupełniany poprzez rozpad białek). Dzieje się tak na skutek zmniejszenia aktywności, m.in., glutaminazy.
Jednocześnie na skutek spadku poziomu glutaminy w obrębie ściany przewodu pokarmowego dochodzi do zaburzenia jej funkcji i możliwości rozwoju niewydolności wielonarządowej. Przemiany lipidów w początkowej fazie sprowadzają się do nasilenia katabolizmu i zwiększonego rozpadu do wolnych kwasów tłuszczowych (FFA). W późniejszej fazie dochodzi do upośledzenia wykorzystania FFA i powstawania ciał ketonowych. Na skutek nasilonego metabolizmu beztlenowego oraz postępującego niedotlenienia i niedokrwienia dochodzi do spadku poziomu pirogronianów i zaburzenia stosunku mleczany/pirogroniany.

Obraz kliniczny sepsy zależy od stopnia zaawansowania całego procesu. W początkowym okresie mogą to być objawy tzw. ogólnoustrojowej reakcji zapalnej (co najmniej dwa z wymienionych):
Dodatkowo mogą być obecne objawy określonego zakażenia, np. zapalenia opon mózgowo-rdzeniowych:
Należy pamiętać o tym, że kryteria rozpoznania SIRS według nowych wytycznych leczenia sepsy nie są wystarczające do rozpoznania sepsy ze względu na ich niewystarczającą swoistość. Obecnie uważa się, że ważniejszym kryterium rozpoznawania sepsy jest ocena stopnia niewydolności narządowej.
W przypadku braku lub nieodpowiedniego leczenia pojawiają się objawy niewydolności określonych narządów i układów:
W rozwoju tych zaburzeń funkcjonuje mechanizm błędnego koła, polegający na nasileniu zaburzeń pracy jednego układu przez dysfunkcję drugiego, który sam podlega niekorzystnym wpływom pierwszego (sprzężenie zwrotne dodatnie). W rzeczywistości jest to mechanizm wieloukładowy i zachodzące zmiany są połączone skomplikowaną siecią powiązań. Efektem jest zazwyczaj zespół niewydolności wielonarządowej, często prowadzący do fatalnych następstw.
Rozpoznanie sepsy stawiano dawniej na podstawie stwierdzenia objawów SIRS. Obecnym kryterium rozpoznania sepsy jest nagła zmiana wyniku oceny w skali SOFA (Sepsis-related organ failure assessment score) o co najmniej 2 punkty, jeśli występuje podejrzenie zakażenia. Następnym etapem jest potwierdzenie obecności specyficznego patogenu w badaniach mikrobiologicznych. Pobiera się 2 próbki krwi do diagnostyki z osobnego nakłucia żyły oraz z każdego cewnika naczyniowego wprowadzonego przed upływem 48 godzin[24]. Wskazane jest pobranie próbki krwi przed wdrożeniem przeciwdrobnoustrojowego leczenia empirycznego. W zależności od przypuszczalnej etiologii pobiera się materiał na posiew także z innych miejsc:
Nie ma specyficznego markera laboratoryjnego potwierdzającego sepsę. Stosowane w oznaczeniach CRP[26] i prokalcytonina (PCT) ze względu na niewystarczającą czułość i swoistość[27] są wykorzystywane jedynie do monitorowania (oceny nasilenia) stanu zapalnego (PCT wykazuje większą skuteczność w monitorowaniu sepsy z towarzyszącą niewydolnością wielonarządową[28].) W wykrywaniu procesu zapalnego i ocenie skuteczności leczenia stosuje się również oznaczanie poziomu leukocytów (morfologia z rozmazem i oceną procentowej obecności poszczególnych elementów morfotycznych), OB czy interleukiny 6.
W procesie diagnostycznym dużą rolę odgrywają również badania obrazowe, mające na celu zlokalizowanie ogniska zakażenia. W zależności od przypuszczalnej etiologii wykonuje się RTG płuc, USG (gł. jamy brzusznej), TK i inne.
Dysfunkcję narządową monitoruje się za pośrednictwem badań laboratoryjnych takich jak: gazometria krwi żylnej i tętniczej, poziom mleczanów w surowicy, ocena parametrów hemostazy, nerkowych (kreatynina, mocznik) czy wątrobowych (AspAT, AlAT, bilirubina).
W diagnostyce różnicowej należy uwzględnić także HLH (zespół hemofagocytowy)[29].
Leczenie sepsy stanowi duży problem kliniczny. Powinno być prowadzone na oddziałach intensywnej terapii, gdzie pacjentowi można zapewnić odpowiednią opiekę. Jest długotrwałe, wymagające dużych nakładów finansowych. W krajach Unii Europejskiej roczny koszt leczenia wynosi 6,7 mld dolarów, a w Stanach Zjednoczonych – 17 mld dolarów[30] i obarczone dużą śmiertelnością.
Należy rozpocząć zaraz po stwierdzeniu sepsy, jeszcze przed przekazaniem pacjenta na oddział intensywnej terapii. Leczenie polega głównie na przetaczaniu płynów dożylnie w takich ilościach, aby w ciągu pierwszych 6 godzin osiągnąć ośrodkowe ciśnienie żylne na poziomie 8–12 mm Hg (u chorych mechanicznie wentylowanych 12–15 mm Hg), średnie ciśnienie tętnicze > 65 mm Hg, diurezę > 0,5 ml/kg/h, wysycenie tlenem hemoglobiny krwi żylnej z żył centralnych bądź krwi mieszanej SvO2 > 70%. Przy braku wzrostu wysycenia hemoglobiny powyżej 70%, a przy osiągniętym zalecanym poziomie ośrodkowego ciśnienia żylnego, pacjentowi przetacza się koncentrat krwinek czerwonych (KKCz) w takich ilościach, aby osiągnąć hematokryt > 30% lub stosuje się wlewy dożylne z dobutaminy (maksymalna dawka 20 μg/kg/min).
Dożylne podawanie antybiotyków powinno się rozpocząć nie później niż w godzinę od rozpoznania ciężkiej postaci sepsy (po pobraniu próbek do badań mikrobiologicznych). Początkowo stosuje się antybiotykoterapię empiryczną z zastosowaniem leków przeciwdrobnoustrojowych o szerokim spektrum działania, z których przynajmniej jeden powinien wykazywać aktywność wobec przypuszczalnego czynnika etiologicznego. Nierozpoczęcie wczesnego leczenia antybiotykiem wobec którego dany patogen mogący być przyczyną wystąpienia sepsy jest wrażliwy skutkuje większą śmiertelnością wśród pacjentów[31][32][33]. Po uzyskaniu dodatnich posiewów, wdraża się leczenie celowane, zgodne z antybiogramem. Należy jak najszybciej odchodzić od terapii antybiotykami o szerokim spektrum działania, przeciwdziałając w ten sposób rozwinięciu lekooporności. W zależności od skuteczności leczenia, powinno ono trwać przez 7–10 dni.
Należy zawsze dążyć do usunięcia ogniska będącego źródłem zakażenia. W zależności od rodzaju infekcji, działania mogą polegać na: drenowaniu ropni, nekrektomii (usunięciu mas martwiczych), usunięciu cewników naczyniowych i pęcherzowych czy większych zabiegów chirurgicznych[34]. Szybkie opanowanie źródła zakażenia ma duże znaczenie w zwiększeniu przeżywalności[35].
Stosuje się głównie krystaloidy lub koloidy (naturalne lub sztuczne)[36]. Początkowo przetacza się 500–1000 ml krystaloidów (lub 300–500 ml koloidów) w ciągu 30 minut, ewentualnie, w zależności od obecności wzrostu ciśnienia, zabieg powtarza się (tzw. próba płynowa). Należy obserwować pacjenta w celu uniknięcia obrzęku płuc. Zazwyczaj w ciągu pierwszych 24 godzin istnieje duże zapotrzebowanie na płyny, znacznie przewyższające ich utratę.
Jeżeli po przetoczeniu odpowiedniej ilości płynów nie dochodzi do wzrostu ciśnienia rozwija się wstrząs septyczny. W leczeniu stosuje się wazopresory (leki obkurczające naczynia krwionośne). Można je podawać kontrolując stężenia mleczanów w surowicy, które są wskaźnikiem niedostatecznej perfuzji (ukrwienia) narządowej i niedotlenienia. Wazopresory powinno się podawać po uzupełnieniu łożyska naczyniowego płynami, ale w szczególnie ciężkich przypadkach można je stosować również na początku leczenia. Jako leków pierwszego rzutu używa się noradrenaliny i dopaminy. Przy opornym wstrząsie należy rozważyć podanie wazopresyny.

U chorych z małym rzutem serca można podać dobutaminę. Przy współistniejącym niskim ciśnieniem tętniczym można ją połączyć z lekami obkurczającymi naczynia. Nie powinno się zwiększać wartości wskaźnika sercowego ponad normę[37].
Zaleca się stosowanie kortykoidów u osób we wstrząsie septycznym niereagującym na właściwe nawodnienie i wymagającym stosowania wazopresorów. Zazwyczaj podaje się hydrokortyzon w dawce 200–300 mg na dobę w pulsach (3–4 dawki) lub we wlewie ciągłym przez 7 dni[38][39][40]. Nie należy podawać dawek wyższych niż zalecane[41].
Rekombinowane, ludzkie aktywowane białko C (rhAPC, drotrekogin) należy stosować u ludzi we wstrząsie septycznym lub z niewydolnością wielonarządową przy braku przeciwwskazań w postaci np. zwiększonego ryzyka krwawienia. Obecnie zostało wycofane ze stosowania, gdyż nie udało się zgromadzić dowodów na jego skuteczność[42].
Koncentrat krwinek czerwonych należy przetaczać w chwili, gdy poziom hemoglobiny spadnie poniżej 7,0 g/dl i dążyć do poziomu 7,0–9,0 g/dl. Nie zaleca się stosowania erytropoetyny z wyjątkiem sytuacji, kiedy na skutek niewydolności nerek zostaje zahamowane wytwarzanie erytrocytów. Osocze świeżo mrożone powinno być stosowane tylko przed planowanymi zabiegami chirurgicznymi z chwilą współistnienia zaburzeń krzepnięcia. Nie zaleca się stosowania antytrombiny III, gdyż jest nieskuteczna[43]. Koncentrat krwinek płytkowych należy przetaczać przy ich spadku poniżej 5 000/mm³. Przy istotnym ryzyku krwawienia lub przed planowanymi zabiegami chirurgicznymi toczenie powinno odbyć się także przy wyższych wartościach.
Wyniki wstępnych badań przeprowadzonych pod kierunkiem dr. Paula Marika na Eastern Virginia Medical School (EVMS) wskazują, iż wczesne dożylne podawanie kortyzolu, witaminy C oraz witaminy B1 w ramach terapii pomocniczej, jest efektywne w zatrzymaniu postępu sepsy. Skuteczność tej terapii została też potwierdzona na Old Dominion University. Badania przeprowadzono na dwóch grupach po 47 osób, gdzie w grupie kontrolnej było 19 zgonów, natomiast w grupie poddanej terapii pomocniczej – 4 zgony. Potrzeba jeszcze wielu badań by potwierdzić te wstępne ustalenia[44].
Powyższe badanie[44] było studium retrospektywnym i spotkało się tak z zainteresowaniem, jak i ostrą krytyką. Dotychczas zostały przeprowadzone dodatkowe badania, kolejne retrospektywne badanie na łącznej sumie 1144 pacjentach[45], oraz podwójnej ślepej próby na 24 pacjentach[46]. Oba badania nie wykazały poprawy przeżywalności pacjentów z sepsą. Obecnie prowadzone jest badanie podwójnej ślepej próby na szacowanej liczbie 400 pacjentów mające zakończyć się w 2020 roku[47].
Korzystne efekty w sepsie może przynieść stosowanie statyn jako terapii pomocniczej[51][52], zwłaszcza jeśli były podawane przed wystąpieniem sepsy i w fazie poprawy stanu pacjenta[53].

Śmiertelność na oddziałach intensywnej terapii jest wysoka[54]. W sepsie wynosi 16%, w ciężkiej sepsie 36%, a we wstrząsie septycznym – 58%[55]. Średni czas leczenia wynosi około 19 dni[10].
W krajach Europy Zachodniej i w Stanach Zjednoczonych śmiertelność szacuje się na około 30%[10].
Największą ilość przypadków sepsy notuje się w obrębie szpitala, głównie na oddziałach intensywnej terapii. Jako metody zapobiegania stosuje się ograniczenie liczby procedur inwazyjnych, ograniczenie czasu założenia cewników donaczyniowych i pęcherzowych, stosowanie ściśle określonych zasad aseptyki, agresywne leczenie zakażeń szpitalnych. Należy unikać nieprzemyślanego leczenia przeciwbakteryjnego i podawania glikokortykosteroidów.
W warunkach pozaszpitalnych główną rolę w profilaktyce odgrywa właściwa higiena. Stosuje się również szczepionki przeciwko patogenom wywołującym zapalenie opon mózgowo-rdzeniowych, które są główną przyczyną występowania sepsy (pozaszpitalną). W przypadku bliskiego kontaktu z osobą chorą podaje się profilaktyczne dawki antybiotyków.
Najskuteczniejszą metodą profilaktyki są szczepienia – immunoprofilaktyka czynna. Szczepienia nie zapobiegają wystąpieniu sepsy a jedynie zmniejszają częstość infekcji patogenami, które mogą doprowadzić do posocznicy.
| Patogen | Okres szczepień | |||||
|---|---|---|---|---|---|---|
| Haemophilus influenzae typu b | 2. mż. | 3–4. mż. | 5–6. mż. | 16–18. mż. | 2–5 lat1 | |
| Streptococcus pneumoniae | 2. mż.² | 3–4. mż.² | 5–6. mż.² | 16–18. mż.² | 2–5 lat²,³ | > 6 lat³ |
| Neisseria meningitidis | 3–4. mż.4 | 7. mż.4 | > 2. rż.4,5 | |||
| Przypisy | ||||||
|
¹ – zalecane dzieciom do 3 rż. nieobjętych szczepieniami | ||||||
| Legenda | ||||||
| szczepienia obowiązkowe, finansowane przez Ministerstwo Zdrowia | ||||||
| szczepienia nieobowiązkowe, ale zalecane, niefinansowane przez Ministerstwo Zdrowia | ||||||
| 2. mż. | wiek szczepienia, w tym przypadku 2 miesiąc życia | |||||
W przypadku bliskiego kontaktu z osobą zakażoną stosuje się profilaktyczne podanie antybiotyków (lub chemioterapeutyków), przy czym nie dają one stuprocentowej ochrony.
Przy zakażeniu meningokokami chemioprofilatyka jest zalecana osobom, które miały kontakt z chorym w okresie 7 dni poprzedzających zachorowanie. Jako bliski kontakt rozumie się:
Najczęściej stosuje się rifampicynę – doustnie przez 2 dni co 12 godzin (dorośli 600 mg; dzieci > 1. mż. 10 mg/kg; dzieci < 1. mż. 5 mg/kg), ciprofloksacynę – doustnie, jednorazowo 500 mg (może być stosowana tylko u dorosłych) i ceftriakson – domięśniowo, jednorazowo (dorośli 250 mg; dzieci < 15. rż. 125 mg).
W przypadku stwierdzenia zachorowania na zapalenie opon mózgowo-rdzeniowych wywołanego przez pałeczki grypy profilaktyka obejmuje wszystkich domowników, jeżeli jeden z członków rodziny ma mniej niż 4 lata (ryzyko zakażenia jest szczególnie duże dla dzieci). Stosuje się rifampicynę przez 4 dni raz dziennie w dawce 20 mg/kg (maks. 600 mg dziennie).
Przy zakażeniu dwoinką zapalenia płuc rzadko obserwuje się zachorowania endemiczne, aczkolwiek szczególnie narażone są środowiska zamknięte – więzienia, koszary, domy opieki. W profilaktyce stosuje się rifampicynę przez 2 dni co 12 godzin w dawce 10 mg/kg.
U kobiet w ciąży i karmiących zalecanym antybiotykiem jest ceftriakson 250 mg domięśniowo, jednorazowo.
| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: A40 | Posocznica paciorkowcowa |
| ICD-10: A40.0 | Posocznica wywołana przez paciorkowce grupy A |
| ICD-10: A40.1 | Posocznica wywołana przez paciorkowce grupy B |
| ICD-10: A40.2 | Posocznica wywołana przez paciorkowce grupy D |
| ICD-10: A40.3 | Posocznica wywołana przez Streptococcus pneumoniae |
| ICD-10: A40.8 | Inne posocznice paciorkowcowe |
| ICD-10: A40.9 | Posocznica paciorkowcowa nieokreślona |
| ICD-10: A41 | Inne posocznice |
| ICD-10: A41.0 | Posocznica wywołana przez Staphylococcus aureus |
| ICD-10: A41.1 | Posocznica wywołana przez inne określone gronkowce |
| ICD-10: A41.2 | Posocznica wywołana przez nieokreślone gronkowce |
| ICD-10: A41.3 | Posocznica wywołana przez Haemophilus influenzae |
| ICD-10: A41.4 | Posocznica wywołana przez beztlenowce |
| ICD-10: A41.5 | Posocznica wywołana przez inne bakterie Gram-ujemne |
| ICD-10: A41.8 | Inna posocznica nieokreślona |
| ICD-10: A41.9 | Posocznica nieokreślona |
| ICD-10: P36 | Posocznica bakteryjna noworodka |
| ICD-10: P36.0 | Posocznica noworodka wywołana przez paciorkowca grupy B |
| ICD-10: P36.1 | Posocznica noworodka wywołana przez inne i nieokreślone paciorkowce |
| ICD-10: P36.2 | Posocznica noworodka wywołana przez Staphylococus aureus |
| ICD-10: P36.3 | Posocznica noworodka wywołana przez inne i nieokreślone gronkowce |
| ICD-10: P36.4 | Posocznica noworodka wywołana przez Escherichia coli |
| ICD-10: P36.5 | Posocznica noworodka wywołana przez beztlenowce |
| ICD-10: P36.8 | Inna posocznica bakteryjna noworodka |
| ICD-10: P36.9 | Posocznica bakteryjna noworodka nieokreślona |
| ICD-10: A20.7 | Posocznica wywołana przez Yersinia pestis |
| ICD-10: A21.7 | Posocznica wywołana przez Francisella tularensis |
| ICD-10: A22.7 | Posocznica wąglikowa |
| ICD-10: A24.1 | Posocznica w przebiegu melioidozy |
| ICD-10: A26.7 | Posocznica wywołana Erysipelothrix rhusiopathiae |
| ICD-10: A28.2 | Posocznica w pozajelitowej jersiniozie |
| ICD-10: A32.7 | Posocznica wywołana przez Listeria monocytogenes |
| ICD-10: A39.2 | Ostra posocznica meningokokowa |
| ICD-10: A39.3 | Przewlekła posocznica meningokokowa |
| ICD-10: A42.7 | Posocznica promienicza |
| ICD-10: A54.8 | Posocznica wywołana przez Neisseria gonorrhoeae |
| ICD-10: B00.7 | Posocznica opryszczkowa |
| ICD-10: B37.7 | Posocznica wywołana przez Candida |
| ICD-10: O85 | Posocznica połogowa |
| ICD-10: T81.4 | Posocznica pozabiegowa |
| ICD-10: T88.0 | Posocznica spowodowana szczepieniem |
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.