Najlepsze pytania
Chronologia
Czat
Perspektywa
Hemoglobina
białko przenoszące tlen we krwi Z Wikipedii, wolnej encyklopedii
Remove ads
Hemoglobina (gr. αἷμα haîma „krew”[1], łac. globus „kula”), oznaczana też skrótami Hb lub HGB – czerwony barwnik krwi, białko zawarte w erytrocytach, którego zasadniczą funkcją jest transportowanie tlenu – przyłączanie go w płucach i uwalnianie w tkankach. Prawie wszystkie kręgowce posiadają hemoglobinę[2], z wyjątkiem ryb z rodziny bielankowatych[3].




Wśród ssaków hemoglobina stanowi około 96% suchej masy i około 35% masy całkowitej (z uwzględnieniem wody) krwinki czerwonej[4]. Hemoglobina ma zdolność wiązania tlenu 1,34 ml O2 na gram, co zwiększa całkowitą pojemność tlenową krwi 70-krotnie w porównaniu do tlenu rozpuszczonego w samym osoczu krwi[5].
Mutacje genu hemoglobiny prowadzą do chorób dziedzicznych: anemii sierpowatej, talasemii lub rzadkich chorób zwanych hemoglobinopatiami[6].
Remove ads
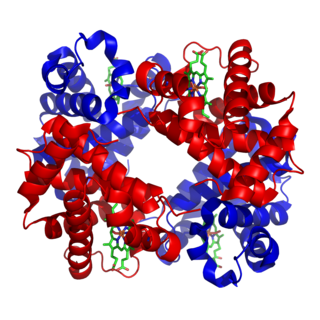
Budowa hemoglobiny
Cząsteczka hemoglobiny jest tetramerem złożonym z dwóch par białkowych podjednostek. Podjednostki oznaczone są najczęściej literami greckiego alfabetu (np. α, β, γ, δ).
Podjednostki nie są związane kowalencyjnie. Każda podjednostka zawiera jako grupę prostetyczną (niebiałkową) cząsteczkę hemu. Cząsteczka hemu zawiera położony centralnie kation żelaza (Fe2+) umożliwiający jej wiązanie cząsteczek tlenu (O2). Jedna cząsteczka hemoglobiny może przyłączyć od jednej do czterech cząsteczek tlenu[7], co powoduje, że hemoglobina może występować albo w stanie „odtlenowanym” (deoxyHb) lub w różnym stopniu „utlenowania” (oxyHb). Hem nadaje białku (i krwi) czerwony kolor.
Przykładowa hemoglobina zbudowana z 574 reszt aminokwasowych ma masę cząsteczkową ok. 66,5 kDa, a jej wzór sumaryczny to C3032H4816O872N780S8Fe4[8].
Konformacja łańcuchów α i β ludzkiej hemoglobiny wykazuje podobieństwa do cząsteczki mioglobiny.
Remove ads
Podział hemoglobin
Podsumowanie
Perspektywa
Hemoglobiny „prawidłowe”
- HbA (HbA1) (2α2β) – prawidłowa hemoglobina dorosłych
- HbA2 (2α2δ) – prawidłowa hemoglobina dorosłych; stanowi około 1,5–3% hemoglobiny
- HbF (2α2γ) – hemoglobina płodowa; ma większe powinowactwo do tlenu niż HbA, dzięki czemu jest w stanie pobrać tlen z krwi matki przez łożysko i uwolnić go w tkankach płodu. W życiu pozamacicznym jest zastępowana, gdyż słabiej uwalnia tlen w tkankach przy wyższym ciśnieniu parcjalnym tlenu. U dorosłych do 2%
- hemoglobiny embrionalne – mają podobne właściwości jak HbF:
- Hemoglobina Gower 1 (ξ2ε2)
- Hemoglobina Gower 2 (α2ε2)
- Hemoglobina Portland (ξ2γ2)
- HbA1c – HbA z przyłączoną nieenzymatycznie, trwale cząsteczką glukozy do N-końcowych aminokwasów łańcuchów globiny. Duże stężenie świadczy o proporcjonalnie podwyższonej glikemii, co może pozwolić na określenie średniego poziomu glukozy w surowicy przez okres 2-3 miesięcy, a to ma znaczenie np. w ocenie skuteczności leczenia cukrzycy. Norma stanowi 4–6% ogólnej ilości hemoglobiny. Produkty przejściowe pomiędzy HbA1 a HbA1c stanowią formy HbA1a oraz HbA1b będące zasadami Schiffa, w których glukoza jest przyłączona odwracalnie. Ogólna liczba wszystkich form glikowanej hemoglobiny powinna mieścić się w zakresie 6–8% ogólnej ilości hemoglobiny.
Hemoglobiny nieprawidłowe
- HbS – jest efektem mutacji punktowej, w efekcie której następuje podmiana hydrofilowej reszty kwasu glutaminowego w pozycji A2 (6β) na hydrofobową resztę waliny, co powoduje powstanie lepkich miejsc i tworzenia agregatów nieutlenowanej HbS, które zniekształcają erytrocyty prowadząc do niedokrwistości sierpowatokrwinkowej.
- HbM – mutacja powodująca zamianę reszty histydyny w pozycji F8 na resztę tyrozyny, która stabilizuje żelazo w hemie w formie Fe3+ zamiast Fe2+. Hemoglobina zawierająca Fe3+ (methemoglobina, metHb) nie wiąże się z tlenem.
- Hemoglobina typu Chesapeake – zamiana Arg na Leu w pozycji FG4 (92 w łańcuchu α).
- Hemoglobina typu Bristol – zmiana Val na Asp w pozycji 67 łańcucha β. Zmiana nie powoduje zaburzenia funkcji.
- Hemoglobina typu Sydney – zmiana Val na Ala w pozycji 67 łańcucha β. Zmiana nie powoduje zaburzenia funkcji.
- Hemoglobina typu Hikari – zmiana Lys na Asn w pozycji 61 łańcucha β. Zmiana nie powoduje zaburzenia funkcji.
- Hemoglobina typu Milwaukee – zmiana Val na Glu w pozycji 67 łańcucha β. Zmiana nie powoduje zaburzenia funkcji.
- Hemoglobina typu Lepore – (2α2Lepore) – hemoglobina w jednym z typów β-talasemii, wynik delecji genów kodujących łańcuchy β i δ. Ich resztki tworzą gen kodujący łańcuch Lepore.
Uwaga: litery greckie w nawiasach oznaczają jakie łańcuchy globiny wchodzą w skład cząsteczki.
Remove ads
Wiązanie tlenu
Podsumowanie
Perspektywa
Hemoglobina zawiera 4 grupy hemowe, dzięki czemu może związać i transportować 4 cząsteczki tlenu. O ile w wolnym hemie w obecności tlenu następuje szybkie utlenienie atomu żelaza(II) do żelaza(III), to w hemie związanym z globiną utlenienie takie nie następuje. Wynika to z otoczenia atomu żelaza przez niepolarne łańcuchy boczne reszt aminokwasowych globiny (podobny efekt występuje w mioglobinie). Ma to kluczowe znaczenie dla funkcjonowania hemoglobiny, gdyż jedynie forma zawierająca żelazo(II) jest zdolna do wiązania tlenu. Wiązanie to ma charakter koordynacyjny, a przyłączenie tlenu jest odwracalne. W hemoglobinie atom żelaza skoordynowany jest z czterema atomami azotu pierścienia porfirynowego oraz jednym białkowym atomem azotu reszty histydyny. Cząsteczka tlenu zajmuje szóstą pozycję koordynacyjną. Hemoglobina związana z tlenem nosi nazwę hemoglobiny utlenowanej lub oksyhemoglobiny, natomiast pozbawiona tlenu – deoksyhemoglobiny[9][10].
Przyłączenie cząsteczki tlenu do jednej z czterech cząstek hemu hemoglobiny powoduje zmianę struktury drugo-, trzecio- i czwartorzędowej całego tetrameru. Przyczyną jest wsunięcie atomu żelaza (położonego w przypadku nieutlenowanej hemoglobiny w odległości około 0,06 nm od płaszczyzny hemu) w płaszczyznę pierścienia hemu po połączeniu z tlenem.
Wsunięcie atomu żelaza pociąga związaną z nim tzw. histydynę proksymalną leżącą w pozycji F8, co powoduje przemieszczenie sąsiednich aminokwasów globiny. Doprowadza to w rezultacie do pęknięcia wiązań poprzecznych pomiędzy końcami karboksylowymi wszystkich czterech cząstek globiny. W efekcie dochodzi do rotacji pary α1/β1 względem pary α2/β2 o 15°.
Przyłączenie cząsteczki tlenu do hemoglobiny ułatwia przyłączanie następnych cząsteczek (tzw. wiązanie kooperacyjne), zaś odczepienie każdej cząsteczki tlenu ułatwia uwalnianie kolejnych cząsteczek O2. Wiązanie kooperacyjne sprzyja maksymalizacji wysycania tlenem hemoglobiny w płucach (przy danym ciśnieniu parcjalnym tlenu – PO2) oraz oddawania przez nią tlenu w tkankach.
Remove ads
Wiązanie dwutlenku węgla
Hemoglobina transportuje około 15% z ogólnej ilości CO
2 przenoszonego przez krew. W momencie gdy z cząsteczki hemoglobiny zostaje uwolniony tlen, dwutlenek węgla wchodzi w reakcję z grupą α-aminową globiny, tworząc karbaminian, jednocześnie w wyniku tej reakcji powstają wolne protony równoważące protony zużywane w płucach przez efekt Bohra (dwa mole protonów na każdy mol CO2). W wyniku powstania karbaminianu zmienia się ładunek grup na końcach łańcuchów globiny, co umożliwia tworzenie wiązań poprzecznych i przejście do stanu T.
W płucach natomiast, w momencie gdy dochodzi do przejścia ze stanu T do stanu R, w wyniku rozerwania wiązań poprzecznych następuje deprotonacja atomów azotu pierścieni imidazolowych histydyny znajdującej się w pozycji HC3 (His 146) na łańcuchach β. Uwolnione protony (H+
) neutralizują aniony wodorowęglanowe, co prowadzi do powstania kwasu węglowego, rozkładanego następnie przez anhydrazę węglanową zawartą w erytrocytach na wodę i dwutlenek węgla usuwany z krążenia.
W tkankach występuje niższe pH niż w płucach, w związku z czym protony wiążą się z histydyną HC3, sprzyjając przejściu hemoglobiny ze stanu R do stanu T.
Remove ads
Rola bisfosfoglicerynianu
W warunkach niedotlenienia w organizmie zwiększa się synteza 2,3-bisfosfoglicerynianu (BPG). Substancja ta, powstająca z 1,3-bisfosfoglicerynianu będącego produktem pośrednim glikolizy, ma właściwość wiązania się z tetramerem hemoglobiny znajdującym się w stanie T i stabilizowania go.
W stanie T konformacja łańcuchów hemoglobiny umożliwia wniknięcie między nie jednej cząsteczki BPG, która następnie wytwarza po trzy (w sumie sześć) wiązania poprzeczne z każdym z łańcuchów β, a dokładniej z posiadającymi dodatni ładunek resztami waliny w pozycji NA1, lizyny EF6 oraz histydyny H21. Te dodatkowe wiązania utrudniają przejście ze stanu T o niższym powinowactwie do tlenu do stanu R, w którym hemoglobina jest mniej skłonna do uwalniania tlenu.
Ciekawym przystosowaniem ewolucyjnym jest zamiana histydyny H21 na serynę w łańcuchu γ, który zastępuje łańcuch β w hemoglobinie płodowej HbF. Dzięki temu BPG ma mniejszy wpływ na hemoglobinę płodową, a co za tym idzie przy niższym stężeniu tlenu HbF ma do niego większe powinowactwo niż HbA. Efekt ten umożliwia wymianę gazową między krwią płodu a krwią matki zachodzącą w łożysku.
Remove ads
Normy

Normy ilości hemoglobiny we krwi dorosłego człowieka wynoszą około 11,0–17,5 g/dl, jednak ze względu na różne metody pomiarowe każde laboratorium analityczne ustala własne normy (zwykle podyktowane przez producenta analizatora). Ponadto fizjologicznie stężenie hemoglobiny u mężczyzn jest wyższe niż kobiet.
Stężenie hemoglobiny we krwi jest podstawowym kryterium przy diagnozowaniu niedokrwistości. Zmniejszone stężenie występuje również w stanach przewodnienia i w ciąży, a zwiększone świadczy o czerwienicy[11].
Remove ads
Pochodne hemoglobiny
- oksyhemoglobina
- karbaminohemoglobina
- karboksyhemoglobina
- methemoglobina
- cyjanomethemoglobina
- sulfohemoglobina
Zobacz też
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads