Ácido desoxirribonucleico
ácido nucleico que contén instrucións xenéticas From Wikipedia, the free encyclopedia
Remove ads
O ácido desoxirribonucleico (ADN, ou DNA, nas súas siglas en inglés) é un ácido nucleico que contén as instrucións xenéticas usadas no desenvolvemento e funcionamento de todos os organismos vivos coñecidos e algúns virus, e é responsable da súa transmisión hereditaria. O papel principal da molécula de ADN é o almacenamento a longo prazo de información. O ADN é comparado a miúdo cun plano ou unha receita, ou un código, xa que contén as instrucións necesarias para construír outros compoñentes das células, como as proteínas e as moléculas de ARN. Os segmentos de ADN que levan esta información xenética son chamados xenes, pero as outras secuencias de ADN teñen propósitos estruturais ou toman parte na regulación do uso desta información xenética.
Para outras páxinas con títulos homónimos véxase: ADN (homónimos).


Quimicamente o ADN consiste en dous longos polímeros formados por unidades sinxelas chamadas nucleótidos, con columnas feitas de azucres e grupos fosfato unidos por vínculos éster (esqueleto pentosa-fosfato). Estes dous polímeros van en direccións opostas, polo que se di que son antiparalelos e trénzanse entre si formando unha dobre hélice. Unidas a cada azucre hai un dos catro tipos de moléculas chamados bases, que son: adenina (A), guanina (G), citosina (C) e timina (T). As dúas febras do ADN son complementarias en bases, xa que a adenina dunha cadea sempre está enfronte dunha timina da outra cadea, e viceversa, e a citosina sempre está en fronte dunha guanina. Son as secuencias formadas por estas catro bases as que codifican a información. Esta información é lida usando o código xenético, o cal especifica os aminoácidos que se deben utilizar durante a tradución das proteínas. A expresión dos xenes realízase copiando o anaco do ADN correspondente a ese xene noutro ácido nucleico, o ARNm, nun proceso chamado transcrición, e traducindo este ARNm a proteínas nos ribosomas.
En canto á súa forma, as moléculas de ADN do núcleo das células eucarióticas son de forma linear, pero as dos procariotas, mitocondrias e cloroplastos son tipicamente circulares.
Remove ads
Propiedades físicas e químicas

O ADN é un longo polímero formado por unidades repetitivas, os nucleótidos.[1][2] Unha dobre cadea de ADN mide de 22 a 26 ángstroms (2,2 a 2,6 nanómetros) de diámetro, e unha unidade (un nucleótido) mide 3,3 Å (0,33 nm) de longo.[3] Aínda que cada unidade individual que se repite é moi pequena, os polímeros de ADN poden ser moléculas enormes que conteñen millóns de nucleótidos. Por exemplo, o cromosoma humano máis longo, que é o cromosoma 1, ten aproximadamente 220 millóns de pares de bases.[4]
Nos organismos vivos, o ADN non adoita existir como unha molécula individual, senón como unha parella de moléculas longas estreitamente asociadas. As dúas cadeas de ADN enrólanse unha sobre a outra formando unha especie de escaleira de caracol, denominada dobre hélice. O modelo de estrutura en dobre hélice foi proposto en 1953 por James D. Watson e Francis Crick (o seu artigo Molecular Structure of Nucleic Acids: A Structure for Deoxyribose Nucleic Acid publicouse o 25 de abril de 1953 en Nature).[5] O éxito deste modelo debíase á súa consistencia coas propiedades físicas e químicas do ADN coñecidas. O estudo mostraba ademais que a complementariedade de bases podía ser relevante na súa replicación, e tamén a importancia da secuencia de bases como portadora de información xenética.[6][7][8] Cada unidade que se repite, o nucleótido, contén un segmento da estrutura de soporte (azucre + fosfato), que mantén a cadea unida, e unha base nitroxenada, que interacciona coa outra cadea de ADN na hélice. En xeral, unha base ligada a un azucre denomínase nucleósido e unha base ligada a un azucre e a un grupo fosfato recibe o nome de nucleótido. A dobre hélice do ADN é estabilizada principalmente por dúas forzas: enlaces de hidróxeno entre as bases dos nucleótidos e as interaccións entre as bases aromáticas que se sitúan unhas enriba das outras.[9]
Cando se unen moitos nucleótidos, como ocorre no ADN, o polímero que se forma denomínase polinucleótido.[10]
Compoñentes
Estrutura de soporte (esqueleto ou columna pentosa-fosfato): A estrutura de soporte dunha febra de ADN está formada por unidades alternas de grupos fosfato e azucre.[11] O azucre no ADN é a pentosa desoxirribosa.[12]

- A súa fórmula química é H3PO4. Cada desoxirribonucleótido (dN) contén un grupo fosfato (monofosfato: dNMP). Dos desoxirribonucleótidos derivan os desoxirribonucleósidos (sic)[13] con dous ou tres fosfatos (dNDP e dNTP). Non obstante, como monómeros constituíntes dos ácidos nucleicos só aparecen en forma de monofosfato (dNMP), aínda que chegan á zona onde se está producindo a replicación do ADN en forma de dNTP, momento en que, durante a súa incorporación ao ADN, perden dous fosfatos en forma dun pirofosfato.[14] Os fosfatos teñen un dos seus átomos de O ionizado a pH celular, o que fai que o ADN estea cuberto de cargas negativas e sexa moi hidrófilo. Estas cargas negativas únense ás cargas positivas das proteínas histonas, o que facilita o empaquetamento do ADN coas histonas para formar a cromatina.[15]
- A desoxirribosa ou, máis exactamente, 2-desoxirribosa, é un monosacárido de 5 átomos de carbono (unha pentosa derivada da ribosa), que forma parte da estrutura dos nucleótidos do ADN. A súa fórmula é C5H10O4. Unha das principais diferenzas entre o ADN e o ARN é o azucre que levan, que no ADN é a 2-desoxirribosa (sen OH no carbono 2) e no ARN é a ribosa (igual, pero cun OH no carbono 2).[8]
- As moléculas de azucre únense entre si por medio dos seus grupos fosfato, que forman enlaces fosfodiéster entre os átomos de carbono terceiro (3′, «tres prima») e quinto (5′, «cinco prima») de dous aneis adxacentes de azucre.[16] Nunha dobre hélice, a dirección dos nucleótidos nunha cadea (3' → 5') é oposta á dirección na outra cadea (5' → 3'). Esta organización das cadeas de ADN denomínase antiparalela, e significa que son cadeas paralelas, pero con direccións opostas. Do mesmo xeito, os extremos asimétricos das cadeas de ADN denomínanse extremo 5' e extremo 3', respectivamente.[17]
- As catro bases nitroxenadas maioritarias que se encontran no ADN son a adenina (A), a citosina (C), a guanina (G) e a timina (T).[18] Cada unha destas catro bases está unida ao armazón de azucre-fosfato a través do azucre para formar o nucleótido completo (base-azucre-fosfato). As bases son compostos heterocíclicos e aromáticos con dous ou máis átomos de nitróxeno, e, dentro das bases maioritarias, clasifícanse en dous grupos: as bases púricas ou purinas (adenina e guanina), coa estrutura da purina e formadas por dous aneis, e as bases pirimidínicas ou pirimidinas (citosina e timina), coa estrutura da pirimidina e cun só anel.[8] Nos ácidos nucleicos existe unha quinta base pirimidínica, denominada uracilo (U), que normalmente ocupa o lugar da timina no ARN e difire desta en que carece dun grupo metilo no seu anel. O uracilo non se encontra habitualmente no ADN, só aparece raramente como un produto residual da degradación da citosina por procesos de desaminación, ou tamén en certos virus bacteriófagos como os bacteriófagos PBS1 e PBS2 de Bacillus subtilis, o fago piR1-37 de Yersinia e o S6 de Staphylococcus nos que a timina foi substituída por uracilo.[19][20]

-
- Represéntase pola letra T. É unha pirimidina cun grupo oxo (=O) nas posicións 2 e 4, e un grupo metil (-CH3) na posición 5.[21] Forma o nucleótido desoxitimidina monofosfato (dTMP). No ADN, a timina sempre se aparea coa adenina da cadea complementaria por medio de dúas pontes de hidróxeno, T=A.[22]

-
- Represéntase coa letra C. É unha pirimidina cun grupo amino (-NH2) en posición 4 e un grupo oxo (=O) en posición 2.[21] Forma o nucleótido desoxicitidina monofosfato (dCMP). A citosina sempre se aparea no ADN coa guanina da cadea complementaria por medio dun triplo enlace, C≡G.[22]

-
- Represéntase coa letra A. É unha purina cun grupo amino (-NH2) na posición 6.[21] Forma o nucleótido desoxiadenosina monofosfato (dAMP). No ADN sempre se aparea coa timina da cadea complementaria por medio de dúas pontes de hidróxeno, A=T.[22]

-
- Represéntase coa letra G. É unha purina cun grupo oxo na posición 6 e un grupo amino na posición 2.[21] Forma o nucleótido desoxiguanosina monofosfato (dGMP). A guanina sempre se aparea no ADN coa citosina da cadea complementaria por medio de tres enlaces de hidróxeno, G≡C.[22]
Tamén existen outras bases nitroxenadas, as chamadas bases nitroxenadas minoritarias, derivadas de forma natural ou sintética dalgunha outra base maioritaria. Por exemplo a hipoxantina, relativamente abundante no ARNt, ou a cafeína, ambas as dúas derivadas da adenina. Outras, como o aciclovir, derivadas da guanina, son análogos sintéticos usados en terapia antiviral.[23] Algunhas, como o 5-fluorouracilo, derivada do uracilo, son antitumorais.[24] Unha base rara que se orixina por modificación da timina e que pode considerarse un uracilo modificado é a base J (beta-D-glicopiranosiloximetiluracilo), que se encontra nalgúns microorganismos como os flaxelados Diplonema e Euglena, e nos cinetoplástidos.[25][26]
As bases nitroxenadas teñen unha serie de características que lles confiren unhas propiedades determinadas. Unha característica importante é o seu carácter aromático, consecuencia da presenza no anel de dobres enlaces en posición conxugada. Isto dálles a capacidade de absorber luz na zona ultravioleta do espectro en torno aos 260 nm, o cal pode aproveitarse para determinar o coeficiente de extinción[27] do ADN e achar a concentración existente dos ácidos nucleicos, e tamén para calcular o contido G+C[28]. Outra das súas características é que presentan tautomería ou isomería de grupos funcionais, debido a que un átomo de hidróxeno unido a outro átomo pode migrar a unha posición veciña[29][30]; nas bases nitroxenadas danse dous tipos de tautomerías: tautomería lactama-lactima, onde o hidróxeno migra do nitróxeno ao osíxeno do grupo oxo (orixinando a forma lactama) e viceversa (forma lactima)[21], e tautomería imina-amina primaria, onde o hidróxeno pode estar formando o grupo amina (forma amina primaria) ou migrar ao nitróxeno adxacente (forma imina). A adenina só pode presentar tautomería amina-imina, a timina e o uracilo mostran tautomería lactama-lactima, e a guanina e citosina poden presentar ambas as dúas. Por outro lado, e aínda que se trate de moléculas apolares, as bases nitroxenadas presentan suficiente carácter polar como para establecer pontes de hidróxeno, xa que teñen átomos moi electronegativos (nitróxeno e osíxeno) que presentan carga parcial negativa, e átomos de hidróxeno con carga parcial positiva, de maneira que se forman dipolos que permiten que se formen estes enlaces febles.[31]
Calcúlase que o xenoma humano haploide ten arredor de 3.000 millóns de pares de bases.[32] Para indicar o tamaño das moléculas de ADN indícase o número de pares de bases, e como derivados hai dúas unidades de medida moi utilizadas, a quilobase (kb), que equivale a 1.000 pares de bases, e a megabase (Mb), que equivale a un millón de pares de bases.[33]
Apareamento de bases
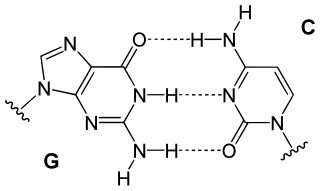

A dobre hélice de ADN mantense estable grazas á formación de pontes de hidróxeno entre as bases asociadas a cada unha das dúas cadeas. Para a formación dun enlace de hidróxeno unha das bases debe presentar un "doante" de hidróxenos cun átomo de hidróxeno con carga parcial positiva (-NH2 ou -NH) e a outra base debe presentar un grupo "aceptor" de hidróxenos cun átomo cargado electronegativamente (C=O ou N).[21] As pontes de hidróxeno son unións máis febles cós típicos enlaces químicos covalentes, como os que conectan os átomos en cada febra de ADN, pero máis fortes ca interaccións hidrófobas individuais, enlaces de Van der Waals etc. Como as pontes de hidróxeno non son enlaces covalentes, poden romper e formarse de novo de forma relativamente sinxela. Por esta razón, as dúas febras da dobre hélice poden separarse como unha cremalleira, ben por forza mecánica ou por alta temperatura.[34] A dobre hélice estabilízase ademais polo efecto hidrófobo e o empillamento, aos que non lles inflúe a secuencia de bases do ADN.[35]
Cada tipo de base nunha cadea forma un enlace unicamente cun tipo de base na outra cadea, o que se denomina complementariedade das bases.[36] Así, as purinas forman enlaces coas pirimidinas, de forma que A se enlaza só con T, e C só con G. A organización de dous nucleótidos apareados ao longo da dobre hélice denomínase apareamento de bases. Este apareamento explica a observación xa realizada por Erwin Chargaff (1905-2002),[37] que mostrou que a cantidade de adenina era similar á cantidade de timina, e que a de citosina era igual á de guanina no ADN. Como resultado desta complementariedade, toda a información contida na secuencia de dobre cadea da hélice de ADN está duplicada en cada cadea, o cal é fundamental durante o proceso de replicación do ADN. Esta interacción reversible e específica entre pares de bases complementarias é esencial para todas as funcións do ADN nos organismos vivos.[1]
Os dous tipos de pares de bases forman un número diferente de enlaces de hidróxeno: A=T forman dúas pontes de hidróxeno, e C≡G forman tres pontes de hidróxeno (ver imaxes). O par de bases GC é polo tanto máis forte que o par de bases AT. Como consecuencia, tanto a porcentaxe de pares de bases GC como a lonxitude total da dobre hélice de ADN determinan a forza da asociación entre as dúas cadeas de ADN. As dobres hélices longas de ADN con alto contido GC teñen cadeas que interaccionan máis fortemente que as dobres hélices curtas con alto contido en AT.[38] Por esta razón, as zonas da dobre hélice de ADN que necesitan separarse doadamente tenden a ter un alto contido en AT, como por exemplo a caixa TATA (eucariotas) ou a secuencia TATAAT da caixa de Pribnow (procariotas) dalgúns promotores dos xenes.[39] No laboratorio, a forza desta interacción pode medirse buscando a temperatura requirida para romper as pontes de hidróxeno, chamada temperatura de fusión do ADN (tamén denominada valor Tm, do inglés melting temperature). Cando todos os pares de bases nunha dobre hélice se desligan, as cadeas sepáranse en solución en dúas cadeas completamente independentes. Estas moléculas de ADN de cadea simple non teñen unha única forma común, senón que algunhas conformacións son máis estables ca outras.[40]
Outros tipos de pares de bases



Existen diferentes tipos de pares de bases que se poden formar por establecemento de pontes de hidróxeno. Os que se observan normalmente na dobre hélice de ADN son os chamados pares de bases de Watson e Crick, pero tamén existen outros posibles pares de bases, como os denominados de Hoogsteen[41] e cambaleantes, que poden aparecer en circunstancias particulares. Ademais, para cada tipo existe á súa vez o mesmo par inverso, é dicir, o que se dá se se xira a base pirimidínica 180º sobre o seu eixe.[42]
- Par de bases de Watson e Crick (pares de bases canónicos da dobre hélice): os grupos da base púrica que interveñen no enlace de hidróxeno son os que corresponden ás posicións 1 e 6 (N aceptor e -NH2 doante se a purina é unha A) e os grupos da base pirimidínica, os que se encontran nas posicións 3 e 4 (-NH doante e C=O aceptor se a pirimidina é unha T). No par de bases de Watson e Crick inverso participarían os grupos das posicións 2 e 3 da base pirimidínica.[43]
- Par de bases de Hoogsteen (descubertos por Karst Hoogsteen[44]): neste caso cambian os grupos da base púrica, que ofrece unha cara diferente (posicións 6 e 7), que forma enlaces cos grupos das pirimidinas das posicións 3 e 4 (como nos de Watson e Crick).[45] Tamén pode haber Hoogsteen inversos. Con este tipo de enlace poden unirse A=U (Hoogsteen e Hoogsteen inverso) e A=C (Hoogsteen inverso).[46]
- Par de bases cambaleante (wobble): este tipo de enlace permite que se unan guanina e citosina cun dobre enlace (G=T). A base púrica (G) forma enlace cos grupos das posicións 1 e 6 (como nos de Watson e Crick) e a pirimidina (T) cos grupos das posicións 2 e 3. Este tipo de enlace non funcionaría con A=C, xa que quedarían enfrontados os dous aceptores e os dous doantes, e só se podería dar no caso inverso. Encontramos pares de bases de tipo cambaleante no ARN, durante o apareamento de codón e anticodón. Con este tipo de enlace poden unirse G=U (cambaleante e cambaleante inverso) e A=C (cambaleante inverso).[47]
En total, na súa forma tautomérica maioritaria, existen 28 posibles pares de bases nitroxenadas: 10 posibles pares de bases purina-pirimidina (2 pares de Watson e Crick e 2 pares de Watson e Crick inverso, 1 par de Hoogsteen e 2 pares de Hoogsteen inverso, 1 par cambaleante e 2 pares cambaleantes inversos), 7 pares homo purina-purina (A=A, G=G), 4 pares A=G e 7 pares pirimidina-pirimidina. Isto sen contar cos pares de bases que poden formarse se tamén temos en conta as outras formas tautoméricas minoritarias das bases nitroxenadas; estes, ademais, poden ser responsables de mutacións puntuais por substitución de tipo transición.[48]
Estrutura
O ADN é unha molécula bicatenaria, é dicir, está formada por dúas cadeas dispostas de forma antiparalela e coas bases nitroxenadas enfrontadas. Na súa estrutura tridimensional, distínguense distintos niveis:[49][50]
- Estrutura primaria:
- É a secuencia de nucleótidos encadeados. É nestas cadeas onde se encontra a información xenética, e dado que o esqueleto pentosa-fosfato é o mesmo en todos, a diferenza da información radica na distinta secuencia de bases nitroxenadas. Esta secuencia presenta un código, que determina unha información ou outra, segundo a orde das bases.[22]
- Estrutura secundaria:
- É unha estrutura en dobre hélice. Permite explicar o almacenamento da información xenética e o mecanismo de duplicación do ADN. Foi postulada por Watson e Crick, baseándose na difracción de raios X que realizaran Franklin e Wilkins, e na equivalencia de bases de Chargaff, segundo a cal a suma de adeninas máis guaninas é igual á suma de timinas máis citosinas.
- É unha cadea dobre, dextroxira (xira á dereita) ou levoxira (xira á esquerda), segundo o tipo de ADN. Ambas as cadeas son complementarias, pois a adenina e a guanina dunha cadea se unen, respectivamente, á timina e á citosina da outra. Ambas as cadeas son antiparalelas, pois o extremo 3´ dunha se enfronta ao extremo 5´ da homóloga.[22]
- Existen tres modelos de ADN. O ADN de tipo B é o máis abundante e é o que ten a estrutura descrita por Watson e Crick.
- Estrutura terciaria:
- É a forma en que se empaqueta o ADN no reducido espazo celular para formar os cromosomas. Varía segundo se trate de organismos procariotas ou eucariotas:
- En procariotas o ADN enrólase como unha súper-hélice, xeralmente en forma circular e asociada a unha pequena cantidade de proteínas. O mesmo ocorre en orgánulos celulares como as mitocondrias e nos cloroplastos.
- En eucariotas, dado que a cantidade de ADN de cada cromosoma é moi grande, o empaquetamento ten que ser máis complexo e compacto; para iso cómpre a presenza de proteínas, como as histonas e outras proteínas de natureza non histónica (nos espermatozoides estas proteínas son as protaminas), que forman as fibras cromatínicas de 10 nm de grosor, e a dobre hélice pode adoptar as formas A, B e Z.[49]
Tipos de estruturas en dobre hélice

O ADN existe en moitas conformacións.[11] Porén, en organismos vivos só se observaron as conformacións ADN A, ADN B e ADN Z.[51] A conformación que adopta o ADN depende da súa secuencia, a cantidade e dirección de superenrolamento que presenta, a presenza de modificacións químicas nas bases e as condicións da solución, tales como a concentración de ións de metais e poliaminas.[52] Das tres conformacións, a forma "B" é a máis común nas condicións existentes nas células.[53] As dúas dobres hélices alternativas do ADN difiren na súa xeometría e dimensións.[51]
A forma "A" é unha espiral que xira cara á dereita, máis ampla cá "B", cun suco menor superficial e máis amplo, e un suco maior máis estreito e profundo. A forma "A" aparece en condicións non fisiolóxicas en formas deshidratadas de ADN, mentres que na célula pode orixinarse en casos de apareamentos híbridos ADN-ARN, ademais de en complexos encima-ADN.[54][55]
Os segmentos de ADN nos que as bases foron modificadas por metilación poden sufrir cambios conformacionais maiores e adoptaren a forma "Z". Neste caso, as cadeas xiran arredor do eixe da hélice nunha espiral que xira cara á esquerda, o oposto á forma "B" máis frecuente.[56] Estas estruturas pouco frecuentes poden ser recoñecidas por proteínas específicas que se unen a ADN Z e posiblemente estean implicadas na regulación da transcrición.[57]
Estruturas en cuádruplex

Nos extremos dos cromosomas lineais existen rexións especializadas de ADN denominadas telómeros. A función principal destas rexións é permitirlle á célula replicar os extremos cromosómicos utilizando o encima telomerase, xa que os encimas que replican o resto do ADN non poden copiar os extremos 3' dos cromosomas.[59] Estas terminacións cromosómicas especializadas tamén protexen os extremos do ADN, e evitan que os sistemas de reparación do ADN da célula os procesen como ADN danado que debe ser corrixido.[60] Nas células humanas os telómeros son longas zonas de ADN dunha soa cadea que conteñen varios milleiros de repeticións dunha única secuencia TTAGGG.[61]
Estas secuencias ricas en guanina poden estabilizar os extremos cromosómicos por medio da formación de estruturas constituídas por conxuntos amoreados de unidades de catro bases, en lugar dos pares de bases encontrados normalmente noutras estruturas de ADN. Neste caso, catro bases guanina forman unidades con superficie plana que se sitúan unha sobre outra, formando unha estrutura cuádrupla-G estable.[62] Estas estruturas estabilízanse formando pontes de hidróxeno entre os extremos das bases e pola quelación dun metal iónico no centro de cada unidade de catro bases. Tamén se poden formar outras estruturas, co conxunto central de catro bases procedente quer dunha febra sinxela (monocatenaria) pregada arredor das bases, quer de varias febras paralelas diferentes, de forma que cada unha contribúe cunha base á estrutura central.[63]
Ademais destas estruturas amoreadas, os telómeros tamén forman longas estruturas en lazo, denominadas lazos teloméricos ou lazos T (T-loops en inglés). Neste caso, as febras simples (monocatenarias) de ADN enrólanse sobre si mesmas formando un amplo círculo estabilizado por proteínas que se unen aos telómeros.[64] No extremo do lazo T, o ADN telomérico de febra sinxela suxéitase a unha rexión de ADN de dobre cadea porque a febra de ADN telomérico altera a dobre hélice e emparéllase a unha das dúas febras. Esta estrutura de tripla febra denomínase lazo de desprazamento ou lazo D (D-loop).[62]
Sucos maior e menor
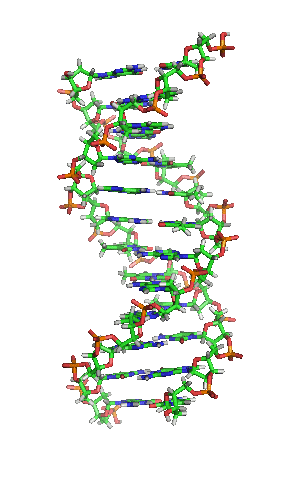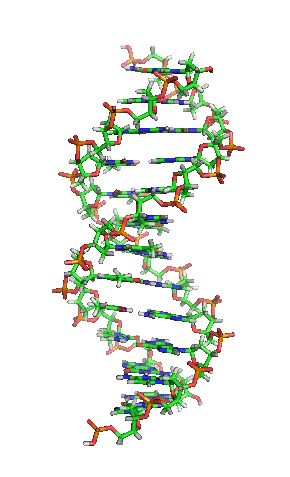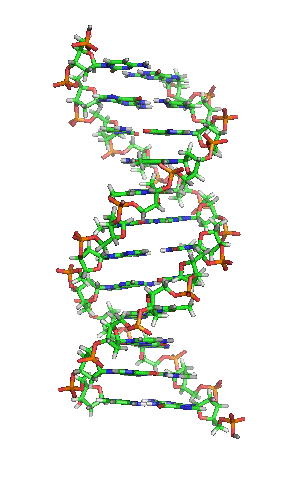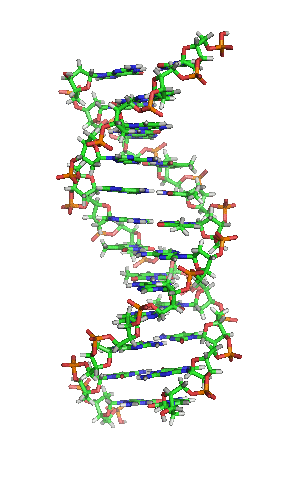

A dobre hélice é unha espiral dextroxira, é dicir, ambas as cadeas de nucleótidos xiran á dereita. Isto pode verificarse se nos fixamos, indo de abaixo a arriba, na dirección que seguen os segmentos das cadeas que quedan en primeiro plano. Se as dúas febras xiran á dereita dise que a dobre hélice é dextroxira, e se xiran á esquerda, levoxira. Aínda que a forma levoxira pode aparecer en hélices alternativas debido a cambios conformacionais no ADN, a conformación máis común que adopta a dobre hélice do ADN é dextroxira, xirando cada par de bases respecto ao anterior uns 36º.[66]
Cando as dúas cadeas de ADN se enrolan unha sobre a outra (sexa á dereita ou á esquerda), fórmanse ocos ou sucos entre unha febra e a outra, deixando expostos os laterais das bases nitroxenadas do interior (ver a animación). Na conformación máis común que adopta o ADN aparecen, como consecuencia dos ángulos formados entre os azucres de ambas as cadeas de cada par de bases nitroxenadas, dous tipos de sucos arredor da superficie da dobre hélice: un deles, a fenda ou suco maior, que mide 22 Å (2,2 nm) de largo, e o outro, a fenda ou suco menor, que mide 12 Å (1,2 nm) de largo.[67] Cada volta de hélice (paso de rosca), que é o tramo no que esta fixo un xiro de 360º, ou o que é o mesmo, o tramo que vai desde o principio do suco maior ao final do suco menor, medirá, polo tanto, 34 Å, e en cada unha desas voltas hai uns 10,5 pb.[5]
A largura do suco maior implica que os extremos das bases son máis accesibles alí, de forma que a cantidade de grupos químicos expostos tamén é maior, o cal facilita a distinción entre os pares de bases A-T, T-A, C-G, G-C. Como consecuencia, tamén se verá facilitado o recoñecemento de secuencias de ADN por parte de diferentes proteínas sen a necesidade de abrir a dobre hélice. Así, proteínas como os factores de transcrición que poden unirse a secuencias específicas, frecuentemente contactan cos laterais das bases expostos no suco maior.[68] Ao contrario, os grupos químicos que quedan expostos no suco menor son similares, de forma que o recoñecemento dos pares de bases é máis difícil; por iso se di que o suco maior contén máis información có suco menor.[66]
Sentido e antisentido
Unha secuencia de ADN denomínase "sentido" se a súa secuencia é a mesma que a secuencia dun ARN mensaxeiro que se traduce nunha proteína (pero a ARN polimerase non fixo a transcrición do ARNm complementario a partir da febra sentido senón da antisentido). A secuencia da febra de ADN complementaria denomínase "antisentido". Polo tanto, o ARNm ten unha secuencia complementaria da febra antisentido (da cal se transcribiu) e igual á da febra sentido. En ambas as febras de ADN da dobre hélice poden existir tanto secuencias sentido, que codifican ARNm, coma antisentido, que non o codifican. É dicir, as secuencias que codifican ARNm non están todas presentes nunha soa das febras, senón repartidas entre as dúas febras. Tanto en procariotas coma en eucariotas prodúcense ARNs con secuencias antisentido, pero a función deses ARNs non está completamente clara.[69] Propúxose que os ARN antisentido están implicados na regulación da expresión xénica por medio de apareamentos ARN-ARN: os ARNs antisentido aparéanse cos ARNm complementarios, bloqueando desta forma a súa tradución.[70]
Nunhas poucas secuencias de ADN en procariotas e eucariotas (este feito é máis frecuente en plásmidos e virus), a distinción entre febras sentido e antisentido é máis difusa, debido a que presentan xenes superpostos.[71] Nestes casos, algunhas secuencias de ADN teñen unha función dobre, codificando unha proteína cando se le ao longo dunha febra, e outra proteína cando se le na dirección contraria ao longo da outra febra. En bacterias, esta superposición pode estar implicada na regulación da transcrición do xene,[72] mentres que en virus os xenes superpostos aumentan a cantidade de información que pode codificarse nos seus diminutos xenomas.[73]
Superenrolamento

O ADN pode retorcerse como unha corda nun proceso que se denomina superenrolamento do ADN. Cando o ADN está nun estado "relaxado", unha cadea normalmente xira arredor do eixe da dobre hélice unha vez cada 10,4 pares de bases, pero se o ADN está retorto as febras poden estar unidas máis estreitamente ou máis relaxadamente.[74] Se o ADN está retorto na dirección da hélice, dise que o superenrolamento é positivo, e as bases mantéñense xuntas de forma máis estreita. Se o ADN se retorce na dirección oposta, o superenrolamento chámase negativo, e as bases afástanse. Na natureza, a maior parte do ADN ten un lixeiro superenrolamento negativo que é producido por encimas denominados topoisomerases.[75] Estes encimas tamén son necesarios para liberar as forzas de torsión introducidas nas febras de ADN durante procesos como a transcrición e a replicación.[76]
Remove ads
Modificacións químicas

Modificacións de bases
- Artigos principais: Metilación do ADN e Cromatina.
A expresión dos xenes está influenciada pola forma na que o ADN está empaquetado en cromosomas, nunha estrutura denominada cromatina. As modificacións de bases poden estar implicadas no empaquetamento do ADN: as rexións que presentan unha expresión xénica baixa ou nula normalmente conteñen niveis altos de metilación das bases citosina. Por exemplo, a metilación de citosina produce 5-metilcitosina, que é importante para a inactivación do cromosoma X.[77] O nivel medio de metilación varía entre organismos: o verme Caenorhabditis elegans non presenta metilación de citosina, mentres que os vertebrados presentan un nivel alto, de modo que ata o 1% do seu ADN contén 5-metilcitosina.[78] Malia a importancia da 5-metilcitosina, esta pode desaminarse para xerar unha base timina. As citosinas metiladas son, polo tanto, particularmente sensibles ás mutacións.[79] Outras modificacións de bases inclúen a metilación de adenina en bacterias, e a glicosilación que orixina a "base J" en cinetoplástidos (que pode considerarse un uracilo glicosilado).[80][81]
Danos no ADN
- Artigo principal: Mutación.

O ADN pode quedar danado pola acción de moitos tipos de mutáxenos que cambian a secuencia do ADN, como poden ser: axentes alquilantes, e radiación electromagnética de alta enerxía, como luz ultravioleta (UV) e raios X. O tipo de dano producido no ADN depende do tipo de mutáxeno. Por exemplo, a luz UV pode danar o ADN producindo dímeros de timina, que se forman por ligamento cruzado entre bases pirimidínicas.[83] Por outro lado, oxidantes tales como radicais libres ou o peróxido de hidróxeno producen múltiples danos, incluíndo modificacións de bases, sobre todo guanina, e roturas da dobre cadea.[84] Nunha célula humana calquera, arredor de 500 bases sofren dano oxidativo cada día.[85][86] Destes danos oxidativos, os máis perigosos son as roturas da dobre cadea, xa que son difíciles de arranxar e poden producir mutacións puntuais, insercións e delecións da secuencia de ADN, ou translocacións cromosómicas.[87]
Moitos mutáxenos colócanse entre dous pares de bases adxacentes, polo que se denominan axentes intercalantes. A maioría dos axentes intercalantes son moléculas aromáticas e planas, como o bromuro de etidio, a daunomicina, a doxorrubicina e a talidomida. Para que un axente intercalante poida integrarse entre dous pares de bases, estas deben separarse, distorsionando as febras de ADN e abrindo a dobre hélice. Isto inhibe a transcrición e a replicación do ADN, causando toxicidade e mutacións. Xa que logo, os axentes intercalantes do ADN son frecuentemente carcinóxenos: o benzopireno, as acridinas, a aflatoxina e o bromuro de etidio son exemplos ben coñecidos.[88][89][90] Porén, debido á súa capacidade para inhibir a replicación e a transcrición do ADN, estas toxinas tamén se utilizan en quimioterapia para inhibir o rápido crecemento das células cancerosas.[91]
Os danos no ADN inician unha resposta que activa diferentes mecanismos de reparación que recoñecen danos específicos no ADN, que son reparados no momento para recuperar a secuencia orixinal do ADN. Igualmente, o dano no ADN provoca a parada do ciclo celular, que implica a alteración de numerosos procesos fisiolóxicos, o que á súa vez implica síntese, transporte e degradación de proteínas (véxase tamén ciclo celular). Alternativamente, se o dano xenómico é demasiado grande para que poida ser amañado, os mecanismos de control inducirán a activación dunha serie de vías celulares que levarán á apoptose ou morte celular.[92]
Remove ads
Funcións biolóxicas
As funcións biolóxicas do ADN inclúen o almacenamento de información (xenes e xenoma), a codificación de proteínas (transcrición e tradución) e a súa autoduplicación (replicación do ADN) para asegurar a transmisión da información ás células fillas durante a división celular.[36]
Xenes e xenoma
- Artigos principais: Núcleo celular, Cromatina, Cromosoma e Xenoma.
O ADN pódese considerar como un almacén que contén a información (mensaxe) necesaria para construír e soster o organismo no que reside, a cal se transmite de xeración en xeración. O conxunto de información que cumpre esta función nun organismo dado denomínase xenoma, e o ADN que o contén, ADN xenómico.[93]
O ADN xenómico (que se organiza en moléculas de cromatina, que á súa vez se ensamblan en cromosomas) encóntrase no núcleo celular dos eucariotas, ademais de pequenas cantidades nas mitocondrias e cloroplastos. En procariotas, o ADN atópase nunha formación irregular denominada nucleoide.[94]
O ADN codificante

- Artigo principal: Xene.
A información xenética dun xenoma está contida nos xenes, e o conxunto de toda a información que corresponde a un organismo denomínase xenotipo. Un xene é unha unidade de herdanza e é unha rexión de ADN que inflúe nunha característica particular dun organismo (como a cor dos ollos, por exemplo). Os xenes conteñen un "marco aberto de lectura" que pode transcribirse, ademais de secuencias reguladoras, tales como promotores e amplificadores (enhancers),[96] que controlan a transcrición do marco aberto de lectura.
Desde este punto de vista, as traballadoras deste mecanismo son as proteínas. Estas poden ser estruturais, como as proteínas dos músculos, cartilaxes, pelo etc., ou funcionais, como a hemoglobina ou os innumerables encimas do organismo. A función principal da herdanza é a especificación das proteínas, sendo o ADN unha especie de plano ou receita para producilas. A maior parte das veces a modificación do ADN provocará unha disfunción proteica que dará lugar á aparición dalgunha enfermidade. Pero en determinados casos, as modificacións poderán provocar cambios beneficiosos que darán lugar a individuos mellor adaptados ao seu contorno.[14]
As máis de trinta mil proteínas diferentes do corpo humano están constituídas por vinte aminoácidos diferentes, e unha molécula de ADN debe especificar a secuencia en que se unen ditos aminoácidos.
No proceso de elaborar unha proteína, o ADN dun xene lese e transcríbese a ARN. Este ARN serve como mensaxeiro entre o ADN e a maquinaria que elaborará as proteínas e por iso recibe o nome de ARN mensaxeiro ou ARNm. O ARN mensaxeiro serve de molde á maquinaria que elabora as proteínas, para que ensamble os aminoácidos na orde precisa para armar a proteína.[14]
O dogma central da bioloxía molecular establecía que o fluxo de actividade e de información era: ADN → ARN → proteína.[97] Non obstante, xa pouco despois da súa formulación se demostrou que este "dogma" debía ser ampliado, porque se encontraron outros fluxos de información. Hoxe sabemos que nalgúns organismos (virus de ARN) e nos retrotransposóns a información flúe de ARN a ADN; este proceso coñécese como transcrición inversa, tamén chamada retrotranscrición ou reversotranscrición. Ademais, sábese que existen secuencias de ADN que se transcriben a ARN e son funcionais como tales, sen chegar a traducirse nunca a proteínas: son os ARN non codificantes, como por exemplo os ARN interferentes.[49][50]
O ADN non codificante
- Artigo principal: ADN non codificante.
O ADN do xenoma dun organismo pode dividirse conceptualmente en dous: o que codifica as proteínas (os xenes) e o que non codifica. En moitas especies, só unha pequena fracción do xenoma codifica proteínas. Por exemplo, só arredor do 1,5% do xenoma humano consiste en exóns que codifican proteínas (20.000 a 25.000 xenes), mentres que máis do 90% consiste en ADN non codificante.[98]
O ADN non codificante (tamén denominado por veces e con menos precisión ADN lixo) corresponde a secuencias do xenoma que non xeran unha proteína (procedentes de transposicións, duplicacións, translocacións e recombinacións de virus etc.), incluíndo os intróns. Ata hai pouco tempo pensábase que a maior parte do ADN non codificante non tiña utilidade ningunha, mais estudos recentes indican que iso é inexacto. Entre outras funcións, postúlase que parte do chamado "ADN lixo" regula a expresión diferencial dos xenes.[99] Por exemplo, algunhas secuencias teñen afinidade por proteínas especiais que teñen a capacidade de unirse ao ADN (como os homeodominios, os complexos receptores de hormonas esteroides etc.), cun papel importante no control dos mecanismos de transcrición e replicación. Estas secuencias chámanse frecuentemente "secuencias reguladoras", e os investigadores supoñen que só se levan identificado unha pequena fracción das que realmente existen. A presenza de tanto ADN non codificante en xenomas eucarióticos e as diferenzas en tamaño do xenoma entre especies representan unha incógnita a resolver que é coñecida como o "enigma do valor C".[100] Recentemente, un grupo de investigadores da Universidade de Yale descubriu unha secuencia de ADN non codificante que sería a responsable de que os seres humanos desenvolveran a capacidade de agarrar e/ou manipular obxectos ou ferramentas.[101]
Por outro lado, algunhas secuencias de ADN desempeñan un papel estrutural nos cromosomas: os telómeros e centrómeros conteñen poucos ou ningún xene codificante de proteínas, pero son importantes para estabilizaren a estrutura dos cromosomas.[60][102] Algúns xenes non codifican proteínas, pero si se transcriben en ARN: ARN ribosómico, ARN de transferencia e ARN interferente (que é ARN que bloquea a expresión de xenes específicos). A estrutura de intróns e exóns dalgúns xenes (como os de inmunoglobulinas e protocadherinas) son importantes por permitiren os empalmes alternativos do pre-ARN mensaxeiro que fan posible a síntese de diferentes proteínas a partir dun mesmo xene (sen esta capacidade non existiría o sistema inmune, por exemplo). Algunhas secuencias de ADN non codificante representan pseudoxenes que teñen valor evolutivo, xa que permiten a creación de novos xenes con novas funcións.[50][103][104] Outros ADN non codificantes proceden da duplicación de pequenas rexións do ADN; isto ten moita utilidade, xa que o rastrexo destas secuencias repetitivas permite estudos filoxenéticos.[105]
Transcrición e tradución
- Artigos principais: Transcrición (xenética), Tradución (proteínas) e Código xenético.
Nun xene, a secuencia de nucleótidos ao longo dunha febra de ADN transcríbese a un ARN mensaxeiro e esta secuencia á súa vez tradúcese a unha proteína que un organismo é capaz de sintetizar ou "expresar" nun ou varios momentos da súa vida, usando a información de dita secuencia.
A relación entre a secuencia de nucleótidos e a secuencia de aminoácidos da proteína vén determinada polo código xenético, que se utiliza durante o proceso de tradución ou síntese de proteínas.[106] A unidade codificadora do código xenético é un grupo de tres nucleótidos (triplete), representado polas tres letras iniciais das bases nitroxenadas (por exemplo, ACT, CAG, TTT). Os tripletes do ADN transcríbense nas súas bases complementarias no ARN mensaxeiro, e neste caso os tripletes denomínanse codóns (para o exemplo anterior, UGA, GUC, AAA).[107] No ribosoma cada codón do ARN mensaxeiro interacciona cunha molécula de ARN de transferencia que conteña o triplete complementario, denominado anticodón. Cada ARNt leva o aminoácido correspondente ao codón de acordo co código xenético, de modo que o ribosoma vai unindo os aminoácidos para formar unha nova proteína de acordo coas "instrucións" da secuencia do ARNm. Existen 64 codóns posibles, de modo que corresponde máis dun para cada aminoácido (por iso se di que o código xenético é un código dexenerado: non é unívoco). Algúns codóns indican a terminación da síntese, o fin da secuencia codificante; estes codóns de terminación, tamén chamados de parada, de stop ou sen sentido, son UAA, UGA e UAG.[49]
Replicación do ADN

- Artigo principal: Replicación do ADN.
A replicación do ADN é o proceso polo cal se obteñen copias ou réplicas idénticas dunha molécula de ADN. A replicación é fundamental para a transferencia da información xenética dunha xeración á seguinte e, polo tanto, é a base da herdanza. O mecanismo consiste esencialmente na separación das dúas febras da dobre hélice, as cales serven de molde para a posterior síntese de cadeas complementarias a cada unha delas. O proceso é diferente en cada unha das febras debido ao mecanismo de funcionamento da ADN polimerase. O resultado final son dúas moléculas idénticas á orixinal. Este tipo de replicación denomínase semiconservativa (ou semiconservadora) debido a que cada unha das dúas moléculas orixinadas na duplicación presenta unha cadea procedente da molécula "nai" e outra acabada de sintetizar.[108][109]
Remove ads
Interaccións ADN-proteína
Todas as funcións do ADN dependen das súas interaccións con proteínas. Estas interaccións poden ser inespecíficas, ou a proteína pode unirse de forma específica a unha única secuencia de ADN. Tamén poden unirse ao ADN encimas, entre os cales son especialmente importantes as polimerases, que copian as secuencias de bases do ADN durante a transcrición e a replicación.
Proteínas que se unen ao ADN
- Artigos principais: Histona e Nucleosoma.
Interaccións inespecíficas
 |
Interacción do ADN con histonas (en branco). Os aminoácidos básicos destas proteínas (en azul) únense aos grupos ácidos dos fosfatos do ADN (en vermello).
As proteínas estruturais que se unen ao ADN son exemplos ben coñecidos de interaccións inespecíficas ADN-proteínas. Nos cromosomas, o ADN forma complexos con proteínas estruturais. Estas proteínas organizan o ADN nunha estrutura compacta denominada cromatina. En eucariotas a formación desta estrutura implica a unión do ADN a un complexo formado por pequenas proteínas básicas denominadas histonas, mentres que en procariotas están implicadas unha gran variedade de proteínas.[110][111] As histonas forman un complexo de forma cilíndrica denominado nucleosoma, arredor do cal se enrola a dobre hélice do ADN dando case dúas voltas. Estas interaccións inespecíficas quedan determinadas pola existencia de residuos básicos nas histonas, que forman enlaces iónicos co esqueleto de azucre-fosfato do ADN e, polo tanto, son en gran parte independentes da secuencia de bases.[112] Estes aminoácidos básicos experimentan modificacións químicas como metilación, fosforilación e acetilación,[113] que alteran a forza da interacción entre o ADN e as histonas, facendo ao ADN máis ou menos accesible aos factores de transcrición e, polo tanto, modificando a taxa de transcrición.[114]
Outras proteínas que se unen ao ADN de maneira inespecífica na cromatina inclúen as proteínas do grupo de alta mobilidade (HMG) que se unen ao ADN pregado ou distorsionado.[115] Estas proteínas son importantes durante o pregamento dos nucleosomas, organizándoos en estruturas máis complexas para constituíren os cromosomas[116] durante o proceso de condensación cromosómica. Propúxose que neste proceso tamén intervirían outras proteínas, formando unha especie de "andamio" sobre o cal se organiza a cromatina; os principais compoñentes desta estrutura serían o encima topoisomerase II α (ou topoIIalpha) e a condensina 13S.[117] Porén, o papel estrutural da topoisomerase II alfa na organización dos cromosomas aínda se discute, xa que algúns investigadores argumentan que este encima se intercambia rapidamente tanto nos brazos cromosómicos coma nos cinetocoros durante a mitose.[118]
Interaccións específicas
Un grupo ben definido de proteínas que se ligan ao ADN é o conformado polas proteínas que se unen especificamente ao ADN monocatenario ou ADN de febra sinxela (ssDNA). En humanos, a proteína A de replicación é a mellor coñecida da súa familia e actúa en procesos nos que a dobre hélice se separa, como a replicación do ADN, a recombinación ou a reparación do ADN.[119] Estas proteínas parecen estabilizar o ADN monocatenario, protexéndoo para evitar que forme estruturas de talo-lazo ou de que sexa degradado por nucleases.[120]

Porén, outras proteínas evolucionaron para unirse especificamente a secuencias determinadas de ADN. A especificidade da interacción das proteínas co ADN procede dos múltiples contactos coas bases do ADN, o que lles permite "ler" a secuencia do ADN. A maioría desas interaccións coas bases ocorre no suco maior, onde as bases son máis accesibles.[122]
As proteínas específicas estudadas con maior detalle son as encargadas de regular a transcrición, denominadas factores de transcrición.[123] Cada factor de transcrición únese a unha secuencia concreta de ADN e activa ou inhibe a transcrición dos xenes que presentan estas secuencias próximas aos seus promotores. Os factores de transcrición poden efectuar isto de dúas formas:
- En primeiro lugar, poden unirse á ARN polimerase responsable da transcrición, ben directamente ou a través doutras proteínas mediadoras. Desta forma, estabilízase a unión entre a ARN polimerase e o promotor, o que permite o inicio da transcrición.[124]
- En segundo lugar, os factores de transcrición poden unirse a encimas que modifican as histonas do promotor, o que altera a accesibilidade do molde de ADN á ARN polimerase.[125]
Como os ADN diana poden encontrarse por todo o xenoma do organismo, os cambios na actividade dun tipo de factor de transcrición poden afectar a miles de xenes. En consecuencia, estas proteínas son frecuentemente as dianas dos procesos de transdución de sinais que controlan as respostas a cambios ambientais ou a diferenciación e desenvolvemento celular.[126]

Encimas que modifican o ADN
Nucleases e ligases
As nucleases son encimas que cortan as febras de ADN catalizando a hidrólise dos enlaces fosfodiéster.[128] As nucleases que hidrolizan nucleótidos a partir dos extremos das febras de ADN denomínanse exonucleases, mentres que as que cortan no interior das febras son endonucleases.[129] As nucleases máis utilizadas en bioloxía molecular son os encimas de restrición, que son endonucleases que cortan o ADN onde este ten determinadas secuencias de nucleótidos específicas. Por exemplo, o encima EcoRV, que se mostra na figura da esquerda, recoñece a secuencia de 6 bases 5′-GAT|ATC-3′, e fai un corte en ambas as febras do ADN na liña vertical indicada, xerando dúas moléculas de ADN cos extremos romos. Outros encimas de restrición xeran extremos cohesivos, xa que cortan de forma diferente as dúas febras de ADN.[130] Na natureza, estes encimas preséntanse nas bacterias, e protexen ás mesmas contra as infeccións de fagos, ao dixeriren o ADN de ditos fagos cando entra a través da parede bacteriana, actuando como un mecanismo de defensa.[131] En biotecnoloxía, estas nucleases específicas de secuencias do ADN utilízanse en enxeñaría xenética para clonar fragmentos de ADN,[132] e na técnica da pegada xenética.[133]
Os encimas denominados ADN ligases poden unir febras de ADN cortadas ou rotas.[134] As ligases son particularmente importantes na replicación da febra que sofre replicación descontinua no ADN (febra retardada), xa que unen os fragmentos (de Okazaki) curtos de ADN xerados na forquita de replicación para formar unha copia completa do molde de ADN. Tamén se utilizan na reparación do ADN e en procesos de recombinación xenética.[134]
Topoisomerases e helicases
As topoisomerases son encimas que posúen á vez actividade nuclease e ligase. Estas proteínas varían a cantidade de ADN superenrolado. Algúns destes encimas funcionan cortando a hélice de ADN e permitindo que unha sección rote, de maneira que reducen o grao de superenrolamento. Unha vez feito isto, o encima volve unir os fragmentos de ADN.[75] Outros tipos de encimas poden cortar unha hélice de ADN e logo pasar a segunda febra de ADN a través da rotura, antes de unir as hélices.[135] As topoisomerases son necesarias para moitos procesos nos que intervén o ADN, como a replicación do ADN e a transcrición.[76]
As helicases son unhas proteínas que pertencen ao grupo dos motores moleculares. Utilizan enerxía química almacenada nos nucleósidos trifosfatos, fundamentalmente ATP, para romperen pontes de hidróxeno entre bases e separaren a dobre hélice de ADN en febras simples.[136] Estes encimas son esenciais para a maioría dos procesos nos que os encimas necesitan acceder ás bases do ADN.[137]
Polimerases
- Artigos principais: ADN polimerase e ARN polimerase.
As polimerases son encimas que sintetizan cadeas de nucleótidos a partir de nucleósidos trifosfato. A secuencia dos seus produtos é copia de cadeas de polinucleótidos existentes, que se denominan moldes. Estes encimas funcionan engadindo nucleótidos ao grupo hidroxilo en 3' do nucleótido previo da cadea de ADN. En consecuencia, todas as polimerases funcionan en dirección 5′ → 3′.[138] Nos sitios activos destes encimas, o nucleósido trifosfato que se incorpora aparea a súa base coa correspondente no molde: isto permite que a polimerase sintetice de forma precisa a cadea complementaria ao molde.
As polimerases clasifícanse de acordo co tipo de molde que utilizan:
- Na replicación do ADN, unha ADN polimerase dependente de ADN realiza unha copia de ADN a partir dunha secuencia de ADN. A precisión é vital neste proceso, polo que moitas destas polimerases teñen unha actividade de comprobación da lectura. Grazas a esta actividade, a polimerase recoñece erros ocasionais no apareamento de bases durante a síntese. Se se detecta un destes erros de apareamento, actívase unha actividade de exonuclease en dirección 3′ → 5′ e a base incorrecta elimínase.[139] Na maioría dos organismos as ADN polimerases funcionan nun gran complexo denominado replisoma, que contén múltiples unidades accesorias, como helicases.[140]
- As ADN polimerases dependentes de ARN son unha clase especializada de polimerases que copian a secuencia dunha febra de ARN en ADN. Inclúen a transcriptase inversa, que é un encima viral implicado na infección de células por retrovirus, e a telomerase, que é necesaria para a replicación dos telómeros.[59][141] A telomerase é unha polimerase infrecuente, porque contén o seu propio molde de ARN como parte da súa estrutura.[60]
- A transcrición lévase a cabo por unha ARN polimerase dependente de ADN que copia a secuencia dunha das febras de ADN en ARN. Para empezar a transcribir un xene, a ARN polimerase únese a unha secuencia do ADN denominada promotor, e separa as febras do ADN. Entón copia a secuencia do xene nun transcrito de ARN mensaxeiro ata que acada unha rexión do ADN denominada terminador, onde se detén e deslígase do ADN. Como acontece coas ADN polimerases dependentes de ADN en humanos, a ARN polimerase II (o encima que transcribe a maioría dos xenes do xenoma humano) funciona como un gran complexo multiproteico que contén múltiples subunidades reguladoras e accesorias.[142]
Remove ads
Recombinación xenética
 |
 |
Estrutura dun estado intermedio en unión de Holliday na recombinación xenética. As catro febras de ADN separadas están coloreadas en vermello, azul, verde e amarelo.[143]
- Artigo principal: Recombinación xenética.

Unha hélice de ADN normalmente non interacciona con outros segmentos de ADN, e nas células humanas os diferentes cromosomas mesmo ocupan áreas separadas no núcleo celular, denominadas “territorios cromosómicos”.[144] A separación física dos diferentes cromosomas é importante para que o ADN manteña a súa capacidade de funcionar como un almacén estable de información. Un dos poucos momentos nos que os cromosomas interaccionan é durante o sobrecruzamento cromosómico, durante o cal se recombinan. O sobrecruzamento cromosómico ocorre cando dous cromosomas homólogos intercambian segmentos, para o cal as dúas hélices de ADN rompen, intercámbianse e únense de novo.[145]
A recombinación permite que os cromosomas intercambien información xenética e produce novas combinacións de alelos, o que aumenta a eficiencia da selección natural e pode ser importante na evolución rápida de novas proteínas.[146] Durante a profase I da meiose, unha vez que os cromosomas homólogos están perfectamente apareados formando estruturas chamadas bivalentes, prodúcese o sobrecruzamento ou entrecruzamento (crossing-over), no cal as cromátides homólogas (non irmás), procedentes do pai e da nai, intercambian material xenético. Como consecuencia do sobrecruzamento prodúcese unha recombinación xenética, que acrecenta en gran medida a variabilidade xenética entre a descendencia de proxenitores que se reproducen por vía sexual. A recombinación xenética tamén pode estar implicada na reparación do ADN, en particular na resposta celular ás roturas de dobre febra do ADN.[147]
A forma máis frecuente de sobrecruzamento cromosómico é a recombinación homóloga, na que os dous cromosomas implicados comparten secuencias moi similares. A recombinación non homóloga pode ser daniña para as células, xa que pode producir translocacións cromosómicas e anomalías xenéticas. A reacción de recombinación está catalizada por encimas coñecidos como recombinases, tales como RAD51.[148] O primeiro paso no proceso de recombinación é unha rotura de dobre febra no ADN, causada por unha endonuclease ou por un dano no ADN.[149] Posteriormente, unha serie de pasos catalizados en parte pola recombinase, conducen á unión das dúas hélices formando polo menos unha unión de Holliday, na que un segmento dunha febra simple é aliñado ou hibridado (annealed) coa febra complementaria na outra hélice. A unión de Holliday é unha estrutura de unión tetraédrica que pode moverse ao longo do par de cromosomas, intercambiando unha febra por outra. A reacción de recombinación detense polo corte da unión e a subseguinte reunión dos segmentos de ADN libres.[150]
Remove ads
Evolución do metabolismo de ADN
- Artigos principais: Hipótese do mundo de ARN e Orixe da vida.
O ADN contén a información xenética que permite á maioría dos organismos viventes funcionar, crecer e reproducirse. Porén, non está claro durante canto tempo leva exercendo esta función nos ~3000 millóns de anos da historia da vida, xa que se suxeriu que as formas de vida máis temperás poderían ter utilizado ARN como material xenético.[151][152] O ARN puido funcionar inicialmente como a molécula central dun metabolismo primixenio, xa que pode transmitir información xenética e simultaneamente actuar como catalizador formando parte de ribozimas.[153] Este antigo mundo de ARN onde os ácidos nucleicos funcionarían como catalizadores e como almacéns de información xenética puido influír na evolución do código xenético actual, baseado en catro nucleótidos. Isto deberíase a que o número de bases diferentes nun organismo é un compromiso entre un número pequeno de bases (o que aumentaría a precisión da replicación) e un número grande de bases (que aumentaría a eficiencia catalítica dos ribozimas).[154]
Porén, non temos evidencias directas dos sistemas xenéticos primitivos, xa que a recuperación do ADN a partir da maior parte dos fósiles é imposible, porque o ADN só pode sobrevivir no medio ambiente durante menos dun millón de anos, e logo empeza a degradarse lentamente en fragmentos de menor tamaño en solución.[155] Algunhas investigacións pretenden que se obtivo ADN máis antigo, por exemplo un informe sobre o illamento dunha bacteria viable a partir dun cristal salino de 250 millóns de anos de antigüidade,[156] mais estes datos son controvertidos.[157][158]
Non obstante, poden utilizarse ferramentas de evolución molecular para inferir os xenomas de organismos primitivos a partir de organismos contemporáneos.[159][160] En moitos casos, estas inferencias son suficientemente fiables, de maneira que unha biomolécula codificada nun xenoma primitivo pode resucitarse no laboratorio para ser estudada hoxe.[161][162] Unha vez que a biomolécula primixenia se resucitou, as súas propiedades poden ofrecer inferencias sobre ambientes e estilos de vida primixenios. Este proceso relaciónase co campo emerxente da paleoxenética experimental.[163]
Malia todo, o proceso de traballo cara atrás desde o presente ten limitacións inherentes, razón pola cal outros investigadores tratan de aclarar o mecanismo evolutivo traballando desde a orixe da Terra en diante. Tendo suficiente información sobre a química no cosmos, o xeito en que as substancias cósmicas puideron depositarse na Terra, e as transformacións que puideron ter lugar na superficie terrestre primixenia, quizais poderiamos aprender o suficiente sobre as orixes para desenvolver modelos de evolución ulterior da información xenética[164].
Remove ads
Técnicas máis comúns
O coñecemento da estrutura do ADN permitiu o desenvolvemento de moitas ferramentas tecnolóxicas que explotan as súas propiedades fisicoquímicas para analizar a súa implicación en problemas concretos: por exemplo, desde análises filoxeńeticas para detectar semellanzas entre diferentes taxons, á caracterización da variabilidade individual dun paciente na súa resposta a un determinado fármaco, pasando por un enfoque global, a nivel xenómico, de calquera característica específica nun grupo de individuos de interese. [165]
Podemos clasificar as metodoloxías de análise do ADN en dous grupos: (1) as que procuran a súa multiplicación, xa sexa in vivo, como a reacción en cadea da polimerase (PCR), ou in vitro, como a clonación, e (2) as que explotan as propiedades específicas de elementos concretos, ou de xenomas clonados, como é o caso da secuenciación do ADN e da hibridación con sondas específicas ("Southern blot" e chips de ADN).
Tecnoloxía do ADN recombinante
A tecnoloxía do ADN recombinante, pedra angular da enxeñaría xenética, permite multiplicar en grandes cantidades un fragmento de ADN de interese, o cal se di que foi clonado. Para iso, debe introducirse dito fragmento noutro elemento de ADN, xeralmente un plásmido, que posúe na súa secuencia os elementos necesarios para que a maquinaria celular dun hospedador, normalmente a bacteria Escherichia coli, o replique. Deste modo, unha vez transformada a cepa bacteriana, o fragmento de ADN clonado reprodúcese cada vez que a bacteria se divide.[166]
Para clonar a secuencia de ADN de interese, empréganse encimas como ferramentas de corte e empalme do fragmento e do vector (o plásmido). Ditos encimas pertencen a dous grupos: en primeiro lugar, os encimas de restrición, que posúen a capacidade de recoñecer e cortar secuencias específicas; en segundo lugar, a ADN ligase, que establece un enlace covalente entre extremos de ADN compatibles[165] (ver sección Nucleases e ligases).
Secuenciación
- Artigo principal: Secuenciación do ADN.
A secuenciación do ADN consiste en determinar a orde dos nucleótidos dun polímero de ADN de calquera lonxitude, pero adoita dirixirse á determinación de xenomas completos, debido a que as técnicas actuais permiten realizar esta secuenciación a gran velocidade, o cal foi de grande importancia para proxectos de secuenciación a grande escala como o Proxecto Xenoma Humano. Outros proxectos relacionados, en ocasións froito da colaboración entre científicos a escala mundial, estableceu a secuencia completa do ADN de moitos xenomas de animais, plantas e microorganismos.[167]
O método de secuenciación de Sanger[168] foi o máis empregado durante o século XX. Baséase na síntese de ADN en presenza de desoxirribonucleósidos trifosfato (ddNTP), compostos que, a diferenza dos desoxinucleósidos normais (dNTPs), carecen dun grupo hidroxilo no seu extremo 3'. Aínda que os didesoxinucleósidos trifosfatados poden incorporarse á cadea en síntese, a carencia dun extremo 3'-OH imposibilita a xeración dun novo enlace fosfodiéster co nucleótido seguinte; polo tanto, provocan o remate da síntese. Por esta razón, o método de secuenciación tamén se denomina «de terminación de cadea». A reacción realízase usualmente preparando un tubo co ADN molde, a polimerase, un cebador ou primer, desoxinucleósidos normais e unha pequena cantidade de didesoxinucleósidos marcados con fluorescencia na súa base nitroxenada. Deste modo, o ddTTP pode ir marcado en azul, o ddATP en vermello etc. Durante a polimerización, vanse truncando as cadeas crecentes, ao chou, en distintas posicións. Polo tanto, prodúcese unha serie de produtos de distinto tamaño, coincidindo a posición da terminación coa incorporación do ddNTP correspondente. Unha vez terminada a reacción, é posible someter a mestura a unha electroforese capilar (que separa todos os fragmentos segundo a súa lonxitude) na cal se le a fluorescencia para cada posición do polímero. No noso exemplo, a lectura azul-vermello-azul-azul traduciríase como TATT.[169][170]
Reacción en cadea da polimerase (PCR)
- Artigo principal: Reacción en cadea da polimerase.
A reacción en cadea da polimerase, xeralmente coñecida polas súas siglas en inglés como PCR, é unha técnica de bioloxía molecular descrita en 1986 por Kary Mullis,[171] cuxo obxectivo é obter un gran número de copias dun fragmento de ADN dado, partindo dunha escasa cantidade inicial. Para iso, emprégase unha ADN polimerase termoestable que, en presenza dunha mestura dos catro desoxinucleótidos, un tampón da forza iónica axeitada e os catións precisos para a actividade do encima, dous oligonucleótidos (denominados cebadores ou primers) complementarios dunha parte da secuencia (situados a distancia suficiente e en dirección antiparalela) e baixo unhas condicións de temperatura adecuadas, controladas por un aparello denominado termociclador, xera exponencialmente novos fragmentos de ADN semellantes ao orixinal e acoutados polos dous cebadores.[166]
A PCR pode efectuarse como unha técnica de punto final, é dicir, como unha ferramenta de xeración do ADN desexado, ou como un método continuo, no que se avalíe dita polimerización a tempo real. Esta última variante é común na PCR cuantitativa.[165]
Southern blot
- Artigo principal: Southern blot.
O método de «transferencia de Southern»[172] ou «Southern blot» permite a detección dunha secuencia de ADN nunha mostra complexa ou non do ácido nucleico. Combina unha separación mediante masa e carga (efectuada por medio dunha electroforese en xel) cunha hibridación cunha sonda de ácido nucleico marcada dalgún modo (xa sexa con radioactividade ou cun composto químico) que, tras varias reaccións, dea lugar á aparición dun sinal de cor ou fluorescencia. Dita hibridación realízase trala transferencia do ADN separado por electroforese a unha membrana de filtro. Unha técnica semellante, pero na cal non se produce a mencionada separación electroforética denomínase dot blot.[173]
O método recibe o seu nome en honor ao seu inventor, o biólogo inglés Edwin Southern.[174] Por analoxía ao método Southern, desenvolvéronse técnicas parecidas que permiten a detección de secuencias dadas de ARN (método northern, que emprega sondas de ARN ou ADN marcadas)[175] ou de proteínas específicas (técnica western, baseada no uso de anticorpos).[176]
Chips de ADN
- Artigo principal: Chip de ADN.
Os chips de ADN son coleccións de oligonucleótidos de ADN complementario dispostos en ringleiras fixadas sobre un soporte, frecuentemente de cristal. Utilízanse para o estudo de mutacións de xenes coñecidos ou para monitorizar a expresión xénica dunha preparación de ARN.[178]
Remove ads
Aplicacións
Enxeñaría xenética
A investigación sobre o ADN ten unha grande influencia, sobre todo en medicina, mais tamén en agricultura e gandaría, onde os obxectivos son os mesmos que coas técnicas tradicionais que o home leva utilizando desde hai milenios: domesticación, selección e cruces dirixidos para obter variedades de animais e plantas máis produtivos. A moderna bioloxía e bioquímica fan uso intensivo da tecnoloxía do ADN recombinante, introducindo xenes de interese en organismos, co obxectivo de expresar unha proteína recombinante concreta, que pode ser:
- illada para o seu uso posterior: por exemplo, pódense transformar microorganismos para convertelos en auténticas fábricas que producen grandes cantidades de substancias útiles, como insulina ou vacinas, que posteriormente se illan e se utilizan terapeuticamente.[179][180][181]
- necesaria para substituír a expresión dun xene endóxeno danado que deu lugar a unha patoloxía, o que permitiría o restablecemento da actividade normal da proteína perdida e levaría á recuperación do estado fisiolóxico normal, non patolóxico. Este é o obxectivo da terapia xénica, un dos campos nos que se está a traballar activamente en medicina, analizando vantaxes e inconvenientes de diferentes sistemas de administración do xene (virais e non virais) e os mecanismos de selección do punto de integración dos elementos xenéticos (distintos para os virus e os transposóns) no xenoma diana.[182] Neste caso, antes de pensar na posibilidade de realizar unha terapia xénica nunha determinada patoloxía, é fundamental comprender o impacto do xene de interese no desenvolvemento de dita patoloxía, para o cal é necesario o desenvolvemento dun modelo animal, eliminando ou modificando dito xene nun animal de laboratorio, por medio da técnica ‘’knockout’’. Só no caso de que os resultados no modelo animal sexan satisfactorios se procedería a analizar a posibilidade de restablecer o xene danado por terapia xénica.[183]
- utilizada para enriquecer un alimento: por exemplo, a composición do leite (unha importante fonte de proteínas para o consumo humano e animal) pode modificarse por medio da transxénese, engadindo xenes exóxenos e desactivando xenes endóxenos para mellorar o seu valor nutricional, reducir infeccións nas glándulas mamarias, proporcionar aos consumidores proteínas antipatóxenas e preparar proteínas recombinantes para o seu uso farmacéutico.[184][185]
- útil para mellorar a resistencia do organismo transformado: por exemplo en plantas pódense introducir xenes que confiren resistencia a patóxenos (virus, insectos, fungos…), ou a axentes estresantes abióticos (salinidade, seca, metais pesados…).[186][187][188]
Medicina forense
- Véxase tamén: Pegada xenética.
En investigación forense pódese utilizar o ADN presente no sangue, o seme, as células de pel, saliva ou pelo de restos atopados na escena dun crime para identificar ao responsable. Esta técnica denomínase pegada xenética, ou tamén "perfil de ADN". Ao realizar a proba da pegada xenética, compárase a lonxitude de seccións moi variables de ADN repetitivo, como os microsatélites, entre persoas diferentes. Este método é moi fiable para identificar un criminal.[189] Porén, a identificación pode complicarse se a escena está contaminada con ADN de persoas diferentes.[190] A técnica da pegada xenética foi desenvolvida en 1984 polo xenetista británico Sir Alec Jeffreys,[191] e utilizouse por primeira vez en medicina forense para condenar a unha persoa en Inglaterra en 1983 e 1986.[192] Pódese requirir ás persoas acusadas de certos tipos de crimes que fornezan unha mostra de ADN para introducir os resultados nunha base de datos. Isto facilitou o labor dos investigadores na resolución de casos antigos, onde só se obtivo unha mostra de ADN da escena do crime, nalgúns casos permitindo exonerar a un convicto. A pegada xenética tamén pode utilizarse para identificar cadáveres en accidentes en masa,[193] ou para realizar probas de consanguinidade.[194]
Bioinformática
- Artigo principal: Bioinformática.
A bioinformática implica a manipulación, procura e extracción de información dos datos da secuencia do ADN. O desenvolvemento das técnicas para almacenar e buscar secuencias de ADN supuxo avances no desenvolvemento do software dos computadores, para moitas aplicacións, especialmente algoritmos de busca de frases, aprendizaxe automática e teorías de bases de datos.[195] A procura de frases ou algoritmos de coincidencias, que buscan a presenza dunha secuencia de letras dentro dunha secuencia de letras maior, desenvolveuse para buscar secuencias específicas de nucleótidos.[196] Noutras aplicacións como editores de textos, poden funcionar mesmo algoritmos simples, pero as secuencias de ADN poden xerar que estes algoritmos presenten un comportamento de case-o-peor-caso, debido ao baixo número de caracteres. O problema relacionado do aliñamento de secuencias persegue identificar secuencias homólogas e localizar mutacións específicas que as diferencien. Estas técnicas, fundamentalmente o aliñamento múltiple de secuencias, utilízanse ao estudar as relacións filoxenéticas e a función das proteínas.[197] As coleccións de datos que representan secuencias de ADN do tamaño dun xenoma, tales como as producidas polo Proxecto Xenoma Humano, son difíciles de usar sen anotacións, que marcan a localización dos xenes e os elementos reguladores en cada cromosoma. As rexións de ADN que teñen patróns asociados con xenes que codifican proteínas (ou ARN) poden identificarse por algoritmos de localización de xenes, o que permite aos investigadores predicir a presenza de produtos xénicos específicos nun organismo mesmo antes de que fose illado experimentalmente.[198]
Nanotecnoloxía de ADN

A nanotecnoloxía de ADN utiliza as propiedades únicas de recoñecemento molecular do ADN e outros ácidos nucleicos para crear complexos ramificados autoensamblados con propiedades útiles. Neste caso, o ADN utilízase como un material estrutural, máis que como un portador de información biolóxica.[199] Isto levou á creación de retículas periódicas de dúas dimensións usando o método de ADN origami, ademais de estruturas en tres dimensións con forma de poliedros.[200] Tamén se demostrou a creación de aparellos nanomecánicos e autoensamblaxes algorítmicas,[201] e estas estruturas de ADN foron utilizadas como moldes para a colocación doutras moléculas como nanopartículas de ouro coloidal e moléculas da proteína estreptavidina.[202]
Evolución, historia e antropoloxía
- Artigo principal: Filoxenia.
Ao longo do tempo, o ADN almacena mutacións que se herdan e, polo tanto, contén información histórica, de maneira que comparando secuencias de ADN, os xenetistas poden inferir a historia evolutiva dos organismos, a súa filoxenia.[203] A investigación filoxenética é unha ferramenta fundamental en bioloxía evolutiva. Se comparamos as secuencias de ADN dentro dunha especie, os xenetistas de poboacións poden coñecer a historia de determinadas poboacións. Isto pódese utilizar nunha ampla variedade de estudos, desde ecoloxía ata antropoloxía. Por outro lado, o ADN tamén se utiliza para estudar relacións familiares recentes.[204]
Almacenamento de información
En 2013 publicouse en Nature que o Instituto Europeo de Bioinformática e a compañía Agilent Technologies propuxeran un mecanismo para usar a capacidade do ADN de codificar información como un medio para o almacenamento de datos dixital. O grupo conseguiu codificar 739 kilobytes de datos en código de ADN, sintetizar ese ADN, secuencialo despois e descodificar a información de novo á súa forma orixinal, cunha exactitude do 100%. A información codificada consistía en ficheiros de texto e de son. Anteriormente, publicárase un experimento realizado por investigadores da Universidade Harvard, onde se codificara o texto dun libro de 54.000 páxinas.[205][206]
Remove ads
Historia da investigación do ADN

O ADN foi illado por primeira vez polo médico suízo Friedrich Miescher que, en 1869, descubriu unha substancia microscópica no pus de vendaxes de feridas. Como se atopaba no núcleo das células chamoulle "nucleína".[207] En 1919, Phoebus Levene identificou a base nitroxenada, o azucre e o fosfato da unidade nucleotídica.[208] Levene suxeriu que o ADN consistía nunha cadea de nucleótidos unidos uns a outros polos seus fosfatos. Porén, Levene pensaba que a cadea era moi curta e as bases repetíanse continuamente nunha orde determinada. En 1937 William Astbury fixo a primeira difracción de raios X do ADN, que mostraba que tiña unha estrutura regular.[209]
En 1927 Nikolai Koltsov propuxo que as características hereditarias herdábanse por medio dunha "molécula xigante hereditaria" que estaría feita de "dúas cadeas especulares que se replicarían de modo semiconservativo usando cada unha das cadeas como molde".[210] En 1928, Frederick Griffith descubriu que o carácter "liso" de certas cepas da bacteria pneumococo podía transformarse en "rugoso" mesturando bacterias mortas "lisas" con bacterias vivas "rugosas". Algunha substancia debía pasar dunhas a outras levando a información necesaria, pero non soubo identificar cal era. Naquela época moitos pensaban que a información xenética se almacenaba nas proteínas.[211] Anos despois en 1943 Oswald Avery, xunto con MacLeod e McCarty, identificaron ao ADN como molécula causante da transformación no experimento de Griffith.[212] O papel do ADN como molécula hereditaria foi confirmado nos experimentos de Hershey e Chase con virus en 1952.[213]
En 1953, James D. Watson e Francis Crick propuxeron o primeiro modelo de dobre hélice do ADN, que foi publicado en "Nature".[214] O seu modelo de dobre hélice estaba baseado na imaxe de difracción de raios X etiquetada como "Foto 51"[215] tomada por Rosalind Franklin e Raymond Gosling en maio de 1952, e na información sobre o apareamento de bases obtida anos antes de Erwin Chargaff. As regras de Chargaff xogaron un importante papel no establecemento das configuracións de dobre hélice dos ADN B e A.[216]
As probas experimentais que apoiaban o modelo de Watson e Crick foron publicadas nunha serie de cinco artigos nunha mesma edición de Nature.[217] Destes cinco artigos, o de Franklin e Gosling foi a primeira publicación das súas propias difraccións de raios X e métodos de análise orixinais que parcialmente sostiñan o modelo de Watson e Crick;[218][219] esta edición tamén contiña un artigo da estrutura do ADN de Maurice Wilkins e dous dos seus colegas, cuxas análises e modelos de raios X do ADN B in vivo tamén apoiaban a presenza in vivo da dobre hélice do ADN proposta por Crick e Watson nas dúas páxinas previas de Nature.[220] En 1962, despois da morte de Franklin, Watson, Crick, e Wilkins recibiron conxuntamente o Premio Nobel de Fisioloxía e Medicina.[221] Porén, as regras do Nobel daquela época só permitían que fose outorgado a persoas vivas (Franklin xa morrera daquela), e iniciouse un forte debate que aínda continúa sobre quen debería recibir o crédito polo seu descubrimento.[222]
Crick presentou en 1957 o dogma central da bioloxía molecular, que predicía as relacións entre o ADN, ARN e proteínas, e formulou a "hipótese do adaptador".[223] O mecanismo de replicación semiconservativo do ADN foi demostrado nos experimentos de 1958 de Meselson e Stahl con isótopos do nitróxeno.[224] Posteriores traballos de Crick e colaboradores demostraron que o código xenético estaba baseado en tripletes de bases non solapados, chamados codóns, o que permitiu a Har Gobind Khorana, Robert W. Holley e Marshall Warren Nirenberg descifrar o código xenético.[225] Estes descubrimentos representaron o nacemento da bioloxía molecular.[226]
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
