From Wikipedia, the free encyclopedia
A estreptavidina é unha proteína de 52,8 kDa purificada na bacteria Streptomyces avidinii, da que recibe o seu nome. Os homotetrámeros de estreptavidina teñen unha afinidade extraordinariamente alta pola biotina (tamén chamada vitamina B7 ou vitamina H). A súa constante de disociación (Kd) é da orde de ≈10−14 mol/L,[1], o que fai que a unión da biotina á estreptavidina sexa unha das interaccións non covalentes máis fortes que se coñecen na natureza. A estreptavidina utilízase extensamente en bioloxía molecular e bionanotecnoloxía debido á resistencia que teñen os complexos estreptavidina-biotina aos solventes orgánicos, desnaturalizantes (por exemplo, cloruro de guanidinio), deterxentes (por exemplo, SDS, Triton), encimas proteolíticos, e valores extremos de temperatura e pH.
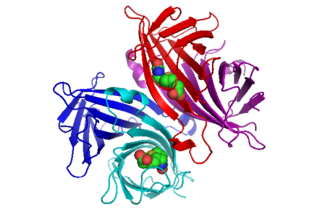
En 1989 dous grupos de investigación informaron da obtención da estrutura cristalina da estreptavidina. A estrutura foi resolta utilizando difraccións anómalas de multi lonxitude de onda por Hendrickson et al.[2] na Universidade de Columbia e tamén, utilizando substitucións isomorfas múltiples, por Weber et al.[3] no Departamento de Desenvolvemento e Investigación Central de E. I. DuPont. En 2012, había 135 estruturas depositadas no Protein Data Bank. Ver esta ligazón para ter unha lista completa. Os extremos N-terminal e C-terminal da proteína completa de 159 residuos son procesados para dar un núcleo de estreptavidina máis curto, xeralmente composto polos residuos do 13 ao 139. A eliminación dos extremos N- e C-terminais é necesaria para que teña a súa característica alta afinidade pola biotina. A estrutura secundaria dun monómero de estreptavidina está composta de oito febras β antiparalelas, que se pregan para orixinar unha estrutura terciaria en barril β antiparalela. Hai un sitio de unión á biotina localizado nun extremo de cada barril β. Para orixinar a estruitura cuaternaria tetramérica da estreptavidina asócianse catro monómeros de estreptavidina idénticos (é dicir, catro barrís β idénticos). O sitio de unión da biotina de cada barril está formado por residuos do interior do barril xunto cun Trp120 conservado da subunidade veciña. Deste xeito, cada subunidade contribúe á formación do sitio de unión na subunidade veciña, e así o tetrámero pode considerarse tamén un dímero de dímeros funcionais.
As numerosas estruturas cristalinas obtidas do complexo estreptavidina-biotina serviron para esclarecer as orixes da alta afinidade coa biotina. En primeiro lugar, hai unha gran complementariedade de forma entre a biotina e o seu peto de unión. En segundo lugar, hai unha extensa rede de enlaces de hidróxeno que se forman coa biotina cando esta está situada no seu sitio de unión. Hai oito enlaces de hidróxeno feitos directamente con residuos situados no sitio de unión (a denominada 'primeira capa' de enlaces de hidróeno), nos que están implicados os residuos Asn23, Tyr43, Ser27, Ser45, Asn49, Ser88, Thr90 e Asp128. Hai tamén unha 'segunda capa' de enlaces de hidróxeno que implican aos residuos que interaccionan coa primeira capa de residuos. Con todo, a afinidade estreptavidina-biotina excede o que se agardaría tendo en conta só as interaccións por enlaces de hidróxeno, o que indica que debe haber outro mecanismo que contribúa á alta afinidade.[4] O peto de unión á bitotina é hidrofóbico, e hai numerosos contactos mediados por forzas de van der Waals e interaccións hidrofóbicas coa biotina cando está no peto, o cal se cre tamén que inflúe na alta afinidade. En particular, o peto está tapizado de residuos de triptófano conservados. Finalmente, a unión da biotina está acompañada pola estabilización dun bucle flexible que conecta as febras B 3 e 4 (L3/4), que se pecha sobre a biotina unida, actuando como unha 'tapa' sobre o peto de unión e contribuíndo á extremadamente baixa taxa de disociación observada.
A maioría dos intentos de mutar a estreptavidina tiveron como resultado unha diminución da afinidade da unión da biotina, que é o que se agardaba nun sistema tan optimizado como este. Porén, un mutante da estreptavidina obtido por enxeñaría recentemente, chamado traptavidina, ten unha disociación coa biotina dez veces máis lenta, ademais dunha estabilidade mecánica e termal máis alta,[5] e é distribuída polo Departamento de Bioquímica da Universidade de Oxford. Esta diminución da disociación estaba acompañada dunha diminución á metade na taxa de asociación.
Entre os usos máis comúns están a purificación ou detección de varias biomoléculas. O forte enlace estreptavidina-biotina pode utilizarse para unir varias biomoléculas entre si ou a un soporte sólido. Necesítanse condicións fortes para romper a interacción estreptavidina-biotina, que a miúdo desnaturaliza a proteína de interese que se purifica. Porén, unha curta incubación en auga por riba dos 70 °C rompe reversiblemente a interacción sen desnaturalizar a estreptavidina, o que permite a reutilización do soporte sólido da estreptavidina.[6] Outra aplicación é a denominada Strep-tag, que é un sistema optimizado para a purificación e detección de proteínas. A estreptavidina úsase amplamente na técnica do western blot e en inmunoensaios conxugada a algunha molécula reporteira, como a peroxidase do ravo pìcante (Armoracia rusticana). A estreptavidina foi tamén utilizada no campo en desenvolvemento da nanobiotecnoloxía, no que se usan moléculas biolóxicas como proteínas ou lípidos para crear estruturas ou dispositivos a nanoescala. Neste contexto a estreptavidina pode utilizarse como material para ligar moléculas de ADN biotiniladas para crear armazóns de nanotubos de carbono de parede simple[7] ou mesmo poliedros de ADN complexos.[8] A estreptavidina tetramérica utilizouse tamén como un núcleo arredor do cal se poden dispoñer outras proteínas, ou ben cunha etiqueta de afinidade como Strep-tag ou Avitag ou ben por fusión xenética a SpyTag.[9] A fusión con SpyTag permitiu a xeración de ensamblaxes de 8 ou 20 subunidades de estreptavidina. Ademais dunha sonda de forza molecular para estudos de microscopia de forza atómica,[10] creáronse novos materiais como retículas cristalinas en tres dimensións.[11]
A inmunoterapia destinada a unha diana (pretargeted immunotherapy) usa a estreptavidina conxugada a un anticorpo monoclonal contra antíxenos específicos de células cancerosas para enviar a radiación só ás células cancerosas e non aos tecidos circundantes. Atopáronse inicialmente problemas coa saturación dos sitios de unión á biotina da estreptavidina pola biotina endóxena en vez de pola biotina inxectada radioetiquetada, e un alto grao de exposición radioactiva nos riles debido ás fortes propiedades de adsorción ás células da estreptavidina. Actualmente, crese que este alto nivel de unión a tipos celulares adherentes, como plaquetas activadas e melanomas, é o resultado da unión a integrinas mediada pola secuencia RYD da estreptavidina.[12]

A estreptavidina é un tetrámero e cada subunidade únese á biotina con igual afinidade. Nalgunhas aplicacións a multivalencia é unha vantaxe, por exemplo naquelas nas que os efectos de avidez melloran a capacidade das moléculas unidas á estreptavidina para detectaren células T específicas.[13] Noutros casos, como o uso de estreptavidina para visualizar proteínas específicas nas células, a multivalencia pode perturbar a función da proteína de interese. A estreptavidina monovalente é unha forma recombinante obtida por enxeñaría da estreptavidina, que é un tetrámero pero só un dos catro sitios de unión é funcional. Este único sitio de unión ten unha afinidade de 10−14 mol/L e non pode causar enlaces cruzados.[14] A estreptavidina monovalente é distribuída por Oxford. As aplicacións da estreptavidina monovalente inclúen un rastreo fluorescente de receptores da superficie celular, que decoran o ADN origami, e actúan como un sinalador que identifica rexións específicas para microscopia crioelectrónica.
A estreptavidina monomérica é unha forma recombinante da estreptavidina que presenta mutacións que rompen o tetrámero nun monómero e potencian a solubilidade da subunidade illada resultante. As versións da estreptavidina monomérica teñen unha afinidade pola biotina de 10−7mol/L 10−8mol/L e non son ideais para aplicacións de etiquetado, mais son útiles para a purificación, na cal é desexable a reversibilidade.[15][16]

Pode prepararse unha estreptavidina con exactaemnte dous sitios de unión á biotina por tetrámero mesturando subunidades con e sen un sitio de unión á biotina funcional e purificación por cromatografía de intercambio iónico. Os sitios de unión funcionais teñen aquí a mesma estabilidade de unión á biotina que a estreptavidina de tipo salvaxe ou natural. Poden purificarse por separado as estreptavidinas divalentes cos dous sitios de unión á biotina xuntos (cis-divalente) ou separados (trans-divalente), como se ve na figura.[17]
A estreptavidina non é a única proteína que pode unirse á biotina con alta afinidade. A avidina é outra das proteínas máis notables que se unen á biotina. A avidina foi illada orixinalmente da clara de ovo, e só ten un 30% de identidade de secuencia coa estreptavidina, pero ten unhas estruturas secundaria, terciaria e cuaternaria case idénticas. Ten unha afinidade aínda maior pola biotina (Kd ~ 10−15M) pero, a diferenza da estreptavidina, está glicosilada, cargada positivamente, ten actividade pseudocatalítica (pode potenciar a hidrólise alcalina dun enlace éster entre a biotina e un grupo nitrofenilo) e ten unha tendencia maior á agragación. Ademais, a estreptavidina é o mellor ligante de conxugados de biotina; a avidina ten unha afinidade de unión máis baixa que a estreptavidina pola biotina conxugada a outra molécula, malia que a avidina ten unha maior afinidade pola biotina libre non conxugada.
A estreptavidina ten un punto isoeléctrico (pI) lixeiramente ácido de ~5, pero tamén se dispón comercialmente dunha forma recombinante da estreptavidina con pI case neutro. Como a estreptavidina carece totalmente de modificacións de carbohidratos e ten un pI case neutro, ten a vantaxe de ter unha unión non específica moito máis baixa que a avidina. A avidina desglicosilada (NeutrAvidin) é máis comparable en tamaño, pI e unión non específica á estreptavidina.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.