composto químico From Wikipedia, the free encyclopedia
A tirosina (abreviadamente Tyr ou Y)[1] ou 4-hidroxifenilalanina, é un dos 20 aminoácidos que forman parte das proteínas. É un α-aminoácido cunha cadea lateral formada por un CH2 unido a un grupo fenol, o que fai que sexa unha cadea lateral cíclica aromática cun grupo OH, que lle dá carácter polar neutro.
| Tirosina | |
|---|---|
 | |
 | |
(S)-Tirosina | |
Outros nomes Ácido L-2-amino-3-(4-hidroxifenil)propanoico | |
| Identificadores | |
| Número CAS | 60-18-4 (L) |
| PubChem | 1153 |
| ChemSpider | 5833 |
| DrugBank | DB03839 |
| ChEBI | CHEBI:58315 |
| ChEMBL | CHEMBL925 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C9H11NO3 |
| Masa molar | 181,19 g mol−1 |
| Perigosidade | |
| NFPA 704 | |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |

Os seus codóns son o UAC e UAU. É un aminoácido proteinoxénico non esencial. O seu nome procede do grego tyri, que significa queixo, xa que foi descuberta en 1846 polo químico alemán Justus von Liebig na proteína caseína do queixo.[2][3] O seu grupo funcional denomínase tirosil.

Ademais do seu papel como compoñente das proteínas, a tirosina ten funcións especiais debido ao seu grupo fenol. Forma parte importante de proteínas que interveñen en procesos de transdución de sinais na célula. Funciona como un receptor de grupos fosfato que se transfiren por medio de proteína quinases. A fosforilación do seu grupo hidroxilo cambia a actividade da proteína diana.
Un residuo de tirosina ten tamén unha función moi importante na fotosíntese. No fotosistema II dos cloroplastos actúa como un doante de electróns na redución da clorofila oxidada. Neste proceso, a tirosina sofre desprotonación do seu grupo OH fenólico. Este radical é despois reducido no fotosistema II polos clusters de manganeso.
A tirosina pode sintetizarse no corpo a partir de fenilalanina, polo que non é esencial. Abunda a tirosina en moitos alimentos con contido proteico abondoso, como soia, polo, pavo, peixe, cacahuetes, améndoas, aguacates, produtos lácteos, fabas de Lima, sementes de cabaza, e de sésamo.[4]
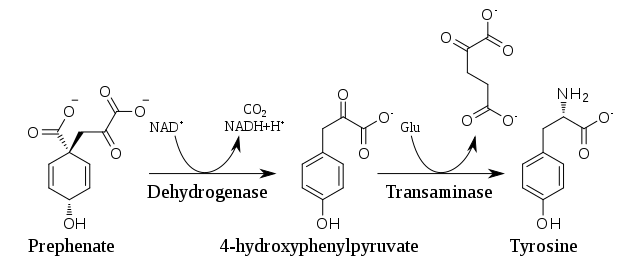
Nas plantas e na maioría dos organismos, a tirosina prodúcese a partir do ácido prefénico (prefenato), un intermediato da vía do ácido siquímico. O prefenato sofre unha descarboxilación oxidativa con retención do grupo hidroxilo para dar p-hidroxifenilpiruvato, o cal é transaminado usando ácido glutámico como fonte de nitróxeno para dar tirosina e α-cetoglutarato.
Nos mamíferos a síntese de tirosina parte do aminoácido esencial fenilalanina, que se obtén dos alimentos. A conversión de fenilalanina en tirosina está catalizada polo encima fenilalanina hidroxilase, unha monooxixenase. Este encima cataliza a reacción que causa a adición dun grupo hidroxilo ao extremo do anel aromático de 6 carbonos da fenilalanina, que así se converte en tirosina.

Algúns dos residuos de tirosina poden ser marcados cun grupo fosfato (é dicir, fosforilados) por proteína quinases. Neste estado fosforilado recibe o nome de fosfotirosina. A fosforilación da tirosina considérase un paso chave na transdución de sinais e na regulación da actividade encimática. A fosfotirosina pode detectarse con anticorpos específicos. Os residuos de tirosina poden tamén modificarse por adición dun grupo sulfato, un proceso coñecido como sulfatación da tirosina.[5] Esta sulfatación está catalizada pola tirosilproteína sulfotransferase (TPST). Existen anticorpos específicos que se poden usar para detectar a sulfotirosina.
Nas células dopaminérxicas do cerebro, a tirosina convértese en levodopa por acción do encima tirosina hydroxilase (TH). A tirosina hidroxilase é o encima limitante implicado na síntese do neurotransmisor dopamina. Ademais, na medula adrenal, a tirosina convértese nas hormonas catecolaminas norepinefrina (noradrenalina), e epinefrina (adrenalina).
As hormonas tiroideas triiodotironina (T3) e tiroxina (T4) tamén derivan da tirosina.
Na papoula Papaver somniferum, produtora de opio, a tirosina úsase para producir o alcaloide morfina.

A descomposición da L-tirosina (ou para-hidroxifenilalanina) empeza cunha transaminación co α-cetoglutarato catalizada pola tirosina transaminase para dar para-hidroxifenilpiruvato. A descrición posicional para (abreviado p) significa que o grupo hidroxilo e a cadea lateral no anel fenilo están unha en fronte da outra (nunha liña recta, 180º).
A seguinte reacción oxidativa catalizada pola p-hidroxilfenilpiruvato-dioxixenase converte o p-hidroxifenilpiruvato en homoxentisato (2,5-dihidroxifenil-1-acetato). Despois, para escindir o anel aromático do homoxentisato requírese outra dioxixenase, a homoxentisato-oxixenase. Así, coa incorporación dunha molécula máis de O2 orixínase maleilacetoacetato.
A partir do maleilacetoacetato orixínase fumarilacetato grazas á intervención da maleilacetoacetato-cis-trans-isomerase, que cataliza a rotación do grupo carboxilo creado por oxidación do grupo hidroxilo. Esta isomerase cis-trans contén o coencima glutatión. O fumarilacetoacetato é finalmente escindido pola fumarilacetoacetato-hidrolase que lle adiciona unha molécula de auga.
Deste modo libéranse fumarato (que tamén é un metabolito do ciclo do ácido cítrico) e acetoacetato (3-cetobutirato). O acetoacetato é un corpo cetónico, que se activa con succinil-CoA, e despois pode converterse en acetil-CoA, o cal á súa vez pode oxidarse entrando no ciclo do ácido cítrico ou pode usarse para a síntese de ácidos graxos. Polos produtos finais que se orixinan na degradación da tirosina, esta é un aminoácido tanto glicoxénico coma cetoxénico.

Coñécense tres isómeros da tirosina. Ademais do aminoácido común L-tirosina que é o isómero para (para-tyr, p-tyr ou 4-hidroxifenilalanina) hai na natureza outros dous isómeros máis, a meta-tirosina (m-tyr ou 3-hidroxifenilalanina ou L-m-tirosina) e a orto-tirosina (o-tyr ou 2-hidroxifenilalanina). Os isómeros m-tyr e o-tyr, que son pouco comúns, orixínanse por hidroxilación por radicais libres non encimática da fenilalanina en condicións de estrés oxidativo.[6][7]
A m-tirosina e análogos (raros na natureza e, por tanto, obtidos sinteticamente) utilízanse no tratamento da enfermidade de Parkinson, enfermidade de Alzheimer e artrite.[8]
A tirosina é precursor de neurotransmisores e incrementa os niveis plasmáticos de neurotransmisores (especialmente da dopamina e norepinefrina)[9], pero ten pouco ou ningún efecto sobre o estado de ánimo.[10][11][12] O efecto no estado de ánimo é máis apreciable en persoas sometidas a estrés.
Algúns estudos encontraron que o uso de tirosina era útil en situacións de estrés, frío, fatiga,[13] shock emocional, traballo prolongado e privación de sono,[14][15] con reducións nos niveis das hormonas do estrés,[16] reducións na perda de peso inducida polo estrés observada en ensaios con animais,[13] melloras no rendemento físico e cognitivo[11][17][18] ; porén, como a tirosina hidroxilase é un encima limitante, os efectos son menos significativos cós obtidos coa L-dopa.
En circunstancias de normalidade a tirosina non parece ter ningún efecto significativo no estado de ánimo, e nas prestacións físicas ou cognitivas.[19][20][21] Unha dose diaria adecuada usada para ensaios clínicos é duns 100 mg/kg para adultos.[22]. Non se recomenda exceder de 12000 mg (12 g) diarios. De feito, doses demasiado altas de tirosina reducen os niveis de dopamina.[19] En exceso a tirosina pode facer decrecer a absorción doutros aminoácidos e de L-dopa.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.