Aromaticidade
From Wikipedia, the free encyclopedia
En química orgánica, a aromaticidade é unha propiedade dos hidrocarburos cíclicos conxugados que consiste en que os electróns dos enlaces dobres son libres de poder circular dun enlace a outro, sexa dobre ou simple, o que lle dá á molécula unha estabilidade maior que a que tería se ditos electróns permanecesen fixos no enlace dobre.[1] Os compostos con esta propiedade denomínanse "aromáticos", porque August Wilhelm Hofmann os denominou así en 1855, aínda que poucos deles teñen un cheiro ou aroma significativo.
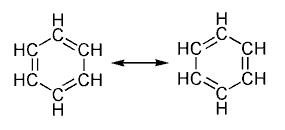
Ao representar a molécula debúxanse os enlaces dobres nunha configuración e xunto a ela, entre frechas, debúxanse as demais configuracións como posibilidades adicionais que teñen os electróns dos enlaces dobres de formar outros enlaces arredor do anel aromático. A molécula de benceno, por exemplo ten varios estados de resonancia, dos cales se represeéntan dous aquí (na figura), que corresponden aos enlaces dobres alternándose cos enlaces simples.
Enlaces dobres do benceno
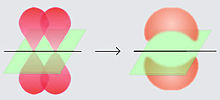
Un dobre enlace está conformado por dous electróns situados en orbitais atómicos designados coa letra p. No caso do benceno, os electróns dos dobres enlaces localizan un dos seus orbitais por encima do plano do anel e outro por debaixo del.[2] Debido á configuración circular do anel do benceno, os electróns no orbital p do dobre enlace interaccionan entre si, orbitando libremente arredor da molécula por encima e por debaixo do plano do anel.
Isto implica que en vez de estar comprometidos cun só átomo de carbono, cada electrón (de cada dobre enlace orixinal) é compartido polos seis átomos de carbono no benceno:
Resonancia


Como nos indica a teoría da resonancia e os seus diagramas, onde se use unha frecha dobre significa que ningunha das dúas estruturas representadas son entidades diferentes, senón que son soamente entidades hipotéticas. Por tanto, ningunha das dúas estruturas son unha representación fiel e real do composto que pode ser así mellor representado mediante o seu híbrido de resonancia. Un enlace C=C é máis curto que un enlace C-C, pero no caso do benceno, C6H6 todos os enlaces carbono-carbono posúen a mesma lonxitude de enlace, que é intermedia entre a lonxitude dun enlace simple e dobre.
Se non aplicamos o concepto de resonancia (ver os dous diagramas da esquerda por separado), os enlaces simples C-H e C-C, (formados por compartición dun par de electróns entre un átomo de carbono e outro de hidróxeno, ou entre dous átomos de carbono veciños) serían enlaces σ. Por outra parte, os dobres enlaces C=C consisten nun enlace sigma e un enlace pi, nos que os enlaces pi se forman por superposición lateral de orbitais atómicos pz dos dous átomos de C que forman o dobre enlace, como nos indica o Método de orbitais moleculares como unha combinación liñal de orbitais atómicos que é parte á sá vez da Teoría dos orbitais moleculares.
Se aplicamos o concepto de resonancia (ver o diagrama da dereita), non poderemos diferenciar os enlaces C-C e C=C, porque en realidade os seis enlaces no anel hexagonal bencénico son iguais e intermedios entre un sinxelo e un dobre. Unha mellor explicación dese enlace intermedio consiste na suma dun enlace σ entre cada dous átomos de C veciños, máis un enlace π circular no que a densidade electrónica está distribuída uniformemente por todo o anel hexagonal tanto por encima coma por debaixo del, por superposición lateral dos 6 orbitais atómicos pz e a conseguinte formación dun orbital molecular que cobre toda a molécula. Este modelo representa máis axeitadamente a densidade electrónica dentro do anel aromático.
A imaxe seguinte móstranos eses orbitais atómicos:

Auínda que os mesmos se encontran por fóra do plano, aínda así poden interaccionar libremente entre eles e desta forma prodúcese unha deslocalización electrónica. Desta maneira, podemos notar que non existe unha cantidade de electróns dabondo como para que se formen enlaces dobees en todos os enlaces, pero a deslocalización electrónica proporciona electróns "extra" que fortalecen igualmente todos os enlaces dando lugar á simetría π do orbital molecular.

Historia
A primeira vez que se usou o termo "aromático" como termo químico, aplicado a aqueles compostos que conteñen o grupo fenilo ocorreu nun artigo de August Wilhelm Hofmann en 1855.[3] Aínda que esta foi a introdución máis temperá do termo, é curioso que Hofmann non tivera aclarado por que elixiu un adxectivo relativo ao olfacto para aplicalo a este grupo de substancias químicas; cando só algunhas delas posúen aromas perceptibles. Ademais, moitas das substancias químicas orgánicas coñecidas con propiedades odoríferas son terpenos, os cales non son aromáticos no sentido químico. Pero os terpenos e os derivados do benceno posúen unha característica química en común: posúen índices de insaturación máis altos que moitos compostos alifáticos e mesmo así, Hofmann non realizou ningunha distinción entre ambas as categorías. Respecto á súa estrutura, sabemos que a estrutura do ciclohexatrieno para o benceno foi proposta inicialmente por August Kekulé en 1865. Logo, durante as décadas seguintes, moitos químicos aceptárona rapidamente, xa que estaba xustificada por moitas das relacións isoméricas da química dos compostos aromáticos. Porén, seguía sendo enigmático que esta estrutura proposta, altamente insaturada, fora tan pouco reactiva fronte a reaccións de adición.
O descubridor do electrón, J. J. Thomson, entre 1897 e 1906 situou tres electróns equivalentes entre cada átomo de carbono do benceno.
A explicación da excepcional estabilidade do benceno atribúese normalmente a Sir Robert Robinson, que aparentemente foi o primeiro (en 1925)[4] en acuñar o termo "sexteto aromático" como un grupo de seis electróns que se resisten a ser alterados.
Tamén, este concepto pode ser rastreado desde Ernest Crocker en 1922,[5] a Henry Edward Armstrong, o cal, en 1890, nun artigo titulado The structure of cycloid hydrocarbons ("A estrutura dos hidrocarburos cicloides"), no que escribiu: as afinidades céntricas (seis) actúan dentro dun círculo... o benceno, pode ser representado por un anel dobre (sic) ... e cando se forma un composto de adición, o círculo interno de afinidade sofre unha alteración, os átomos de carbono contiguos aos cales non se lles puidera engadir nada, necesariamente adquiren un estado etilénico.[6]
Aquí, Armstrong describe polo menos catro conceptos modernos. Primeiro, a súa "afinidade" polos electróns que é hoxe en día mellor coñecida, a cal foi posta en evidencia sete anos despois por J. J. Thomson. Segundo, Armstrong describe a substitución electrofílica aromática, que ocorre (terceiro concepto) por medio do intermediario de Wheland, no cal (cuarto) a conxugación do anel rompe. Introduciu o símbolo C centrado no anel como un símbolo que representaba o círculo interno, anticipándose desta maneira á notación de Eric Clar. Ademais, dicútese se tamén anticipou a natureza da mecánica ondulatoria, dado que recoñeceu que as afinidades eran dirixidas e non eran simplemente partículas puntuais e colectivamente posuían unha distribución que podía ser alterada mediante a introdución de substituíntes ao anel bencénico (dado que a distribución da carga eléctrica nun corpo é alterada polo acercamento doutro corpo).
A orixe mecánico-cuántica desta estabilidade, ou aromaticidade, foi formulada primeiro por Hückel en 1931. Hückel, foi o primeiro que separou os electróns enlazantes en electróns sigma e electróns pi.
Compostos aromáticos
A aromaticidade é común en compostos derivados do benceno, tales como o tolueno e os xilenos (configuracións orto- e para-). Os compostos heterocíclicos e policíclicos tamén son aromáticos. A aromaticidade pode atoparse en certos compostos iónicos. Moitos compostos importantes para a vida son aromáticos. As bases nitroxenadas do ADN son aromáticos. Algúns dos aminoácidos son aromáticos, e os compostos clorofila e hemoglobina tamén.
Para que un composto sexa aromático ten que cumprir a chamada Regra de Hückel, que di que a cantidade de electróns nos orbitais pi, ten que ser múltiplo de 4n + 2 para n = 0, 1, 2, 3, .
Índices de aromaticidade
Admitindo que o benceno é o prototipo de composto aromático, discutiuse se a aromaticidade é unha propiedade única ou se ten sentido tratar de cuantificar a aromaticidade doutros compostos que teñen algunhas propiedades en común.[7] Non hai consenso sobre unha escala única para cuantificar a aromaticidade. As principais escalas ou índices que se propuxera que se basean en criterios enerxéticos, magnéticos, ou xeométricos, que son esencialmente independentes entre si.
Os criterios enerxéticos baséanse nunha extensión da ley de Hess, supoñendo primeiro que os dobres enlaces dun composto sofren reaccións independentes, e denominando Enerxía de Estabilización Aromática ás desviacións observadas. Como exemplo máis sinxelo, se o benceno non tivese aromaticidade esperariamos que a calor de reacción de hidroxenación do benceno para obter ciclohexano fora o triplo que a do ciclohexeno, o cicloalqueno análogo cun só enlace dobre. Para poder establecer diferenzas válidas, estas reaccións deben ser isodésmicas e homodesmóticas, é dicir, que se manteña entre elas non só o número e tipo de enlaces total, senón tamén a hibridación dos átomos enlazados.
Os criterios magnéticos consideran que no benceno e nos hidrocarburos aromáticos se produce (en presenza dun campo magnético externo) unha circulación de carga característica na nube pi, que á súa vez xera un campo. Esta circulación reflíctese no diamagnetismo do composto, é dicir, pódese cuantificar con medidas de susceptibilidade magnética, e tamén no desprazamento químico dos hidróxenos veciños, en experimentos de resonancia magnética nuclear.
Os criterios xeométricos ou estruturais céntranse noutra das manifestacións da aromaticidade: a uniformidade nas distancias dos enlaces implicados e o carácter planar da molécula.
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

