Loading AI tools
związek chemiczny Z Wikipedii, wolnej encyklopedii
Nimesulid (łac. nimesulidum) – wielofunkcyjny organiczny związek chemiczny z grupy sulfonamidów, zbudowany ze szkieletu eteru difenylowego podstawionego grupą metanosulfonamidową i nitrową. Jest preferencyjnym inhibitorem cyklooksygenazy-2 (COX-2). Stosowany jako ogólnoustrojowy niesteroidowy lek przeciwzapalny o dodatkowym działaniu przeciwbólowym i przeciwgorączkowym[10].
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C13H12N2O5S | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
308,31 g/mol | ||||||||||||||||||||||||||||||||||
| Wygląd |
żółtawy, krystaliczny proszek[1] | ||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
Przy podaniu doustnym nimesulid wchłania się dobrze i szybko, jego działanie rozpoczyna się po około 15 minutach, maksymalny poziom we krwi osiąga po czasie 1–3 godzin. Lek metabolizowany jest w 99% w wątrobie, w której powstaje kilkanaście jego pochodnych, wydalanych głównie z moczem. W porównaniu do klasycznych niesteroidowych leków przeciwzapalnych wykazuje mniejszą liczbę działań ubocznych w zakresie górnego odcinka przewodu pokarmowego, natomiast możliwe są rzadkie przypadki ciężkich powikłań ze strony wątroby. Europejska Agencja Leków uznała w decyzji wydanej w 2012 roku, że w niektórych sytuacjach klinicznych korzyści ze stosowania nimesulidu przewyższają ryzyko, w związku z czym jest on w pewnych przypadkach podawany jako lek drugiego rzutu. Nie stwierdzono poważnych interakcji z innymi lekami, natomiast jego stosowanie razem z alkoholem może nasilać działania niepożądane, w szczególności wobec wątroby.
Wyniki badań z lat 60. XX wieku wskazujące na istotną rolę wolnych rodników w patofizjologii przewlekłych chorób zapalnych pozwalały przypuszczać, iż substancje pełniące funkcję zmiataczy wolnych rodników mogą prezentować nowy mechanizm działania przeciwzapalnego[11].
Historia odkrycia nimesulidu rozpoczyna się w 1969 roku w laboratorium koncernu 3M, w którym doktorzy George Moore, Karl F. Swingle oraz Bob Scherer (odkrywca kwasu meklofenamowego) wraz z zespołem pracowali nad nowymi pestycydami oraz substancjami przeciwzapalnymi. Nimesulid otrzymano podczas badań nad dwoma fluoroalkanosulfonanilidami: trimuflumidatem i diflumidonem[12]. Odkryty wówczas (2-fenoksy-4-nitro)trifluorometanosulfoanilid wykazywał działanie terapeutyczne na modelu zwierzęcym. W 1971 roku opracowano syntezę bezfluorowego analogu tego związku (2-fenoksy-4-nitro)metanosulfoanilidu i nadano mu nazwę roboczą „R-805”, zmienioną później na „nimesulid”. Dalsze badania były prowadzone w Riker Laboratories Inc. w Kalifornii[13]. W ich wyniku 8 października 1974 roku nimesulid został opatentowany w Stanach Zjednoczonych (nr patentu US 3.840.597). Za autorów wynalazku zostali uznani George Moore i Joseph Kenneth Harrington, natomiast właścicielem praw została Riker Laboratories Inc.[14] W przeprowadzonych wówczas badaniach klinicznych potwierdzono skuteczność przeciwbólową u pacjentów z reumatoidalnym zapaleniem stawów oraz zaobserwowano uszkodzenie wątroby przy bardzo wysokich dawkach leku (do 800 miligramów na dobę). W 1980 roku prawa do nimesulidu nabyła szwajcarska firma farmaceutyczna Helsinn Healthcare. Po przeprowadzeniu dalszych badań klinicznych oraz podstawowych badań nad mechanizmem działania leku, został on zarejestrowany po raz pierwszy w 1985 roku we Włoszech[15]. W kolejnych latach bezpośrednio lub przez udzielane licencje został wprowadzony na rynek w ponad 50 krajach Europy, Środkowej i Południowej Ameryki oraz Azji, z wyjątkiem Stanów Zjednoczonych, Wielkiej Brytanii i Niemiec[16] oraz Australii[15], gdzie nie podjęto próby wprowadzenia nimesulidu na rynek apteczny. Praw do zastosowań weterynaryjnych udzielono francuskiej firmie farmaceutycznej Virbac S.A.[17], po uzyskaniu światowej ochrony patentowej.
W drugiej połowie 1998 i pierwszych miesiącach 1999 roku pojawił się szereg doniesień o niekorzystnych skutkach ubocznych nimesulidu. Spowodowało to ograniczenie wskazań zarówno w zakresie wieku, jak i jednostek chorobowych, czasowe zawieszenie lub też wycofanie rejestracji w wielu krajach świata[18]. Ogółem w latach 1985–2000 zgłoszono 192 przypadki zdarzeń niepożądanych, z których 81 uznano za ciężkie[19].
Europejska Agencja Leków dokonała oceny nimesulidu dwukrotnie, w 2007 i 2010 roku, uznając w decyzji wydanej w 2012 roku, że korzyści ze stosowania ogólnoustrojowego leku w sytuacjach klinicznych, do których ograniczono jego stosowanie, przewyższają ryzyko[20].
Nazwa leku pochodzi od angielskiej nazwy chemicznej[21]: 4-nitro-2-phenoxymethanesulphonanilide.
Nimesulid jest jedynym sulfonanilidem (sulfonowaną pochodną aniliny) w grupie niesteroidowych leków przeciwzapalnych. Pomimo że jest on jednocześnie sulfonamidem[22], nie wywołuje reakcji alergicznych u osób uczulonych na tę grupę związków[23]. Efekt biologiczny uzyskano poprzez podstawienie pierścienia w pozycji 4 grupą nitrową[13]. Grupa metylosulfonamidowa obecna w cząsteczce nimesulidu nie występuje w innych niesteroidowych lekach przeciwzapalnych, penetruje ona do drugiej kieszeni centrum receptorowego enzymu COX, co może wyjaśniać wyjątkowe preferencyjne działanie na COX-2, któremu towarzyszy wpływ na COX-1[10].
W skali laboratoryjnej syntezę można prowadzić w dwóch etapach. Procedurę rozpoczyna się od reakcji 2-fenoksyaniliny z chlorkiem metanosulfonowym, w wyniku której powstaje 2-fenoksymetanosulfoanilid.
W drugim etapie otrzymany 2-fenoksymetanosulfoanilid wprowadza się do 100% kwasu octowego, a następnie podczas podgrzewania dodawany jest 70% kwas azotowy. Po podgrzaniu mieszaninę dodaje się do wody i odfiltrowuje powstały osad. Po rekrystalizacji z etanolem uzyskuje się nimesulid w postaci delikatnie jasnobrązowego ciała stałego[15].

Istnieje wiele metod syntezy nimesulidu na skalę przemysłową i nadal trwają prace nad uzyskaniem nowych metod nie zastrzeżonych w istniejących patentach[24].
W pierwszym etapie mieszaninę 2-chloronitrobenzenu i fosforanu trifenylu ogrzewa się w obecności wodorotlenku potasu oraz dimetyloformamidu (DMF) przez 1 godzinę. Po ostygnięciu do temperatury pokojowej dodaje się wodę, a następnie ekstrahuje eterem. Fazę organiczną suszy się bezwodnym siarczanem sodu i odparowuje pod zmniejszonym ciśnieniem, uzyskując produkt reakcji: 2-fenoksynitrobenzen.

W drugim etapie przeprowadzana jest redukcja grupy nitrowej do aminowej. 2-Fenoksynitrobenzen dodawany jest do przygotowanej mieszaniny wody, sproszkowanego żelaza i kwasu octowego ogrzanej do temperatury 90–95 °C, następnie całość jest mieszana w tej samej temperaturze przez 3–4 godziny. Mieszaninę produktów reakcji alkalizuje się przy użyciu wody amoniakalnej, odfiltrowywuje na gorąco, przemywa wodą, a następnie ekstrahuje toluenem, do którego przechodzi otrzymana 2-fenoksyanilina.
W trzecim etapie do 2-fenoksyaniliny w chlorku metylenu i trietyloaminie dodawany jest stopniowo chlorek metanosulfonowy przez 3–4 godziny w temperaturze 0–5 °C. Po zatrzymaniu reakcji poprzez dodanie wody oddziela się fazę organiczną zawierającą mieszaninę 2-fenoksymetanosulfoanilidu i 2-fenoksymetanodwusulfoanilidu. Po przemyciu wodą, ekstrakcji z użyciem roztworem wodorotlenku sodu i zakwaszeniu uzyskiwany jest 2-fenoksymetanosulfoanilid.

Czwarty etap syntezy to nitrowanie. 2-Fenoksymetanosulfoanilid jest rozpuszczany na ciepło w 100% kwasie octowym, a następnie dodaje się stopniowo 70% kwas azotowy przez ponad 15 minut, po czym mieszanina jest ogrzewana na łaźni parowej przez 4 godziny i wytrącana poprzez dodanie do wody. Osad zawierający dwunitrofenoksyfenylometanosulfonamid i nitrofenoksyfenylometanosulfonamid zostaje oddzielony przez filtrowanie. Krystalizacja z metanolu pozwala na uzyskanie czystego produktu docelowego (nimesulidu)[25].
Nimesulid jest słabo rozpuszczalny w wodzie (0,014 mg/ml), natomiast dobrze rozpuszcza się w acetonie, chloroformie, octanie etylu, słabiej w etanolu (3,32 mg/ml), PEG 400 i ich mieszaninie. Jego rozpuszczalność zwiększa się wraz ze wzrostem pH (1000 razy przy wzroście pH o 3). Rozpuszczalność nimesulidu w wodzie zwiększa się istotnie przy użyciu etanolu jako drugiego rozpuszczalnika. Nimesulid jest również rozpuszczalny w glikolu propylenowym i mieszaninie gliceryny z etanolem, które są uważane za bezpieczne przy podawaniu doustnym. Informacje te mogą być przydatne przy projektowaniu płynnych i pozajelitowych form leku[26]. Układ przestrzenny cząsteczki z odchylonym pod kątem 75° względem nitroaminosulfoanilidu podstawnikiem fenylowym w pozycji O5 jest stabilizowany przez wewnątrzcząsteczkowe wiązanie wodorowe pomiędzy grupą NH a atomem tlenu. Spójność kryształu nimesulidu jest wynikiem wzajemnych oddziaływań wiązania NH−O i sił van der Waalsa[27].
Główną chemiczną własnością nimesulidu oraz jego głównego metabolitu hydroksynimesulidu jest potencjał antyoksydacyjny, przy czym w przypadku rodnika hydroksylowego OH•
hydroksynimesulid jest słabszym zmiataczem niż nimesulid, natomiast w przypadku rodnika ponadtlenkowego O•−
2 jest odwrotnie[28].
Pod wpływem światła ultrafioletowego nimesulid ulega hydrolizie na 2-fenoksy-4-nitroanilinę i kwas metanosulfonowy[29]:
Pod wpływem prądu elektrycznego grupa nitrowa nimesulidu ulega redukcji do grupy nitrozowej[30]:
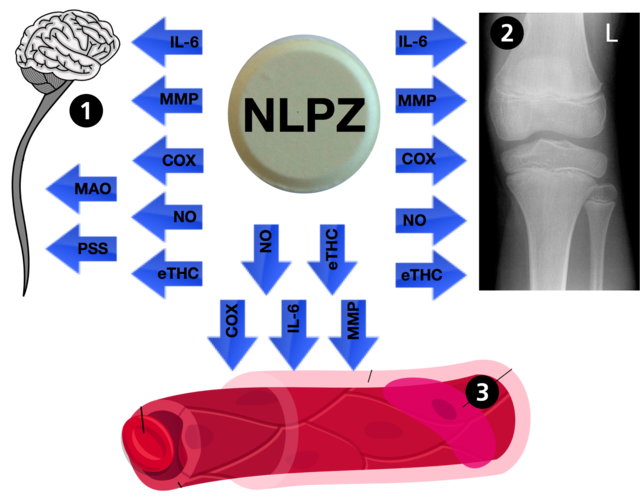
Podstawowy mechanizm działania niesteroidowych leków przeciwzapalnych odbywa się poprzez hamowanie cyklooksygenazy, enzymu przekształcającego kwas arachidonowy w prostaglandynę H2. Prostaglandyna H2 jest prekursorem wszystkich prostaglandyn – hormonów wywołujących rozszerzanie naczyń krwionośnych, zwiększanie przepuszczalności ściany naczyń krwionośnych oraz zwiększanie czułości receptorów bólu na bodźce mechaniczne i chemiczne (bradykinina, histamina, TNF-α, substancja P). Dwie formy cyklooksygenazy COX-1 i COX-2, kodowane przez dwa różne geny zlokalizowane w chromosomie 1 i chromosomie 9, podczas procesu zapalnego pozostają w równowadze i działając równolegle, aktywują wszystkie szlaki przemiany kwasu arachidonowego[10][31]. W przeciwieństwie do kwasu acetylosalicylowego, który poprzez acetylację seryny w centrum aktywnym trwale inaktywuje cyklooksygenazę[32], hamowanie cyklooksygenazy przez niesteroidowe leki przeciwzapalne jest odwracalne[22]. Niesterydowe leki przeciwzapalne oddziaływają również na poziomie centralnego układu nerwowego, naczyń krwionośnych i w miejscu zapalenia na endokannabinoidy, tlenek azotu oraz szlaki przekaźnictwa monoaminoergicznego i przywspółczulnego. Grupa niesterydowych leków przeciwzapalnych obejmuje nieselektywne, preferencyjne (do której należy nimesulid) i selektywne inhibitory cyklooksygenazy. [10][31]
Nimesulid jest lekiem o złożonym mechanizmie działania:
Pomimo iż nimesulid zaliczany jest do inhibitorów cyklooksygenazy preferencyjnie hamujących aktywność COX-2, ogólnie jest bardzo słabym inhibitorem cyklooksygenazy, a jego głównym mechanizmem działania jest hamowanie metaloproteinaz[22].
Podany doustnie dobrze, szybko i prawie całkowicie wchłania się z przewodu pokarmowego, podany doodbytniczo wolniej. Nie zaobserwowano różnic we wchłanianiu pomiędzy różnymi formami doustnymi. Dostępność biologiczna wynosi 99% przy podaniu doustnym[5] (80–100%)[8] i 54–64% przy podaniu doodbytniczym[9][5]. Po podaniu 100 mg doustnie maksymalne stężenie we krwi osiąga po 1–3 godzinach, po podaniu doodbytniczym 200 mg po 4–5 godzinach. W około 97,5% wiąże się z albuminami. Pomimo umiarkowanie niskiej objętości dystrybucji dobrze przenika do płynu stawowego[21], w którym jego poziom utrzymuje się o wiele dłużej niż we krwi[10], oraz płynów wysiękowych[5]. Czas półtrwania T0,5 wynosi 1,8–4,7 godziny dla leku i 3–9 godzin dla głównego metabolitu. Jest metabolizowany w wątrobie poprzez cytochrom P450.
Wydalany jest w 50,5–62,5% z moczem i 17,9–36,2% z kałem głównie w postaci glukuronianów i siarczanów. W postaci niezmienionej opuszcza organizm 1–3% leku. W przypadku zaburzonej funkcji nerek nie dochodzi do kumulowania się zarówno nimesulidu, jak i jego metabolitów. W przypadku zaburzonej funkcji wątroby dochodzi do 4–5-krotnego zmniejszenia eliminacji nimesulidu z organizmu[5].

Nimesulid jest metabolizowany poprzez trzy podstawowe szlaki metaboliczne: rozkład cząsteczki na poziomie wiązania eterowego, redukcja grupy −NO
2} do −NH
2 oraz hydroksylacja pierścienia aromatycznego. Pozostałe metabolity są produktami współistniejącej hydroksylacji i redukcji, acetylacji grupy aminowej, sprzężania z kwasem glukuronowym lub sulfonowaniem hydroksylowanych metabolitów[34], jedynie 1–3% leku zostaje wydalone w stopniu niezmienionym[8].
Jedynym metabolitem obecnym w surowicy krwi[35] z ogółem zidentyfikowanych 16 metabolitów[10] nimesulidu (nazwanych M1 do M18) jest N-[2-(4-hydroksyfenoksy)-4-nitrofenylo]metanosulfonamid (hydroksynimesulid lub M1) mający również działanie przeciwzapalne i przeciwbólowe, jednakże słabsze niż lek, którego jest pochodną[36]. Został on zidentyfikowany również w moczu. Drugim ważnym metabolitem obecnym w moczu i kale jest M5, pozostałe metabolity znajdowane są w mniejszych stężeniach, a metabolity M2, M3 i M4 uważane są za pośrednie metabolity na szlaku biotransformacji nimesulidu.
| Metabolit | Wzór chemiczny | Obecność w moczu |
Opis |
|---|---|---|---|
| M1 |  |
1,4% | ma aktywność terapeutyczną, jedyny istotny metabolit obecny w surowicy, powstaje z nimesulidu w wyniku hydroksylowania pierścienia fenylowego |
| M2 |  |
brak | pośredni metabolit powstający w wyniku redukcji grupy NO2 do grupy NH2 |
| M3 |  |
brak | pośredni metabolit powstający z metabolitu M2 poprzez hydroksylowanie pierścienia fenylowego |
| M4 |  |
brak | pośredni metabolit powstający z metabolitu M2 poprzez acetylowanie grupy aminowej |
| M5 |  |
brak | powstaje z metabolitu M3 poprzez acetylowanie lub z metabolitu M4 poprzez hydroksylowanie |
| M6 |  |
brak | powstaje z nimesulidu poprzez rozpad wiązania eterowego |
| M7 |  |
brak | powstaje z postulowanego metabolitu M2 w wyniku substytucji grupy aminowej grupą hydroksylową |
| M8 |  |
6,4% | powstaje z metabolitu M7 poprzez kondensację z kwasem glukuronowym |
| M9 |  |
brak | powstaje z metabolitu M1 poprzez estryfikację grupy hydroksylowej resztą kwasu siarkowego |
| M10 |  |
14,6% | powstaje z metabolitu M1 poprzez kondensację z kwasem glukuronowym |
| M11 |  |
2,4% | powstaje z nimesulidu w wyniku hydroksylowania pozycji 2 lub 3 pierścienia fenylowego i kondensacji z kwasem glukuronowym |
| M12 |  |
brak | powstaje z metabolitu M1 w wyniku kolejnego hydroksylowania pierścienia |
| M13 |  |
brak | powstaje z metabolitu M7 poprzez estryfikację grupy hydroksylowej resztą kwasu siarkowego |
| M14 |  |
4,6% | powstaje z metabolitu M5 poprzez kondensację z kwasem glukuronowym |
| M15 |  |
2,3% | powstaje z metabolitu M12 poprzez kondensację z kwasem glukuronowym |
| M16 |  |
2,8% | powstaje z metabolitu M12 poprzez estryfikację grupy hydroksylowej resztą kwasu siarkowego |
| M17 |  |
5,1% | powstaje z metabolitu M2 poprzez kondensację z kwasem glukuronowym |
| M18 |  |
2,5% | powstaje z metabolitu M5 poprzez estryfikację grupy hydroksylowej resztą kwasu siarkowego |
Nimesulid może być stosowany wyłącznie jako lek drugiego rzutu, w następujących wskazaniach[37][38][39][40]:
W dniu 20 stycznia 2012 roku decyzją Komisji Europejskiej 2012/C 78/02[41] wykreślono z charakterystyki tego produktu leczniczego następujące wskazanie[42]:
Cyklooksygenaza COX-2 jest nadmiernie produkowana w licznych nowotworach[43], a także hodowlach komórek nowotworowych, a prostaglandyny mają istotny wpływ na metabolizm komórek, ich proliferację, resorpcję kości oraz zdolność do tworzenia przerzutów przez nowotwory[44]. Obserwacje te leżą u podłoża badań zastosowania nimesulidu w poniższych wskazaniach:
Choroba Alzheimera posiada wszystkie cechy choroby zapalnej, a badania epidemiologiczne sugerują wolniejsze pogarszanie się funkcji poznawczych u chorych przewlekle pobierających niesterydowe leki przeciwzapalne.
Nie stwierdzono istotnych interakcji nimesulidu, ale ponieważ hamuje on izoenzym CYP2C9 cytochromu P450 (chociaż nie jest jego silnym inhibitorem[49]), może dochodzić do zwiększenia stężenia w surowicy leków metabolizowanych w tym szlaku metabolicznym (heksobarbital, nordazepam, diazepam i prokwanil[50]).
Istnieją następujące przeciwwskazania stosowania leku i sytuacje, gdy zaleca się zachowanie ostrożności[8][37][38][40][39][51][52][53]:
Działania niepożądane stwierdzone podczas badań klinicznych oraz późniejszych obserwacji[8][37][38][40][39][51][52][53]:
| Rodzaj zaburzenia | Częstość występowania | Działanie niepożądane |
|---|---|---|
| Krew i układ limfatyczny | rzadkie | niedokrwistość[i] |
| eozynofilia[i] | ||
| bardzo rzadkie | małopłytkowość | |
| pancytopenia | ||
| skaza krwotoczna | ||
| Układ odpornościowy | rzadkie | nadwrażliwość[i] |
| bardzo rzadkie | anafilaksja | |
| Metabolizm i odżywianie | rzadkie | hiperkaliemia[i] |
| Psychiczne | rzadkie | lęki[i] |
| niepokój[i] | ||
| koszmary senne[i] | ||
| Układ nerwowy | niezbyt częste | zawroty głowy |
| bardzo rzadkie | bóle głowy | |
| senność | ||
| zespół Reye’a | ||
| Wzrok | rzadkie | zamazane widzenie[i] |
| bardzo rzadkie | zaburzenia widzenia | |
| Słuch i błędnik | bardzo rzadkie | zawroty głowy |
| Serce | rzadkie | tachykardia[i] |
| Układ naczyniowy | niezbyt częste | nadciśnienie[i] |
| rzadkie | krwawienia[i] | |
| zmiany ciśnienia tętniczego[i] | ||
| uderzenia gorąca[i] | ||
| Układ oddechowy | niezbyt częste | duszność[i] |
| bardzo rzadkie | astma oskrzelowa | |
| skurcz oskrzeli | ||
| Żołądek i jelita | częste | biegunka[i] |
| nudności[i] | ||
| wymioty[i] | ||
| niezbyt częste | zaparcia[i] | |
| wzdęcia[i] | ||
| zapalenie błony śluzowej żołądka[i] | ||
| krwawienie z przewodu pokarmowego[42] | ||
| owrzodzenie i perforacja żołądka[42] | ||
| owrzodzenie i perforacja dwunastnicy[42] | ||
| bardzo rzadkie | bóle brzucha | |
| niestrawność | ||
| zapalenie jamy ustnej | ||
| smoliste stolce | ||
| Wątroba i drogi żółciowe | bardzo rzadkie | zapalenie wątroby |
| piorunujące zapalenie wątroby (włączając przypadki śmiertelne) | ||
| żółtaczka | ||
| cholestaza | ||
| Skóra i tkanka podskórna | niezbyt częste | świąd[i] |
| wysypka[i] | ||
| zwiększona potliwość[i] | ||
| rzadkie | rumień[i] | |
| zapalenie skóry[i] | ||
| bardzo rzadkie | pokrzywka | |
| obrzęk naczynioruchowy | ||
| obrzęk twarzy | ||
| rumień wielopostaciowy | ||
| zespół Stevensa-Johnsona | ||
| zespół Lyella | ||
| Nerki i drogi moczowe | rzadkie | bolesne oddawanie moczu[i] |
| krwiomocz[i] | ||
| zatrzymanie moczu[i] | ||
| bardzo rzadkie | niewydolność nerek | |
| skąpomocz | ||
| śródmiąższowe zapalenie nerek | ||
| Ogólne i miejscowe | niezbyt częste | obrzęki[i] |
| rzadkie | złe samopoczucie[i] | |
| osłabienie[i] | ||
| bardzo rzadkie | nadmierne obniżenie temperatury ciała | |
| Badania diagnostyczne | częste | zwiększenie aktywności enzymów wątrobowych[i] |
Nimesil jest lekiem przeciwbólowym dozwolonym do stosowania u osób dorosłych oraz dzieci powyżej 12 roku życia. Nimesulid może być podawany doustnie (kapsułki, tabletki, saszetki z proszkiem lub granulatem do zawiesiny), doodbytniczo (czopki)[20], domięśniowo[59] oraz zewnętrznie (maść). Postacie leku do stosowania doodbytniczego, domięśniowego oraz zewnętrznego są niedostępne w Polsce[60].
| Drogi podawania | Dawkowanie |
|---|---|
| Doustnie | |
| Doodbytniczo | |
| Zewnętrznie |
|
| Domięśniowo |
|
Nie ma konieczności dostosowywania dawki leku[8][37][38][40][39][51][52][53].
Leku nie należy stosować u dzieci poniżej 12 lat[8][37][38][40][39][51][52][53].
Nie ma konieczności dostosowywania dawki nimesulidu u pacjentów z niewielką i umiarkowaną niewydolnością nerek[8][37][38][40][39][51][52][53]:
| Klirens kreatyniny | Dawkowanie |
|---|---|
| 30–80 ml/min |
dawka bez zmian |
| <30 ml/min |
nie stosować |
Nimesulid jest przeciwwskazany przy zaburzeniach czynności wątroby[8][37][38][40][39][51][52][53].
Nie przeprowadzono badań klinicznych oceniających wpływ nimesulidu na prowadzenie pojazdów i obsługę urządzeń mechanicznych[37]. Lek może upośledzać zdolność prowadzenia pojazdów i obsługi urządzeń mechanicznych u pacjentów, u których wystąpi senność lub zawroty głowy[63].
Nimesulidu nie należy stosować w ciąży i okresie karmienia piersią, u kobiet planujących zajść w ciążę należy stosować możliwie najmniejszą dawkę przez możliwie najkrótszy okres, w pierwszym i drugim trymestrze ciąży nie zaleca się stosowania poza przypadkami zdecydowanej konieczności i w takich przypadkach należy stosować możliwie najmniejszą dawkę przez możliwie najkrótszy okres. Ryzyko wystąpienia efektów ubocznych zwiększa się ze zwiększaniem dawki i czasu trwania leczenia[8][37][38][40][39][51][52][53].
W badaniach na zwierzętach wykazano, iż podawanie leków z tej grupy powodowało poronienie przed lub po zagnieżdżeniu się jaja płodowego, śmiertelność zarodka lub płodu oraz zwiększoną częstość występowania różnych wad płodu, włączając zaburzenia układu sercowo-naczyniowego[8][37][38][40][39][51][52][53].
Podczas I i II trymestru ciąży nimesulid może narażać płód na[8][37][38][40][39][51][52][53]:
Podczas III trymestru ciąży nimesulid może narażać na[8][37][38][40][39][51][52][53]:
Nimesulidu nie należy stosować w okresie karmienia piersią ze względu na brak informacji o możliwości przenikania leku do ludzkiego mleka[8][37][38][40][39][51][52][53].
Brakuje specyficznych danych dotyczących postępowania w przedawkowaniu nimesulidu. Na nimesulid nie ma specyficznej odtrutki.
Objawami przedawkowania niesteroidowych leków przeciwzapalnych są: śpiączka, senność, nudności, wymioty oraz ból w nadbrzuszu, zwykle ustępujące po zastosowaniu właściwego leczenia. W rzadkich przypadkach może wystąpić krwawienie z przewodu pokarmowego, ostra reakcja anafilaktyczna, nadciśnienie tętnicze, ostra niewydolność nerek, zatrzymanie oddechu lub śpiączka.
Leczenie przedawkowania niesteroidowych leków przeciwzapalnych jest jedynie objawowe i podtrzymujące. Do czterech godzin od przyjęcia leku oraz przy zatruciu dużymi dawkami leku zalecane jest indukowanie wymiotów i podawanie węgla aktywnego w dawce u dorosłych pacjentów 60-100 gramów oraz stosowanie osmotycznych środków przeczyszczających. Wskazane jest monitorowanie funkcji wątroby i nerek.
Ze względu na duży stopień wiązania nimesulidu z białkami osocza wymuszona diureza, alkalizacja moczu, hemodializa oraz hemoperfuzja mogą okazać się nieskuteczne[8][37][38][40][39][51][52][53].
Preparaty zarejestrowane w Polsce[60]: Aulin[38], Aulin[64], AulinDol[65], Minesulin[39], Minesulin[40], Nimesil[37].
Preparaty zarejestrowane w innych krajach Unii Europejskiej[66]: Aflogen, Algimesil, Algolider, Algosulid, Algover, Amocetin, Antalgo, Antifloxil, Arencast, Areuma, Aulin, Aulin Beta, Auromelid, Beiond, Bioxidol, Chemisulide, Cliovyl, Delfos, Dimesul, Discorid, Doleside, Dolostop, Dolxtren, Domes, Donulide, Edemax, Edrigyl, Efridol, Elinap, Erlecit, Eudolene, Fansidiol, Fansulide, Fladalgin, Flaminide, Flamisul, Flogostop, Flolid, G-Revm, Gerilide, Guaxan, Idealid, Isartrox, Isodol, Jabasulide, Kartal, Laidor, Lalide, Lasazin, Ledolid, Ledoren, Lemesil, Lidenix, Lidersolv, Liezpat, Lovirem, Melicat, Melimont, Mesulid, Mesupon, Migraless, Min-A-Pon, Mosuolit, Multiformil, Myxina, Naofid, Nerelid, Neuride, Nexen, Niberan, Nide, Nidemol, Nimalge, Nimartin, Nimed, Nimedex, Nimegel, Nimelide, Nimenol, Nimesil, Nimesoral, Nimesul, Nimesulen E, Nimesulene, Nimesulid E UCB, Nimesulida, Nimexan, NIMS, Nisal, Noalgos, Noxalide, Omnibus, Oxetian, Polyfen, Pronidal, Remov, Resulin, Reumalide, Rhemid, Ribantil, Ristolzit, Ritamine, Rolaket, Scaflam, Solving, Specilid, Sudinet, Sulidamor, Sulide, Sulimed, Sulinime, Sulmedil, Teonim, Tranzicalm, Ventor, Vitolide, Volonten, Zulid.
Preparaty zarejestrowane w krajach Ameryki Południowej[67]:
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.