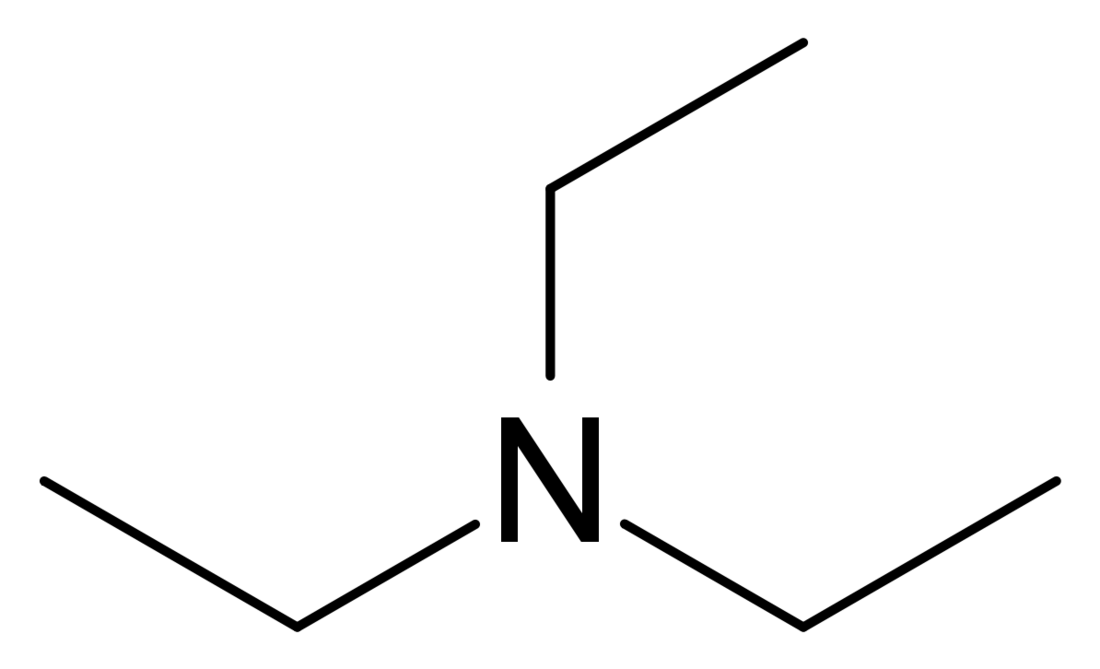
Trietyloamina
związek chemiczny Z Wikipedii, wolnej encyklopedii
Trietyloamina (TEA) – organiczny związek chemiczny z grupy amin alifatycznych. Jest aminą trzeciorzędową. Jak większość amin ma nieprzyjemny dla człowieka, rybi zapach.
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C6H15N | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
(C2H5)3N; Et3N | ||||||||||||||||||||||||||||||||||||||||||
| Masa molowa |
101,19 g/mol | ||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna ciecz[1] | ||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||
| Podobne związki |
etyloamina, dietyloamina, trimetyloamina, N,N-diizopropyloetyloamina, tetraetyloołów | ||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||
Właściwości
Jest zasadą (pKBH+ 10,75) silniejszą od amoniaku (pKBH+ 9,25) i o podobnej zasadowości jak etyloamina (pKBH+ 10,65) i dietyloamina (pKBH+ 10,84)[10]. Podobnie jak dla innych amin alifatycznych, wzrost zasadowości w stosunku do amoniaku wynika z efektu indukcyjnego elektrodonorowych grup etylowych, natomiast zrównanie zasadowości mono-, di- i trietyloaminy jest efektem zróżnicowanej solwatacji[11].
Stosowana jako zasada w syntezie organicznej, np. podczas otrzymywania estrów i amidów z chlorków kwasowych i alkoholi, neutralizując wydzielający się chlorowodór[12]:
- R2NH + R’C(O)Cl + Et3N → R’C(O)NR2 + Et3NH+Cl−
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.