阿茲海默氏病
人類疾病 来自维基百科,自由的百科全书
阿茲海默氏病[11](英語:Alzheimer's disease,AD),是一種發病進程緩慢、隨着時間不斷惡化的神經退化性疾病,此病症佔了認知障礙症中六到七成的成因[1][2]。最常見的早期徵狀為喪失短期記憶(難以記住最近發生的事件),當疾病逐漸進展,徵狀可能逐漸出現,包括語言障礙、定向障礙和自能障礙(包括容易迷路)、情緒不穩、喪失動機、無法自理和許多行為問題[1][2]。當情況惡化時,患者往往會因此和家庭或社會脫節[1],並逐漸喪失身體機能,最終導致死亡[12]。雖然疾程因人而異,但診斷後的平均餘命約為三到九年[7][13]。
此條目需要更新。 (2023年8月3日) |
| 阿茲海默症 | |
|---|---|
 | |
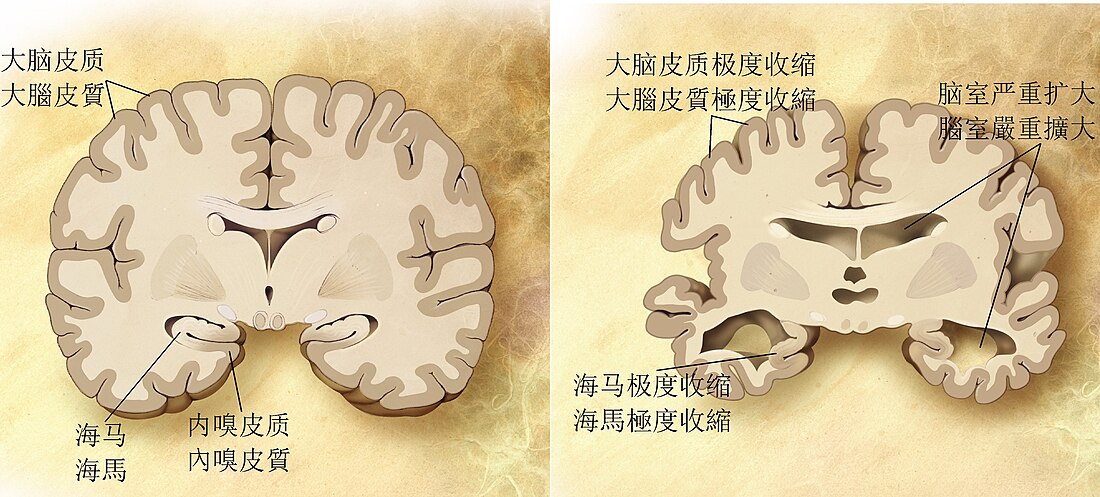
| 比較正常(左)和阿茲海默氏病(右)患者的腦部。 | |
| 徵狀 | 短期記憶喪失、語言障礙、定向障礙、情緒不穩[1][2] |
| 起病年齡 | 大於65歲[3] |
| 病程 | 慢性[2] |
| 類型 | Tau蛋白質異常沉積[*]、衰老相關疾病[*]、疾病 |
| 病因 | 瞭解有限[1] |
| 風險因素 | 遺傳、頭部外傷、憂鬱症、高血壓[1][4] |
| 診斷方法 | 排除其他可能原因後基於徵狀和認知測試診斷[5] |
| 鑑別診斷 | 正常老化[1] |
| 藥物 | 乙酰膽鹼抑制劑、NMDA受體拮抗劑(稍有幫助)[6] |
| 預後 | 餘命3至9年[7] |
| 盛行率 | 2980萬人(2015) |
| 死亡數 | 190萬人(2015) |
| 分類和外部資源 | |
| 醫學專科 | 神經內科 |
| ICD-11 | 8A20 |
| ICD-9-CM | 331.0、290.1 |
| OMIM | 104300 |
| DiseasesDB | 490 |
| MedlinePlus | 000760 |
| eMedicine | 1134817 |
阿茲海默氏病的真正成因至今仍然不明[1]。目前將阿茲海默氏病視為一種神經退化的疾病,並認為有將近七成的風險因子與遺傳有關[4];其他的風險因子還有頭部外傷、憂鬱症和高血壓[1]。疾病的進程與大腦中的纖維狀類澱粉蛋白質斑塊沉積和Tau蛋白有關[4]。 要診斷阿茲海默氏病,需根據病人病史、行為評估、認知測驗、腦部影像檢查和血液採檢來排除其他可能的因素[5]。疾病初期的徵狀常被誤認為是正常老化[1]。確診則需藉助腦部組織檢驗[4]。腦力和身體運動、避免肥胖都有助於減少罹患阿茲海默氏病的風險[4][14]。目前沒有實證證明特定藥物或營養補充品對疾病治療有效[15]。
目前並沒有可以阻止或逆轉病程的治療,只有少數方法或許可以暫時緩解或改善徵狀[2]。疾病會使患者會越來越需要他人的照護,這對照護者是一大負擔;這樣的照護壓力涵括了社會、生理、精神和經濟等各個層面[16]。運動計劃能改善病人的日常生活功能,並可能可以改善預後[17]。由認知障礙症狀引起的行為異常和思覺失調常以抗精神病藥治療,惟其效益不高且可能增加死亡率,因此通常不建議使用[18][19]。
2015年,全球大約有2980萬人罹患阿茲海默氏病[2][20]。患者的發病年齡一般在65歲以上,但大約有4%到5%的患者會在65歲之前就發病,屬於早發性阿茲海默氏病[3]。65歲以上的盛行率約為6%[1]。2015年,認知障礙症造成約190萬人死亡[21]。1906年,德國精神學家與病理學家愛羅斯·阿茲海默首先描述並隨後命名了阿茲海默氏病[22]。在發達國家中,阿茲海默氏病是耗費最多社會資源的一種疾病[23][24]。
徵狀和徵候
阿茲海默氏病的分期[25]
阿茲海默氏病的病程根據認知能力和身體機能的惡化程度分成四個時期,以下分段說明。
阿茲海默氏病最初的徵狀常被誤認為是老化或是壓力[26],但若進行詳細的神經心理學檢查,甚至能在確診為阿茲海默氏病八年前就可發現輕微的認知困難[27]。這些早期徵狀可以影響大部分複雜的日常生活活動[28],最明顯的缺陷是短期記憶障礙,主要是難以記住最近發生的事和無法吸收新資訊[27][29]。
其他徵狀包括注意力管控、計劃事情、彈性處理、抽象思考和語義記憶等方面的問題[27]。冷漠也是此時期會出現的徵狀之一,並會是在病程中持續出現的精神徵狀[30]。阿茲海默氏病的臨床前期也被稱作輕微認知障礙(MCI)[31],這是一個介於正常和失憶症之間的過渡狀態,但MCI可以是許多綜合症的表現,而當它以記憶喪失為主要表現時,則稱作失憶性輕微認知障礙(amnestic MCI),此一名詞常被用來稱呼阿茲海默氏病的臨床前期[32]。
阿茲海默氏病病患的學習與記憶障礙會愈見明顯,最後使醫師能確認診斷。在少部分病患中,語言障礙、執行障礙、認識障礙(失認症)或技能執行障礙(失用症)會比記憶障礙更明顯[33]。阿茲海默氏病並不會對所有記憶能力都有同等的影響,相對於新近發生的事情或記憶,病患長期的情節記憶、語義記憶和內隱記憶(身體記住如何做一件事,例如使用叉子吃東西)受到的影響比較少[34][35]。
阿茲海默氏病患者的語言障礙主要為原發性進行性失語症,特徵是病患可使用的詞彙變少,且流暢度降低,導致病患的口語和書面表達變得困難[33][36]。在這一時期,病患通常還能適當表達簡單的想法[33][36][37];當進行精細動作時(如寫作、畫圖、或是穿衣),可能會出現些微的動作不協調和計劃困難(失用症),但這些徵兆常會被忽略。隨着疾病進展,阿茲海默氏病病患通常仍能獨立完成許多事情,但是大部分需要認知功能的活動可能就需要協助或是監督。[33]
隨着病情惡化,病患將失去獨立生活的能力,而無法進行大部分的日常活動[33]。患者的語言障礙逐漸變得明顯,常會無法想起詞彙(命名不能症),會使用錯誤的字彙來替換(言語錯亂症),同時也漸漸失去讀寫能力,[33][37]患者在執行複雜的動作序列時會變得不協調,增加了跌倒的風險[33]。在這一時期,記憶問題也會惡化,病患可能無法認出親近的家屬[33],之前仍完整的長期記憶也受到影響[33]。
此時期行為和神經精神病學的變化也更為顯著,常見的表現包括遊蕩、易怒和情緒不穩,這些變化會導致病患突然哭泣、突發的非故意攻擊行為、或是拒絕接受照顧[33],此時也會出現日落綜合症[38]。大約30%的患者會產生出現妄想錯認或其他妄想徵狀[33],另外也可能會尿失禁[33]。患者無法體認到疾病的進展(病覺缺失症,即缺乏病識感)[33]。這些徵狀都會對家屬或照護者帶來壓力,由居家照護轉至長期照護機構可減輕此類壓力[33][39]。
在阿茲海默氏病的最終時期,病患已經完全依賴照護者[33],語言能力退化至簡單的詞語甚至僅有單字,最後完全失去談話能力,[33][37]除了失去口語能力之外,病患通常能理解並回應情感刺激[33],雖然攻擊行為仍然存在,但大多時間表現得極度冷漠和疲倦[33],病患最終無法獨立進行任何簡單的事情[33],肌肉品質和行動能力退化至長期臥床,也無法自行進食[33]。阿茲海默氏病是一種絕症,但死因通常是外在因素,例如褥瘡感染或肺炎,而不是疾病本身[33]。
病因
大部分病患罹患阿茲海默氏病的原因仍然不明(除了1%到5%的病患可以找到基因差異)[40][41]。目前有幾個不同的假說嘗試解釋阿茲海默氏病的病因。
根據雙胞胎和家族研究,阿茲海默氏病的基因遺傳性約在49%到79%之間[42][43]。約0.1%家族性遺傳的患者為體染色體顯性遺傳,他們常在65歲前發病,稱為早發性家族性阿茲海默氏病[44]。前類澱粉蛋白質基因APP 、早老素基因 PSEN1 和 PSEN2 是目前家族型阿茲海默氏病已知的相關基因中,最有直接證據會導致阿茲海默氏病的基因[45]。這三個突變都會影響前類澱粉蛋白(APP)的切除,導致類澱粉蛋白斑塊的主要成分Aβ42在細胞中的產量升高[46],一些突變雖然不增加Aβ42的產量,但會改變細胞內Aβ42和其他主要同型異構物(特別是Aβ40)的比例[47][48]。
阿茲海默氏病患者多數沒有上述的體染色體遺傳,稱為偶發型阿茲海默氏病。但有些基因或環境因素仍可能是罹患此病的危險因子。最著名的基因危險因子是載脂蛋白E(APOE)的ε4等位基因[49][50],約有40%到80%的病患帶有至少一個APOEε4等位基因[50],其中異型合子的個體罹患風險增加3倍,而同型合子則增加15倍[44]。然而,環境或基因造成的影響並不一定會完全表現出來。舉例來說,不同於其他族群,部分尼日利亞族群罹患阿茲海默氏病的概率和發病年齡與其是否帶有APOEε4沒有相關[51][52]。遺傳學家已經檢驗超過400個候選基因與遲發性偶發性阿茲海默氏病(LOAD)的關聯,但大部分的基因都沒有發現明顯相關性[44][53]。近期使用全基因組關聯分析(GWAS)的研究則找到了19個可能會影響罹病風險的基因區塊[54],這些基因為CASS4、CELF1、FERMT2、HLA-DRB5、INPP5D、MEF2C、NME8、PTK2B、SORL1、ZCWPW1、SlC24A4、CLU、PICALM、CR1、BIN1、MS4A、ABCA7、EPHA1和CD2AP[54]。研究也發現TREM2的某些等位基因變異會增加罹患阿茲海默氏病的風險達3到5倍,可能的原因是某些TREM2變異會使腦中的白血球將無法控制大腦中Aβ的產生量[55][56]。2018年的一項研究利用記憶、語言、視覺立體、執行,和功能等五個項目,配合新發表的30個與阿茲海默氏病相關的單核苷酸多態性(SNPs),將阿茲海默氏病分為6大類[57]。
膽鹼性假說是最早被提出來的假說,也是現今大部分阿茲海默氏病藥物所依據的理論基礎[58],該假說認為阿茲海默氏病是由於神經系統減少產生神經傳導物質乙酰膽鹼而造成的,雖然膽鹼性假說的歷史悠久,但是沒有受到廣泛的支持,主要是由於使用藥物治療乙酰膽鹼缺乏後,對於阿茲海默氏病的療效有限[59]。
1991年,學者提出類澱粉胜肽假說,認為β類澱粉胜肽(Aβ)在大腦堆積可能是導致阿茲海默氏病的根本原因[60][61]。有關唐氏症患者的研究支持了這項假說,表現Aβ的前類澱粉蛋白基因(APP)位在21號染色體上,而唐氏症病患多了一個21號染色體的副本,同時唐氏症病患幾乎全都在40歲左右時罹患阿茲海默氏病[62][63]。此外,E型載脂蛋白4(APOE4)是上阿茲海默氏病的主要遺傳危險因子,雖然載脂蛋白會增強Aβ的降解,但特定的載脂蛋白異構體對此反應的效果較差(如APOE4),導致多餘的Aβ在大腦中累積[64]。進一步的證據則是來自於基因轉殖鼠實驗,研究人員在實驗鼠身上表現突變型人類APP基因,結果發現其大腦會產生纖維狀類澱粉蛋白斑塊(fibrillar amyloid plaques),並出現類似阿茲海默氏病的大腦病理變化及空間學習障礙[65]。
曾有一種實驗性疫苗在早期人體試驗中可以清除類澱粉蛋白斑塊,但此種治療對認知障礙症卻沒有顯著的效果[66]。因此研究者轉而懷疑沒有形成大型類澱粉蛋白斑塊的Aβ寡聚體才是主要的致病型態,這些寡聚體也被稱為類澱粉蛋白質衍生可溶性配體(amyloid-derived diffusible ligands, ADDLs),它們會結合到神經細胞表面的受體並改變突觸的結構,因此會破壞神經元溝通[67]。其中一種可能的Aβ寡聚體受體可能是普利昂蛋白,這種蛋白的錯誤構型會引起瘋牛症和人類庫賈氏症,因此暗示著阿茲海默氏病與其他神經退化性疾病的機轉可能互有關聯[68]。
2009年,類澱粉胜肽假說有了新的發展,新的研究指出和Aβ關係密切的蛋白質可能才是阿茲海默氏病的罪魁禍首。此類與類澱粉斑塊相關的機制會在早年快速發育的時期,使腦部神經元間的連結減少,並在年紀較大後受到老化相關過程的刺激,導致阿茲海默氏病中的神經元退化[69]。該研究發現APP是DR6的一個配體,β-secretase會切下的APP的N端片段產生N-APP(同樣的酵素也參與APP修飾為Aβ的過程),N-APP則會與死亡受體6(death receptor 6,DR6,或稱TNFRSF21)結合,啟動細胞凋亡途徑。DR6在阿茲海默氏病患者受影響的腦區中有高量的表現,因此在老化的大腦中,可能就是N-APP/DR6途徑被活化而造成了神經元損傷[69]。N-APP/DR6途徑所啟動的細胞凋亡包含了神經細胞本體和軸突,不同於一般細胞凋亡的機制需要活化caspase-3,軸突的退化需要活化caspase-6。此外,經由caspase-6路徑所啟動的細胞凋亡,也可能和另一種杭廷頓舞蹈症相關[70]。2017年,β-secretase抑制劑verubecestat的臨床試驗,證實該藥物在輕至中度阿茲海默氏病沒有顯著效益,且會增加副作用而遭到中止[71]。
中樞神經系統的血管周圍的膠淋巴系統在大腦的廢物上具有重要功能,其中清除的對象包含β類澱粉胜肽[72]。睡眠期間,膠淋巴系統的清除速度會較清醒時快速,睡眠剝奪會導致膠淋巴系統的排毒效能遭到抑制,進而導致廢物累積[73]。

Tau蛋白假說認為Tau蛋白異常是引起阿茲海默氏病病情發展的主因[61]。在這個模型中,過度磷酸化的Tau蛋白會開始與其他Tau蛋白質配對結合,結果在神經細胞中形成了神經纖維糾結[74]。在這種情形下,神經細胞內的微管開始瓦解並導致由細胞骨架構成的運送系統崩壞[75],這將造成神經細胞之間的化學訊息溝通失效,接着導致神經細胞死亡[76]。
新生血管假說認為血腦屏障功能減低也可能和阿茲海默氏病有關[77]。
阿茲海默氏病患者細胞內外金屬離子(如銅、鐵、鋅離子)會不平衡,雖然目前不清楚是蛋白質的改變造成離子不平衡,抑或離子的改變造成蛋白質的變化,這些離子會影響tau蛋白、APP和APOE[78],這些蛋白失調會造成細胞內部的氧化壓力,並因此造成相關的病變[79][80][81][82][83]。然而有些相關研究的品質受到批評[84][85],因此這種推論仍有爭議[86]。多數的研究者並不支持鋁離子和阿茲海默氏病有因果關係[85]。
抽煙是阿茲海默氏病的顯著危險因子[87], 先天免疫系統的發炎指標則是遲發型阿茲海默氏病的危險因子[88]。有限的證據指出空氣污染可能也是促進阿茲海默氏病發展的一項因素[89]。
牙周炎發生時的螺旋體感染也可能造成失智,並參與阿茲海默氏病的病理機制 [90]。真菌感染也是一個可能的疾病機轉[91]。
也有假說認為 寡突膠細胞功能異常以及其在老化過程中產生的髓鞘問題會造成軸突的傷害,最後導致了類澱粉生成和tau蛋白過磷酸化的副作用[92][93]。
逆生假說(Retrogenesis)是貝里·萊斯伯格(Barry Reisberg)在1980年代提出的另一項阿茲海默氏病假說[94]。胎兒發育時會歷經一連串的神經發生,這個過程始於神經板形成,終於髓鞘形成,該假說認為阿茲海默氏病患者的神經退化就如同此一過程的逆轉,先是神經脫鞘、白質的軸突死亡、最後灰質的神經元死亡[95]。同樣地,嬰兒會經歷認知發展,該假說也認為阿茲海默氏病患者的認知障礙就如同此一過程的倒轉[94]。萊斯伯格也發展出了一套稱為FAST(功能性評估分級工具,Functional Assessment Staging Tool)的照護評估工具,用以評估阿茲海默患者的病程發展到哪個階段,以此為依據為每個階段的患者提供適當的照護建議[94][96]。
病生理學


阿茲海默氏病的特徵是大腦皮質及特定皮質下區域的神經元和突觸喪失。神經元喪失過多的區域甚至會導致巨觀解剖上的萎縮,常見主要遭到的進犯部位包含顳葉、頂葉、一部份的額葉,和扣帶回[97]。某些腦幹的核區可能也會受到影響,如藍斑核等[98]。磁振造影(MRI)和正子電腦斷層掃瞄(PET)研究已報導患者在疾病進程中部分腦區萎縮的狀況,且跟其他健康老年人比較也能發現有部分腦區萎縮[99][100]。
在顯微鏡下,阿茲海默氏病患者的腦皮質可以看到明顯的類澱粉斑塊以及神經元纖維纏結[101]。斑塊大多由緻密且不溶於水的β類澱粉胜肽及細胞衍生物所構成,通常堆積於神經元周圍。神經纖維纏結則通常是由微管相關蛋白質Tau所構成,患者的Tau蛋白會過度磷酸化並聚集於細胞內。雖然許多老年人的大腦中都可發現這些因老化形成的斑塊和纏結,但阿茲海默氏病患者會在特定腦區出現更多斑塊及纏結,例如顳葉等[102]。路易氏體在病患腦中也很常見[103]。
阿茲海默氏病也被視為一種蛋白質折疊錯誤的疾病(蛋白質構象病),是由於大腦中折疊異常的β類澱粉蛋白和Tau蛋白質堆積而造成[104]。構成斑塊的β類澱粉蛋白(Aβ)是由約39至43個氨基酸構成的短鏈胜肽。Aβ為前類澱粉蛋白(APP)的一小片段,該蛋白為神經元細胞膜上的一種跨膜蛋白,對神經元的生長、存活和受傷後的修復非常重要[105][106]。阿茲海默氏病患者的γ分泌酶及β分泌酶會共同進行蛋白酶解作用,將APP切成小片段[107]。其中某些片段即為β類澱粉蛋白,他們會在神經元的胞外間質堆積,形成老年斑塊[101][108]。
還有一種理論認為阿茲海默氏病是Tau蛋白質異常沉積造成。每個神經元都有由微管組成的細胞內支撐系統,稱為細胞骨架,這些微管的作用如同軌道,引導營養物質和其他分子在細胞本體和軸突之間來回移動。Tau蛋白質被磷酸化之後可以穩定微管,所以被歸類為微管關聯蛋白質[109]。在阿茲海默氏病病患中,Tau蛋白質發生突變而過度磷酸化,進而造成微管瓦解。釋出的Tau蛋白質會聚集起來,產生神經纖維團塊並且瓦解神經元的運輸系統[110]。變性後的tau蛋白質將使轉座子運作異常,導致神經元死亡[111]。
目前仍不清楚Aβ蛋白的異常合成與異常聚集,如何導致阿茲海默氏病的病理變化[112][113]。類澱粉蛋白假說指出Aβ蛋白的堆積是造成神經元退化的主要原因,聚集的類澱粉蛋白纖維會瓦解細胞的鈣離子平衡,並造成細胞凋亡[114]。Aβ蛋白也會選擇性地堆積於病灶處細胞的線粒體中,抑制部分酵素的功能以及神經元使用葡萄糖的能力[115]。
多種發炎反應和細胞激素也可能在阿茲海默氏病的病理變化相關[116]。越來越多證據顯示腦部神經元與免疫系統之間有很強的交互作用。肥胖與全身性發炎反應等干擾免疫反應的因子,可能都會引起疾病惡化[117]。
不同神經滋養因子(如腦源性神經營養因子)的分佈變化,以及其受體的表現狀況,都曾有研究指出與阿茲海默氏病有關[118][119]。
診斷

阿茲海默氏病的診斷一般透過病史收集和行為觀察獲得。臨床醫師可透過觀察患者神經學及神經心理學上的特徵,並排除其他診斷來佐證診斷[120][121]。一些醫學影像技術,可以協助排除其他大腦病變或認知障礙症亞型[122]。此外,醫學影像也可以用於預測從輕微認知失調到阿茲海默氏病的轉變[123]。
神經心理學評估(包括記憶測試)可以進一步鑑別疾病狀態[26],醫學組織已經為臨床醫師建立診斷標準以簡化及標準化診斷程序。阿茲海默氏病最準確的診斷方法為屍體病理解剖,直接取得腦組織,經由組織學免疫染色法進行確認診斷[124]。
美國神經與溝通疾患及中風研究院(NINCDS,現改名為美國神經與中風研究院)及阿茲海默氏病及相關疾病協會(ADRDA)於1984年制定了NINCDS-ADRDA阿茲海默氏病診斷標準,為目前最常用的診斷標準之一[124],最新一版於2007年更新[125]。臨床診斷標準包含認知功能損害、疑似認知障礙症狀,並經由神經心理學評估確認。
腦組織的顯微鏡檢可以提供阿茲海默氏病的組織病理學確認診斷。上述的診斷標準在藉由組織病理學進行評估後,顯示該標準的信度及效度都不錯[126]。阿茲海默氏病最常損害的八個智能區塊為記憶、語言、知覺、注意力、動作技能、定向力、問題解決能力、執行能力等。這些問題在NINCDS-ADRDA診斷標準及美國精神醫學學會發行的《精神疾病診斷與統計手冊》(DSM-IV-TR)皆有提到[127][128]。

簡短智能測驗(MMSE)等神經心理學檢查常被用於評估認知功能障礙,以利於後續診斷。若要取得更可信的結果,可以進行更全面的測試,特別是在疾病初期的患者[129][130]。除非有明顯的認知功能障礙,神經學檢察結果在疾病初期一般會呈現正常,可能無法與其他疾病做出鑑別,包含其他原因造成的認知障礙症。
進一步的神經學檢查對於阿茲海默氏病的鑑別診斷相當重要[26],與家人會談也有助於評估病情。主要照護人能夠提供患者日常活動功能的重要資訊,以及病人心智功能下降的情形[131]。由於患者通常自己無法查覺自身的異狀,因此旁觀者的觀點對於疾病的評估相當重要[132]。但在認知障礙症初期時,家人通常也無法察覺病人的徵狀,而無法提供醫師準確的資訊[133]。
輔助性檢查可以提供一些額外資訊,以利排除其他診斷。血液檢查也可以協助排除阿茲海默氏病以外的診斷[26],偶見有些病因是可以治癒的[134]。常見的血檢項目包含甲狀腺功能測試、維生素B12、梅毒檢測、代謝性疾病檢查(如腎功能檢查、電解質水平,以及糖尿病檢查)、重金屬水平,以及貧血等等。另外也必須譫妄的可能性。
針對抑鬱症的心理測驗也建議進行,因為阿茲海默氏病常同時伴隨抑鬱徵狀,也是認知功能損傷的早期徵狀之一[135],甚至是原因[136][137]。
電腦斷層掃瞄(CT)、核磁力共振掃描(MRI)、單光子電腦斷層攝影(SPECT),和正子電腦斷層攝影(PET)等高階醫學影像技術,可以協助排除腦膜瘤、硬膜下出血等其他腦部疾病或認知障礙症亞型[122]。此外,醫學影像也可以用於預測從輕微認知失調到阿茲海默氏病的轉變[123]。海馬迴計量(Hippocampal volumetry)的診斷價值或許較高,但大多數醫院不易取得[45]。目前核磁共振已經有影像評分系統,可以協助識別皮質萎縮的區域。
C-PIB正子照影(C-PIB PET)在疾病初期的準確率不高,因此不建議用於早期診斷,或預測輕度知能障礙患者進展到阿茲海默氏病的機會[138]。¹⁸F-FDG正子照影(¹⁸F-FDG PET)在預測阿茲海默氏病的發生機會上也沒有實證支持[139]。
目前用於阿茲海默氏病的放射性示蹤劑中,針對檢測大腦中的類澱粉樣斑塊(可能是阿爾茨海默氏症的生物標記),美國FDA核准的藥物有florbetapir F18,flutemetamol F18和florbetabenF18。針對tau20,它們都用於檢測大腦中的澱粉樣β斑塊(可能是阿爾茨海默氏症的生物標記)。[來源請求]
澱粉樣蛋白的PET診斷藥物目前已有3個藥物被FDA核准,但在tau蛋白病變中,Tauvid是第一個可以診斷tau蛋白病變的藥物。[來源請求]
目前全球醫學界認為阿茲海默氏病病患,主要是在大腦中發現有tau蛋白以及類澱粉樣蛋白(amyloid)堆積,並且認為這兩種蛋白質可能是造成阿茲海默氏病的病變原因。目前FDA針對澱粉樣蛋白的PET診斷藥物已有3個藥物(florbetapir F18,flutemetamol F18和florbetaben F18)被A核准,但在tau蛋白病變中,flortaucipir F18 (Tauvid)是第一個可以診斷tau蛋白病變的PET藥物。[來源請求]
預防

目前實證上沒有任何能有效預防阿茲海默氏病的方式[15],有關預防及推遲阿茲海默氏病進程的跨國研究結果經常不一致。流行病學研究推測阿茲海默氏病可能與某些飲食、心血管風險、藥物等因子相關。某些智力活動及族群發生阿茲海默氏病的機會可能也不同。但這些相關性是否真的可以用來預防阿茲海默氏病,仍需進一步的研究闡明[15]。
雖然高膽固醇、高血壓、糖尿病,及吸煙等心血管風險增強因子,可能與較高的阿茲海默氏病發生率相關[140][141]。但服用降膽固醇用的他汀類藥物(Statins)無法有效預防阿茲海默氏病的發生或推遲其進程[142][143]。
長期使用非類固醇抗發炎藥(NSAIDs)在2007年時被認為可能與較低的阿茲海默氏病發生率相關[144]。亦有證據顯示NSAID可以減少與類澱粉斑塊相關的發炎反應。但由於副作用過高,相關的臨床實驗提早中止[15]。截至目前為止,尚無預防研究完成試驗[15]。NSAID對於治療阿茲海默氏病沒有任何功效,但為預防的候選藥物之一[145]。更年期的激素替代療法可能會增加失智的風險,即使已經停藥也一樣[146]。
從事某些益智活動的人群罹患阿茲海默氏病的風險似乎較低,如閱讀、圖版遊戲、填字遊戲、演奏樂器,及從事日常社交活動等[148]。這點符合認知存量假說,該假說認為有些生活經歷會增進神經功能的效能,並擴充個人的認知存量,進而延遲認知障礙症的發生[148]。接受教育也會延遲阿茲海默氏病的發生,但並不會改變病程的長短[149]。學習第二語言也有可能可以延遲疾病發生[150]。體能鍛鍊亦顯示可以降低阿茲海默氏病的風險[149],且發生認知障礙症的比率較低[151],另外也能減輕患者徵狀嚴重程度[152]。
平時身體健康者、日本人、地中海飲食者顯示罹患阿茲海默氏病的機會較小[153]。地中海飲食同時也能改善患病者的預後[154]。飲食含有高脂肪酸及簡單碳水化合物(simple carbohydrates,單醣或雙醣等)患病概率也較高[155]。地中海飲食對心血管正面影響的機制也已有文獻發表[156]。
飲食的配方與阿茲海默氏病間的關係目前仍不明朗,因為相關的研究結果沒有定論[153]。有限證據顯示適量飲酒,與較低的阿茲海默氏病發生率相關,特別是紅酒[153]。另有證據表明咖啡因可能為阿茲海默氏病的保護因子[157]。含有高量黃酮類的食物,如可可、紅酒、茶,等,也可能與較低的阿茲海默氏病風險相關[158][159]。
目前沒有有力證據支持攝取維生素或礦物質對疾病有幫助,此部分已研究的物質包含維生素A[160][161]、C[162][163]、α-生育酚態的維生素E[164]、硒[165]、鋅[166][167]、葉酸,以及B12等[168]。一項證據品質中等的隨機分派研究指出,α-生育酚態的維生素E可以減緩認知功能下降的速度[164];而葉酸及其他維生素B的臨床試驗則無法證明有同樣功能[169]。植物油及魚油中常見的Omega-3脂肪酸,以及二十二碳六烯酸(DHA)對於改善阿茲海默氏病沒有已知助益[170][171]。
薑黃在動物實驗中顯示對阿茲海默氏病有幫助,但截至2010年為止,尚無人體實驗證實有效[172]。銀杏及大麻素目前也尚無有力證據支持其在認知障礙症的效果[173][174],但內源性大麻素(endocannabinoids)似乎有一些證據顯示有所助益[175]。
熬夜也會增加患上阿茲海默氏病的風險,有充足睡眠減少阿茲海默氏病的風險。
CAIDE風險量表(CAIDE risk score)能夠評估20年內罹患認知障礙症的機會,該量表考量了年齡、教育水平、性別、血壓、BMI、總膽固醇,及日常活動等因子[176]。
治療
目前阿茲海默氏病尚無法根治,僅有一些徵狀性治療,此類療法大多屬於和緩醫療。現行治療可分為藥物治療、心理治療和醫療照護。


常見用於改善阿茲海默氏病認知障礙的藥物有五種,其中四種為乙酰膽鹼酯酶抑制劑(塔克寧、憶思能、加蘭他敏、愛憶欣),另外一種為NMDA受體拮抗劑(美金剛胺)。但這些藥物的效益都不大[6][177][178],且截至目前為止,仍沒有證據證明這些藥物能延緩或停止疾病的進程。2023年,美國藥監局批准了侖卡奈單抗作為緩解早期阿茲海默氏病的單株抗體藥物,目前該藥對於認知功能完整和晚期患者並無很好的作用。
阿茲海默氏病會降低膽鹼性神經元的活性[179],而乙酰膽鹼酯酶抑制劑可以減緩乙酰膽鹼(ACh)的降解速率,藉此提升突觸間的乙酰膽鹼濃度,以補足因膽鹼性神經元死亡而造成乙酰膽鹼濃度下降的現象[180]。目前此類藥品在輕度至中度的阿茲海默氏病的徵狀控制上,已經證實有效[178][181][182],有一些證據甚至表示重度患者使用也有效果[182]。輕度知能障礙患者用藥並不能延遲阿茲海默氏病的發生[183]。此類藥物最常見的副作用為噁心和嘔吐,兩者皆為膽鹼過量的副作用。約10–20%的患者用藥後會產生副作用,嚴重程度從輕度到中度皆有。如有此類問題,可以緩慢調降藥量來改善[184]。比較少見的副作用包含肌肉抽搐、心搏過緩、食慾及體重下降,以及胃酸製造增加等等[181]。
麩胺酸為興奮性神經傳遞物質,若在腦中含量過多可能會引起興奮性毒性反應,使細胞因受體過度刺激而死亡。興奮性毒性反應存在於阿茲海默氏病、帕金森氏症,以及多發性硬化症等神經性疾病中[185]。美金剛胺為一種非競爭性NMDA受體拮抗劑,一開始被用於治療流行性感冒,但後來發現它可以藉由抑制NMDA受體來達到抑制麩胺酸系統的效果[185][186]。後來的研究顯示美金剛胺對於阿茲海默氏病有些許效益[187]。本品已知的不良反應包含偶爾產生輕微幻覺、意識混亂、暈眩、頭痛,以及疲勞[188]。美金剛胺與愛憶欣併用的效果統計上呈現顯著,但臨床效益不大[189]。
非典型抗精神病藥對於緩解患者的攻擊性及思覺失調徵狀具有一些效果,但同時此類藥物也會造成一些嚴重副作用,例如中風、動作障礙,已及認知功能損傷等等[190]。長期使用此類藥物可能會增加死亡風險,而對於精神徵狀輕度至中度的長期服藥者,停藥似乎為安全的選擇[191]。石杉鹼甲對改善認知功能似乎有正面影響,但目前仍需進一步研究證實其效果[192]。
2019年11月中國國家藥品監督管理局批准國產研發公司綠谷製藥的「九期一」製劑上市是一種甘露特鈉膠囊[9],是長達17年來阿茲海默氏病首次有新藥出現上市,根據上海交通大學醫學院附屬精神衛生中心和北京協和醫院聯合的三年臨床實驗證明,此藥能顯著反轉中期患者的病況,且完全無副作用,甚至有病人入組時的認知功能分數26分藥後漲到了29分(常人滿分30分),據藥物研發團隊負責人中國科學院上海藥物研究所耿美玉研究員介紹:GV-971是一種新型的海洋來源的寡糖,具有多種靶向機制,包括抑制澱粉樣β纖維的形成,神經發炎和腸道菌群失調的修復。但需要進一步研究以進一步闡明和確認其有希望的生物學和臨床效果。[193][194]「九期一」引起了不少質疑,包括研發單位綠谷製藥曾販賣假藥中華靈芝寶(雙靈固本散),PubPeer網站對耿美玉課題組發表的4篇論文發出質疑,認為存在圖片不當裁剪、一圖多用等問題。[195][196]此外,2019年11月29日,首都醫科大學校長饒毅實名舉報李紅良、裴鋼、耿美玉造假,稱耿美玉的文章「不造假是不可能的」。[197][198]
社會心理治療可用於輔助藥物治療,分為行為性、情緒性、認知性、刺激性等介入方式。但此類治療的效度無法測量,且此類研究的研究對象大多收錄了所有認知障礙症,鮮少明確針對阿茲海默氏病[199]。
行為治療乃是藉由識別問題行為的前因及結果,進而試圖減少之。此類治療雖然無法改善整體功能[200],但可以減少一些特定的問題行為,例如尿失禁[201]。但目前對於遊走(wandering)等其他問題並沒有足夠實證顯示其效果[202][203]。音樂治療可能對於減少行為性或心理性徵狀有些效果[204]。
情緒導向治療包括懷舊療法、確認療法、支持性心理治療、 感官統合(或稱為多感官治療)和情境模擬治療。一份考科藍的回顧性文章認為此類療法並無足夠實證支持效果[205]。 支持性心理治療的正式學術研究相當少,但有些治療者認為對於改善病人的病感有些許效果[199]。懷舊療法的做法是與病患引導病人回憶過去的經驗,治療者會反覆藉由照片、日常用品、音樂、錄音檔,或是病患熟悉的事物引導病人回憶並組織過去的經驗。懷舊療法可以個別進行或以小組模式進行。一份2018年的回顧性文章認為懷舊療法的一致性不足,且對象規模過小、各團體差異過大,以致不足以彰顯其臨床意義[206]。情境模擬治療的理論是建基於依附理論上,治療者會播放病患熟悉的聲音。此療法在改善病患的挑釁行為有部分證據[207]。最後,確認療法是基於接受患者所感受到的真實和個人信念,而感官統合療法則以刺激訓練患者的感知為目標。目前沒有證據支持這些療法是否有效[208][209]。
認知導向治療的目標包含協助病人恢復現實定向(reality orientation)以及認知功能再訓練(cognitive retraining)。現實定向的做法是提供病人當下的人、事、時、地、物等現實資訊,以協助病人了解其環境。認知功能再訓練則旨在協助病人改善其心智功能。上述兩者對於改善認知能力都有一些效果[210][211],雖然在部分研究中,這些效果短暫的,負面效果如使患者感到沮喪也曾被提出[199]。
刺激導向治療(Stimulation-oriented treatments)包括以藝術、音樂、寵物、運動或其他任何娛樂活動來進行治療。刺激可以適當地協助患者改善行為、心情和少部分的功能。雖然如此,這些治療提供的支持除了其本身的效果外,患者習慣的改變也是同等重要的[199]。非侵入性腦刺激和侵入性腦刺激在阿茲海默氏病的效用目前還不明瞭[212]。
由於阿茲海默氏病無法治癒,且會逐漸使患者無法自理,因此照護實質上是治療的核心,在整個疾病進程中必須小心處理。在疾病早期,改善居住環境和生活模式可以增進病人安全,並減少照護者的負擔[213][214],實務上包括讓患者的生活作息符合固定簡單的模式、使用安全防護裝置、在居家物品上做標示(用以提示患者)或使用特殊設計的生活用具[199][215][216]。若有進食問題,則須將食物切成小塊或甚至做成泥狀[217];當出現吞嚥障礙時,則可能需使用餵食道,對於這樣的患者,照護者和家人必須仔細考量藥物療效和餵食與否等倫理議題[218][219]。無論是哪個階段的阿茲海默氏病的患者,通常都不需要身體拘束,雖然在少數狀況下,為了保護患者或照護者仍必須執行拘束[199]。
當疾病逐漸惡化,各式病症也會逐漸出現,如口腔或牙科疾病、褥瘡、營養不良、衛生問題、呼吸道感染、皮膚感染、眼感染等。小心的照護管理能避免上述問題產生,但若真的發生了,則需要專業的治療[220][221]。在疾病的最末期,治療着重於在患者死亡前緩解其痛楚,通常會需要緩和醫療的協助[222]。
預後

無資料
≤ 50
50–70
70–90
90–110
110–130
130–150
150–170
170–190
190–210
210–230
230–250
≥ 250
阿茲海默氏病早期十分難診斷,通常要到認知障礙影響到日常生活後才會確診,雖然此時患者可能仍能獨立生活。患者的徵狀會由輕度的認知功能問題(例如記憶力衰退)開始逐漸惡化,到疾病後期完全不可能獨自生活。[33]
阿茲海默氏病患者的預期壽命較短[223],診斷後的預期餘命約三到十年[223],少於3%的人能活超過14年[224]。會造成存活年數顯著減少的特徵包括認知障礙嚴重度增加、生活功能減退、曾經跌倒和神經學檢查出現問題。其他共病如心血管疾病、糖尿病、曾經酗酒都和存活年數減少有關[225][226][227]。雖然越年輕時就診斷的患者有越長的存活年數,但事實上年輕的患者相對於健康族群來說壽命較短[228]。男性的預後也較女性差[224][229]。
流行病學
| 年齡 | 年發生率(每千人) |
|---|---|
| 65–69 | 3 |
| 70–74 | 6 |
| 75–79 | 9 |
| 80–84 | 23 |
| 85–89 | 40 |
| 90– | 69 |
阿茲海默氏病的流行病學研究主要着重在盛行率和發生率上:盛行率指的是某種疾病在任一時間點占群體總人數的比例;發生率則是指特定時期內某人群新發生某一疾病的比率。
在發生率方面,縱貫性世代研究(追蹤一群無疾病人口的發病比率)指出,每年認知障礙症發生風險約為1-1.5%,而其中阿茲海默氏病的風險則為0.5-0.8%[230][231]。這代表在每年新發生的認知障礙症中,有幾乎一半是阿茲海默氏病。高齡是阿茲海默氏病的主要風險因子,本病在每個年齡層的發生率不同,年齡越大者發生風險越高。65歲以上的長者,每五年的罹病風險就會增加一倍,[230][231]除年齡外,阿茲海默氏病的發生率還存在性別差異,女性的發生率較男性為高,特別是85歲以上的年長女性[231][232]。在美國,非拉丁裔白人死於阿茲海默氏病的風險,比起非裔高出了26%,更比拉丁裔高出了30%[233]。

0–4
5–8
9–10
11–13
14–17
18–24
25–45
46–114
115–375
376–1266
阿茲海默氏病的盛行率取決於許多因素,包括當地患者的存活率。由於阿茲海默氏病的發生率隨年齡增加,考量當地人口的平均年齡是相當重要的。美國的阿茲海默氏病的總人口盛行率和65–74歲的族群盛行率皆為1.6%,但在75–84歲的族群盛行率則為19%,85歲以上的族群更達到42%[234]。低度開發地區的盛行率也因此較低[235]。世界衛生組織估計2005年全球的認知障礙症盛行率為0.379%,2015年會增加到0.441%,並在2030年達到0.556%[236];其他研究也有類似的結論[235]。另一項研究估計2006年全球約有0.40%(範圍從0.17到0.89%;實際人數約2660萬人,範圍從1140萬到5940萬人)的人口受阿茲海默氏病的影響,在2050年以前,盛行率會是現在的三倍,實際人數則會高達四倍[237]。
歷史

早在古希臘羅馬時代,當時的哲學家和醫師就已經發現年老與失智的關聯性[22]。1901年,德國精神科醫師愛羅斯·阿茲海默描述了第一個阿茲海默氏病病例。這名病患是一名名叫奧古斯特·迪特的50歲女性,阿茲海默持續追蹤迪特的病程進展至病人於1906年死亡為止,並在之後發表該病例[238]。其後五年,陸續又出現了11例類似的病例報告,其中有些論文已經用「阿茲海默氏病」來稱呼此疾病[22]。1910年7月15日,艾米爾·克雷珀林於《精神科學課本》(Textbook of Psychiatry)第八版中首次將這些徵狀描述為一個單一疾病,並將奧古斯特的部分徵狀(如幻覺和妄想)及病理特徵(血管硬化)劃出該病的描述範圍[239]。艾米爾採用了「阿茲海默氏病」這個名字,並同時將其稱為「早發性老年認知障礙症」(presenile dementia)將其視為是老年認知障礙症的一個亞型[240]。
截至1970年代為止,阿茲海默氏病的診斷仍然僅限於描述45至65歲之間,提早出現特定認知障礙症狀的患者。直到1977年,一場阿茲海默氏病研討會共識認定,阿茲海默氏病和老年認知障礙症的臨床和病理表徵大致相同。雖然同時也強調兩者的病因學可能不同[241],但這樣的共識已促使阿茲海默氏病的診斷,不再應該限定於特定年紀的患者[242]。此後一段時期,超過65歲且擁有阿茲海默氏病徵狀的患者,另被描述為「阿茲海默型老年認知障礙症」(senile dementia of the Alzheimer type,SDAT)。如今,阿茲海默氏病已經被接受為醫學的正式名詞,描述各年齡患者某種共同特定徵狀的病徵[243]。
社會及文化
認知障礙症(特別是阿茲海默氏病)已成為歐美社會花費最多的疾病之一[23][24],其他如阿根廷[244]和南韓[245]等國家的花費也節節攀升。這些花費可能會使社會結構老化,進而成為社會問題。與阿茲海默氏病有關的社會成本包括直接的醫療費用(如護理之家照護、在宅日間照護)和間接的成本(如病人和照護者生產力降低)[24]。雖然各個研究的數據有差異,但全球每年在認知障礙症上花費約1600億美元[246],單是美國每年就可能花費了約1000億美元[24]。
社會成本最大的來源為醫療專業人員的長期照護,特別是機構照護的費用可能佔了總花費的2/3[23]。患者在家的生活花費通常很高[23],尤其還需考慮患者家人的非正式成本,如照護時間和因照顧患者而減少的收入[247]。
隨着失智的嚴重度和行為問題增加,患者的花費將會上升[248],需要醫療照護的時間也會增加[247]。因此,任何能減緩認知功能下降、延遲機構照護或減少照護時間的治療都對經濟有幫助,目前的治療方法在經濟評估上已顯示正向的結果[24]。
患者的主要照護者通常是其配偶或關係較密切的親屬[249]。阿茲海默氏病會帶給照護者社會上、心理上、生理上,和經濟上極沉重的負擔[16][250][251]。居家照護可以延遲或減少病人接受更昂貴和更專業的照護[252][253],因此通常家屬和患者會傾向選擇居家照護[252]。但即使如此,認知障礙症患者仍然佔了護理之家住院人數的三分之二[199]。
認知障礙症患者的照護者罹患生理和心理疾患的機會較高[254]。 造成主要照護者有較大心理問題的因素包括患者住在家中、患者為其配偶、患者有令照護較為吃力的行為(如憂鬱、行為干擾、幻覺、睡眠問題、行走問題或社交孤立)等[255][256]。在經濟層面上,作為照護者的家人平均每週放棄47小時的工作時間來照護阿茲海默氏病患者,照護的代價相當高昂。在美國,每年直接和間接的照護支出從18,000到77,500美元不等,數值因研究而異,[247][249]
許多電影或劇集描述過阿茲海默氏病,例如《長路將盡》(2001,取材自約翰·貝禮描述其妻的回憶錄)[258]、《忘了、忘不了》(2004,取材自尼可拉斯·史派克同名小說)[259]、《我腦海中的橡皮擦》(2004)、《Thanmathra》(2005)[260]、《明日的記憶》 (2006,取材自荻原浩同名小說)[261]、《妳的樣子》(2006,取材自艾麗斯·芒羅短篇小說《恨,友誼,追求,愛情,婚姻》)[262]、《永遠的愛麗絲》(2014,取材自莉莎·潔諾娃同名小說)。相關紀錄片有《馬爾柯姆與芭芭拉:愛的故事》(1999,Malcolm and Barbara: A Love Story)和《馬爾柯姆與芭芭拉:愛的告別》(2007,Malcolm and Barbara: Love's Farewell),兩者都以鋼琴家馬爾柯姆·波因頓為主角[263][264][265]。
在中國大陸,熱播劇《辣媽正傳》(2013)、《產科醫生》(2014)、《嘿,老頭!》(2015)、《急診科醫生》(2017)、《都挺好》(2019)、《八零九零》(2021)、《您好!母親大人》(2021)、《天才基本法》(2022)、《謝謝你醫生》(2022)、《非凡醫者》(2023)及《我的阿勒泰》(2024)均刻畫了阿茲海默氏病患者的生活。綜藝節目《周六夜現場》(中國版;2018)、《忘不了餐廳》(2019~2020)也表達了對此類病患的重視與關懷。
研究方向
在2002到2012的十年中,244種化合物進入了第一、第二和第三期臨床試驗,但僅有美金剛胺獲得美國食品藥品監督管理局的核准(有部分仍在申請程序)[266]。現今治療阿茲海默氏病的藥物研究,大體來說可以分成下列幾個路徑:活化膽鹼路徑、抑制麩胺酸路徑、減少類澱粉斑塊、減少神經纖維纏結,以及減少神經發炎反應等[267]。
膽鹼路徑可分為膽鹼脂酶抑制劑、5-HT6受體拮抗劑、H3受體拮抗劑、α7煙鹼性膽鹼受體興奮劑。目前已核准的阿茲海默氏病藥物,除美金剛胺外為NMDA受體拮抗劑之外,其他全為膽鹼脂酶抑制劑,但此類藥物目前僅知能暫時減少記憶損失的程度,但不能延緩病程。[267]
減少β類澱粉蛋白是此類開發中藥物常見的目標(例如去水嗎啡)[268]。免疫治療或針對類澱粉蛋白的疫苗也是一種研究中的療法[269]。和預防接種不同的是,開發中的疫苗預計是給已被診斷的患者施打的,希望藉由訓練免疫系統辨識、攻擊、並逆轉類澱粉蛋白的堆積來改變疾病的進程[270]。然而目前已發現免疫治療藥物會導致一些令人擔憂的藥物不良反應,例如類澱粉蛋白相關影像異常[271]。其他研究中的方法還有神經保護物質和降低金屬蛋白交互作用的物質(如PBT2)[272]。恩博是一種能阻斷TNFα受體的融合蛋白,近年已有部分令人振奮的初步結果[273]。
2008年,兩項個別的臨床試驗顯示亞甲藍對輕至中度阿茲海默氏病有效果,可以抑制tau蛋白的聚集[274][275]。抗組織胺藥Dimebon[276]的第三期試驗則未顯示顯著效果[277][278][279]。但口服亞甲藍的腸道生物利用度會被胃酸影響,因此其劑量難以控制[280]。亞甲藍的前驅藥物LMTX已經完成第三期試驗,相關結果仍待公佈。
有研究顯示,睡眠可以促進腦脊髓液排除Tau蛋白的功能,慢性睡眠剝奪則會使腦間質中的tau蛋白累積,可能進而造成阿茲海默氏病[281]。
有前端研究顯示冥想在認知障礙症恢復記憶和認知功能上或有效果[282]。一篇2015年的回顧性文章認為正念療法可能在預防和延遲輕度認知損傷及阿茲海默氏病上有效[283]。
研究發現一型單純疱疹病毒(HSV-1)會出現在和類澱粉斑塊相同的區域[286][287],這項發現開啟了以抗病毒藥物治療或預防阿茲海默氏病的可能性[286][288]。抗病毒藥物在細胞培養實驗中已展現了十分有潛力的結果[289]。
阿茲海默氏病與腦部真菌感染的關聯也曾被提出[290],這項假說由微生物學家卡拉斯科(L. Carrasco)提出,他的研究團隊發現瀰漫性真菌症和阿茲海默氏病有統計關聯[291]。進一步的研究顯示,阿茲海默氏病患者的各個腦區都出現真菌感染的現象,但對照組的一般大眾卻沒有[292][293]。真菌感染似乎解釋了阿茲海默氏病患者的徵狀。阿茲海默氏病患者緩慢的病程,似乎也與一些慢性的全身性真菌感染類似,徵狀一樣不顯著、一樣難以注意到,自然也難以治癒[292]。真菌感染的假說,也呼應了阿茲海默氏病某些現在已經較為確立的假說,例如類澱粉蛋白假說,同樣可以將阿茲海默氏病解釋為某種免疫系統對於中樞神經系統感染的反應[294][295][296]。該阿茲海默氏病成因的假說由莫伊爾(R. Moir)和譚茲(R. Tanzi)在大鼠與蠕蟲上所建立。
在現在既存的醫學影像技術中,單光子電腦斷層掃描似乎是用於鑑別阿茲海默氏病與其他認知症的最佳方式,比起心智能力測試與病史分析,也能提供更為精確的資料[297]。這樣的進展也促進診斷標準的更新,[26][125]
雖然PiB PET目前還僅供研究使用,但已有醫療團隊使用類似的正子電腦斷層技術,將核醫放射示蹤劑藥物florbetapir用於治療。Florbetapir於2011年通過美國食品藥物管理局審查,可用於阿茲海默氏病的診斷[298][299]。這項藥物可以偵測患者腦中的澱粉蛋白斑塊[300],若結果顯示為陰性,表示澱粉斑塊不存在或數量極為稀少,那麼就可以考慮排除阿茲海默氏病[301]。2017年一項大型研究亦顯示類澱粉斑塊追跡藥物對於輕度失智患者的臨床決策有幫助[302]。
而類澱粉蛋白顯影技術與掃描其他生物標記的技術能相輔相成,並不互相取代[303]。計量型的核磁共振影像可以用計算體素的方式估計特定腦區的容量。當阿茲海默氏病的病程持續進行,測量萎縮的腦區是否有所變化,是相當重要的診斷指標。目前許多研究都認為比起其他醫學影像的方式,這很有可能會提供較為平價的選擇[304]。
目前針對Tau蛋白顯影的追蹤藥物,以氟-18標記的flortaucipir(Tauvid,AV-1451 F18)已被FDA允許用於Tau蛋白的正子電腦斷層掃描診斷[305]。
現在對阿茲海默氏病的研究致力於在徵狀發生前診斷出病情[306]。目前已經發展出一些可用於早期檢驗的生物化學方法,這些檢驗包括分析腦脊液中β-澱粉樣蛋白、tau蛋白與tau181P(磷酸化tau蛋白)總量的濃度測定。但因為抽取腦脊髓液的過程十分疼痛,應避免重複抽取。檢測血液中循環的miRNA與發炎指標則是具有潛力的替代指標。[307]
參考文獻
延伸閱讀
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.