蛋白質摺疊(英語:Protein folding)是蛋白質獲得其功能性結構和構象的物理過程。通過這一物理過程,蛋白質從無規則捲曲摺疊成特定的功能性三維結構[1]。在從mRNA序列轉譯成線性的氨基酸鏈時,蛋白質都是以去摺疊多肽或無規則捲曲的形式存在。
此條目需要擴充。 (2007年9月26日) |

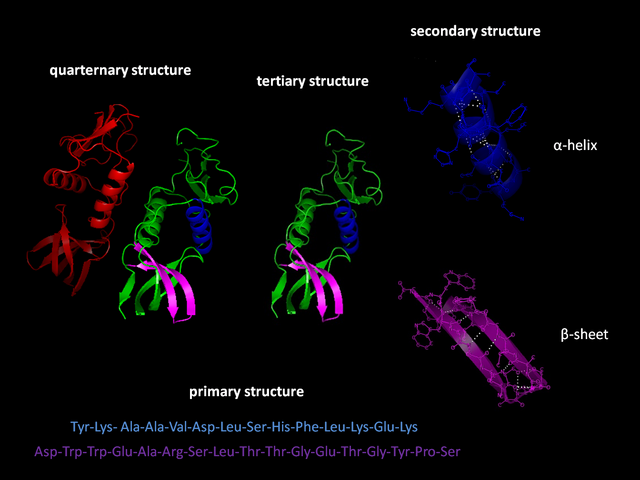
蛋白質的基本單位為氨基酸,而蛋白質的一級結構指的就是其氨基酸序列。蛋白質會由所含氨基酸殘基的親水性、疏水性、帶正電、帶負電等特性通過殘基間的相互作用而摺疊成一立體的三級結構。
根據克里斯琴·B·安芬森(1972年的諾貝爾化學獎得主)的研究,蛋白質可由加熱或置於某些化學環境而變性,三級結構解體;而當環境回復到原本的狀態時,蛋白質可於不到一秒的時間折疊至原先的立體結構,不論試驗幾次,蛋白質都僅此一種立體結構,於是安芬森提出一個結論:蛋白質分子的一級結構決定其立體結構(安芬森法則)[2]。
安芬森的研究結果非常重要,因為蛋白質的功能取決於其立體結構,而目前根據已知某基因序列可轉譯獲得對應蛋白質的氨基酸序列,即蛋白質的一級結構;如果從蛋白質的一級結構就能知道立體結構,那麼即可直接從基因推測其編碼蛋白質所對應的生物學功能。雖然蛋白質可在短時間中從一級結構摺疊至立體結構,研究者卻無法在短時間中從氨基酸序列計算出蛋白質結構,甚至無法得到準確的三維結構。因此,研究蛋白質摺疊的過程,可以說是破譯摺疊密碼的過程。
目前蛋白質的再摺疊依然遵從先使用胍或脲變性,然後逐漸降低胍或者脲的濃度,也就是逐漸降低對蛋白質天然「回縮」能力的干擾。使其自然回到天然的最低能量狀態。只是這個過程無法很好的控制肽鏈與肽鏈之間和肽鏈內部形成錯誤摺疊的干擾。
摺疊與氨基酸序列之間的關係
蛋白質的氨基酸序列決定於氨基酸的特性。蛋白質在生物合成的過程或是生物合成結束後進行折疊。蛋白質摺疊受到許多環境因素的影響,例如:溶劑(水、脂類雙層),鹽的濃度、pH值、溫度。可能會出現輔助因子(cofactor)或伴侶因子(chaperon)。
盡量減少疏水性蛋白暴露在水中,對蛋白質摺疊來說是一個很好的驅動力,分子內的氫鍵則可以穩定蛋白質結構。氫鍵強度與環境有關,因此在自然情況下,被包覆於疏水性核心的氫鍵和存在於充滿水環境下的氫鍵比起來,對於穩定性的貢獻較多。
摺疊與轉譯是同時進行的(co - translationly),因此蛋白質的C端被核糖體(ribosome)製作出來,N端同時進行折疊的過程。特化的蛋白:伴侶因子可以使蛋白質不與其他蛋白作用(防止非特定區域結合)。最好的例子就是Gro-EL系統,能夠阻礙蛋白質非特定區域折疊的球蛋白(globular protein)。在真核生物中,伴侶因子稱作熱休克蛋白(heat shock protein)。即使球蛋白可以在沒有任何輔助的情形下防止蛋白質非特定區域摺疊,伴侶因子的作用在細胞內部還是需要的。伴侶因子也可以防止蛋白質在細胞高溫或其他環境下產生錯誤的折疊或聚集。
目前兩種蛋白質摺疊有兩種模型:
- 擴散碰撞模型(diffusion collision model),細胞核形成之時,蛋白質也同時形成二級結構,接着這些二級結構碰撞再一起並緊緊的包住。
- 成核縮合模型(nucleation-condensation model),二級和三級結構同時形成。近期的學說顯示出某些蛋白具有以上的折疊現象。
大多數的科學家已能研究出許多相同的蛋白,將其聚合在一起。不論蛋白質是在惡劣的環境或是在天然狀態下,氨基酸摺疊過程大致上還是一樣的,通常會先摺疊成一般二級結構(secondary structure)或超二級結構(supersecondary structure),尤其是α-螺旋結構(alpha heliex)和β-摺疊結構(beta sheet),之後再形成三級結構,若要形成四級結構則必須要和其他摺疊完成的結構進行組裝。一般的 α螺旋結構和β摺疊結構很快就可以快速折疊因為有分子內的氫鍵穩定其結構,此現象第一個發現者為萊納斯·鮑林(Linus Pauling)。蛋白質摺疊另外還有共價鍵結參與──兩個半胱氨酸(cysteine)間形成的雙硫鍵 (disulfide bridges)或是金屬的聚集(metal clusters)。為了使能量達到穩定分子會形成中間產物:熔球(molten globule)型態。 事實上,每個蛋白質的氨基酸序列都含有在蛋白質在特定狀態摺疊的訊息,這並不表示的氨基酸折疊方式都是一樣的。蛋白質折疊的構型也受到環境的影響,相同的蛋白在不同的環境下也會產生不同的折疊結構。摺疊是一個不需消耗能量的自發性過程,摺疊主要是由蛋白質的疏水作用主導,形成分子內氫鍵、凡德瓦力。
自然狀態的阻擾
蛋白質在某些情況下會形成有別於一般生物摺疊的摺疊結構,當環境的溫度超出或低於細胞所能承受的溫度時,會造成蛋白質的展開(unfold)或是變性,這同時也是蛋白在沸水中變得不透明的原因。高濃度溶液、極端的酸鹼值、機械性影響以及其他會使蛋白質變性的溶劑都會造成類似的影響。但是,蛋白質的熱平衡常數相當高(即高溫才會產生變性的現象)。以超級嗜熱菌(hyperthermophilic bacteria)為例,其可在其高溫度122℃生存,其體內重要的蛋白質間的組合,在此溫度或更高溫時仍然能夠維持的相當穩定。
一個已完全變性的蛋白質缺乏三級結構與四級結構,形成所謂的隨機螺旋(random coil),特定情況下蛋白質可以再次摺疊(refold),然而,蛋白質的變性往往是不可逆的。細胞有時候會產生酵素──伴侶因子或熱休克蛋白來預防蛋白質在高溫中變性,伴侶因子或熱休克蛋白可以抵抗蛋白質的不正常摺疊與維持、協助正常摺疊。有些蛋白質因為彼此間不會有交互作用或其功能為幫助未摺疊或摺疊錯誤的蛋白質二度摺疊,因此伴侶因子不會阻止此類蛋白質摺疊。此現象亦可防止蛋白質沉澱以及防止蛋白質產生不規則形狀的結晶。
外在因子對蛋白質摺疊的影響
許多外在因子像是溫度、電場、磁場、分子的堆積,空間限制對於蛋白質的摺疊會有很大的影響。[3] 外在因子若對蛋白質局部極小修飾,亦可引發蛋白質產生不一樣的摺疊方式。 蛋白質摺疊對於蛋白質來說是一個很好的調整過程,不同原子間的氫鍵所提供的力量是必要的,疏水性蛋白間的疏水性作用包覆住疏水性殘基(residue)。
摺疊密碼
決定蛋白質如何摺疊為特定的三級結構的因素稱為摺疊密碼(英語:folding code)。肽鏈被轉譯出來後,多條肽鏈能自行摺疊成蛋白質。但其可能因為環境因素導致摺疊錯誤,需要分子伴侶正確摺疊。[4]因此摺疊密碼並不是決定蛋白質摺疊的唯一因素。
蛋白質摺疊的預測
此法在假設摺疊後蛋白質的分子構象為熱力學最穩定,能量最低狀態的基礎下,使用分子力學的能量極小化方法,預測對象摺疊後的結構。
此法先從已有的蛋白質一級與三維結構之關係找到規律,再用該規律推測出對象摺疊後的結構。
蛋白酶解(Proteolysis)
蛋白酶解經常用於探測出在廣泛的溶液情況中(有許多影響因子)分離出沒有被摺疊的蛋白質。快速並行蛋白酶解便是一個很好的例子。
蛋白的不正確摺疊與神經退化症
有些不正常的蛋白聚集與許多疾病相關。
朊毒體相關的例如:克雅二氏症(Creutzfeldt-Jakob disease),又稱作海綿狀腦症(bovine spongiform encephalopathy)。又如牛腦海綿狀病變。
澱粉樣蛋白相關的疾病例如:阿茲海默症(Alzheimer's disease)、家族性澱粉樣蛋白心肌病(familial amyloid cardiomyopathy)以及多發性神經病變(polyneuropathy),還有細胞質(包漿)內聚集的疾病,例如:亨丁頓舞蹈症(Huntington's disease)及帕金森氏症(Parkinson's disease)。這些退化性的疾病起因皆與蛋白質的聚集並摺疊錯誤使其不溶於水有關,胞外聚集或包裹在胞內形成 交叉β折疊澱粉樣纖維(cross-beta sheet amyloid fibrils)。截至目前並不完全清楚這些不正常的蛋白質聚集現象是造成蛋白質失衡的主因還是只是蛋白質失衡所產生的反應。
參考文獻
參閱
外部連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
