молекул који носи генетске информације From Wikipedia, the free encyclopedia
Дезоксирибонуклеинска киселина (ДНК), нуклеинска је киселина која садржи упутства за развој и правилно функционисање свих живих организама. Заједно са РНК и протеинима, ДНК је један од три главна типа макромолекула који су есенцијални за све познате форме живота. Сва жива бића свој генетички материјал носе у облику ДНК, са изузетком неких вируса који имају рибонуклеинску киселину (РНК). ДНК има веома важну улогу не само у преносу генетичких информација са једне на другу генерацију, већ садржи и упутства за грађење неопходних ћелијских органела, протеина и РНК молекула. ДНК сегмент који преноси ова важна упутства се назива ген.[1]

У еукариотима, организмима као што су животиње, биљке, гљиве и протисте, највећи број ДНК молекула се налази у једру ћелије, а мањи број је у органелама, као што су митохондрије или хлоропласти.[2] У прокариотима (нпр. бактеријама) ДНК се налази у цитоплазми ћелије. За разлику од ензима, ДНК молекул не утиче директно на друге молекуле, већ различити ензими сарађују са ДНК и реализују информације било у облику РНК молекула или у облику протеина. Овакав однос је део централне догме молекуларне биологије.[3]
Ћелије садрже ДНК организован у дуге структуре које се зову хромозоми. Током припреме за ћелијску деобу хромозоми се дуплирају процесом репликације ДНК, тако да свака од новонасталих ћелија има комплетан сет хромозома. У хромозомима, хроматински протеини, као што су хистони, организују ДНК на такав начин да молекул постаје веома компактан и може да стане у ћелије које су на хиљаде пута мање од расплетених ДНК молекула. Ове компактне структуре условљавају интеракције између ДНК и других протеина, и помажу у контролисању делова ДНК који се транскрибују.[4]
ДНК је дугачак полимер, састављен од мањих јединица које се називају нуклеотиди. ДНК се састоји од два полимерна ланца који имају антипаралелну оријентацију. Међусобно повезани нуклеотиди чине скелет ДНК молекула формиран од шећера дезоксирибозе и фосфатних група. Овај скелет такође садржи четири различите нуклеобазе, везане за дезоксирибозу. Редослед ове четири базе је основа кодирања генетичког материјала. Информација се чита користећи генетички код, којим се специфицира секвенца аминокиселина у протеинима. Код се чита копирањем делова ДНК у молекуле РНК у процесу који се назива транскрипција.

ДНК молекул је дугачак полимер који се састоји од нуклеотида, јединица које се понављају.[6][7][8] Нуклеотиди су веома мале јединице, међутим, ДНК молекул се састоји од милиона нуклеотида, што га чини веома дугим. Највећи људски хромозом се састоји од 440 милиона нуклеотида, односно 220 милиона парова.[9] База која је повезана са шећером назива се нуклеозид, док база која је повезана са шећером и једном или више фосфатних група се назива нуклеотид.[10] Када је више нуклеотида међусобно повезано, као нпр. у ДНК молекулу, тај полимер се онда назива полинуклеотидни ланац.[11]
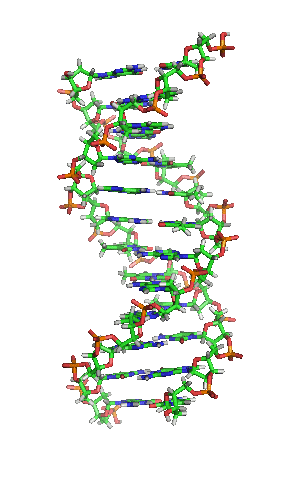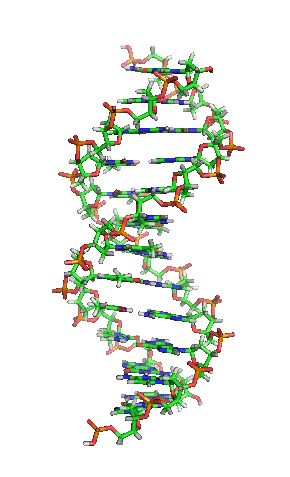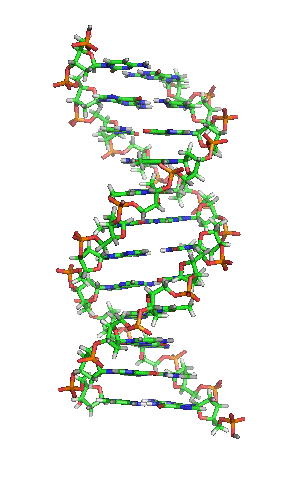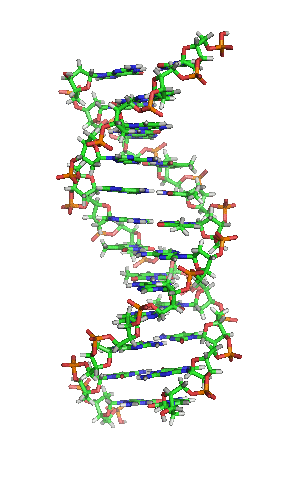
Вотсон и Крик су 1953. показали да је у живим организмима ДНК молекул састављен од два полинуклеотидна ланца који су спирално увијени један око другог. За то откриће су награђени Нобеловом наградом. Вертикална дужина сваког обртаја спирале је 34 ангстрема (3,4 ) и пречник је 10 ангстрема (1,0 ).[12][13] Према једној другој студији, када се мерење изврши у одређеном раствору ДНК ланац је 22 до 26 широк ангстрома (2,2 до 2,6 ), и једна нуклеотидна јединица доприноси дужини са 3,3 Å (0,33 ).[14]
Шећер у ДНК молекулу је пентоза (назван тако јер садржи пет угљеникових атома) 2-дезоксирибоза (РНК молекул се састоји од шећера рибозе, отуда и пун назив рибонуклеинска киселина). Шећери су међусобно повезани фосфатним групама које стварају фосфодиестарску везу између трећег и петог угљениковог атома шећерног прстена. Фосфодиестарске везе су асиметричне, те ДНК полинуклеотидни ланци имају смер. Како ови ланци иду у супротним смеровима, каже се да је ДНК антипаралелна. Асиметрични крајеви ДНК база се означавају са 5' (пет прим) и 3' (три прим). Антипаралелност значи да један ланац иде у смеру 5'→ 3', док супротни ланац иде у смеру 3'→ 5'. Спирални ланац који чини ДНК се одржава у том облику помоћу водоничних веза између парова база.[15] У ДНК молекулу постоје четири базе Аденин (), Цитозин (), Гуанин () и Тимин ():[13]
Четири базе су међусобно комплементарне: аденин () једног ланца је увек у пару са тимином () наспрамног ланца, и повезани су двема водоничним везама. Гуанин () једног ланца је увек у пару са цитозином () наспрамног ланца, и повезани су трима водоничним везама. Сваки пар база ротира у односу на суседни за 36°, тако да сваки обртај спирале два полинуклеотидна ланца чине десет парова база ( и ). Полинуклеотидни ланци ротирају у правцу супротном од казаљки на сату.
Базе су подељене у две групе — пуринске (аденин и гуанин) и пиримидинске (цитозин и тимин). Урацил () база која се налази у РНК молекулу и која замењује тимин, припада пиримидинској групи. Једина разлика између тимина и урацила је недостатак једне метил-групе код урацила. Урацил је стандардна база РНК молекула, и не постоји као таква у ДНК молекулу. Једини, тренутно познати, изузетак је бактеријски вирус који у свом ДНК молекулу има урацил као саставну базу[16]. Осим РНК и ДНК велики број вештачких аналога нуклеинских киселине је креиран ради студирања особина нуклеинских киселина, као и за примену у биотехнологији.[17]

Два комплементарна хеликсна ланца формирају основу ДНК молекула. Препознатљив је и двоструки хеликс који прати отворе, или жлебове, између ланаца. Та удубљења су непосредно поред парова база, те могу да служе као места везивања протеина и малих молекула. Пошто ланци нису директно насупрот један другом, жлебови немају једнаку величину. Велики жлеб је 22 Å широк, док мали жлеб има 12 Å.[21] Постоји низ изузетака, првенствено у случајевима необичних ДНК конформација. Називи велики и мали жлеб се увек односе на разлике у величини удубљења кад је ДНК у обичној форми.
Базе малог жлеба су на подеснијем растојању за везивање лиганда, него базе великог жлеба. Из тог разлога, протеини попут транскрипционих фактора који се везују за специфичне секвенце двоструког ДНК хеликса обично формирају водоничне везе са изложеним странама база малог жлеба.[22]
Секундарна структура ДНК је подложна денатурацији. Под денатурацијом се подразумева нарушавање секундарне структуре тако да се дволанчани ДНК молекул раздваја на два полинуклеотидна ланца. Под одговарајућим условима може доћи до ренатурације, тј. до поновног спајања комплементарних ланаца ДНК.[23] Процеси денатурације и ренатурације одигравају се и у ћелији под контролисаним условима и у ограниченом обиму. Ти процеси представљају неопходан предуслов за нормално функционисање ДНК, односно за њену репликацију и транскрипцију.
Када се у раствору нађу два полинуклеотидна ланца који имају комплементарне редоследе нуклеотида, наградиће се хибридни дволанчани молекул.[24][25] Денатурисана ДНК може да хибридизује са денатурисаном ДНК исте или различите врсте, или са РНК. Хибридизација је нашла веома широку примену у истраживањима у молекуларној биологији и представља једну од основних техника генетичког инжењеринга.

 |
 |
Свака база једног ланца се спарује само са једном базом на наспрамном ланцу. Овакво спаривање се назива комплементарно спаривање. Пурин се спарује са пиримидином водоничним везама, те се А спарује само са Т (двема водоничним везама) и само са (са три водоничне везе). Како водоничне везе нису ковалентне, оне се лако раскидају и лако поново формирају. Ове везе се раскидају или механичким силама (нпр. током репликације) или високом температуром.[26] Две водоничне везе се лакше раскидају од три. Овај податак је битан ако секвенца ДНК молекула није унапред позната. Кад је секвенца ДНК молекула непозната, у молекуларној биологији се између осталог примењује техника која користи температуру. Што је температура виша, то се ДНК молекул теже раскида, те се може претпостави да тај молекул ДНК има велики број Ц и Г база (и.е. висок -садржај). ДНК са високим -садржајем је стабилнија од ДНК са ниским -садржајем.[27]
Директна последица нуклеотидне комплементарности је да су информације у дволанчаној секвенци ДНК хеликса дуплиране, што је витално за репликацију молекула. Ова реверзибилна и специфична интеракција између комплементарних парова база је критична за све функције ДНК у живим организмима.[7]
Као што је горе напоменуто, већина ДНК молекула се састоји од два полимерна ланца, спојена у хеликсну структуру нековалентним везама. Ова дволанчана структура () се у знатној мери одржава посредством интеракција међуланчаног слагања база, које се најјаче за стекове. Два ланца се могу раздвојити у процесу познатом као топљење, чиме се формирају два молекула (). До топљења долази кад су услови подесни, као што су високе температуре, ниске концентрације соли и високе вредности (низак такође отапа ДНК, али пошто је ДНК нестабилна услед денатурације киселине, низак се ретко користи).
Стабилност форме зависи не само од -садржаја (% базних парова) него и од секвенце (пошто је формирање стекова зависно од ње), као и од дужине (дужи молекули су стабилнији). Стабилност се може мерити на различите начине. Уобичајен приступ је мерење температуре топљења (она се још назива Тм вредност), што је температура на којој се 50% дволанчаних молекула конвертује у једноланчане молекуле. Настали једноланчани ДНК молекули немају јединствен заједнички облик, мада су неке конформације стабилније од других.[28] Температура топљења је зависна од јонске снаге и ДНК концентрације. Консеквентно, садржај и дужина двоструког ДНК ланца одређују јачину асоцијације између ланаца. Дуги ДНК хеликси са високим садржајем имају ланце са јачим интеракцијама, док кратки хеликси са високим AT садржајем имају ланце са слабијим интеракцијама.[29] У биологији, делови ДНК двоструких хеликса који се лако раздвајају, као што је TATAAT Прибнов-кутија у неким промотерима, теже да имају висок AT садржај.[30][31][32]

ДНК секвенца се назива смисаоном (енгл. ) (негативна (-)), ако је њена секвенца иста као и секвенца иРНК копије која се транслира у протеин.[33] Комплементарна секвенца супротног ланца се назива антисмисаона (позитивна (+)') секвенца. Обе секвенце могу да постоје на различитим деловима истог ДНК ланца (и.е. оба ланца могу да садрже обе смисаоне и антисмисаоне секвенце). Понекад се фраза кодирајући ланац среће. Међутим, кодирајућа и некодирајућа РНК могу да буду транскрибоване на сличан начин са оба ланца. У неким случајевима до транскрипције долази у оба правца почевши од заједничког промотерског региона, или до транскрипције може доћи унутар интрона, на оба ланца.[34][35][36]
Код прокариота и еукариота, антисмисаоне РНК секвенце се формирају, мада функција тих молекула није потпуно јасна.[37] Једна од претпоставки је да антисмисаони РНК молекули учествују у регулацији експресије гена путем РНК-РНК спаривања база.[38]
Код малог броја ДНК секвенци прокариота у еукариота, и нешто већег броја плазмида и вируса, разлика између смисаоних и антисмисаоних ланаца је замагљена преклапањем гена.[39] У тим случајевима, неке ДНК секвенце имају двоструку улогу. Оне кодирају један протеин кад се читају дуж једног ланца, и други протеин кад се читају у супротном правцу дуж другог ланца. Код бактерија, ово преклапање може да учествује у регулацији транскрипције гена,[40] док код вируса, преклапајући гени повећавају количину информације која може да буде кодирана унутар малог виралног генома.[41]

| Нуклеозом | |||||
|---|---|---|---|---|---|
 | |||||
| Кристална структура нуклеозома. Протеинске компоненте су и . Поглед је одозго кроз суперхеликсну осу. (1KX5 1KX5)[42] | |||||
| Идентификатори | |||||
| Симбол | Histone | ||||
| Пфам | PF00125 | ||||
| Пфам клан | CL0012 | ||||
| ИнтерПро | IPR007125 | ||||
| СКОП | 1hio | ||||
| |||||
Готово код свих прокариота, ДНК је кружни молекул саграђен од два спирално увијена полинуклеотидна ланца. Код еукариота организација ДНК молекула је нешто компликованија. ДНК молекул је веома дугачак, у просеку до 1,8 m. Молекул те дужине мора да стане у ћелије које су веома мале и не могу да се виде голим оком. Ћелије морају да веома компактно спакују ДНК молекул. То омогућавају протеинима који се зову хистони.[43]
Хистони су мали, веома базни протеини, богати амино киселинама као што су лизин и аргинин. Они су главне протеинске компоненте хроматина, које делују као калеми око којих се намотава ДНК. Они учествују у регулацији генске активности. Без хистона, несавијена ДНК у хромозомима би била веома дугачка (однос дужине и ширине је већи од 10 милиона код људске ДНК). ДНК намотана на хистоне производи око 90 микрометара (0.09 ) хроматина, који се дуплира и кондензује током митозе, дајући око 120 микрометара хромозома.[44]
У еукариотским ћелијама је постоји пет типова хистона: , , , и .[45][46] Хистони су у директном контакту са ДНК молекулом. Осам хистона (по два ), стварају структуре које изгледају као диск. Структура ДНК молекула обавијеног око диска се назива нуклеозом. Око сваког диска ДНК молекул се обавије 1,65 пута, у дужини од 147 базних парова (А-Т и Ц-Г), формирајући леворуки суперхеликсни намотај.[47] Тако увијени ДНК молекул се обавије око преосталог хистона , који не формира структуру у облику диска, већ служи само као веза до следећег диска (изграђеног од горепоменутих хистона) и поново се обавија око следећег диска.[48] Хистон омогућава формирање структуре вишег реда. Најосновнија таква формација је влакно пречника 10 . Гледано кроз микроскоп свеукупна оваква структура изгледа као перлана огрлица. Ово укључује паковање ДНК око нуклеозома са око 50 базних парова између њих (ти сегмент се називају линкер ДНК).
Основа нуклеозома је формирана од два димера и тетрамера. Они формирају две скоро симетричне половине терцијарне структуре, са симетријом, где је један макромолекул слика у огледалу другог молекула.[47] Четири основна хистона ( и ) имају релативно сличне структуре и високо су очувани током еволуције. Сви имају хеликс обрт хеликс обрт хеликс мотив (који омогућава лаку димеризацију). Они исто тако имају дуге репове на једном од крајева аминокиселинског ланца, на којима долази до низа посттранслационих модификација.
Сматра се да су хистонски протеини еволуционо сродни са хеликсним делом продуженог ААА+ АТПазног домена,[49][50] -домена, и са -терминусним доменом препознавања супстрата протеина.[51][52] Упркос разликама у њиховој топологији, они имају хомологан хеликс-раван-хеликс () мотив.[53]
Користећи технику спин-обележене електронске парамагнетне резонанце, Британски истраживачи су измерили растојање између намотаја око којих еукариотске ћелије намотавају своју ДНК. Утврђено је да су растојања у опсегу од 59 до 70 Å.[54]
Хистони формирају пет типова интеракција са молекулом ДНК:
Високо базна природа хистона, осим што омогућава ДНК—хистон интеракције, доприноси њиховој растворљивости у води.


ДНК може да буде увијена попут канапа процесом који се назива суперспирализација ДНК. Кад је ДНК у свом „опуштеном” стању, ланци обично обиђу осу двоструког хеликса једном свака 10,4 базна пара, док ако је ДНК упредена ланци постају више или мање збијени.[55] Када је ДНК упредена у правцу хеликса, у питању је позитивна суперспирализација и базе су ближе једна другој. Ако је ДНК упредена у супротном правцу (негативна суперспирализација), базе се лакше растављају. У природи, ДНК је најчешће благо негативно суперспирализована. То се остварује ензимима који се зову топоизомеразе.[56] Ти ензими су исто тако потребни за отпуштање напрезања услед ДНК увијања насталог током процеса транскрипције и репликације ДНК.[57][58]
Хромозоми могу да буду веома велики, те средишњи сегменти могу да се понашају као да су крајеви учвршћени. Резултат тога је да они не могу да расподеле сувишне намотаје на остатак хромозома, или да апсорбују завијање да би се опоравили од одвијања, те сегменти могу да постану суперспирализовани. У одговору на суперспирализацију они ће бити изложени напрезању, као да су крајеви спојени.
Суперспирализација ДНК је важна за њено паковање унутар ћелија. Дужина неспирализоване ДНК је хиљадама пута већа од дужине ћелије, те је паковање генетичког материјала унутар ћелије или једра (код еукариота) комплексан задатак. Суперспирализација ДНК редукује потребни простор и омогућава паковање знатно веће количине ДНК. Код прокариота, плектонемски супернамотаји су предоминантни, зато што је хромозом најчешће кружног облика и садржи релативно малу количину генетичког материјала.[59][60][61][62][63] Суперспирализација ДНК код еукариота се јавља на више нивоа плектонемских и соленоидних супернамотаја, при чему се соленоидна суперспирализација показује најефективнијом у збијању ДНК молекула. Соленоидна суперспирализација се остварује путем хистона и формира се влакно пречника 10 . Ово влакно се даље намотава у 30 широко влакно, које се даље намотава на само себе више пута.[64][65][66]
ДНК паковање се одвија у знатно повећаној мери током деобе једра у процесима митозе или мејозе, при којим се ДНК мора поделити и сажети у новонасталим ћелијама. Кондензини[67][68] и кохезини[69][70][71] су протеини за структурно одржавање хромозома који помажу у кондензацији хроматида и везивању њихових центромера. Ти протеини индукују позитивну суперспирализацију.[72][73][74]



ДНК може да постоји у мноштву могућих конформација међу којима су А-ДНК,[75] Б-ДНК,[76][77][78] и З-ДНК форме[79][80], мада су једино Б-ДНК и З-ДНК директно примећене у функционалним организмима.[10] Конформација коју ДНК поприма зависи од нивоа хидратације, ДНК секвенце, количине и правца супернамотавања, хемијских модификација база, типа и концентрације металних јона, као и присуства полиамина у раствору.[81]
Први објављени извештаји о Рендгенској структури А-ДНК и Б-ДНК форми су користили анализу базирану на Патерсоновој трансформацији која даје само ограничену количину структурне информације о оријентацији ДНК влакана.[82][83][84] Један алтернативни аналитички приступ су предложили Вилкинс ет ал. 1953, за ин виво Б-ДНК дифракцију X-зрака/распореда максимума расејавања високо хидратисаних ДНК влакана базиран на квадратима Баселових функција.[85] У истом журналу, Џејмс Д. Вотсон и Франсис Крик су објавили њихову анализу молекулског моделовања ДНК дифракционих образаца X-зрака и предложили структуру двоструког хеликса.[12]
Мада је Б-ДНК форма најчешћа под условима који владају у ћелијама,[86] она није добро дефинисана конформација него је фамилија сродних ДНК конформација[87] која се јавља при високим нивоима хидратације присутним у живим ћелијама. Њихови одговарајући рендгенски дифракциони обрасци расипања су карактеристични за молекулске паракристале са знатним степеном нереда.[88][89]
У поређењу са Б-ДНК, А-ДНК форма је шира деснорука спирала, са плитким, широким главним жлебом и ужим, дубљим малим жлебом. А форма се јавља под нефизиолошким условима у парцијално дехидратисаним ДНК узорцима, док се у ћелији може формирати при хибридном спаривању ДНК и РНК ланаца,[90][91][92] као и у ензим-ДНК комплексима.[93][94] Сегменти ДНК где су базе хемијски модификоване метилацијом могу да подлегну већим конформационим променама и да поприме З форму. Овде, ланци формирају леворуку спиралу око хеликсне осе, што је супротно уобичајеној Б форми.[95] Те необичне структуре се могу препознати по специфичним З-ДНК везујућим протеинима. Оне могу да учествују у регулацији транскрипције.[96][97][98][99][100][101]

Током дужег низа година егзобиолози су предлагали постојање једне алтернативне биосфере која користи радикално различите биохемијске и молекулске процесе него тренутно познате животне форме. Једна од претпоставки је била постојање животног облика који користи арсеник уместо фосфора у ДНК.
На једној конференцији за штампу НАСА је децембра 2010. изјавила да бактерија , која је еволуирала у окружењу богатом у арсенику, прва земаљска животна форма која можда има ту способност.[102] Бактерија је нађена у језеру Моно, источно од Јосемитског националног парка. је штапићаста екстремофилна бактерија из фамилије , која у одсуству фосфора можда има способност инкорпорисања обично отровног елемента арсена у свој ДНК.[103] Ово откриће иде у прилог дугогодишњој идеји да би ванземаљски живот можда могао да има различиту биохемијску основу од живота на Земљи.[103][104] Истраживања је извео тип предвођен Фелисом Волф-Симон, која је геомикробиолог и геобиохемичар на НАСА астробиолошком институту при Државном универзитету Аризоне.
Овај налаз је наишао на јак критицизам у научној заједници. Научници тврде да нема доказа да је арсеник заправо инкорпориран у биомолекуле.[104][105] Микробиолог Јохан Хајдер је критиковао презентоване резултате студије. Он је упутио на могуће грешке у мерењу као и на погрешну интерпретацију резултата студије. По њему је, у оригиналној публикацији аутора поменуто загађење узорака остацима фосфата, који су вероватно присутни у довољној количини за основно снабдевање бактерија.[106] Независно потврђивање овог до сад није било могуће.




На крајевима линеарних хромозома су специјализовани региони ДНК који се називају теломере.[108][109][110] Главна функција тих региона је да се омогући ћелији да репликује крајеве хромозома користећи ензим теломеразу, пошто ензими који нормално репликују ДНК не могу да копирају екстремне 3’ крајеве хромозома.[111][112] Ти специјализовани хромозомски завршеци такође помажу у заштити ДНК крајева, и спречавају системе за поправку ДНК у ћелији да их третирају као оштећења која треба поправљати.[113][114][115] У људским ћелијама, теломере су обично сегменти једноланчане ДНК који се састоје од неколико хиљада понављања једноставне секвенце.[116][117][118]
Ове гуанином богате секвенце могу да стабилизују хромозомске крајеве формирањем структура свежњева јединица са четири базе, уместо уобичајених базних парова ДНК молекула. Овде, четири гуанинске базе формирају равну површину, и те равне четворобазне јединице се затим слажу једна на другу да формирају стабилне Г-квадруплексне структуре (Г-тетраде Г4-ДНК).[119][120] Ове структуре су стабилизоване водоничним везивањем између база и хелацијом металног јона у центру сваке четворобазне јединице.[121] Низ других структуре се може формирати, са централним сетом од четири базе које долазе било из једног ланца савијеног око база, или неколико различитих паралелних ланаца, при чему сваки доприноси једну базу централној структури.
Осим ових стекованих структура, теломере исто тако формирају структуре са великим петљама које се називају теломерне петље, или Т-петље. Овде се једноланчана ДНК склупча у већи круг стабилизованом протеинима који се везују за теломере.[122] На самом крају Т-петље, једноланчана теломерна ДНК је спојена са регионом дволанчане ДНК тако што теломерни ланац делом ремети структуру ДНК двоструког хеликса и базно се спарује са једним од два ланца. Ова троланчана структура се назива депласманска петља или Д-петља.[119]
Квадруплекси се јављају не само у теломерама, него и на другим локацијама. На пример, за протоонкоген је показано[123][124] да формира квадруплекс у нуклеазном хиперсензитивном региону[125][126], који је критичан за активност гена.[127] Након тог иницијалног открића, за многе друге гене је нађено да имају Г-квадруплексе у њиховим промотерским регионима.[128] Неки од њих су живински β-глобински ген,[129][130][131] људска убиквитинска лигаза [132][133][134] и протоонкогени [138][139][140], ,[141][142][143] [[Ras potfamilija|-{H-ras}]]-[144][145][146] и .[147][148][149]
Идентификација и предвиђање секвенци које имају способност формирања квадруплекса је важан корак у разумевању њихове улоге. Генерално једноставни обрасци се користе за претрагу могућих квадруплекс формирајућих секвенци: , при чему је база (укључујући гуанин).[150][151] Ово правило је нашло широку примену у онлајн алгоритмима.
Прегледи целокупног генома базирани на правилу налажења квадруплекса су идентификовали 376.000 могућих квадруплексних секвенци () у људском геному. Знатан број њих се вероватно не формира ин виво.[151] Једна слична студија је идентификовала могуће Г-квадруплекс код прокариота.[152] Постоји више модела који објашњавају како квадруплекси могу да контролишу активност гена. Један модел показује да формирање Г-квадруплекса на или близо промотера блокира транскрипцију гена, и тиме га деактивира.[153][154][155] У једном другом моделу квадруплекс формиран на некодирајућем ДНК ланцу помаже у одржавању отворене конформације кодирајућег ДНК ланца, те поспешује експресију респективног гена.[156][157][158]
Један начин индуковања или стабилизовања Г-квадруплексних формација, је увођење молекула који се могу везати за Г-квадруплексне структуре.[159][160] Познати су бројни лиганди, мали молекули и протеини који имају ту способност. Знатан број протеина који се јавља у природи се селективно везује за Г-квадруплексе. Међу њима су хеликазе,[161][162][163] које су имплициране у Блумов[164][165] и Вернеров синдром[164][166], и протеин из .[167][168][169] Развијен је протеин са доменом цинковог прста[170] који се назва ,[171][172][173] као и специфична антитела.[174][175][176]
Познато је да се катјонски порфирини везују за Г-квадруплексе,[177][178][179] као и молекул теломестатин.[180][181][182]
 |
 |
| Једна грана | Вишеструко гранање |
До ДНК крзања долази кад некомплементарни региони постоје на једном или оба краја иначе комплементарне дволанчане ДНК. Разграната ДНК се може јавити ако се уведе трећи ДНК ланац који има способност хибридизације са отвореним ДНК сегментима дволанчане ДНК. Најједноставнији пример разгранавања је троланчана ДНК. Комплекси са додатним ланцима и вишеструким гранањем су такође познати.[184] Разграната ДНК налази примену у нанотехнологији.
Тест разгранате ДНК је тест амплификације сигнала (за разлику од теста амплификације биолошке мете) који се користи за детектовање молекула нуклеинских киселина.[185] Овај тест се може користити за детектовање и квантификацију многих типова РНК или ДНК. У тесту се разграната ДНК помеша са тестираним узорком. Детекција се врши користећи нерадиоактивни метод. Претходна амплификација нуклеинске киселине није неопходна. Тест је у потпуности завистан од хибридизације. Ензими се користе за одређивање степена хибридизације, али се не користе за манипулацију нуклеинских киселина. Мале количине нуклеинске киселине се могу детектовати и квантификовати без корака реверзне транскрипције (у случају РНК) и/или .[186][187] Тест је подесан за употребу у високо проточном моду, за разлику од квантитативног [7][188] или теста РНК протекције.[189]
ДНК може да изводи ниско фреквентно колективно кретање. Оно се може мерити Рамановом спектроскопијом[190][191] и анализирати применом модела квази континуума.[192][193]
 |
 |
 |
| Цитозин | 5-метилцитозин | Тимин |
  |
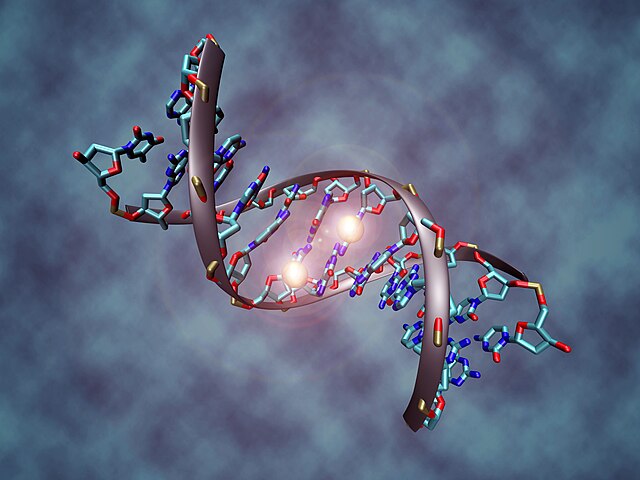
Експресија гена је зависна од начина на који је ДНК пакована у хромозомима, у структурама званим хроматини. Модификације база могу да утичу на паковање. Региони који имају низак ниво или одсуство експресије обично садрже високе нивое метилације цитозинских база.[203] На пример, цитозинска метилација, производи 5-метилцитозин, који је важан за инактивацију X-хромозома.[204]
Просечни нивои метилације варирају између организама. Црв не испољава цитозинску метилацију,[205][206] док кичмењаци имају високе нивое. До 1% њихове ДНК садржи 5-метилцитозин.[207]
ДНК метилација је кључни део нормалног развоја организма и ћелијске диференцијације виших организама. ДНК метилација стабилно мења обрасце генског изражавања у ћелијама тако да оне могу да „запамте где су биле” или да умање експресију гена. На пример, ћелије програмиране да буду Лангерхансова острвца током ембрионског развоја остају Лангерхансова острвца током животног века организма. ДНК метилација се типично уклања током формирања зигота и поново успоставља током накнадног ћелијског развоја. Недавна истраживања су показала да се метил групе заправо не уклањају у зиготима, него да долази до хидроксилације метил група.[208] Неке метилационе модификације које регулишу експресију гена су наследне и то се назива епигенетичком регулацијом. ДНК метилација супресује изражавање виралних гена и других штетних елемената који су били инкорпорирани у геном домаћина током времена. ДНК метилација је исто тако основа хроматинске структуре, која омогућава ћелијама да поприме велики број карактеристика неопходних за мултицелуларни живот полазећи од једне непроменљиве ДНК секвенце.
ДНК метилација у позицији 5 цитозина има специфичан ефекат редуковања генске експресије и нађена је код свих кичмењака. У соматском ткиву одраслих особа, ДНК метилација се типично јавља у динуклеотидном контексту, док је у ембрионским матичним ћелијама тренд супротан.[209][210][211]
ДНК метилација је од пресудне важности у развоју скоро свих типова канцера.[212] Упркос важности 5-метилцитозина, може доћи до деаминације чиме се формира база тимин, тако да су метилисани цитозини посебно склони мутацијама.[213] Аберантни обрасци ДНК метилације су везани за велики број људских малигности и групишу се у две дистинктне форме: хиперметилација и хипометилација у односу на нормално ткиво. Хиперметилација је једна од главних епигенетичких модификација које репресују транскрипцију путем промотерског региона тумор супресивних гена.[214][215][216] Хиперметилација се типично јавља на острвима у промотерском региону те производи инактивацију гена. Глобална хипометилација је била имплицирана у развој и прогрес канцера путем различитих механизама.[217][218][219]
Модификације других база су метилација аденина код бактерија,[220][221] присуство 5-хидроксиметилцитозина у мозгу,[222] и гликозилација урацила којом се формира „Ј-база” у кинетопластидима.[223][224]

ДНК може да буде оштећена многим врстама мутагена, који мењању ДНК секвенцу. Мутагени обухватају оксидационе агенсе,[228][229][230] алкилирајуће агенсе,[231][232] као и електромагнетну радијацију високе енергије, попут ултраљубичастог светла[233][234] и X-зрака.[235][236] Тип произведеног ДНК оштећења зависи од типа мутагена. На пример, светло може да оштети ДНК формирањем тиминских димера, који су међусобно повезани између пиримидинских база.[237] С друге стране, оксиданси попут слободних радикала[238][239] или водоник пероксида[240][241] производе вишеструке форме оштећења, као што су модификације база, посебно гуанозина, и прекиди двоструких ланаца.[242] Типична људска ћелија садржи око 150.000 база које су подлегле оксидативним оштећењима.[243] Међу тим оксидативним озледама, најопаснији су прекиди двоструких ланаца, јер се они тешко поправљају и могу да произведу генске мутације, генетичка уметања и делеције из ДНК секвенце, као и хромозомске транслокације.[244]
 |
Многи мутагени се уклапају у простор између два суседна базна пара. То се назива интеркалација.[245][246] Већина интеркалатора су ароматични и планарни молекули. Примери су етидијум бромид,[247][248] акридини,[249][250] дауномицин,[251][252][253] и доксорубицин.[251][252][254] Да би интеркалатор могао да се уклопи између пара база, оне се морају раздвојити. Стога долази до дисторзије ДНК ланаца путем одвијања двоструког хеликса. Тиме се инхибирају транскрипција и репликација ДНК, што узрокује токсичност и мутације.[255] Резултат је да ДНК интеркалатори могу да буду карциногени, и у случају талидомида, тератогени.[256][257] Други, попут бензо[а]пирен диол епоксида[258][259] и афлатоксина,[260][261][262] формирају ДНК адукте који индукују грешке у репликацији.[263] Упркос томе, услед њихове способности да инхибирају ДНК транскрипцију и репликацију, група сличних токсина се такође користе у хемотерапији за инхибирање брзог раста ћелија канцера.[264]

Мутације могу да узрокују дуплирање великих делова ДНК, обично путем генетичке рекомбинације.[265] Та дуплирања су главни извор полазног материјала за еволуцију нових гена. Од неколико десетина до неколико хиљада гена се дуплира у животињском геному сваких милион година.[266] Већина гена припада већим фамилијама гена са заједничким наслеђем.[267] Нови гени настају на неколико начина. До тага најчешће долази путем дупликације и мутације наслеђених гена, или рекомбинацијом делова различитих гена чиме се формирају комбинације са новим функцијама.[268][269]
Овде, домени делују као модули, сваки од којих има специфичну и независну функцију. Њихове комбинације могу да произведу гене који кодирају нове протеине са јединственим особинама.[270] На пример, очи човека користе четири гена за формирање структура које реагују на светло: три за распознавање боја и један за ноћни вид. Сва четири су настала од заједничког предачког гена.[271] Још једна предност дуплирања гена (или чак целокупног генома) је да то повећава редундантност. Тиме се омогућава једном гену да у пару поприми нову функцију, док друга копија има оригиналну функцију.[272][273] Други типови мутација понекад креирају нове гене из претходно некодирајуће ДНК.[274][275]
Промене у броју хромозома могу да обухвате мутације још већих размера, при којима се ДНК сегменти хромозома одвајају и затим преуређују. На пример, код раних хоминина, два хромозома су спајањем дала људски хромозом 2. Та фузија се није јавила у родовима других човеколиких мајмуна, те су код њих та два хромозома засебна.[276] У еволуцији, најважнија последица таквих хромозомска реаранжмана јесте убрзање дивергенције популација у нове врсте путем умањивања вероватноће укрштања између популација.[277]
Секвенце ДНК које могу да се померају у геному, попут транспозона, сачињавају главну фракцију генетичког материјала биљки и животиња, и сматра се да су биле важне у еволуцији генома.[278] На пример, више од милион копија секвенце је присутно у хуманом геному, и те секвенце поседују функције као што је регулација генске експресије.[279] Још један ефекат тих мобилних ДНК секвенци је да њихово померање унутар генома може да проузрокује мутације или делеције постојећих гена, те оне стога доприносе генетичкој разноврсности.[280][281][282]
Нелеталне мутације се акумулирају унутар генског фонда и увећавају количину генетичке варијабилности.[283] Обиље неких генетичких промена унутар генског фонда може да буде редуковано природном селекцијом, док се друге „повољније” мутације могу акумулирати и произвести адаптивне промене.
На пример, лептир може да произведе потомство са новим мутацијама. Већина тих мутација неће имати ефекта, док једна може да промени боју једног од лептирових потомака, чинећи га теже (или лакше) уочљивим за предаторе. Ако је та промена боје корисна, вероватноћа преживљавања тог лептира и произвођења потомства је у извесној мери повећана, и током времена број лептира са том мутацијом може да формира већи удео популације.
Неутралне мутације се дефинишу као мутације чији ефекти не утичу на адаптивну способност једне индивидуе.[284][285] Оне могу да се акумулирају током времена услед генетичког дрифта. Верује се да огромна већина мутација нема значајан утицај на адаптивност организма. Исто тако, механизми ДНК поправке су у стању да поправе већину промене пре него што постану сталне мутације, и многи организми имају механизме за елиминисање иначе перманентно мутираних соматских ћелија.
Корисне мутације могу да побољшају репродуктивни успех.[286][287]

ДНК хеликс обично не формира интеракције са другим ДНК сегментима, и у људским ћелијама различити хромозоми чак заузимају засебне области једра које се називају „хромозомске територије”.[290] Ова физичка сепарација различитих хромозома је важна за способност ДНК да функционише као стабилна ризница информација. Један од ретких случајева кад хромозоми формирају интеракције је током хромозомског кросинг-овера у процесу рекомбинације. При укрштању хромозома два ДНК хеликса се раскидају, замењују секције и поново спајају.
Рекомбинација омогућава хромозомима да размене генетичке информације и произведу нове комбинације гена. Тиме се повећава ефикасност природне селекције и она може да буде важна за брзу еволуцију нових протеина.[291] Генетичка рекомбинација може да буде део поправке ДНК, посебно у ћелијском одговору на раскидање двоструких ланаца.[292]
Најчешћа форма хромозомског кросинг-овера је хомологна рекомбинација, где два хромозома размењују веома сличне секвенце.[7][74] Нехомологна рекомбинација може да буде штетна за ћелије, јер она може да произведе хромозомске транслокације и генетичке абнормалности. Реакцију рекомбинације катализују ензими познати као рекомбиназе, попут .[293] Први степен рекомбинације је раскидање ланца двоструког хеликса било посредством ендонуклеазе или услед оштећења ДНК.[294] Серија корака који су делом катализовани рекомбиназом доводи до спајања два хеликса у најмање један Холидејов спој, у коме су сегменти једног ланца сваког хеликса спојени са комплементарним ланцем другог хеликса.[295][296] Холидејов спој је тетраедрална структура која се може померати дуж хромозома, замењујући један ланац за други. Реакција рекомбинације се затим зауставља раскидањем споја и религацијом ослобођене ДНК.[297]
У нормалној мејози свака хроматида одлази у посебан гамет. Гамети који садрже хроматиде које су размењивале делове називају се кросинг-овер гамети. Јединке које настају од таквих гамета називају се рекомбинанти.[298][299]
Гени на једном хромозому називају се везани гени. Они се заједно преносе у потомство и да не постоји кросинг-овер увек би се јављали у истим комбинацијама. Број група везаних гена једног организма једнак је његовом броју хромозомних хаплоида. Заједничко испољавање два или више гена који се налазе на истом хромозому назива везано наслеђивање (корелативно наслеђивање). У стварности међутим, није довољно да се два гена налазе на истом хромозому да би се везано наслеђивали. Они морају бити врло близу један до другог на истом хромозому. Уколико то није случај може доћи до њиховог рекомбиновања током кросинг-овера. Вероватноћа одигравања кросинг-овера између два гена на истом хромозому зависи од њиховог међусобног растојања. Што је то растојање веће и вероватноћа да ће доћи до кросинг-овера је већа и обратно. У геному човека постоје гени између којих је растојање толико мало да се практично кросинг-овер не одиграва. Такви скупови гена који се као целина преносе на потомство називају се хаплотипови.[7][74]
Чињеница да учесталост кросинг-овера зависи од растојања између гена користи се приликом мапирања гена на хромозому (одређивање места генима на хромозому).[300][301] Генетичке мапе које се добијају на основу учесталости кросинг-овера дају нам увид о релативном положају гена на хромозомима.[302][303][304] Растојање између два гена процењује се на основу броја кросинг-овер гамета на 100 гамета (у %). При томе 1% кросинг-овера представља јединицу растојања или центиморган (), тако да је 1 = 1% кросинг-овера.[305][306][307]
ДНК се обично јавља у облику линеарних хромозома код еукариота, и кружних хромозома код прокариота. Сет хромозома у ћелији чини њен геном. Људски геном има око 3 милијарде базних парова ДНК груписаних у 46 хромозома.[308] Информације су садржане у деловима секвенце ДНК који се називају гени. Трансмисија генетичке информације садржане у генима се остварује путем комплементарног спаривања база. На пример, током транскрипције, кад ћелија користи информацију у генима, ДНК секвенца се копира у комплементарну РНК секвенцу путем привлачења између ДНК и коректних РНК нуклеотида. Обично се ова РНК копија затим користи за прављење одговарајуће протеинске секвенце у процесу транслације, која зависи од истих интеракција између РНК нуклеотида. У алтернативном маниру, ћелија може да једноставно копира свој генетички садржај у процесу репликације ДНК.
Геномска ДНК је чврсто и уредно упакована процесом који се зове ДНК кондензација тако да се може сместити у мали доступни простор унутар ћелије. Код еукариота, ДНК је лоцирана у ћелијском нуклеусу. Мање количине ДНК су присутне и у митохондријама и хлоропластима. Код прокариота, ДНК се налази унутар тела неправилног облика у цитоплазми које се назива нуклеоид.[309] Комплетна генетичка информација једног организма је његов генотип. Ген је јединица наслеђивањаи и регион ДНК који производи специфичну карактеристику организма. Гени садрже отворене оквире читања[310][311] који се могу транскрибовати, регулаторне секвенце као што су промотери, и појачиваче,[312] који контролишу транскрипцију отворене оквире читања.
Код многих врста, само мала фракција тоталне секвенце генома кодира протеине. На пример, само око 1,5% хуманог генома се састоји од протеин кодирајућих ексона, и преко 50% хумане ДНК су некодирајуће понављајуће секвенце.[313] Разлози за присуство толике количине некодирајуће ДНК у еукариотским геномима и изузетно велике разлике у величинама генома, или Ц-вредностима, између врста представља дугогодишњу загонетку познату као „енигма Ц-вредности”.[314] Међутим, ДНК секвенце које не кодирају протеине још увек могу да кодирају функционалне некодирајуће РНК молекуле, који учествују у регулацији генске експресије.[315][316]
Неке некодирајуће ДНК секвенце имају структурне улоге у хромозомима. Теломере и центромере[317][318] типично садрже мали број гена, али су важни за функцију и стабилност хромозома.[113][319] Богата фамилија некодирајуће ДНК код људи су псеудогени,[267][320] који су копије гена које су онеспособљене мутацијама.[321] Те секвенце су обично само молекулски фосили, мада оне могу повремено да служе као сирови генетички материјал за креирање нових гена путем процеса дуплирања гена[322][323] и дивергенције.[324][325][326][327]



Ген је ДНК секвенца која садржи генетичке информације и која може да утиче на фенотип организма.[329][330] Структура и/или ензимска активност сваког протеина првенствено произлази из његове примарне секвенце аминокиселина. Путем одређивања секвенце аминокиселина протеина гени имају способност ношења информације неопходне за дефинисање активног полипептидног ланца. На тај начин један једноставан тип молекулске структуре има способност изражавања безбројних протеинских форми. Колективно дејство разних протеинских производа ћелије спроводи каталитичке и структурне активности које су неопходне за успостављање фенотипа.
Унутар гена, секвенца база дуж ДНК ланца дефинише секвенцу информационе РНК, која затим дефинише једну или више протеинских секвенци. Однос између нуклеотидних секвенци гена и аминокиселинских секвенци протеина је одређен правилима транслације, која су позната као генетички код. Он се састоји од речи са три слова које се називају кодони. Они су формирани од секвенци са три нуклеотида (нпр. ).[331] Генетички код декодира комплексни апарат који стоји између нуклеинске киселине и протеина. Тај апарат је есенцијалан за пренос информације коју садржи ДНК. Само један од два ДНK ланца кодира протеин, тако да се генетички код записује као секвенца нуклеотида, а не базних парова.
Током транскрипције, кодони гена се копирају у информационе РНК молекуле посредством РНК полимеразе. Те РНК копије се затим декодирају у рибозомима који читају РНК секвенце путем базног спаривања информационе РНК са транспортним РНК молекулима, који носе аминокиселине. Пошто постоје четири базе у комбинацијама од три слова, могућа су 64 кодона (4³ комбинације).[332] Кодони кодирају двадесет стандардних аминокиселина. Већина аминокиселина је кодирана са више од једног кодона. Постоје три стоп или несмисаона кодона који означавају крај кодирајућег региона. То су: и кодони.[333]
Ген садржи серију кодона која се чита секвенцијално од почетне тачке на једном крају до крајње тачке на другом. Написана у конвенционалном 5'-3' смеру, секвенца нуклеотида ДНК ланца која кодира протеин одговара секвенци аминокиселина написаној у правцу од -терминуса до -терминуса.
Општа база кода је откривене путем генетичке анализе мутација региона бактеријског вируса, фаг Т4. Крик је 1961. показао да се код мора читати у непреклапајућим триплетима почевши од фиксне почетне тачке. Непреклапање значи да се сваки кодон састоји од три нуклеотида и да су узастопни кодони представљени узастопним тринуклеотидима. Употреба фиксне почетна тачке значи да конструкција протеина мора да почне на једном крају и тече ка другом, тако да се различити делови кодирајуће секвенце не могу независно читати.
Ако се генетички код чита у непреклапајућим триплетима, онда постоје три могућа начина транслирања нуклеотидне секвенце у протеин у зависности од почетне тачке. Они се називају оквирима читања. На пример за секвенцу три оквира читања су:
Мутација која уметне или уклони једну базу мења оквир читања целокупне секвенце. Промена те врсте се назива померање оквира (енгл. ). Пошто се секвенца новог оквира читања комплетно разликује од старе, целокупна аминокиселинска секвенца протеина је промењена иза места мутације, те се стога функција протеина вероватно комплетно губи.
Мутације промене оквира читања могу да индукују акридини, једињења која се везују за ДНК и изобличавају структуру двоструког хеликса, узрокујући инкорпорацију или изостављање додатне базе током репликације. Свака мутација узрокована акридином доводи до адиције или уклањања једног базног пара. Ако једна акридинска мутација произведе на пример адицију нуклеотида, ДНК се може вратити у почетно стање уклањањем то нуклеотида. До реверзије се доћи и одстрањивањем различите базе на месту у близини првог. Комбинација таквих мутација даје веома корисне информације о природи генетичког кода.
Оригинална анализа је изведена генетичним путем, тако што су све акридинске мутације класификоване у две групе, обележене са (+) и (-). Оба типа мутација узрокују фрејмшифт. Тип (+) путем адиције базе, а тип (-) путем делеције базе. Двоструке комбинације типова (+ +) и (- -) су и даље мутиране. Међутим, комбинације типова (+ -) и (- +) се међусобно поништавају, те је један од мутанта супресор другог. Ови резултати показују да се генетички код мора читати у секвенци са оквиром читања који има фиксну почетну тачку, тако да адиција и делеција могу да компензују једна другу, док двоструке адиције или двоструке делеције задржавају карактер мутанта. Ови налази не дају индикацију о величини кодона.
Кад се формирају троструке мутације, само (+ + +) и (- — -) комбинације показују почетни фенотип, док остале комбинације остају мутиране. Ако се претпостави да три адиције или три делеције одговарају респективно адицији или изостављању једне аминокиселине, може се закључити да се код чита у триплетима. Некоректна аминокиселинска секвенца се налази између два спољашња места мутација, док секвенце на оба краја остају непромењене.
Било да ћелија има само један хромозом (као код прокариота) или мноштво хромозома (као код еукариота), целокупни геном се мора репликовати једном током сваке ћелијске деобе.[3] Два општа принципа се користе за поређење стања репликације са условима ћелијског циклуса:
Регулаторни гени ћелијског циклуса активирају прекидаче који иницирају ДНК репликацију и покрећу саму деобу. Код прокариота, иницијација репликације је догађај у коме учествује јединствено место бактеријског хромозома, и процес деобе је праћен развојем преграде. Код еукариотских ћелија, иницијација репликације је идентификована почетком С фазе, дужег периода током којег долази до синтезе ДНК, и који обухвата многе индивидуалне иницијационе догађаје. Чин поделе се остварује реорганизацијом ћелије током митозе.
Јединица ДНК у којој се јавља индивидуални чин репликације се назива репликон. Сваки репликон се активира једном и само једном у сваком ћелијском циклусу. Репликон је дефинисан поседовањем контролних елемената потребних за репликацију. Он садржи место почетка на коме се иницира репликација. Он исто тако може да садржи „терминус” на коме се репликација зауставља. Свака секвенца везана за место почетка, или прецизније секвенца која није раздвојена од места почетка терминусом, се репликује као део репликона. Место почетка може да утиче само на ДНК молекул на коме се налази. Геном прокариотске ћелије је један репликон, тако да су јединице репликације и сегрегације на истом месту. Највећи такав репликон је сам бактеријски хромозом. Репликон је флексибилна јединица. У случају бактеријских хромозома, он се користи за формирање копија дуплирањем дволанчане ДНК. Он се такође може користити за генерисање једноланчаних копија генома фага или плазмида у монометријским или мултиметријским формама. Мод репродукције репликона зависи од природе интеракција које се јављају током иницијације на месту почетка. Општи принцип је да је репликација контролисана степеном иницијације. Након почетка репликације, она се наставља док се целокупни геном не дуплира.[1]
Главна разлика у организацији бактеријских и еукариотских генома је у њиховој репликацији. Сваки еукариотски хромозом садржи велики број репликона, тако да јединица сегрегације обухвата мноштво јединица репликације. Тиме се додаје нова димензија проблему контроле. Сви репликони на хромозому се морају активирати током ћелијског циклуса, мада они нису истовремено активни, него се активирају током дужег периода. Сваки репликон се мора активирати само једном у датом ћелијском циклусу. Сигнал мора да разликује реплициране од нереплицираних репликона, тако да до активације репликона дође само једном. Пошто су многи репликони независно активирани, мора да постоји сигнал који означава да је целокупан процес репликације завршен.
Репликација може да буде једносмерна и двосмерна. Тип је одређен тиме да ли се једна или две репликационе рачве формирају. Код једносмерне репликације, једна репликациона виљушка напушта место почетка и креће се дуж ДНК. Код двосмерне репликације, две репликационе виљушке се формирају и крећу се у супротним смеровима. Кад се репликација ДНК посматра под електронским микроскопом, репликациони регион изгледа као око унутар нерепликоване ДНК. Међутим на основу изгледа сегмента се не може рећи да ли је репликација једносмерна или двосмерна. Око може да представља било коју од те две структуре. Ако је око формирано једносмерном репликацијом, оно представља непомерно место почетка и покретну репликациону рачву. Ако је формирано двосмерном репликацијом, оно представља пар репликационих рачви. Независно од типа, прогрес репликације проширује око док се ултиматно не прошири на цео репликон. Кад је репликон кружан, присуство ока формира θ структуру.
Број репликационих рачви репликационог ока се може одредити на два начина. Избор метода зависи од тога да ли се анализира дефинисани молекул ДНК или недефинисани регион ћелијског генома. У случају дефинисаног молекула, може се користити електронска микроскопија за мерење растојања крајева репликационог ока од крајева ДНК. Затим се позиција сваког краја ока може поредити у молекулима са који имају различите величине ока. Ако је репликација једносмерна само се један крај помера. Ако је репликација двосмерна оба краја се померају, док је место почетка у средини. У случају недефинисаних региона великог генома, два узастопна радиоактивна пулса се могу користити за обележавање кретања репликационе виљушке. Ако један од пулсева има интензивнију ознаку, они се могу разликовати по релативним интензитетима ознака применом ауторадиологије. Код једносмерне репликације једној ознаци следи друга на једном крају ока, док се код двосмерне јавља симетричан образац на обе стране ока. Симетрични образац се обично уочава у репликонима еукариотских хромозома.
Савременији метод мапирања места почетка са повећаном резолуцијом користи променљиве ефекте промене облика путања након електрофоретске миграције ДНК. Техника дводимензионог мапирања раздваја рестрикционе фрагменте репликујуће ДНК електрофорезом по маси у првој димензији, док је у другој димензији кретање првенствено одређено обликом. Различити типови репликационих молекула следе карактеристичне путеве, који се мере њиховом девијацијом од линије коју би следили линеарни молекули удвостручене величине. Једноставна Y-структура у којој се једна виљушка креће дуж линеарног фрагмента следи континуирани пут. Тачка инфлекције се јавља кад су све три гране једнаке дужине. Та структура максимално одступа од линеарне ДНК. Аналогним разлози одређују путеве двоструких Y-структура или мехура. Асиметрични мехур следи испрекидани пут, који се прекида у тачки у којој се мехур конвертује у Y-структуру.
Бактеријски репликон треба да подржава следеће функције да би се коректно наслеђивао
Прве две функције су особине места почетка. Сегрегација може да буде независна функција, али у прокариотским системима обично почива на секвенци у близини места почетка. То није случај код еукариота. ДНК секвенца места почетка репликона има способност подржавања репликације било које ДНК секвенце у коју се унесе. Кад се она клонира у молекул који не садржи место почетка, реконструкција формира плазмид који има способност аутономне репликације. Места почетка су идентификована код бактерија, квасаца, хлоропласта и митохондрија. Опште својство је да је секвенца богата паровима. Сматра се да је то услед потребе да се дволанчана ДНК отопи како би се иницирала репликација.
Геном Ешерихије коли се двосмерно репликује из једног места почетка, које се идентификује као генетички локус .[334][335] Додатак сегмента у било коју ДНК секвенцу формира вештачки плазмид који се може репликовати у . Путем редуковања величине клонираног фрагмента утврђено је да се регион неопходан за иницирање репликације састоји од 245 базна пара. Плазмиди који се коректно иницирају могу да имају ирегуларну сегментацију, али се то може стабилизовати увођењем додатних секвенци. Из тога следи да место почетка које је неопходно за иницијацију не садржи довољно информација да омогући поделу дуплираних ДНК молекула у ћелије ћерке при подели бактерије. Функције које учествују у подели се могу идентификовати карактеризацијом секвенци које условљавају сегрегациону стабилност плазмида.
Прокариотски репликони су обично кружни. Кружне структуре обухватају бактеријски хромозом, плазмиде и многе бактериофаге. Оне су исто тако честе у хлоропластима и митохондријским ДНК молекулима. Репликација кружних молекула избегава проблем репликације крајева, али има проблем завршавања репликације. Бактеријски хромозом се двосмерно репликује као једна јединица почевши од локације. Две репликационе рачве се крећу око генома приближно истом брзином до тачке састајања, и до терминације долази у дискретном региону. Након терминације саме репликације ДНК, ензими вишег нивоа који манипулишу структуре су неопходни да би се два новонастала хромозома раздвојила. Секвенце које узрокују терминацију се називају тер места. Она се састоје од кратке (~23 базна пара дугачке) секвенце која узрокује терминацију ин витро. Терминационе секвенце функционишу само у једном смеру. Терминација захтева протеин кодиран геном[336][337] који препознаје консензус секвенцу и спречава даљи напредак репликационе виљушке.
Код Ешерихије коли репликациона рачва се обично зауставља у тачки на пола пута око хромозома. Постоје два терминациона региона ( и ) лоцирана око 100 кб на свакој страни места сретања. Сваки терминални регион је специфичан за један смер кретања рачве, и они су распоређени на такав начин да би свака рачва морала да пређе други завршни регион да би досегла до завршног краја који препознаје. Овај аранжман формира клопку за репликационе рачве. Ако је из било ког разлога једна рачва касни, тако да рачве не успеју да се сретну у уобичајеној централној позицији, бржа рачва ће бити заустављена у тер региону и чекаће долазак спорије рачве.
У случају да репликациона рачва (која се креће десет пута брже) наиђе на РНК полимеразу која се креће у истом смеру, она је обилази без поремећаја транскрипције. Механизам ове интеракције није познат. У случају да се РНК полимераза креће у супротном смеру, конфликт се вероватно не би могао решити, те може доћи до леталног исхода. То је могући разлог што су код Ешерихије коли скоро све активне транскрипционе јединице оријентисане тако да се изражавају у истом смеру као и репликациона рачва. Изузеци су једино мале транскрипционе јединице које се ретко изражавају.
Код еукариотских ћелија, репликација ДНК је ограничена на део ћелијског циклуса. С фаза се јавља као део интерфазе која обично траје неколико часова код ћелија виших еукариота. Репликација велике количине ДНК садржане у еукариотском хромозому се остварује поделом у мноштво репликона. Само део тих репликона учествује у репликацији у било којем тренутку С фазе. Сваки репликон се активира у специфично време, мада евиденција о томе није потпуна. Сигнал за почетак С фазе је активација првог репликона. Током следећих неколико сати долази до активације других репликона. Контрола С фазе стога обухвата два процеса: излазак ћелије из претходне Г1 фазе, и иницијацију репликације индивидуалних репликона на уређен начин.
Највећи део познатих својстава појединачних репликона је добијен путем ауторадиографских студија. Хромозомски репликони обично имају двосмерну репликацију. Потешкоћа у карактерисању појединачних јединица је у томе да се суседни репликони спајају и производе велике репликационе мехуре. Приступ који се користи за разликовање индивидуалних репликона од спојених се обично ослања на сегменте ДНК у којима се може видети неколико активних репликона, који су вероватно активирани у приближно исто време и чије рачве се још нису среле. Постоје докази да „регионална” контрола може да произведе известан облик регулационог обрасца у коме су групе репликона инициране више или мање координирано, што је у супротности са механизмом у коме су индивидуални репликони активирани један по један у расутим областима генома. Две структурне особине сугеришу могућност организације на великој скали. Веома велики региони хромозома се могу карактерисати као „рано репликујући” или „касно репликујући”, из чега следи да постоји извесна расподела између репликона који се активирају рано и касно. Визуелизација репликационих рачви обележених са ДНК прекурсорима показује 100—300 центара, уместо униформне расподеле. Сваки центар вероватно садржи >300 репликационих рачви. Рачве могу да представљају фиксне структуре кроз које репликујућа ДНК мора да прође.
У групама активних репликона, просечна величина јединице се мери растојањем између места почетака. Брзина кретања репликационе рачве се може проценити из максималног растојања које ауторадиографски траг пређе током датог временског интервала. Појединачни еукариотски репликони су релативно мали, иако њихова дужина варира више од десет пута унутар генома. Брзина којом се они репликују је знатно мања од брзине бактеријске репликације. Геном сисара би се могао репликовати у току једног сата, ако би сви репликони симултано функционисали. Међутим, С фаза заправо траје дуже од шест сати у типичним соматским ћелијама, из чега следи да је до 15% репликона активно у било ком моменту. Постоје неки изузетни случајеви, као што је рани ембрионски развој Дрозофила ембриона, где је дужина С фазе компресована симултаним функционисањем великог броја репликона.
Доступна евиденција сугерише да хромозомски репликони немају терминусе на којима се репликационе рачве заустављају и ензимски комплекс дисоцира од ДНК. Вероватнији сценарио је да репликационе рачве настављају кретање од свог места почетка док се не сретну са рачвом која се креће у супротном смеру.
Сваки ДНК сегмент који садржи место почетка би требало да има способност репликације. Мада су плазмиди ретки код еукариота, могуће их је формирати путем подесних манипулација ин витро. То је остварено код квасца, мада не и код виших еукариота. мутанти се могу трансформисати до дивљег типа додатком ДНК која садржи копију гена дивљег типа. Неки ДНК фрагменти квасца (често кружни) имају способност веома ефективног трансформисања дефективних ћелија. Ти фрагменти могу да опстану у ћелијама у неинтегрисаном (аутономном) стању, попут саморепликујућих плазмида. Фрагменти који се трансформишу са високом фреквенцијом поседује секвенце које имају способност ефективне репликације у квасцу. Тај сегмент се назива АРС (аутономно репликујућа секвенца). АРС елементи су изведени из аутентичних места почетка репликације хромозома. Секвенце са АРС функцијом се јављају са скоро једнаком фреквенцијом као и места почетка репликације. АРС елементи су систематски мапирани на дужим регионима хромозома. Само део њих се заправо користи за иницијацију репликације. Други су неми, или се можда користе повремено. Ако је тачно да нека места почетка имају варирајућу вероватноћу активације, следи да границе репликона нису фиксне. У том случају дати регион хромозома може да буде репликован из различитих места почетака у различитим ћелијским циклусима. АРС елемент се састоји од богатог региона који садржи одређена дискретна места на којима мутације имају знатан утицај. Садржај база уместо саме секвенце може да буде значајан за остатак региона.


Репликација ДНК молекула је веома сложен и важан процес. Стога је пуно времена и труда је уложено у његово разумевање.
Ћелијска деоба је есенцијална за раст организма. Током деобе ћелија долази до репликације ДНК тако да свака од новонасталих ћелија има исти генетички садржај као и њихов родитељ. Дволанчана структура ДНК омогућава једноставан механизам за репликацију. Овде се два ланца раздвајају и формира се комплементарна секвенца за сваки од њих посредством ензима ДНК полимераза.[13] Тај ензим формира комплементарни ланац тако што налази коректну базу путем спаривања комплементарних база, и њиховог везивања на оригинални ланац. Пошто ДНК полимеразе могу да продуже једино ДНК ланац у 5’ ка 3’ смеру, други механизми се користе за копирање антипаралелних ланаца двоструког хеликса.[338] На тај начин, базе старог ланца одређују у којој секвенци се базе појављују у новом ланцу, и ћелија добија перфектну копију своје ДНК.
Репликација ДНК се такође може изводити ин витро (вештачки, изван ћелије). ДНК Полимеразе, изоловане из ћелија, и вештачки ДНК прајмери се користе за иницирање синтезе ДНК на познатим секвенцама молекулских темплета. Полимеразна ланчана реакција (ПЦР) је уобичајена лабораторијска техника у којој се примењује таква вештачка синтеза у цикличном режиму ради умножавања специфичног циљног ДНК фрагмента из ДНК смеше.
Репликација ДНК молекула почиње на месту који се зове локус.[334][335] Протеин ДНК-А се везује за локус и притом се врши хидролиза аденозин трифосфата. Ово прво надовезивање доводи до почетног одвијања ДНК молекула из спирале у два линеарна ланца повезана водоничним везама. Да би репликација била успешна ДНК мора да постане линеарна, а не спирално увијена, дакле мора да изгледа као мердевине. Ензими који одвијају ДНК молекул у облик мердевине се зову хеликазе.[340][341] Ензими одвијају ДНК молекул веома брзо, чак 75 до 100 револуција у секунди.[342] Овакво брзо одвијање молекула ДНК може да доведе до стварања тензија полинуклеотидних ланаца. Ова појава тензија се на пример може видети када се увију пертле и када покушамо брзо да их раздвојимо, пертле се увију у чворове услед тензије. Да би се ово избегло стварање чворова које би могло да оштетити ДНК молекул, присутни су ензими који се зову ДНК топоизомеразе. Они попуштају водоничне везе како би се тензија и стварање чворића избегло.[56][57][58] У исто време док се ДНК молекул раздваја у облик мердевина, структура која се назива репликациона виљушка (или рачва)[341] иде одмах иза топоизомераза и раздваја водоничне везе између парова (А-Т и Г-Ц). Да би ови полинуклеотидни ланци остали раздвојени раздвајајући протеини се везују на обе стране сваког ланца и на тај начин одржавају ланце одвојене. Репликација ДНК молекула се може упоредити са рајсфершлусом. Када желимо да отворимо рајсфершлус, вучемо механизам надоле, и на тај начин добијамо две стране рајсфершлуса за раздвојеним зупчаницима. На исти начин се ДНК раздваја, при чему механизам рајсфершлуса представља репликациону виљушку.
Након раздвајања постоје два полинуклеотидна ланца, један иде у правцу 3'→ 5' док други иде у правцу 5'→ 3' (антипаралелност). Веома важан ензим који синтетише нове полинуклеотидне ланце ДНК полимераза δ,[343][344] може да синтетише нови ланац само у правцу 5'→ 3'. То није проблем за водећи ланац који се синтетише у правцу кретања репликационе виљушке.[345][346]
Синтезу оба ланца обавља ДНК полимераза тек пошто се веже за родитељски ланац који служи као матрица. Овај ензим не може да се веже за огољени ланац-матрицу већ захтева постојање зачетника (прајмера). Зачетник је кратки ланац РНК и његову синтезу катализује ензим примаза. Када се кратки ланац РНК комплементарно спари (хибридизује) са почетком ланца матрице то омогућује везивање ДНК полимеразе и почиње синтеза новог ланца. За синтезу ланца који заостаје потребно је да се синтетише већи број зачетника. Оказакијеве фрагменте, по завршетку синтезе, међусобно повезује ензим лигаза.[347][348]
Ланац који се синтетише правцу супротном од правца кретања репликационе виљушке 3' → 5' не може да буде синтетисан без прекида. Он се синтетише у фрагментима који се називају Оказакијеви Фрагменти[349][350] (названим по научнику Реији Оказаки који је први указао на њихово постојање 1966.[351]) и појављују се само на ланцу који иде у овом правцу. Они су комплементарни са темплетом заостајућег ланца, са којим формирају дволанчане ДНК секције. Оказакијеви фрагменти су између 100 до 200 нуклеотида дугачки код еукариота, док код Ешерихије коли имају 1 000 то 2 000 нуклеотида. Они су раздвојени РНК примерима од ~10-нуклеотида и до спајања долази након уклањања прајмера.
Да би нови ДНК молекул био комплетан и без прекида, ензим лигаза има улогу лепка и везује фрагменте један за други, и тако настају од једног ДНК молекула, два новоформирана ДНК молекула. ДНК полимераза β има важну улогу у провери нових ДНК молекула,[352][353] тако што иде дуж целих новонасталих ланаца, чита их и проверава да ли су све базе коректно повезане (А-Т и Г-Ц). ДНК репликација се зауставља када репликациона виљушка наиђе на секвенцу на ДНК молекулу који кодира за стопирање ДНК репликације.
Процес ДНК репликације је веома компликован. Један од разлога за ову комплексност је да новонастали ДНК молекули морају да буду тачни. Грешке у синтези ДНК молекула могу да доводе до разних болести и често су фаталне. Овај процес звучи веома невероватно када се узме у обзир да се нових 850 базних парова код прокариота синтетише у року од једне секунде, док је код еукариота ова брзина је нешто нижа, око 150 базних парова у једној секунди.
Прокариотска репликација ДНК је бидирекциона и започиње у центру репликације ().[355]
Иницијацију ДНК репликације посредује [356], протеин који се везује за регион центра репликације познат као кутија. Код постоји пет кутија, свака од којих садржи девет високо конзервираних базних парова, консензус секвенцу .[357] Последица везивања за тај регион је да ДНК постаје негативно супернамотана. Након тога, региони испред кутија (познати као кутије) се отапају. Постоје три таква региона, и сваки је дугачак 13 базних парова, и богат АТ паровима (што олакшава топљење јер је мање енергије потребно за разлагање две водоничне везе. Тај регион има консензус секвенцу .[358] За растапање кутија је неопходан аденозин трифосфат (који хидролизује ). Након растапања, регрутује хексамерну хеликазу (шест протеина) на супротне крајеве растопљене ДНК. На том месту се формира репликациона виљушка. За регрутовање хеликазе је неопходно шест протеина, сваки од којих се везује за једну подјединицу хеликазе. Након формирања тог комплекса, додатних пет протеина се везује. се затим одваја, и комплекс је комплетан. Да би се ДНК репликација наставила потребан је једноланчани протеин који спречава једноланчане ДНК ланце да формирају секундарну структуру, као и за спречавање њиховог поновног међусобног спаривања. ДНК гираза[359][360] је потребна да би се умањио стрес узрокован формирањем негативних супернамотаја формираних посредством хеликазе.[361][362] Одмотавање ДНК хеликазом омогућава примази ([363][364]) полимерази да формира прајмер на сваком ДНК темплету тако да ДНК синтеза може да почне.
Након формирања прајмера, ДНK полимераза III холоензим започиње репликацију ДНК.[365][366] Њен каталитички механизам обухвата употребу два метална јона у активном месту. Овај ензим има способност разликовања дезоксирибонуклеотида и рибонуклеотида. Метални јони су генерално дивалентни катјони који помажу 3' да иницира нуклеофилни напад на алфа фосфат дезоксирибонуклеотида и да оријентише и стабилизује негативно наелектрисани трифосфат на дезоксирибонуклеотиду. Нуклеофилни напад 3' -а на алфа фосфат ослобађа пирофосфат, који се накнадно хидролизује (неорганском фосфатазом) у два фосфата. Ова хидролиза завршава синтезу ДНК.
Терминација репликације ДНК код Ешерихије коли се обавља путем употребе терминационих секвенци и протеина.[336][337] Те секвенце омогућавају да две репликационе виљушке иду само у једном правцу. Репликација ДНК иницијално производи два повезана кружна ДНК дуплекса, сваки од којих се састоји од једног родитељског ланца и новоформираног ланца. Код Ешерихије коли топоизомераза IV раздваја кружне ДНК дуплексе.[367][368]
Неки бактериофагови имају само једну стратегију опстанка. Након инфекције подложног домаћина, они мењају његове ћелијске функције и подређују их производњи великог броја вирусних потомака. Резултат литичке инфекције је смрт бактеријског домаћина. У типичном литичком циклусу ДНК (или РНК) фага улази у ћелију домаћин, његови гени се транскрибују у одређеном реду, генетички материјал фага се репликује, и протеинске компоненте вируса се производе. Коначно, бактерија домаћин се отвара (лизира) да би се ослободило формирано потомство фага.
Други фагови имају двоструки начин постојања. Они могу да производе литичке циклусе, што је отворена стратегија којом се производи што више копија за што краће време. Они исто тако имају алтернативну форму постојања, у којој је геном фага присутан у бактерији у латентној форми познатој као профаг. Та форма пропагације се назива лизогенија. У лизогеној бактерији профаг је интегрисан у бактеријски геном, и наслеђује се на исти начин као и бактеријски гени. Услед поседовања профага, лизогена бактерија је имуна на даљу инфекцију другим фаговима истог типа. Имуност се успоставља интеграцијом једне копије профага, тако да бактеријски геном садржи само једну копију профага било ког типа. Транзиција се јавља између лизогеног и литичког мода постојања. Кад је фаг произведен литичким циклусом уђе у нову бактеријску ћелију, он било понавља литички циклус или улази у лизогено стање. Исход зависи од услова инфекције и генотипа фага и бактерије. Профаг се ослобађа лизогених ограничења процесом индукције, у коме се издваја из бактеријског генома, да формира слободну ДНК фага, која затим пролази кроз литички пут. Алтернативне форме у којима се фагови пропагирају су одређене регулацијом траскрипције. Лисогенија се одржава путем интеракције фагног репресора са оператором. За литички циклус је неопходна каскада транскрипционе контроле. Транзиција између два начина живота се остварује успостављањем репресије (литички циклус у лизогенију), или ослобађањем од репресије (индукција лизогена у литички циклус).
Плазмиди су још један тип постојања ДНК унутар бактерије. Они су аутономне јединице које постоје у ћелији као екстрахромозомни геноми. Плазмиди су саморепликујући кружни ДНК молекули, који се одржавају у ћелији са стабилним и карактеристичним бројем копија.[39] Другим речима, њихов број остаје константан из генерације у генерацију. Неки плазмиди такође имају алтернативне животне стилове. Они могу да постоје било у аутономном екстрахромозомском стању, или могу да буду уметнути у бактеријски хромозом, и онда су ношени као његов део попут било којег дела секвенце. Такве јединице се називају епизоми, мада се термини плазмид и епизом често користе као синоними. Попут лизогених фагова, плазмиди и епизоми одржавају себичну поседовање њихове бактерије и често онемогућавају другим елементима истог типа да се успоставе. Тај ефекат се назива имуност, мада се база плазмидне имуности разликује од лизогене имуности. Неки плазмиди и епизоми се преносе између ћелија путем конјугативног процеса који обухвата директни контакт између ћелија донора и примаоца.
Геноми фага су неопходно мали.[40] Као и код свих вируса, они су ограничени потребом да се упакује нуклеинска киселина унутар протеинског омотача. То ограничење диктира многе виралне репродукционе стратегије. Типично вирус преузима контролу над ћелијом домаћина и користи њену структуру за репликацију и изражавање својих гена. Обично фаг садржи гене чија функција је осигуравање преферентне репликације фагне ДНК. Протеини кодирани тим генима обављају иницијацију репликације. Фаг може да садржи ген ДНК полимеразе. Фаг мења капацитет ћелије домаћина да обавља транскрипцију. То се постиже заменом РНК полимераза или модификовањем способности иницијације или терминације. Резултат је увек исти: фагни иРНК молекули су преферентно транскрибовани. У погледу синтезе протеина фаг се обично ослања на апарат домаћина, преусмеравајући његове активности заменом бактеријске иРНК фагном.
Литички развој се остварује биохемијским путем у коме се фагни гени изражавају у специфичном редоследу. Тиме се осигурава да је одговарајућа количина сваке компоненте присутна у одговарајуће време. Циклус се може поделити у два општа пута:
Рана фаза је посвећена производњи ензима који учествују у репродукцији ДНК. То обухвата ензиме ДНК синтезе, рекомбинације, и понекад модификације. Њихове активности узрокују акумулацију резервоара генома фага. У том резервоару геноми се константно репликују и рекомбинују. Током касније фазе протеинске компоненте се синтетишу. Често је неопходно мноштво различитих протеина да би се формирале структуре главе и репа, тако да се највећи део генома фага састоји од структурних гена. Осим структурних протеина потребни су „монтажни протеини” који помажу у конструисању честица фагова, мада они сами не постају део финалних структура. До стадијума склапања структурних компоненти у главу и реп, репликација ДНК је достигла своју максималну брзину. Геноми се затим умећу у празне протеинске главе, репови се додају, и ћелија домаћина се лизира да би се омогућило ослобађање нових вирусних честица.
Организација фагне генетичке мапе често одражава секвенцу литичког развоја. Концепт оперона је донекле доведен до екстрема, у коме су гени који кодирају протеине са сродним функцијама груписани да би се омогућила њихова контрола са максималном ефикасношћу. То омогућава контролу пута литичког развоја са малим бројем регулаторних прекидача. Литички циклус је под позитивном контролом, тако да се свака група гена фага може изразити само након давања одговарајућег сигнала. Регулаторни гени функционишу у каскади у којој је ген изражен у једном стадијуму неопходан за синтезу гена који су изражени у следећем стадијуму. Тако је у сваком стадијуму експресије један или више активних гена регулатор који је потребан у следећем стадијуму. Регулатор може да има облик нове РНК полимеразе, сигма фактора који преусмерава специфичност домаћинове РНК полимеразе, или антитерминациони фактор који омогућава читање нове групе гена.
Први стадијум генске експресије се ослања на транскрипциони апарат ћелије домаћина. Обично је само неколико гена изражено у том стадијуму. Њихови промотери су као и промотери гена домаћина. Име ове класе гена зависи од фага. У већини случајева, они су познати као рани гени. Један од тих гена увек кодира протеин који је неопходан за транскрипцију следеће класе гена. Друга класа гена је позната као одложени рана или средња група. Њено изражавање типично почиње непосредно након кодирања регулаторног протеина. У зависности од природе контролног циклуса, иницијални сет раних гена може, или не мора да настави са даљом експресијом. Често долази до редукције изражавања гена домаћина. Два сета раних гена обухватају све функције фага изузев формирања протеинског омотача и лизирања ћелије. Кад репликација фагне ДНК започне, време да се изразе касни гени. Њихова транскрипција у овом касном стадијуму обично је узрокована регулаторним протеином које формиран у претходној фази. У случају ламбда фага то је антерминациони фактор, мада може да буде сигма фактор (као код ).
Секвенца кодирајућег ланца ДНК, која се чита у смеру од 5' да 3', се састоји од нуклеотидних триплета (кодона) и одговара аминокиселинској секвенци протеина од до -терминуса. Секвенцирање ДНК и протеина омогућава директно поређење секвенци нуклеотида и аминокиселина. Транспортна РНК је адаптер који повезује кодон са одговарајућом аминокиселином. Транспортна ТРК има пивоталну улогу у синтези протеина. Она је посредник који омогућава транслацију кодона у аминокиселине. Значење кодона који представља аминокиселину је одређено његовом транспортном РНК, док значење терминирајућих кодона произилази директно из протеинских фактора.
Решавање генетичког кода је оригинално показало да се генетичка информација одржава у облику нуклеотидних триплета, али није било познато како кодони специфицирају одговарајуће аминокиселине. Пре развоја секвенцирања, релације између аминокиселине и кодона су одређене користећи два типа ин витро студија. Систем за транслацију синтетичких полинуклеотида је уведен 1961. и показано је да полиуридинска киселина (поли(U)) садржи инструкције за формирање полифенилаланина из фенилаланина.[369] Други систем је касније уведен у коме су тринуклеотиди кориштени за опонашање кодона узрокујући везивање одговарајуће тРНК за рибозом. Применом комбинације ове две технике су одређена значења кодона.
Пошто постоји више кодона (61) него амино киселина (20), скоро све аминокиселине су представљене са више кодона. Једини изузеци су метионин и триптофан. Кодони са истим значењем се називају синоними. Пошто се генетички код заправо чита на иРНК, он се обично описује користећи РНК базе: U, C, A и G. Кодони који представљају исту или сродне аминокиселине теже да имају сличне секвенце. Често база у трећој позицији кодона није значајна, јер четири кодона која се разликују у само у трећој бази представљају исту аминокиселину. У неким случајевима разлика се прави само између пурина и пиримидина у тој позицији. Умањена специфичност на задњој позицији кодона је позната као дегенерација треће базе.
Интерпретација кодона захтева спаривање база са антикодоном одговарајуће аминоацил-тРНК. Ова реакција се одвије унутар рибозома. Комплементарни тринуклеотиди у изолацији су сувише кратки да формирају стабилне интеракције. Унутар рибозома реакција је стабилизована његовим активном местом. Формирање базних парова између кодона и антикодона није само питање спаривања база, и . Рибозом контролише средину на такав начин да до конвенционалног спаривања долази на прве две позиције кодона, док су додатне реакције могуће на трећој бази. Резултат тога је да један аминоацил-тРНК молекул може да препозна више од једног кодона у складу са обрасцем дегенерације. На интеракције спаривања може да утиче увођење специјалних база на иРНК. Модификације у или близо антикодона директно утичу на способност иРНК да формира интеракције са жељеним кодонима, док модификације на другим местима могу да утичу на остале функције иРНК молекула.
Тренд да су сличне аминокиселине заступљене сродним кодонима умањује утицај мутација, и увећава вероватноћу да насумична промена једне базе неће произвести промену аминокиселине, или бар не промену у киселу различитог карактера. На пример, мутација у нема ефекта пошто оба кодона представљају леуцин, док мутација у производи замену леуцина са изолеуцином, који је блиско сродан.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-{
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Три кодона ( и ) која не представљају аминокиселине користе се за означавање тачке завршетка синтезе протеина. Крај сваког гена је означен једним од ових кодона.
Поређење ДНК секвенци са одговарајућим протеинским секвенцама је показало да се идентичан сет кодона користи код бактерија и еукариота. Консеквентно иРНК из једне врсте се обично може коректно транслирати ин витро и ин виво протеин синтетичким апаратом друге врсте. Другим речима кодони кориштени у иРНК једне врсте имају исто значење за рибозоме и тРНК других врста.
Универзалност кода иде у прилог претпоставци да је он морао бити формиран веома рано у току еволуције. Оригинално је можда постојао стереохемијски однос између аминокиселина и кодона, који је временом еволуирао до данашњег система селекцијом особина као што су већа ефикасност и прецизност. Могуће је да је код започет у примитивним формама код којих је мали број кодона кориштен за представљање малог броја аминокиселина, или да је чак један кодон одговарао било ком члану групе аминокиселина. Прецизнија значења кодона и додатне аминокиселине су можда еволуирали касније. Једна могућност је да су у почетку само две од три базе коришћене, и да је дискриминација треће позиције развијена касније. До замрзавања даље еволуције кода је могло да дође кад је систем постао довољно комплексан да би даље промене значења кодона унеле знатне поремећаје у постојеће протеине путем неприхватљивих замена аминокиселина. Његова универзалност сугерише да је до тога морало доћи у веома раним стадијумима живота тако да су га сви живи организми наследили из исте групе ћелија.
Док је постојање малих варијација стандардног кода било раније предвиђено[372], такви кодови су откривени тек 1979. кад је показано да људски митохондријални гени користе алтернативни код. Многе мале варијације су откривене од тада[373], укључујући разне алтернативне митохондријске кодове[374] и мале варијанте као што је транслација кодона UGA као триптофан у врстама микоплазме и транслација као серин уместо леуцина код неких врста рода кандида.[375][376] Код бактерија и археја, и су често старт кодони, мада у ретким случајевима, поједини протеини могу да користе алтернативне старт кодоне који се нормално не користе код тих врста.[373]
У неким протеинима, нестандардне аминокиселине су замењене за стандардне стоп кодоне у зависности од сигналне секвенце информационе РНК. На пример, може да кодира селеноцистеин, и може да кодира пиролизин. Селеноцистеин се сматра двадесет првом аминокиселином, и пиролизин се сматра двадест другом.[373] Упркос тих разлика, сви познати природни кодови су веома слични један другом, и механизам кодирања је сличан за све организме: тробази кодони, тРНК, рибозоми, читање кода у истом смеру и транслација кода кодон по кодон у секвенцу аминокиселина. Проблем поремећаја узрокованих променама значења кодона је мање озбиљан код митохондрија, јер њихов ДНК кодира мали број протеина (~10). Промењени кодони вероватно нису били екстензивно коришћени у локацијама где би супституције аминокиселина биле штетне. Разноврсне промене нађене у митохондријама различитих врста сугеришу засебну еволуцију, са одсуством наслеђивања од заједничког древног митохондријског кода.
Минимум од 31 тРНК молекула (не рачунајући иницијатор) је неопходан за препознавање 61 кодона (најмање два тРНК молекула су неоходна за сваку кодонску фамилију и један је неопходан по кодонском пару). Код сисарских митохондрија постоје само 22 различита тРНК молекула. Критична особина је поједностављење кодон-антикодон упаривања тако да један тРНК препознаје сва четири члана кодонске фамилије. Тиме се минимални број тРНК молекула неопходних за препознавање свих уобичајених кодона редукује до 23. Употреба за терминацију редукује овај број даље до 22. Код свих осам кодонских фамилија, секвенца тРНК кодона садржи непромењен на првој позицији антикодона. Преостали кодони су груписани у парове у којима се сви кодони који се завршавају пиримидинима читају модификованим у антикодону, и сви кодони који се завршавају пуринима се читају модификованим антикодона, као што је предвиђено хипотезом о неодређености трећег нуклеотида кодона. Компликација са кодоном је избегнута променом кода да чита са као триптофан, и код сисара престаје да представља изолеуцин и уместо њега се чита као и за метионин. Тиме се омогућава читање свих кодона изван кодонских фамилија са 14 парова. Скуп од 22 идентификована гена стога кодирају 14 тРНК молекула који представљају парове, и 8 тРНК молекула који представљају фамилије. То оставља два некориштена терминациона кодона i које тРНК молекули не препознају, заједно са кодонским паром . Слична правила следе митохондрије гљивица.
Поред општих промена кода, постоје специфичне промене у читању индивидуалних гена. Специфичност таквих промена подразумева да је читање појединог кодона зависно од окружујућих база. Упадљив промер је инкорпорација модификоване амино киселине селеноцистеина на појединим кодонима унутар гена који кодирају селенопротеине код прокариота и еукариота. Обично ти протеини катализују реакције оксидо-редуцију, и садрже један селеноцистеински остатак, који формира део активног места. Најбоље је позната употреба кодона у три -E. coli}- гена који кодирају формат дехидрогеназне изозиме. Интерни кодон се чита помоћу селено--тРНК. Ова необична реакција је одређена локалном секундарном структуром иРНК, посебно присуством матичне петље у секвенци непосредно испод . Мутације у четири гена креирају дефицит селенопротеинске синтезе.
Функција тРНК у протеинској синтези је извршена након препознавања кодона унутар рибозома. Интеракција између антикодона и кодона се састоји од спаривања база на начин који иде изван уобичајеног формирања и веза. Правила којима се покоравају ове интеракције се могу извести из секвенци антикодона. Способност било које тРНК да одговори на одређени кодон се може директно мерити путем теста тринуклеидног везивања или његовом употребом у ин витро протеинском синтетичком систему. Сам генетички код даје важне индикације о процесу препознавања кодона. Образац дегенерације треће базе указује да је у скоро свим случајевима та база или није релевантна, или се разлика прави само између пурина и пиримидина. Постоји осам фамилија кодона у којима сва четири кодона имају заједничке прве две базе, тако да треће нема улогу у специфицирању аминокиселине. Код седам кодонских парова значење не зависи од типа пиримидина у трећој позицији, и код пет кодонских парова то је случај са пурином.
Ако се на генетички код гледа у супротном смеру, постоје само три случаја код којих се јединствено значење добија присуством одређене базе у трећој позицији: (за метионин), (за триптофан), и (терминација). Из тога следи да и немају јединствено значење у трећој позицији, док А никад не означава јединствену аминокиселину. Пошто је антикодон комплементаран са кодоном, прва база антикодона се спарује са трећом базом кодона. На пример кодон / антикодон означава:
| Кодон | |
| Антикодон |
| Прва база антикодона | Трећа база кодона |
|---|---|
| A или | |
| само | |
| само | |
| или |
Често једна иРНК може да препозна више кодона. То значи да базе у првој позицији антикодона морају да имају способност формирања интеракција са алтернативним базама у одговарајућој трећој позицији кодона. Спаривање база у тој позицији не може да буде ограничено на уобичајене и парове. Правила која одређују обрасце препознавања се могу сумирати хипотезом флексибилности, која наводи да спаривање између кодона и антикодона у прве две позиције кодона увек следи уобичајена правила, док се флексибилност јавља у трећој позицији. До тога долази зато што конформација петље тРНК антикодона омогућава флексибилност на првој бази антикодона. Правила препознавања треће базе кодона дозвољавају додатно спаривање између и . Та једна промена формира образац базног спаривања у коме А више нема јединствено значење у кодону, јер које га препознаје мора исто тако да препозна . Слично томе такође више нема јединствено значење, јер које га препознаје мора такође да препозна . Препознавање јединствених кодона је могуће само кад је трећа база или . Та опција се не користи често. и су једини примери првог типа, а нема примера другог типа.
парови су чести у РНК дуплекс структурама. С друге стране формирање стабилних контакта између кодона и антикодона, где се само три пара база могу формирати је знатно ограниченије, и стога парови могу да допринесу само у задњој позицији кодона.
Транспортна РНК је јединствена међу нуклеинским киселинама по свом садржају „неуобичајених” база. Неуобичајена база је сваки пурински или пиримидински прстен изузев уобичајених и које улазе у састав свих РНК. Све друге базе се формирају путем модификације једне од четири базе након њене инкорпорације у полирибонуклеински ланац. Све класе РНК показују известан степен модификација, али свим случајевима изузев тРНК то је ограничено на веома једноставне случајеве, као што је адиција метил група. Код тРНК се јавља широк низ модификација, које се крећу од од једноставне метилације до потпуне реконструкције пуринског прстена. Модификације се јављају у свим деловима тРНК молекула. Листа модификованих нуклеотида садржи око педесет база.
Модификације пиримидина ( и ) су мање комплексне од модификација пурина (A и ). Осим модификација самих база, долази и до метилације на 2'-O позицији рибозног прстена. Најчешће модификације уридина су једноставне. Метилација у позицији 5 креира риботимидин (). База је иста са базом тимидина, али је везана за рибозу уместо дезоксирибозе. Дихидроуридин () се формира засићењем двоструке везе, чиме се мења прстен. У псеудоуридину (Ψ) су замењене позиције и атома прстена, док 4-тиоуридин има сумпор уместо кисеоника. Нуклеозид инозин се нормално јавља у ћелијама као интермедијар пута биосинтезе пурина. Он се не уноси директно у РНК, него се формира модификацијом аденозина. Друге модификације анаденозина су додаци комплексних група. Две комплексне серије нуклеозида се формирају променом гуанозина. Q базе попут кјуозина, имају додатни пентенилни прстен додат преко везе на метил групу 7-метилгуанозина. Пентенилни прстен може да носи различите групе. Y базе попут виозина, имају додатни прстен кондензован са пуринским прстеном. Тај додатни прсте има дугачак ланац на коме могу да буду присутне разне групе.[1]
Реакција модификација се обично састоје од промене или адиције постојећих база у тРНК. Изузетак је синтеза Q база, где специјални ензими замењују гуанозински остатак кјуозинским остатком у РНК. Реакција се састоји од раскидања и формирања веза са обе стране нуклеозида. Остали модификовани нуклеозиди се синтетишу специфичним тРНК модификујућим ензимима. Оригинални нуклеозид присутан у датој позицији се може одредити било поређењем секвенце тРНК са геном или путем изоловања прекурсорског молекула коме недостају неке или све модификације. Секвенце прекурсора показују да се различите модификације уводе у различитим фазама током матурације ДНК. Неке модификације су константне особине свих тРНК молекула, на пример остаци по којима је формирано име Д рука, и Ψ нађен у секвенци. На 3' крају антикодона се увек јавља модификовани пурин, мада модификација може знатно да варира. Друге промене су специфичне за поједине тРНК молекуле или групе тРНК молекула. На пример, виозинске базе су карактеристика тРНК код бактерија, квасаца и сисара.
Особине које препознају тРНК модификујући ензими су непознате. Кад је специфична модификација присутна на више места у тРНК молекулу то не мора да значи да је исти ензим направио све промене, на пример, различити ензими могу да буду потребни за синтезу псеудоуридина на свакој локацији. Постоји знатан број модификујућих ензима. Неки ензими врше појединачне реакције са индивидуалним РНК молекулима, док други имају шири опсег супстрата. Поједине промене се врше путем сукцесивног дејства више ензима. Најдиректнији учинак модификације је у антикодону, где промена секвенце утиче на способност везивања кодона, те одређује значење тРНК молекула. Промене на другим местима у близини антикодона исто тако утичу на везивање кодона. Промена база антикодона може да формира додатне обрасце упаривања база, као што су тиоурацил-гуанин, урацил-инозин, и аденин-инозин.
Функционисање ДНК је зависно од интеракција са протеинима. Протеинске интеракције могу да буду неспецифичне, или се протеин може везати за специфичну ДНК секвенцу. Ензими се такође везују за ДНК, и међу њима су посебно важне полимеразе које копирају ДНК секвенцу током транскрипције и репликације ДНК.
 |

Структурни протеини који се везују за ДНК су добро изучени примери неспецифичних ДНК-протеин интеракција. У хромозомима, ДНК је смештена у комплексима са структурним протеинима. Ти протеини организују ДНК у компактне хроматинске структуре. Код еукариота у њима је ДНК везана у комплексе са хистонима, док је код прокариота више типова протеина присутно.[378][379] Хистони формирају комплексе у облику диска, нуклеозоме. Те неспецифичне интеракције се формирају путем јонских веза између базних остатака хистона са киселом шећерно фосфатном основом ДНК, те су стога у знатној мери независне од секвенце база.[47]
Хемијске модификације базних аминокиселинских остатака су метилација, фосфорилација и ацетилација.[380] Те хемијске промене мењају јачину интеракције између ДНК и хистона, што чини ДНК мање доступном за транскрипционе факторе те се мења брзина транскрипције.[381] Други неспецифични ДНК везујући протеини у хроматину су групе протеина високе мобилности, које се везују да би се савила или искривила ДНК.[382] Ти протеини су важни у савијању група нуклеозоме и њиховог организовања у веће структуре које сачињавају хромозоме.[383]
Посебна група ДНК-везујућих протеина су протеини који се специфично везују једноланчану ДНК. Код људи, репликациони протеин А је најбоље изучени члан ове фамилије. Он учествује у процесима где је двоструки хеликс раздвојен, укључујући репликацију ДНК, рекомбинацију и поправку ДНК.[384] Везивање тих протеина стабилизује једноланчану ДНК и штити је од формирања матичних петљи (узрокованих упаривањем база исто ланца), као и од деградације нуклеазама.
Други протеини су еволуирали да се вежу за специфичне ДНК секвенце. Међу њима су најинтензивније студирани различити транскрипциони фактори, који регулишу транскрипцију. Сваки транскрипциони фактор се везује за један специфичан сегмент ДНК секвенце, и активира или инхибира транскрипцију гена који имају те секвенце у близини њихових промотера. Транскрипциони фактори делују на два начина. Они могу да се вежу за РНК полимеразу одговорну за транскрипцију, било директно или путем других посредничких протеина. Тиме се доводи полимераза на промотер и омогућава почетак транскрипције.[385] Алтернативно, транскрипциони фактори се могу везати за ензиме који модификују хистоне на промотерима. Тиме се мења приступачност ДНК темплета за полимеразе.[386]
Ови ДНК циљеви се могу јавити широм генома једног организма, те стога промене у активности једног типа фактора транскрипције фактора могу да утичу на хиљаде гена.[387] Консеквентно, ти протеини су често мета за процесе преноса сигнала који контролишу одговоре на промене у околини, или на ћелијску диференцијацију и развој. Специфичност интеракција транскрипционих фактора са ДНК молекулом се производи контактом протеина са ивицама ДНК база, што им омогућава да „читају” ДНК секвенце. Већина тих интеракција са базама се одвија у главном жлебу, где су базе најприступачније.[22]


Нуклеазе су ензими који пресецају ДНК ланце путем катализовања хидролизе фосфодиестарских веза. Нуклеазе које хидролизују нуклеотиде са крајева ДНК ланаца се називају ексонуклеазе, док ендонуклеазе могу да пресецају унутар ланаца.
Егзонуклеазе одвајају један по један нуклеотид са краја полинуклеотидног ланца. Реакцијом хидролизе се раскидају фосфодиестерске везе са било 3’ или 5’ краја. Еукариоти и прокариоти имају три типа егзонуклеаза које учествују у нормалном промету иРНК: 5’ до 3’ егзонуклеаза, која је зависна од декапирајућег протеина, 3’ до 5’ егзонуклеаза, која је независтан протеин, и поли(А)-специфична 3’ до 5’ егзонуклеаза.[392][393]
Најчешће коришћене нуклеазе у молекуларној биологији су рестрикционе ендонуклеазе, које пресецају ДНК на специфичним секвенцама. На пример, ензим препознаје шестобазну секвенцу и пресеца је на месту означеном вертикалном линијом. У природи, ти ензими штите бактерије против фагне инфекције. Након уноса фагне ДНК у бактеријску ћелију на њу делује рестрикциони модификациони систем.[394] У технологији се нуклеазе специфичне за поједине секвенце користе у молекулском клонирању и ДНА рекомбинацији.
Флап ендонуклеазе (такође познате као 5' нуклеазе у старијој литератури) су класа нуклеолитичких ензима који делују као 5'-3' егзонуклеазе и структурно специфичне ендонуклеазе на специјализованим ДНК структурама које се јављају током репликације, поправке и рекомбинације ДНК. Флап ендонуклеазе су идентификоване код еукариота, прокариота, археја и неких вируса. Организми могу да имају више од једног хомолога. Ова редундантност може да служи као индикација важности ових ензима. Код прокариота, флап ендокриназе су присутне на -терминусном домену ДНК полимеразе I. Неки прокариоти кодирају и други хомолог.[395][396][397]
| Ензим | Извор | Секвенца препознавања | Пресецање |
|---|---|---|---|
| Ешерихија коли |
Многе ендонуклеазе пресецају ДНК у позицијама које нису директно једна наспрам друге, те се старају препусти. Пример такве нуклеазе је .[398][399] Кад овај ензим наиђе на своју секвенцу препознавања, он пресеца сваки ланац између и најближег А базног остатка. Након пресецања, новонастали фрагменти се држе заједно само посредством релативно слабих водоничних веза које спрежу комплементарне базе. Мала јачина ових веза омогућава ДНК фрагментима да се одвоје један од другог. Сваки резултујући фрагмент има истурени 5' крај који се састоји од неспарених база. Други ензими пресецају ДНК ланце на супротан начин тако да се формирају истурени 3' крајеви. Ови једноланчани крајеви, 3' и 5', се понекад називају лепљиви крајеви зато што они имају тенденцију да се везују са комплементарним секвенцама база. Другим речима, ако неспарени сегмент база наиђе на други неспарени сегмент са секвенцом () они ће се везати један за други. Лигазе затим спајају фосфатне основе та два молекула. Ћелијско порекло лепљивих крајева нема утицаја на њихову способност спајања. Сваки пар комплементарних секвенци има тенденцију везивања, чак и у случају комбинација дугачких хуманих ДНК секвенци и бактеријске ДНК. Ово својство омогућава производњу рекомбинантних ДНК молекула, који се састоје од ДНК фрагмената из различитих извора, и који су формирани применом техника генетичког инжењеринга.

Ензими ДНК лигазе могу да споје одсечене или покидане ДНК ланце.[400][401][402] Лигазе су посебне важности у репликацији ДНК заостајућег ланца, где оне спајају кратке сегменте ДНК произведене на репликационој виљушци у комплетну копију ДНК темплета. Оне се такође користе у ДНК поправци и генетичкој рекомбинацији.[400]
Механизам рада ДНК лигазе се састоји од формирања две ковалентне фосфодиестарске везе између 3' хидроксилног краја једног нуклеотида, (акцептора) и 5' фосфатног краја другог (донора). АТП је неопходан за одвијање реакције посредоване лигазом. Реакција се одвија у три степена: (1) аденилација (адиција АМП-а) аминокиселинског остатка у активном центру ензима, пирофосфат се ослобађа; (2) трансфер АМП-а на 5' фосфат донора, чиме се формира пирофосфатна веза; (3) формирање фосфодиестарске везе између 5' фосфата донора и 3' хидроксила акцептора.[403][404][405]
Лигаза такође може да спаја тупе крајеве, мада су више концентрације ензима и различити експериментални услови неопходни.[406][407]
Код сисара постоје четири специфична типа лигазе.[408]
ДНА лигаза код користи енергију стечену раскидањем никотинамид аденин динуклеотида (НАД) да формира фосфодиестерску везу.[356] ДНК лигаза еукариота као и неких микроба користи аденозин трифосфат (АТП) уместо НАД-а.[356]

Постоје три главна типа топологије: супернамотавање, учворавање и катенација. Изван есенцијалних процеса репликације или транскрипције, ДНК се одржавана у компактном облику, и ова три тополошка стања помажу у томе.[57] Међутим, у току транскрипције или репликације ДНК мора бити слободна, те ова три стања знатно ометају процес. Додатно, током репликације, новоформирани и оригинални ДНК дуплекси се испреплећу и морају бити комплетно раздвојени да би се одржао геномски интегритет ћелија током деобе. Како транскрипциони мехур напредује, ДНК испред транскрипционе виљушке постаје прекомерно увијена, или позитивно супернамотана, док ДНК иза транскрипционог мехура постаје одвијена, или негативно супернамотана.
Топоизомеразе могу да реше ове тополошке проблеме. Оне су ензими са нуклеазном и лигазном активношћу. Ови протеини мењају количину супернамотавања у ДНК молекулу. Део ензима ове групе делује тако што пресецају ДНК хеликс и омогућавају једној секцији да ротира, чиме се умањује њен ниво супернамотавања. Ензим затим затвара ДНК прекид.[56] Други типови ових ензима имају способност прекидања једног ДНК хеликса и затим пропуштања другог ланца кроз овај прекид, пре него што поново споје хеликс.[410]
Топоизомеразе се деле на два типа на основу броја пресечених ланаца у једном кругу деловања:[411] Обе класе ензима користе конзервирани тирозин, међутим ови ензими су структурно и механистички различити.
Оба типа (I и II) топоизомеразе мењају ДНК коефицијент везивања.[412] Топоизомеразе типа мењају коефицијент везивања за један, тип и тип топоизомеразе мењају тај параметар за било који цео број, док тип и тип топоизомеразе мењају коефицијент везивања за два.
Хеликазе су протеини који су тип молекулских мотора. Оне користе хемијску енергију нуклеозид трифосфата, предоминантно АТП-а, да раскину водоничне везе између база и да одвију ДНК двоструки хеликс у једноструке ланце.[413] Ови ензими су есенцијални за већину процеса у којима је неопходно да се раздвоје ланци ДНК ланци (репликација ДНК, транскрипција, транслација, рекомбинација, ДНК поправка, биогенеза рибозома). Оне се постепено крећу дуж двоструког ланца нуклеинске киселине. Правац и механизам дејства су зависни од типа ензима.[414]

Хеликазе попримају различите структуре и олигомеризациона стања. хеликазе имају облик хексамерног прстена. Други ензими су активни у облику мономера или димера. Испитивања су показала да хеликазе могу да делују пасивно, чекајући да дође до некаталисаног одвијања након чега оне раздвајају ланце,[416] или да активно учествују у сепарацији ланаца користећи енергију генерисану хидролизом АТП-а.[417] У овом другом случају, хеликазе делују попут молекулских мотора, одвијајући и транслоцирајући свој супстрат користећи хемијску енергију.[418] Хеликазе могу да функционишу много брже ин виво него ин витро услед присуства помоћних протеина који посредују дестабилизацију ДНК рачве.[418]
Хеликазе се класификују у неколико суперфамилија. Све хеликазе везују АТП, и стога садрже класичне мотиве: Валкер А (петља везивања фосфата или П-петља) и Валкер Б (аспартична киселина за везивање ).[414]
Ове суперфамилије не обухватају све познате хеликазе. На пример, [422] i [423] су хеликазе које нису сврстане у горе наведене фамилије.
Дефекти гена који кодирају хеликазе могу да узрокују Вернеров синдром. То је поремећај који је препознатљив по појави превременог старења.[424][425]

Полимеразе су ензими који синтетишу полинуклеотидне ланце из нуклеозидног трифосфата. Секвенце њихових продуката су копије постојећих полинуклеотидних ланаца — који се називају темплетима. Ови ензими функционишу тако што додају нуклеотиде на 3’ хидроксилну групу претходног нуклеотида у ДНК ланцу. Консеквентно, све полимеразе иду у 5’ ка 3’ смеру.[427] У активном месту тих ензима, нови нуклеозид трифосфат формира базни пар са темплетом, чиме омогућава полимерази да прецизно синтетише комплементарни ланац. Полимеразе се класификују по типу темплета који користе.
Током репликације ДНК, ДНК полимеразе формирају копију ДНК секвенце. Прецизност је од виталног значаја у овом процесу, тако да многе полимеразе имају способност вршења корекција. Полимераза лако препознаје повремене грешке у реакцији синтезе зато нема базног спаривања између неусклађених нуклеотида. Ако се неслагање детектује, 3’ ка 5’ егзонуклеаза се активира и погрешна база се уклања.[428] У већини организама, ДНК полимеразе функционишу унутар великих комплекса. Они се називају реплизомима и садрже низ помоћних подјединица, као што су ДНК стеге и хеликазе.[429]
ДНК полимеразе које су зависне од РНК су специјализована класа полимераза која копира секвенцу РНК ланца у ДНК. У ову класу се убрајају реверзна транскриптаза, која је вирални ензим који учествује у инфекцији ћелија ретровирусима, и теломераза, која је неопходна за репликацију теломера.[111][430] Теломераза је необична полимераза зато што садржи свој сопствени РНК темплет, као интегрални део своје структуре.[113]
Транскрипцију изводи ДНК-зависна РНК полимераза која копира секвенцу ДНК ланца у РНК. Да би започела транскрипцију гена, РНК полимераза се веже за ДНК секвенцу промотера и раздвоји ДНК ланце. Она затим копира секвенцу гена на иРНК транскрипт док не дође до ДНК региона који се назива терминатор, где се зауставља и одваја од ДНК. Као и ДНК полимеразе, РНК полимераза II, ензим који транскрибује већину гена у геному еукариота, оперише као део већег протеинског комплекса са вишеструким регулаторним подјединицама.[431][432][433] РНК полимераза II је комплекс са масом од 550 , који се састоји од дванаест подјединица. II је најбоље испитани тип РНК полимеразе. Знатан број транскрипционих фактора је неопходан да би се овај ензим везао за промотере и почео транскрипцију.
ДНК садржи генетичке информације које омогућавају свим животним формама да функционишу, расту и размножавају се. Међутим, није јасно колико дуго је током задњих четири милијарде година историје живота ДНК обављала ту функцију. По једној претпоставци најраније форме живота су користиле РНК као основу генетичког материјала.[434][435] Могуће је да је РНК деловала као централни део раног ћелијског метаболизма пошто она има способност преноса генетичке информације, као и извођења катализе у оквиру рибозима.[436] Такав древни РНК свет у коме би нуклеинска киселина била коришћена за катализу и генетику је можда утицао на еволуцију садашњег генетичког кода базираног на четири нуклеотидне базе. До тога би дошло, пошто би број различитих база у таквом организму био компромис између малог броја база којим се повећава репликациона прецизност и већег броја база којим се увећава каталитичка ефикасност рибозима.[437]
Не постоје директни докази за постојање таквих древних генетичких система. Разлог за то је ДНК екстракција из велике већине фосила није могућа пошто ДНК може да опстане мање од милион година. У влажној средини она се временом разлаже у кратке фрагменте.[438] Упркос томе, налази старије ДНК су били објављени. На пример, познат је извештај о изолацији одрживе бактерије из кристала соли старог 250 милиона година.[439] Ти налази су контроверзни.[440][441]
Један извештај објављен августа 2011. који је базиран на НАСА испитивањима метеорита нађеног на Земљи сугерише да градивни блокови ДНК (аденин, гуанин и сродни органски молекули) можда имају ванземаљско порекло.[442][443][444]

Генетички инжењеринг је директна људска манипулација генома неког организма користећи модерну ДНК технологију. Она обухвата увођење стране ДНК или синтетичких гена у организам. Увођење нове ДНК не захтева употребу класичних генетичких метода, међутим традиционални методи узгоја се типично користе за пропагацију рекомбинантних организама. Организам који је формиран увођењем рекомбинантне ДНК се сматра генетички модификованим организмом. Први генетички модификовани организми су биле бактерије 1973. и затим мишеви 1974. Бактерије које производе инсулин су комерцијализоване 1982. и генетички модификована храна је у продаји од 1994.
Методе су развијене за ДНК пречишћавање из ћелија организма, као што је фенол-хлороформна екстракција, и за њену лабораторијску манипулацију, нпр. рестрикциона разлагања и полимеразна ланчана реакција. Модерна биологија и биохемија интензивно користе те технике у оквиру рекомбинантне ДНК технологије. Рекомбинантна ДНК је вештачка ДНК секвенца која је формирана од других ДНК секвенци. Такве секвенце се могу унети у организам у облику плазмида или у одговарајућем формату, користећи вирални вектор.[445]
Најчешћа форма генетичког инжењеринга је уметање новог генетичког материјала на непознатој локацији у геному домаћина. То се остварује изоловањем и копирањем жељеног генетичког материјала користећи методе молекулског клонирања да би се формирала ДНК секвенца која садржи неопходне генетичке елементе за експресију, и затим њено уметање у организам домаћина. Друге форме генетичког инжењеринга су циљање гена (замена базирана на хомологној рекомбинацији) и уклањање (нокаут) специфичних гена путем пројектованих нуклеаза као што су нуклеазе цинковог прста,[446] или пројектоване хоминг ендонуклеазе.[447]
Технике генетичког инжењеринга се користе у бројним пољима научних истраживања, биотехнологији, и медицини. Генетички модификовани организми налазе примену у изради производа као што су рекомбинантни протеини, они се користе у медицинским истраживањима,[448] и као пољопривредни усеви.[449][450][451] Лекове као што су инсулин и људски фактор раста производе бактерије, експериментални мишеви као што су онкомишеви и нокаут мишеви се користе у истраживањима, репеланти инсеката и/или усеви толерантни на хербициде су комерцијализовани. Генетички модификоване биљке и животиње које имају способност производње биотехнолошких лекова уз мање трошкове производње од садашњих метода се такође развијају. ФДА је 2009. одобрила продају фармацеутског протеина антитромбина произведеног у млеку генетички модификоване козе.[452]
Форензичка анализа може да користи ДНК из крви, сперме, коже, пљувачке или косе нађене на месту злочина за идентификацију подударајуће ДНК неке особе, као што је починилац. Овај процес се формално назива ДНK профилисање, а познат је и као „узимање генетичког отиска”. Мада је 99,9% ДНК секвенци исто код свих људи, довољна количина ДНК се разликује, тако да могуће разликовати једну особу од друге, уколико оне нису монозиготни близанци.[453] У ДНК профилисању, дужина променљивих секција понављајуће ДНК, као што су кратка тандемна понављања и минисателити,[454] се пореде између људи. Тај метод је обично изузетно поуздана техника за идентификацију подударне ДНК.[455] Међутим, идентификација може да буде компликована ако је место злочина контаминирано са ДНК-ом од неколико људи.[456][457] ДНК профилисање је развио 1984. британски генетичар Сир Алек Џефриз,[458] и први пут је коришћено у форензичкој науци да се осуди Колин Пичфорк 1988, у случају Ендерби убистава.[459]
Развој форензичке науке, и способности да се добију генетичка подударања коришћењем веома малих узорака крви, коже, пљувачке или косе је довела до поновног испитивања бројних случајева. Генетичким профилисањем се може произвести евиденција која није постојала током оригиналног испитивања. У комбинацији са уклањањем закона о поновљеним судским процесима, постало је могуће да се поново отворе случајеви са ранијим неуспешним пресудама услед недостатка евиденције. Од људи оптужених за тешке злочине се захтева да дају узорак ДНК ради профилисања. Резултати ДНК профилисања се често доводе у питање тврдњама о контаминацији током узимања узорака. То је довело до развоја детаљних и строгих процедура руковања узорцима нових случајева тешких кривичних дела.[460] ДНК профилисање се такође користи за идентификацију жртава масовних инцидената.[461] Осим позитивне идентификације тела или делова тела озбиљних инцидената, ДНК профилисање се успешно користи и за идентификацију жртава у масовним ратним гробницама, путем ДНК поређења са члановима породице.[462]
Биоинформатика се бави манипулацијом, претраживањем и анализом биолошких података, што обухвата ДНК секвенце. Термин биоинформатика је скован пре почетка „геномске револуције”. Паулиен Хогевег и Бен Хеспер су увели овај термин 1978. са значењем „студирање информационих процеса у биолошким системима”.[463][464] Ова дефиниција ставља биоинформатику као поље паралелно са биофизиком или биохемијом.[464] Међутим, њена примарна употреба од касних 1980-их је било описивање примене информатике и информационих наука у анализи биолошких података, посебно у областима геномике које се баве ДНК секвенцирањем великих размера.
Током задњих неколико декада брз развој геномике и других молекуларних истраживачких технологија, у комбинацији са развојем информационих технологија су произвели огромне количине молекуларно биолошких информација. Развој техника за складиштење и претраживање ДНК секвенци су довели до широке примене софистициране информатике, посебно алгоритама за претрагу низова, машинског учења и теорије база података.[465] Претраживање низова или примена алгоритама подударања, који налазе појаву секвенце слова унутар веће секвенце слова, су развијени специфично за претраживање нуклеотидних секвенци.[466] ДНК секвенца се може поравнати са другим ДНК секвенцама да би се идентификовале хомологне секвенце и лоцирале специфичне мутације које их чине особеним. Те технике, а посебно поравнавање вишеструких секвенци, се користе у студирању филогенетичких односа и протеинске функције.[467]

Податке који обухватају целокупне геноме, као што су на пример подаци које је произвео Пројекат људског генома, је тешко користити без записа који идентификују локације гена и регулаторних елемената на сваком хромозому. Региони ДНК секвенце који имају карактеристичне обрасце асоциране са протеинским или РНК кодирајућим генима се могу идентификовати применом алгоритама за предвиђање гена, који омогућавају формирање хипотеза о постојању специфичних генских производа и о њиховим могућим функцијама у поједином организму пре него што дође до њихове експерименталне идентификације и изолације.[468] Поређења целокупних генома могу да дају индикације о еволуционој историји појединог организма и омогуће разматрање комплексних еволуционих догађаја.
Биоинформатика је примењивана од самог почетка „геномске револуције”. Она се користи у формирању и одржавању база података за складиштење биолошких информација, као што су нуклеотидне и аминокиселинске секвенце. Развој тог типа база података се састоји не само од пројектовања структуре података, него и од развоја комплексних интерфејса који омогућавају приступ постојећим подацима, као и уноса нових или ревидираних података.
Да би се изучавало како се нормалне ћелијске активности мењају у различитим стањима болести, биолошки подаци се морају комбиновати. На тај начин се формира свеобухватна слика тих активности. Поље биоинформатике је еволуирало тако што је фокус стављен на анализу и интерпретацију мноштва различитих типова података. То обухвата нуклеотидне и аминокиселинске секвенце, протеинске домене, и протеинске структуре.[469] Сам процес анализирања и интерпретације података се назива рачунска биологија. Важне поддисциплине у оквиру биоинформатике и рачунске биологије су:
Примарни циљ биоинформатике је повећавање разумевања биолошких процеса. Оно што је издваја од других приступа је њен фокус на развоју и примени рачунарски интензивних техника за постизање овог циља. Неки од примера тога су: алгоритми за препознавање образаца, анализу података и машинско учење, као и технике за визуелизацију биолошких података. Главни истраживачки напори у области укључују поравнавање секвенци, налажење гена, изучавање структуре генома, дизајн лекова, откривање лекова, структурно поравнавање протеина, предвиђање протеинске структуре, предвиђање експресије гена и протеин-протеин интеракција, изучавања геномских асоцијација и моделовање еволуције.
Постоје два фундаментална начина моделовања биолошких система (нпр. живих ћелија).
Структурна биоинформатика је широка поткатегорија биоинформатике. Она се бави анализом и предвиђањем тродимензионалне структуре биолошких макромолекула као што су протеини, РНК и ДНК. Она производи генерализације макромолекуларних 3Д структура као што су поређења свеукупних савијања и локалних мотива, принципи молекуларног савијања, еволуције и интеракције везивања, и односи структуре и функције. Она ради са експериментално уређеним структурама и формира рачунарске моделе. Термин структурна има еквивалентно значење као и у структурној биологији. Структурна биоинформатика се сматра делом рачунарске структурне биологије.

ДНК нанотехнологија користи јединствена својства молекулског препознавања ДНК и других нуклеинских киселина да креира самостално формирајуће разгранате ДНК комплексе који имају низ корисних особина.[471] На овај начин се ДНК употребљава као структурни материјал уместо као носилац биолошких информација. То доводи до креирања дводимензионих периодичних решетки (у облику плочица и користећи „ДНК оригами” метод), као и тродимензионе структуре у облику полиедра.[472]
Наномеханички уређаји и алгоритамско самостално формирање су исто тако били демонстрирани.[473] Те ДНК структуре су биле коришћене као темплет за организовање других молекула као што су наночестице злата и стрептавидински протеини.[474]
Концептуалну основу ДНК нанотехнологије је положио Надријан Симан током раних 1980-их, а поље је почело да привлачи широко интересовање почетком и средином 2000-их. Ова област почиње да се користи као извор оруђа за решавање проблема базне науке у структурној биологији и биофизици, укључујући примену у кристалографији и спектроскопији за демонстрацију протеинске структуре. Потенцијалне практичне примене у електроници молекуларних сразмера и наномедицини се такође истражују.
ДНК нанотехнологија се понекад дели у два преклапајућа потпоља: структурну ДНК нанотехнологија и динамичку ДНК нанотехнологија. Структурна ДНК нанотехнологија има фокус на синтези и карактеризацији нуклеинско киселинских комплекса и материјала који се склапају у статичко, равнотежно крајње стање. С друге стране, динамичка ДНК нанотехнологија се усредсређује на комплексе са корисним неравнотежним понашањем, као што је способност да се промени конфигурације након хемијских и физичких стимулуса. Неки комплекси комбинују својства оба, структурног и динамичког потпоља, нпр. нуклеинско киселински наномеханички уређаји.[475][476]

Комплекси конструисани применом структурне ДНК нанотехнологије користе разгранате структуре нуклеинске киселине која садржи тачке спајања, за разлику од већине биолошке ДНК, која се јавља као неразгранати двоструки хеликс. Једна од најједноставнијих разгранатих структура, и прво направљена, је четворострука раскрсница која се састоји од четири индивидуална ДНК ланца, чије порције су комплементарне и имају специфичан образац. За разлику од природног Холидејовог споја, свака рука у вештачком непокретном споју има различиту базну секвенцу, те је раскрсница фиксна у одређеној позицији. Вишеструки спојеви се могу комбиновати у истом молекулу. У најширој употреби су мотиви „двоструких скретница” (DX). Тај мотив се састоји од два паралелна двострука хеликсна домена, где индивидуални ланци прелазе из једног домена у други у двема тачкама рачвања. Свака тачка рачвања је са тополошког гледишта раскрсница са четири руке, која је ограничена у једној оријентацији, што је у контрасту са флексибилним раскрсницама. Та крутост чини мотив подесним структурним градивним блоком за веће ДНК комплексе.[478][479]
Динамичка ДНК нанотехнологија често користи механизам полазном тачком посредованог замењивања ланца да би се омогућила реконфигурација комплекса нуклеинске киселине. У овој реакцији, ланац се везује за регион једноланчане почетне тачке дволанчаног комплекса, и затим замењује један од ланаца везаних за оригинални комплекс путем процеса миграције гране. Свеукупни ефекат је замена једног ланца комплекса, што омогућава да присуство првог ланца делује као прекидач за контролу реконфигурације комплекса.[475] Могуће је направити структуре и уређаје користећи функционалне нуклеинске киселине као што су дезоксирибозими и рибозими, који могу да изводе хемијске реакције, и аптамере, који могу да вежу специфичне протеине или мале молекуле.[480]
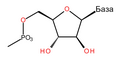 АНК (арабиноза) |  ФАНК (2´-флуороарабиноза) |
 ТНК (треоза) |  ЛНК („закључана” рибоза) |
 ЦеНК (циклохексен) |  ХНК (анхидрохекситол) |
Складиштење и манипулација генетичке информације се у природи ослањају на само два полимера, ДНК и РНК. Није у потпуности разјашњено да ли је ова њихова улога одражава еволуциону историју или фундаментална функционална ограничења молекула. Применом пројектованих полимераза се може показати да се генетичка информација може чувати и користити применом низа алтернативних генетичких полимера базираних на једноставној архитектури нуклеинских киселина које се не јављају у природи, ксенонуклеинских киселина (КНК). Подесним избором КНК аптамера, који се везују за своје циљеве са високим афинитетом и специфичношћу, показано је да поред наследности, специфичне ксенонуклеинске киселине имају способност Дарвинске еволуције и формирања дефинисаних структура. Недавно је објављена студија у којој су описана својства шест алтернативних генетичких полимера који се могу користити за чување и пропагирање информације. Из тога произилази да наследност и еволуција, два обележја живота, нису ограничена на ДНК и РНК него да су вероватно појавни облици полимера који имају способност складиштења информација.[481]
Развој ксенонуклеинских киселина означава почетак ере синтетичке генетике, са импликацијама за астробиологију, биотехнологију и разумевање живота. Досадашњи кораци изван биолошке генетике су скромни. Они обухватају КНК молекуле, који су аналогни са биолошким нуклеинским киселинама. Њихов шећер или шећеру слична компонента није рибоза. Она је замењена различитим шећерима са пет угљеника (арабинозом у АНК, 2´-флуороарабинозом у ФАНК), шећером са четири угљеника (треозом у ТНК), и „закључаним” рибозним аналогом у ЛНК, или структурама са шесточланим прстеном (циклохексеном у ЦеНК, анхидрохекситолом у ХНК). Изучавање ксенонуклеинских киселина је инспирисано питањем о првом генетичком полимеру на Земљи. Можда је то била РНК, али је исто тако могуће да је то била нека од једноставнијих структура које би биле доступније путем пребиотичке синтезе.[482] ТНК и гликолна нуклеинска киселина (ГНК) су примарни кандидати.[483][484] Други разлог за изучавање ксенонуклеинских киселина је њихова примена у облику агенаса који се везују и инхибирају функције биолошких рибонуклеинских киселина. Свих шест Пинхеирових ксенонуклеинских киселина се везују за комплементарне РНК и ДНК, и отпорне су на деградацију биолошким нуклеазама.[481] Конструкција генетичког система базираног на алтернативним хемијским платформама могла би коначно да доведе до синтезе нових форми живота.
Садашњи степен развоја омогућава репликацију КНК реверзним транскрибовањем до ДНК, њеним умножавањем путем ПЦР, и затим транскрибовањем ДНК назад у КНК. У сваком степену се користе полимеразе. Конверзија у ДНК је неопходна за амплификацију.[485] Кључни корак у XНК истраживањима је био развој варијанти полимераза који имају способност копирања информације између XНК и ДНК. XНК полимери са више од 70 подјединица и скоро свака секвенца се може копирати, са просечном тачношћу од 95% (за ЛНК) до 99,6% (за ЦеНК). Тај профил је довољан за спровођење усмерене еволуције функционалних КНК молекула. Применом тог процеса на ХНК полимере је показано је да они могу да еволуирају у лабораторији тако да се добијају функционални молекули (аптамери) који се чврсто и специфично везују за жељени РНК или протеински молекул. Развој полимераза које могу да копирају КНК на њен сопствени комплемент, или да копирају информације између две различите КНК, је у току. До сада, ФАНК и ЦеНК су биле копиране на њихове комплементе, и ЦеНК је била копирана на ХНК, али су ти процеси знатно мање ефикасни него копирање између КНК и ДНК.
Још један важан разлог за настављање развоја функционалних КНК је добијање једињења за потенцијалну примену у науци о материјалима, молекуларној дијагностици, и лековима. Аптамери нуклеинских киселина су већ нашли широку примену у тим областима. Међутим, РНК и ДНК су подложни дејству биолошких нуклеаза, те се они морају модификовати да би се одржали у природним условима. КНК молекули су вештачки те нису подложни дејству нуклеаза. Корист од њихових необичних хемијских особина се мора одмеравати са њиховом већом ценом, непосредно, и у контексту рада у неистраженом домену КНК биохемије.
ДНК током времена сакупи мутације које се преносе са колена на колено, те стога ДНК садржи историјске информације. Поређењем ДНК секвенци се може пратити еволуциона историја организама, њихова филогенија.[486] Ово подручје филогенетике је богат извор информација о еволуционој биологији. Популационо генетички увид у историју појединих популација се може добити путем поређења ДНК секвенци унутар врста. Тај приступ налази примену у широком спектру студија од еколошке генетике до антропологије. Популациона генетика је студија дистрибуције фреквенције алела и промена под утицајем четири главна еволуциона процеса: природна селекција, генетички дрифт, мутација и проток гена. Она исто тако узима у обзир факторе рекомбинације, популационе потподеле и популационе структуре. Популациона генетика покушава да објасни феномене попут адаптације и специјације.
Генетичка генеалогија је примена генетике у традиционалној генеалогији. Генетичка генеалогија обухвата употребу генеалошког ДНК тестирања ради одређивања нивоа генетичких односа између појединаца. Два најчешће коришћена типа генетичких генеалошких тестова су -ДНК (очинска линија)[487] и мтДНК[488] (материнска линија).[487]
Ови тестови се састоје од поређења појединих ДНК секвенци пара особа да би се проценила вероватноћа да они имају заједничког претходника у генеалошком временском оквиру. Применом Бајесовог модела који је објавио Брус Волш, за процену броја генерација које раздвајају две особе од њиховог најскоријег заједничког претка.[489]
Y-ДНК тестирање обухвата кратка тандемна понављања (), а понекад и тестирање једнонуклеарних полиморфизама () Y-хромозома. Овај хромозом је присутан само код мушкараца, те даје информације само о очинској линији. Ови тестови могу да пруже увид у недавно () и древно () генетичко порекло. Y-хромозомни тест садржи хаплотип који је сличан код свих мушких потомака заједничког мушког претка. тестови се користе за сврставање људи у очинске хаплогрупе, које дефинишу знатно већу генетичку популацију.
мтДНК тестирање обухвата секвенцирање региона, региона или оба. мтДНК тест може такође да садржи додатне СНП-ове који су потребни за сврставање људи у материнске хаплогрупе, или чак комплетну мтДНК.
Резултати Y-ДНК или мтДНК тестова се могу поредити са резултатима других особа употребом приватних или јавних ДНК база података.
ДНК је први изоловао швајцарски лекар Фридрих Мишер, који је 1869. открио микроскопску супстанцу у гноју одбачених завоја. Она се налазила у нуклеусима ћелија, те ју је он назвао „нуклеин”.[490] Албрехт Косел је 1878. изоловао непротеинску компоненту „нуклеина”, нуклеинску киселину. Он је касније изоловао и пет примарних нуклеобаза.[491] Фибус Лавин је 1919. идентификовао базу, шећер и фосфат нуклеотидне јединице.[492] Лавин је дошао до закључка да се ДНК састоји од низа нуклеотидних јединица повезаних фосфатним групама. Међутим, он је сматрао да је ланац кратак и да се базе понављају у фиксном поретку. Вилијам Астбури је 1937. произвео прве Рендгенске дифракционе обрасце који су показали да ДНК има уређену структуру.[493][494]

Николај Колтсов је 1927. предложио да се наследне особине могу преносити путем „гигантског молекула за наслеђивање” који би се састојао од „два комплементарна ланца који бе се копирали користећи један ланац као темплет”.[495] Фредерик Грифит је 1928. открио да се својство „глатког” облика бактерије може пренети на бактерије „неравног” облика исте врсте путем мешања мртвих глатких бактерија са живим грубим бактеријама.[496] Тај систем је пружио прву јасну индикацију да ДНК носи генетичке информације. Освалд Ејвери заједно са сарадницима Колином Маклаудом и Маклином Макартијем су идентификовали ДНК као носиоца трансформирајућег принципа 1943.[497] Улога ДНК молекула у наслеђивању је потврђена 1952, кад су Алфред Херши и Марта Чејс показали да је ДНК генетички материјал Т2 фага.[498]
Током 1950-их три групе су радиле на одређивању структуре ДНК. Са радом је прво започела група са Кингс колеџа у Лондону коју је предводио Морис Вилкинс и којој се касније придружила Розалинд Франклин. Друга група се састојала оф Франсиса Крика и Џејмса Вотсона у Кембриџу. Трећа група је радила на Калтеху и била је предвођена Линусом Паулингом. Крик и Вотсон су израдили физичке моделе користећи металне полуге и кугле, у којима се инкорпорисали познате хемијске структуре нуклеотида, као и познате позиције веза које спајају нуклеотиде дуж полимера. На Кингс колеџу Морис Вилкинс и Росалинд Франклин су изучавали рендгенске дифракционе обрасце ДНК нити. Од три групе, једино је лондонска група била у могућности да произведе дифракционе обрасце задовољавајућег квалитета и да тако генерише довољну количину квантитативних података о структури.
Џејмс Д. Вотсон и Франсис Крик су 1953. предложили први коректан модел двоструког хеликса ДНК структуре.[12] Њихов модел је био базиран на само једном рендгенском дифракционом снимку (обележеном као „Фотографија 51”)[499] који су снимили Росалинд Франклин и Рејмонд Гослинг маја 1952, као и информацији да су ДНК базе спарене, што је проистекло из приватне комуникације са Ервином Чаргафом током претходних година. Чаргафова правила су имала веома важну улогу у одређивању конфигурације двоструког хеликса за Б-ДНК као и за А-ДНК.
Експериментални докази који подржавају модел Вотсона и Крика су објављени у серији од пет чланака у истом издању часописа Природа.[500] Међу њима Франклинов и Гослингов чланак су били прва публикација њихових Рендгенских дифракционих података и оригинални метод анализе који је делом подржавао модел Вотсон и Крика.[84][501] То издање је такође садржало чланак о ДНК структури Мориса Вилкинса и двоје његових сарадника, чија анализа ин виво Б-ДНК Рендгенских образаца је такође подржавала присуство ин виво двоструког хеликса у ДНК конфигурације, као што су предложили Крик и Вотсон.[85] Франклин је преминула 1958. Вотсон, Крик и Вилкинс су добили Нобелову награду за физиологију или медицину 1962.[502][503]
У једној утицајној презентацији из 1957, Крик је изложио централну догму молекуларне биологије, која је предсказала однос између ДНК, РНК и протеина, и артикулисала хипотезу адаптера.[504] Финална потврда репликационог механизма који је произашао из структуре двоструког хеликса је уследила 1958. у облику Меселсон-Стахловог експеримента.[505] Даљим радом Крика и његових сарадника је показано да је генетички код базиран на непреклапајућим триплетима база, који се називају кодони. Генетички код су дешифровали Хар Гобинд Корана, Роберт Холи и Маршал Варен Ниренберг.[506] Ови налази означавају рођење поља молекуларне биологије.

Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.