DNK sekvenciranje
From Wikipedia, the free encyclopedia
DNK sekvenciranje obuhvata nekoliko metoda i tehnologija koje se koriste za određivanje redosleda nukleotidnih baza — adenin, guanin, citozin, i timin — u molekulu DNK.
Poznavanje DNK sekvence je postalo neophodno za bazna biološka istraživanja, kao i u brojnim primenjenim poljima kao što je dijagnostika, biotehnologija, forenzika i biološka sistematika. Unapređenje DNK sekvencirana je znatno ubrzalo biološka istraživanja. Velika brzina sekvenciranja koji pruža moderna tehnologija je omogućila sekvenciranje ljudskog genoma u okviru projekta ljudskog genoma. Srodni projekti, često ostvareni putem naučnih kolaboracija širom sveta, su proizveli kompletne DNK sekvence mnogih životinjskih, biljnih, i mikrobnih genoma.
Prve DNK sekvence su dobijene tokom 1970-tih. Njih su proizveli akademski istraživači koristeći tegobne metode bazirane na dvodimenzionoj hromatografiji. Nakon razvoja automatizovanih metoda sekvenciranja baziranih na boji,[1] DNK sekvenciranje je postalo lakše i za nekoliko redova veličine brže.[2]
Uskoro se planira sekvencioniranje DNK 1,5 miliona eukariotskih organizama što će otvoriti prostor istraživačima širom sveta za nova saznanja.
Četiri kanonične baze
Kanonska struktura DNK ima četiri baze: timin (T), adenin (A), citozin (C) i gvanin (G). Sekvenciranje DNK je određivanje fizičkog reda ovih baza u molekulu DNK. Međutim, postoje mnoge druge baze koje mogu biti prisutne u molekulu. Kod nekih virusa (konkretno, bakteriofaga), citozin može biti zamenjen hidroksi metilom ili hidroksi metil glukoznim citozinom.[3] U DNK sisara mogu se naći varijante baza sa metil grupama ili fosfosulfatom.[4][5] U zavisnosti od tehnike sekvenciranja, određena modifikacija, na primer, 5mC (5 metil citozin) uobičajena kod ljudi, može ili ne mora biti otkrivena.[6]
Istorija
Otkriće strukture i funkcije DNK
Dezoksiribonukleinsku kiselinu (DNK) je prvi otkrio i izolovao Fridrih Mišer 1869. godine, ali je ostala nedovoljno proučavana mnogo decenija, jer se smatralo da proteini, a ne DNK, održavaju genetski plan za život. Ova situacija se promenila posle 1944. kao rezultat nekih eksperimenata Osvalda Ejverija, Kolina Meklauda i Meklina Makartija koji su pokazali da prečišćena DNK može da promeni jedan soj bakterija u drugi. Ovo je bio prvi put da se pokazalo da je DNK sposobna da transformiše svojstva ćelija.
Godine 1953, Džejms Votson i Frensis Krik izneli su svoj model DNK sa dvostrukom spiralom, zasnovan na kristalizovanim rendgenskim strukturama koje je proučavala Rosalind Frenklin. Prema tom modelu, DNK se sastoji od dva lanca nukleotida umotanih jedan oko drugog, povezanih vodoničnim vezama i koji se kreću u suprotnim smerovima. Svaki lanac se sastoji od četiri komplementarna nukleotida - adenina (A), citozina (C), gvanina (G) i timina (T) - sa A na jednom lancu koji je uvek uparen sa T na drugom, a C uvek uparen sa G. Oni su predložili da takva struktura omogućava da se svaki lanac koristi za rekonstrukciju drugog, što je ideja koja je centralna za prenošenje naslednih informacija između generacija.[7]

Osnova za sekvencioniranje proteina je prvi put postavljena radom Frederika Sengera koji je do 1955. godine završio sekvencu svih aminokiselina u insulinu, malom proteinu koji luči pankreas. Ovo je pružilo prvi ubedljiv dokaz da su proteini hemijski entiteti sa specifičnim molekularnim uzorkom, a ne nasumična mešavina materijala suspendovanog u tečnosti. Sangerov uspeh u sekvenciranju insulina podstakao je rendgenske kristalografe, uključujući Votsona i Krika, koji su do tada pokušavali da shvate kako DNK usmerava formiranje proteina unutar ćelije. Ubrzo nakon što je prisustvovao nizu predavanja Frederika Sengera u oktobru 1954. godine, Krik je počeo da razvija teoriju koja je tvrdila da raspored nukleotida u DNK određuje redosled aminokiselina u proteinima, što je zauzvrat pomoglo da se odredi funkcija proteina. Ovu teoriju je objavio 1958. godine.[8]
RNK sekvenciranje
Sekvenciranje RNK bilo je jedan od najranijih oblika sekvenciranja nukleotida. Glavni orijentir sekvenciranja RNK je sekvenca prvog kompletnog gena i kompletnog genoma bakteriofaga MS2, koji su identifikovali i objavili Volter Fiers i njegovi saradnici na Univerzitetu u Gentu (Gent, Belgija), 1972.[9] i 1976. godine.[10] Tradicionalne metode sekvenciranja RNK zahtevaju stvaranje cDNK molekula koji se mora sekvencirati.[11]
Rane metode sekvenciranja DNK
Prvi metod za određivanje DNK sekvenci uključivao je strategiju proširenja prajmera specifičnu za lokaciju koju je uspostavio Rej Vu na Univerzitetu Kornel 1970. godine.[12] Kataliza DNK polimerazom i specifično obeležavanje nukleotida, od kojih su obe prominentne u trenutnim šemama sekvenciranja, korišćeni su za sekvenciranje kohezivnih krajeva DNK lambda faga.[13][14][15] Između 1970. i 1973. godine, Vu, R Padmanahan i nihovi saradnici su pokazali da se ovaj metod može koristiti za određivanje bilo koje DNK sekvence korišćenjem sintetičkih prajmera specifičnih za lokaciju.[16][17][18] Frederick Sanger je zatim usvojio ovu strategiju produžetka prajmera da bi razvio brže metode sekvenciranja DNK u MRC Centru, Kembridž, UK i objavio metodu za „sekvencionisanje DNK sa inhibitorima koji završavaju lanac“ 1977. godine.[19][20] Valter Gilbert i Allan Maksam sa Harvarda su takođe razvili metode sekvenciranja, uključujući i onu za „sekvencionisanje DNK hemijskom degradacijom“.[21][22] Godine 1973, Gilbert i Maksam su izvestili o sekvenci od 24 para baza koristeći metod poznat kao analiza lutajućih tačaka.[23] Napredak u sekvenciranju je potpomognut istovremenim razvojem tehnologije rekombinantne DNK, omogućavajući uzorcima DNK da se izoluju iz izvora koji nisu virusi.
Sekvenciranje punih genoma
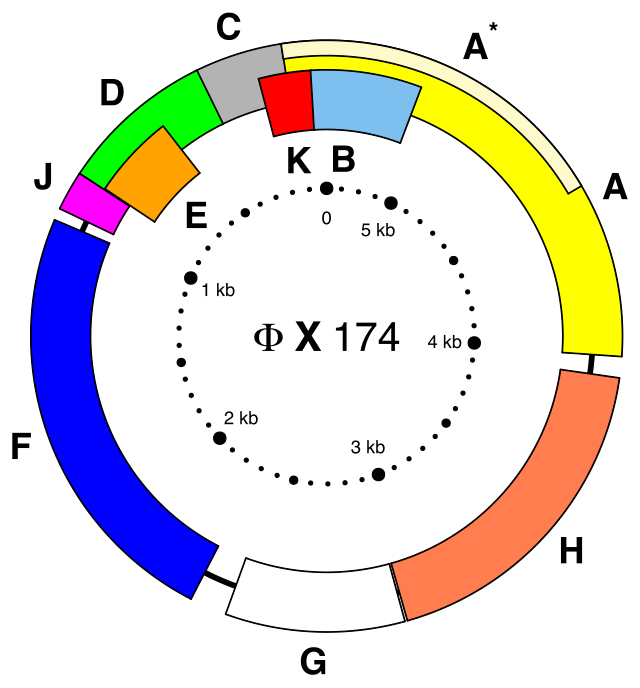
Prvi potpuni DNK genom koji je sekvencioniran bio je genom bakteriofaga φX174 1977. godine.[24] Naučnici Saveta za medicinska istraživanja dešifrovali su kompletnu DNK sekvencu Epštajn-Barovog virusa 1984. godine, otkrivši da sadrži 172.282 nukleotida. Završetak sekvence označio je značajnu prekretnicu u sekvenciranju DNK, jer je postignut bez prethodnog poznavanja genetskog profila virusa.[25]
Herbert Pol i saradnici su tokom ranih 1980-ih razvili su neradioaktivnu metodu za prenošenje molekula DNK reakcionih smeša za sekvencioniranje na imobilizujući matriks tokom elektroforeze.[26][27] Usledila je komercijalizacija DNK sekvencera „Direktno-blotirajuća-elektroforeza sistemom GATC 1500” od strane GATC Biotech, koji se intenzivno koristio u okviru EU programa za sekvenciranje genoma, kompletna DNK sekvenca hromozoma II kvasca Saccharomyces cerevisiae.[28] Laboratorija Leroja E. Huda na Kalifornijskom institutu za tehnologiju objavila je prvu poluautomatsku mašinu za sekvenciranje DNK 1986. godine.[29] Nakon toga je usledio marketing prve potpuno automatizovane mašine za sekvenciranje, ABI 370, od strane Applied Biosystems 1987. i Dupontov Genesis 2000[30] koji je koristio novu tehniku fluorescentnog obeležavanja koja omogućava da se sva četiri dideoksinukleotida identifikuju u jednoj traci. Do 1990. godine, američki Nacionalni instituti za zdravlje (NIH) započeli su opsežna ispitivanja sekvenciranja na Mycoplasma capricolum, Escherichia coli, Caenorhabditis elegans, i Saccharomyces cerevisiae po ceni od 0,75 USD po bazi. U međuvremenu, sekvencioniranje humanih cDNK sekvenci koje se nazivaju ekspresovane oznake sekvence počelo je u laboratoriji Krega Ventera, u pokušaju da se obuhvati deo kodiranja ljudskog genoma.[31] Godine 1995, Venter, Hamilton Smit i kolege sa Instituta za genomska istraživanja (TIGR) objavili su prvi kompletan genom slobodnog živog organizma, bakterije Haemophilus influenzae. Kružni hromozom sadrži 1.830.137 baza, a njegovo objavljivanje u časopisu Science[32] označilo je prvu objavljenu upotrebu obog vida sekvenciranja celog genoma, eliminišući potrebu za početnim naporima za mapiranje.
Reference
Wikiwand - on
Seamless Wikipedia browsing. On steroids.