Estar
From Wikipedia, the free encyclopedia
Remove ads
Estri (nem. , što je stari naziv za etil-etanoat) organska su jedinjenja koja u svojim molekulima sadrže ostatak molekula kiseline i ostatak molekula alkohola.[1] Estri daju miris voću, povrću i četinarima. Njihova opšta formula je: . U hemiji, estar je funkcionalna grupa izvedena iz kiseline (organske ili neorganske) u kojoj je atom vodonika (H) najmanje jedne kisele hidroksilne grupe (−OH) te kiseline zamenjen organskom grupom (R′) . Analogi dobijeni od kiseonika zamenjenog drugim halkogenima takođe pripadaju kategoriji estara.[2] Prema nekim autorima, organski derivati kiselog vodonika drugih kiselina su takođe estri (npr. amidi), ali ne prema IUPAC.[2]


Estri dobijaju nazive u zavisnosti od toga koji je alkohol i koja kiselina izreagovala. Ako je recimo, reagovao etanol i etanska kiselina, dobija se estar koji se naziva etil-etanoat ili etil-acetat. Taj naziv je izveden od etil-grupe alkohola i naziva soli etanske kiseline. Soli etanske kiseline se nazivaju etanoati ili acetati.
Estri se dobijaju u reakciji esterifikacije. Ta se reakcija odvija u kiseloj sredini. Suprotna reakcija esterifikaciji je hidroliza. U toj reakciji se dobijena voda iz esterifikacije jedini sa estrom koji je dobijen i daje polazne supstance: alkohol i kiselinu.
Estri se koriste u prehrambenoj industriji za proizvodnju veštačkih mirisa, kao rastvarači boja, lakova i kao sirovina za dobijanje veštačkih vlakana. Jedan od najpoznatijih estara je nitroglicerin, koji se dobija reakcijom trovalentnog alkohola glicerola i azotne kiseline, uz prisustvo sumporne kiseline.[3][4][5]
Gliceridi su estri masnih kiselina i glicerola; oni su važni u biologiji, jer su jedna od glavnih klasa lipida i čine većinu životinjskih masti i biljnih ulja. Laktoni su ciklični karboksilni estri; Prirodni laktoni su uglavnom 5- i 6-člani laktoni u prstenu. Laktoni doprinose aromi voća, putera, sira, povrća poput celera i druge hrane.
Estri se mogu formirati od oksokiselina (npr. estri sirćetne kiseline, ugljene kiseline, sumporne kiseline, fosforne kiseline, azotne kiseline, ksantične kiseline), ali i od kiselina koje ne sadrže kiseonik (npr. estri tiocijanske kiseline i tritiokarbonske kiseline). Primer formiranja estra je reakcija supstitucije između karboksilne kiseline (R−C(=O)−OH) i alkohola (R'−OH), formirajući estar (R−C(=O)−O−R'), gde R predstavlja bilo koju grupu (obično vodonik ili organil), a R′ označava organil grupu.
Organil estri karboksilnih kiselina obično imaju prijatan miris; oni male molekularne težine se obično koriste kao mirisi i nalaze se u eteričnim uljima i feromonima. Oni deluju kao rastvarači visokog kvaliteta za široku lepezu plastike, plastifikatora, smola i lakova,[6] i predstavljaju jednu od najvećih klasa sintetičkih maziva na komercijalnom tržištu.[7] Poliesteri su važne plastike, sa monomerima povezanim estarskim delovima. Estri fosforne kiseline čine kičmu molekula DNK. Estri azotne kiseline, kao što je nitroglicerin, poznati su po svojim eksplozivnim svojstvima.
Postoje jedinjenja u kojima kiseli vodonik kiselina navedenih u ovom članku nije zamenjen organilom, već nekom drugom grupom. Prema nekim autorima, ta jedinjenja su estri, posebno kada je prvi atom ugljenika organske grupe koja zamenjuje kiseli vodonik, zamenjen drugim atomom iz grupe 14 elemenata (Si, Ge, Sn, Pb); na primer, prema njima, trimetilstanil acetat (ili trimetilkalaj acetat) CH
3COOSn(CH
3)
3 je trimetilstanil estar sirćetne kiseline i dibutilkalaj dilaurat (CH
3(CH
2)
10COO)
2Sn((CH
2)
3CH
3)
2 je dibutilstanilenski estar laurinske kiseline, a Filipsov katalizator CrO
2(OSi(OCH
3)
3)
2 je trimetoksisilil estar hromne kiseline (H
2CrO
4).[8][9]
Remove ads
Imenovanje
Imenovanje estara se bazira na nazivu alkohola koji je stupio u reakciju tj. prvo ide naziv alkilne skupine alkohola (npr. naziv alkilne skupine propanola je propil). Drugim riječima, umjesto uobičajenog završetka -anol na osnovu imena alkohola doda se nastavak -il. Druga riječ u nazivu estera potiče od kiseline, a tvori se tako da se imenu kiseline oduzme nastavak -ska i doda nastavak -oat (npr., druga riječ u imenu estera butanske kiseline bila bi butanoat). Kod estera sa etanskom kiselinom, često se umjesto etanoata upotrebljava: acetat, kod onih sa metanskom kiselinom: formijat, kod estera sa butanskom kiselinom: butirat, a kod propanske kiseline: propionat. Kod alkohola također postoje drugi nazivi pa se tako umjesto pentil, često nađe i amil: alkohol (-ol → -il) + karboksilne kiseline (-ska → -oat)
Etimologija
Reč estar je 1848. skovao nemački hemičar Leopold Gmelin,[10] verovatno kao kontrakciju nemačkog Essigäther, „sirćetni etar「.
IUPAC-ova nomenklatura
Esterska imena izvedena su iz naziva matičnog alkohola i roditeljske kiseline, gde ova može biti organska ili neorganska. Estri izvedeni iz najjednostavnijih karboksilnih kiselina se obično zove prema tradicijskim, takozvanim trivijalnim nazivima, npr. kao format, acetat, propionat, i butirat, za razliku od IUPAC-ove nomenklature: metanoat, etanoat, propanoat i butanoat. Estri izvedeni iz kompleksnijih karboksilnih kiselina su, s druge strane, češće pod nazivom koji koristi sistematski naziv po IUPAC-u, na osnovu imena za kiselinu zatim dolazi sufiks –oat. Na primer, ester-heksiloktanoat, poznat i pod trivijalnim imenom heksil-kaprilat, ima formulu .

Hemijske formule organskih estera obično imaju oblik , gde su i delovi ugljikovodika iz karboksilne kiseline i alkohola. Na primer, butil acetat (sistematski butil-etanoat), izveden iz butanola i acetatne kiseline (sistematski etanska kiselina) se piše kao . Alternativno prikazivanje obično uključuje i . Ciklični estri se zovu laktoni, bez obzira na to da li su izvedeni iz organske ili neorganske kiseline. Jedan primer (organskog) laktona je γ-valerolakton.
Ortoestri
Neuobičajena klasa organskih estera su ortoesteri, koji imaju formulu 3. Trietilortoformat je izvedenica, u smislu imena (ali ne i sinteze) iz ortomravlje kiseline (3) i etanola.
Neorganski estri

Esteri mogu takođe da budu izvedeni iz neorganskih kiselina i alkohola. Dakle, nomenklatura se proteže na neorganske oksokiseline i njihove odgovarajuće estre: fosforna kiselina i fosfatni ester/organofosfati, sumporna kiselina i sulfatni ester/organosulfati, azotna kiselina i nitrat, borna kiselina i borati. Na primer, trifenil fosfat je ester izveden iz fosforne kiseline i fenola. Organski karbonati su izvedeni iz ugljene kiseline; na primer, etilen karbonat je izveden iz ugljene kiseline i etilen glikola.
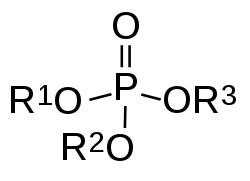


Alkohol i neorganska kiselina povezivani su preko atoma kiseonika. Definicija estera neorganske kiseline koji imaju vezu neorganskih hemijskih elemenata između alkohola i neorganske kiseline – vezanje atoma fosfor i tri alkoksi funkcionalne grupe u organofosfatima – može se proširiti na iste elemente u raznim kombinacijama kovalentne veze između ugljenikovih i centralnog neorganskog atoma i vezi ugljenik-kiseonik, sa centralnim neorganski atomima. Na primer, fosforna svojstva tri veze ugljenik-kiseonik-fosfor i jednu dvostruku vezu fosfor-kiseonik u organofosfatima, tri veze ugljenik–kiseonik–fosfor i nijednu dvostruku vezu fosfor–kiseonik u fosfitni esterima ili organofosfitima, dve veze ugljenik–kiseonik–fosfor, nijedna fosfor–kiseonik dvostruka veza, ali jedna veza fosfor–ugljenik u fosfonitima, jedna veza ugljenik–kiseonik–fosfor, nijedna dvostruka veza fosfor–kiseonik, ali dve veze fosfor–ugljenik u fosfonitima.

Kao posledica, funkcije bora je stvaranje bornih estara ( = 2), boronskih estara ( = 1) i borata ( = 0). Kiseonik je hemijski element grupe 16, a atomi sumpora mogu zameniti neke atome kiseonika u ugljenik–kiseonik centralnom neorganskom atomu kovalentnih veza estera. Kao rezultat, stvaraju se tiosulfinati i tiosulfonati, sa centralnin neorganskim atomom sumpora, jasno pokazujući asortiman sumpornih estera, koji uključuju i sulfatne, sulfitne, sulfonatne, sulfinatne i sulfenatne estere.
Estri se takođe mogu dobiti iz neorganskih kiselina.
- Perhlorna kiselina formira perhloratne estre, na primer, metil perhlorat (CH
3−O−Cl(=O)
3) - Sumporna kiselina formira sulfatne estre, na primer, dimetil sulfat ((CH
3−O−)
2S(=O)
2) i metil bisulfat (CH
3−O−S(=O)
2−OH) - Azotna kiselina formira nitratne estre, npr. metil nitrat (CH
3−O−NO
2) i nitroglicerin (CH(−O−NO
2)(−CH
2−O−NO
2)
2) - Fosforna kiselina formira fosfatne estre, npr. trifenil fosfat (O=P(−O−C
6H
5)
3) i metil dihidrogen fosfat (O=P(−O−CH
3)(−OH)
2)- Pirofosforna (difosforna) kiselina formira pirofosfatne estre, npr. tetraetil pirofosfat, ADP, dADP, ADPR, cADPR, CDP, dCDP, GDP, dGDP, UDP, dTDP, MEcPP, HMBPP, DMAPP, IPP, GPP, FPP, GGPP, ThDP, FAD, NAD, NADP.
- Trifosforna kiselina formira trifosfatne estre, npr. ATP, dATP, CTP, dCTP, GTP, dGTP, UTP, dTTP, ITP, XTP, ThTP, AThTP.
- Ugljena kiselina formira karbonatne estre, npr. dimetil karbonat ((CH
3−O−)
2C=O) i petočlani ciklični etilen karbonat ((−CH
2−O−)
2C=O) (ako se ugljena kiselina klasifikuje kao neorgansko jedinjenje) - Tritiokarbonska kiselina formira tritiokarbonatne estre, npr. dimetil tritiokarbonat ((CH
3−S−)
2C=S) (ako se tritiokarbonska kiselina klasifikuje kao neorgansko jedinjenje) - Hloromravlja kiselina formira hloroformatne estre, npr. metil hloroformijat (Cl−C(=O)−O−CH
3) (ako se hloromravlja kiselina klasifikuje kao neorgansko jedinjenje) - Borna kiselina formira boratne estre, npr. trimetil borat (B(−O−CH
3)
3) - Hromna kiselina formira di-terc-butil hromat (((CH
3)
3C−O−)
2Cr(=O)
2)
Neorganske kiseline koje postoje kao tautomeri formiraju dve ili više vrsta estara.
- Tiosumporna kiselina formira dve vrste tiosulfatnih estara, npr. O,O-dimetil tiosulfat ((CH
3−O−)
2S(=O)(=S)) i O,S-dimetil tiosulfat ((CH
3−O−)(CH
3−S−)S(=O)
2) - Tiocijanska kiselina formira tiocijanatne estre, npr. metil tiocijanat (CH
3−S−C≡N) (ako se tiocijanska kiselina klasifikuje kao neorgansko jedinjenje), ali formira i izotiocijanatne „estre「, npr. metil izotiocijanat (CH
3−N=C=S), iako IUPAC ne klasifikuje organil izotiocijanate kao estre - Fosforna kiselina formira dve vrste estara: fosfitne estre, npr. trietil fosfit (P(−O−CH
2CH
3)
3), i fosfonatne estre, npr. dietil fosfonat (H−P(=O)(−O−CH
2CH
3)
2)
Neke neorganske kiseline koje su nestabilne ili neuhvatljive formiraju stabilne estre.
- Sumporna kiselina, koja je nestabilna, formira stabilan dimetil sulfit ((CH
3−O−)
2S=O) - Dikarbonska kiselina, koja je nestabilna, formira stabilan dimetil dikarbonat (CH
3−O−C(=O)−O−C(=O)−O−CH
3)
U principu, deo metalnih i metaloidnih alkoksida, kojih je poznato na stotine, mogao bi se klasifikovati kao estri odgovarajućih kiselina (npr. aluminijum trietoksid (Al(OCH
2CH
3)
3 može se klasifikovati kao estar aluminijumske kiseline koji je aluminijum hidroksid, tetraetil ortosilikat (Si(OCH
2CH
3)
4) može se klasifikovati kao estar ortosilicijumske kiseline i titanijum etoksid (Ti(OCH
2CH
3)
4) može se klasifikovati kao estar ortotitanske kiseline).
Remove ads
Struktura i vezivanje

Estri sadrže karbonilni centar, koji ima strukturne motive i sa uglovima između veza od 120°. Za razliku od amida, estri su strukturno fleksibilne funkcionalne grupe jer rotacija oko veza ima nisku barijeru. Njihova fleksibilnost i niska polarnost se manifestuje u njihovim fizičkim osobinama. Oni su manje rigidni (imaju nižu tačku topljenja) i isparljiviji su (niža tačka ključanja) od odgovarajućih amida.[12] vrednosti alfa-vodonika estera je oko 25.[13]
Mnogi estri karboksilne kiseline imaju potencijal za konformacioni izomerizam, ali imaju tendenciju da poprime S-cis (ili Z) konformaciju pre nego S-trans (ili E) alternativu, zbog kombinacije efekata hiperkonjugacije i minimizacije dipola. Na preferenciju Z konformacije utiče priroda supstituenata i rastvarača, ako je prisutan.[14][15] Laktoni sa malim prstenovima su ograničeni na s-trans (tj. E) konformaciju zbog svoje ciklične strukture.

Remove ads
Fizička svojstva i karakterizacija
Estri dobijeni od karboksilnih kiselina i alkohola su polarniji od etara, ali manje polarni od alkohola. Oni učestvuju u vodoničnim vezama kao akceptori vodonične veze, ali ne mogu delovati kao donori vodonične veze, za razliku od svojih matičnih alkohola. Ova sposobnost da učestvuju u vezivanju vodonika daje izvesnu rastvorljivost u vodi. Zbog nedostatka sposobnosti doniranja vodonične veze, estri se ne povezuju sami. Shodno tome, estri su isparljiviji od karboksilnih kiselina slične molekulske težine.[12]
Karakterizacija i analiza
Estri se generalno identifikuju gasnom hromatografijom, koristeći prednost njihove isparljivosti. IR spektri za estre karakterišu intenzivnu oštru traku u opsegu 1730–1750 cm−1 koja je dodeljena νC=O. Ovaj pik se menja u zavisnosti od funkcionalnih grupa vezanih za karbonil. Na primer, benzenski prsten ili dvostruka veza u sprezi sa karbonilom će smanjiti talasni broj za oko 30 cm−1.
Triacilglicerol

Triacilgliceroli (masti i ulja) su estri koji sadrže tri hidroksilne grupe. Imenuju se slično kao i soli. Nerastvorni su ili slabo rastvorni u vodi (lipidi).
Estri se mogu dobiti reakcijom, obično organskih, kiselina i alkohola, uz katalitsko prisustvo sumporne kiseline, iako ima i drugih načina dobijanja estera. Esterifikacija je reverzibilna reakcija u kojoj se istovremeno događa i hidroliza, pa je potrebno higroskopno sredstvo koje reakciji oduzima vodu.
- Alkoholi + karboksilne kiseline ↔ ester + voda (esterifikacija)
- Ester + voda ↔ alkoholi + karboksilne kiseline (hidroliza)
Mnogi estri imaju specifičan miris, zbog čega se često koriste kao veštačke arome i u proizvodnji mirisa. Na primer:
Remove ads
Metil formijat
Metil metanoat je bezbojna tečnost karakterističnog eterskog mirisa, lako ispariva, sa malim površinskim naponom.
Etil acetat / etil etanoat
Ovo je bezbojna, lako zapaljiva tečnost karakterističnog mirisa, poput lepka ili sredstava za skidanje laka za nokte (, ili ). Etil acetat je zapaljiv i kožni iritant.
Upotreba
Estri se između ostalog koriste:
- kao otrov za ubijanje insekata (za prepariranje u entomologiji: insekt se ubije, ali se ne uništi)
- u lepkovima i odstranjivačima laka za nokte
- kao reagens za određivanje angiotenzin konvertirajućeg enzima (ACE)
Estri se obično upotrebljavaju u prehrambenoj i konditorskoj industriji, proizvodnji rastvarača i plastičnih masa, i proizvodnju parfema. Upotrebljava se i kao insekticid i u proizvodnji nekih lekova.
Estri su rasprostranjeni u prirodi i široko se koriste u industriji. U prirodi, masti su, generalno, triestri dobijeni od glicerola i masnih kiselina.[16] Estri su odgovorni za aromu mnogih voća, uključujući jabuke, durijane, kruške, banane, ananas i jagode.[17] Godišnje se industrijski proizvodi nekoliko milijardi kilograma poliestera, a važni proizvodi su polietilen tereftalat,[18] akrilatni estri[19] i acetat celuloze.[20]
Remove ads
Dobijanje estera
Esteri se dobijaju pri sintezi sirćetne kiseline i etanola, uz prisustvo jakih kiselina kao što je sumporna kiselina.
Dobijaju se:
- esterifikacijom metanola i etanoata:
- industrijski kombinacijom metanola i ugljen monoksida: .
Esterifikacija je opšti naziv za hemijsku reakciju u kojoj dva reaktanta (obično alkohol i kiselina) formiraju estar kao proizvod reakcije. Estri su uobičajeni u organskoj hemiji i biološkim materijalima i često imaju prijatan karakterističan, voćni miris. To dovodi do njihove široke upotrebe u industriji mirisa i ukusa. Estarske veze se takođe nalaze u mnogim polimerima.
Esterifikacija karboksilnih kiselina alkoholima
Klasična sinteza je Fišerova esterifikacija, koja uključuje tretiranje karboksilne kiseline alkoholom u prisustvu agensa za dehidrataciju:
- RCO
2H + R'OH ⇌ RCO
2R' + H
2O
Konstanta ravnoteže za takve reakcije je oko 5 za tipične estre, na primer, etil acetat.[21] Reakcija je spora u odsustvu katalizatora. Sumporna kiselina je tipičan katalizator ove reakcije. Koriste se i mnoge druge kiseline kao što su polimerne sulfonske kiseline. Pošto je esterifikacija veoma reverzibilna, prinos estra se može poboljšati korišćenjem Le Šateljeovog principa:[22][23][24][25][26]
- Korišćenje alkohola u velikom višku (tj. kao rastvarača).
- Korišćenje sredstva za dehidrataciju: sumporna kiselina ne samo da katalizuje reakciju, već sekvestrira vodu (proizvod reakcije). Druga sredstva za sušenje kao što su molekularna sita[27][28][29] su takođe efikasna.
- Uklanjanje vode fizičkim sredstvima kao što je destilacija kao azeotrop niske tačke ključanja sa toluenom, u kombinaciji sa Dean-Starkovim aparatom.[30][31][32][33]
Poznati su reagensi koji pokreću dehidrataciju smeša alkohola i karboksilnih kiselina. Jedan primer je Steglihova esterifikacija, koja je metoda formiranja estara pod blagim uslovima.[34][35][36] Metoda je popularna u sintezi peptida, gde su supstrati osetljivi na oštre uslove poput visoke toplote. DCC (dicikloheksilkarbodiimid) se koristi za aktiviranje karboksilne kiseline za dalju reakciju. 4-Dimetilaminopiridin (DMAP) se koristi kao katalizator acil-transfera.[37]
Druga metoda za dehidrataciju smeša alkohola i karboksilnih kiselina je Micunobuova reakcija:[38][39][40][41][42][43][44]
- RCO
2H + R'OH + P(C
6H
5)
3 + R
2N
2 → RCO
2R' + OP(C
6H
5)
3 + R
2N
2H
2
Karboksilne kiseline mogu biti esterifikovane pomoću diazometana:
- RCO
2H + CH
2N
2 → RCO
2CH
3 + N
2
Korišćenjem diazometana, smeše karboksilnih kiselina mogu se konvertovati u njihove metil estre u skoro kvantitativnim prinosima, na primer, za analizu gasnom hromatografijom. Metoda je korisna u specijalizovanim organsko sintetičkim operacijama, ali se smatra previše opasnom i skupom za primene u velikim razmerama.
Esterifikacija karboksilnih kiselina epoksidima
Karboksilne kiseline se esterifikuju tretmanom sa epoksidima, dajući β-hidroksiestre:
- RCO
2H + RCHCH
2O → RCO
2CH
2CH(OH)R
Ova reakcija se koristi u proizvodnji vinil estarske smole od akrilne kiseline.
Alkoholiza acilhlorida i anhidrida kiselina
Alkoholi reaguju sa acil hloridima i anhidridima kiselina dajući estre:
- RCOCl + R'OH → RCO
2R' + HCl - (RCO)
2O + R'OH → RCO
2R' + RCO
2H
Reakcije su nepovratne i pojednostavljuju obradu. Pošto acil hloridi i anhidridi kiselina takođe reaguju sa vodom, poželjni su anhidrovani uslovi. Analogne acilacije amina koje daju amide su manje osetljive jer su amini jači nukleofili i reaguju brže od vode. Ova metoda se koristi samo za laboratorijske procedure, jer je skupa.
Alkilacija karboksilnih kiselina i njihovih soli
Trimetiloksonijum tetrafluoroborat se može koristiti za esterifikaciju karboksilnih kiselina pod uslovima gde su reakcije katalizovane kiselinom neizvodljive:[45]
- RCO
2H + (CH
3)
3OBF
4 → RCO
2CH
3 + (CH
3)
2O + HBF
4
Iako se retko koriste za esterifikacije, karboksilatne soli (često stvorene in situ) reaguju sa elektrofilnim alkilacionim agensima, kao što su alkil halogenidi, dajući estre.[20][46] Dostupnost anjona može inhibirati ovu reakciju, što shodno tome pospešeno katalizatorima faznog transfera[47][48][49] ili takvih visoko polarnih aprotičnih rastvarača kao što je DMF. Dodatna jodidna so može, preko Finkelštajnove reakcije,[50][51][52][53][54] da katalizuje reakciju neposlušnog alkil halida. Alternativno, soli koordinacionog metala, kao što je srebro, mogu poboljšati brzinu reakcije olakšavanjem eliminacije halogenida.
Transesterifikacija
Transesterifikacija,[55][56] koja uključuje promenu jednog estra u drugi, široko se praktikuje:
- RCO
2R' + CH
3OH → RCO
2CH
3 + R'OH
Kao i hidroliza, transesterifikacija je katalizovana kiselinama i bazama. Reakcija se široko koristi za razgradnju triglicerida, npr. u proizvodnji estara masnih kiselina i alkohola. Poli(etilen tereftalat) se proizvodi transeterifikacijom dimetil tereftalata i etilen glikola:[20]
- n (C
6H
4)(CO
2CH
3)
2 + 2n C
2H
4(OH)
2 → [(C
6H
4)(CO
2)
2(C
2H
4)]
n + 2n CH
3OH
Podskup transesterifikacije je alkoholiza diketena. Ova reakcija daje 2-ketoestre.[20]
- (CH
2CO)
2 + ROH → CH
3C(O)CH
2CO
2R
Karbonilacija
Alkeni se podvrgavaju karboalkoksilaciji[57][58][59] u prisustvu metalnih karbonilnih katalizatora. Estri propionske kiseline se komercijalno proizvode ovom metodom:
- H
2C=CH
2 + ROH + CO → CH
3CH
2CO
2R
Priprema metil propionata je jedan ilustrativan primer.
- H
2C=CH
2 + CO + CH
3OH → CH
3CH
2CO
2CH
3
Karbonilacija metanola daje metil format, koji je glavni komercijalni izvor mravlje kiseline. Reakcija je katalizovana natrijum metoksidom:
- CH
3OH + CO → HCO
2CH
3
Dodavanje karboksilnih kiselina alkenima i alkinima
U hidroesterifikaciji, alkeni i alkini se umeću u O−H vezu karboksilnih kiselina. Vinil acetat se industrijski proizvodi dodavanjem sirćetne kiseline acetilenu u prisustvu katalizatora cink acetata:[60]
- HC≡CH + CH
3CO
2H → CH
3CO
2CH=CH
2
Vinil acetat se takođe može proizvesti reakcijom etilena, sirćetne kiseline i kiseonika katalizovanom paladijumom:
- 2 H
2C=CH
2 + 2 CH
3CO
2H + O
2 → 2 CH
3CO
2CH=CH
2 + 2 H
2O
Silikovolframska kiselina se koristi za proizvodnju etil acetata alkilacijom sirćetne kiseline etilenom:
- H
2C=CH
2 + CH
3CO
2H → CH
3CO
2CH
2CH
3
Iz aldehida
Tiščenkova reakcija[61][62][63][64] uključuje disproporcionisanje aldehida u prisustvu anhidrovane baze da bi se dobio estar. Katalizatori su aluminijum alkoksidi ili natrijum alkoksidi. Benzaldehid reaguje sa natrijum benziloksidom (generisanim od natrijuma i benzil alkohola) da bi se dobio benzil benzoat.[64] Metoda se koristi u proizvodnji etil acetata iz acetaldehida.[20]
Druge metode
- Favorskijevo preuređenje α-haloketona u prisustvu baze[65][66][67][68][69]
- Bejer-Viligerova oksidacija ketona sa peroksidima[70][71][72]
- Pinerova reakcija[73][74][75][76][77][78][79] nitrila sa alkoholom
- Nukleofilna apstrakcija metal–acil kompleksa[80][81]
- Hidroliza ortoestara u vodenoj kiselini
- Celuloliza putem esterifikacije[82]
- Ozonoliza[83][84][85] alkena korišćenjem obrade u prisustvu hlorovodonične kiseline i raznih alkohola.[86]
- Anodna oksidacija[87][88][89][90] metil ketona dovodi do metil estara.[91]
- Interesterifikacija razmenjuje grupe masnih kiselina različitih estara.[92][93][94][95][96][97]
Remove ads
Reakcije
Estri su manje reaktivni od kiselih halogenida i anhidrida. Kao i kod reaktivnijih acil derivata, oni mogu da reaguju sa amonijakom i primarnim i sekundarnim aminima dajući amide, iako se ova vrsta reakcije ne koristi često, pošto kiseli halogenidi daju bolje prinose.
Transesterifikacija
Estri se mogu konvertovati u druge estre u procesu poznatom kao transesterifikacija. Transesterifikacija može biti katalizovana kiselinom ili bazom i obuhvata reakciju estra sa alkoholom. Pošto je odlazeća grupa takođe alkohol, reakcija unapred i unazad će se često odvijati sličnom brzinom. Korišćenje velikog viška reaktantnog alkohola ili uklanjanje alkohola odlazeće grupe (npr. destilacijom) potisnuće reakciju napred ka završetku, u skladu sa Le Šateljeovim principom.[98]
Hidroliza i saponifikacija
Hidroliza estara katalizovana kiselinom je takođe ravnotežni proces – u suštini reverzan reakciji Fišerove esterifikacije.[99][100][101][102][103] Pošto alkohol (koji deluje kao odlazeća grupa) i voda (koja deluje kao nukleofil) imaju slične pKa vrednosti, direktna i reverzna reakcija se takmiče jedna sa drugom. Kao i kod transesterifikacije, korišćenje velikog viška reaktanta (vode) ili uklanjanje jednog od proizvoda (alkohola) može podstaći reakciju unapred.

Bazna hidroliza estara, poznata kao saponifikacija, nije ravnotežni proces; pun ekvivalent baze se troši u reakciji, pri čemu se proizvodi jedan ekvivalent alkohola i jedan ekvivalent karboksilatne soli. Saponifikacija estara masnih kiselina je industrijski važan proces, koji se koristi u proizvodnji sapuna.[98]
Esterifikacija je reverzibilna reakcija. Estri se podvrgavaju hidrolizi u kiselim i baznim uslovima. U kiselim uslovima, reakcija je reverzna reakcija Fišerove esterifikacije. U baznim uslovima, hidroksid deluje kao nukleofil, dok je alkoksid odlazeća grupa. Ova reakcija, saponifikacija, je osnova za pravljenje sapuna.
Alkoksidna grupa takođe može biti zamenjena jačim nukleofilima kao što su amonijak ili primarni ili sekundarni amini da bi se dobili amidi (reakcija amonolize):
- RCO
2R' + NH
2R″ → RCONHR″ + R'OH
Ova reakcija obično nije reverzibilna. Umesto amina mogu se koristiti hidrazini i hidroksilamin. Estri se mogu konvertovati u izocijanate preko intermedijarnih hidroksaminskih kiselina[104][105] u Losenovom preuređenju.[106][107][108][109][110]
Izvori ugljenikovih nukleofila, na primer, Grignardovi reagensi[111][112][113] i organolitijumova jedinjenja, lako se dodaju karbonilu.
Redukcija
U poređenju sa ketonima i aldehidima, estri su relativno otporni na redukciju. Uvođenje katalitičke hidrogenacije u ranom delu 20. veka predstavljao je proboj; estri masnih kiselina se hidrogenišu u masne alkohole.
- RCO
2R' + 2 H
2 → RCH
2OH + R'OH
Tipičan katalizator je bakar hromit. Pre razvoja katalitičke hidrogenacije, estri su redukovani u velikoj meri korišćenjem Buvo-Blankove redukcije.[114][115][116][117][118][119][120][121] Ovaj metod, koji je u velikoj meri zastareo, koristi natrijum u prisustvu izvora protona.
Posebno za fine hemijske sinteze, litijum aluminijum hidrid se koristi za redukciju estara na dva primarna alkohola. Povezani reagens natrijum borohidrid je spor u ovoj reakciji. DIBAH redukuje estre u aldehide.[122]
Direktna redukcija da bi se dobio odgovarajući etar je teška jer središnji hemiacetal ima tendenciju da se razgradi dajući alkohol i aldehid (koji brzo redukuje da bi se dobio drugi alkohol). Reakcija se može postići korišćenjem trietilsilana sa raznim Luisovim kiselinama.[123][124]
Klajzenova kondenzacija i srodne reakcije
Estri mogu biti podvrgnuti raznim reakcijama sa nukleofilima ugljenika. Reaguju sa viškom Grignardovog reagensa dajući tercijarne alkohole. Estri takođe lako reaguju sa enolatima. U Klajzenovoj kondenzaciji,[125][126][127][128][129] enolat jednog estra (1) će napasti karbonilnu grupu drugog estra (2) da bi dao tetraedarski intermedijer 3. Intermedijer se kolapsira, istiskujući alkoksid (R'O−) i stvarajući β-keto estar 4.

Moguće su i ukrštene Klajzenovove kondenzacije, u kojima su enolat i nukleofil različiti estri. Intramolekularna Klajzenovova kondenzacija se zove Dikmanova kondenzacija[130][131][132] ili Dikmanova ciklizacija, jer se može koristiti za formiranje prstenova. Estri se takođe mogu podvrgnuti kondenzaciji sa ketonskim i aldehid enolatima da bi se dobila β-dikarbonilna jedinjenja.[133] Specifičan primer ovoga je Bejker-Venkataramanovo preuređenje,[134][135][136][137][138][139][140][141][142][143][144] u kome aromatični orto-aciloksi keton prolazi kroz intramolekularnu nukleofilnu acil supstituciju i naknadno preuređenje da bi se formirao aromatični β-diketon.[145] Čanovo preuređenje[146][147] je još jedan primer preuređenja koji je rezultat reakcije intramolekularne nukleofilne acil supstitucije.
Druge estarske reaktivnosti
Estri reaguju sa nukleofilima na karbonilnom ugljeniku. Karbonil je slabo elektrofilan, ali ga napadaju jaki nukleofili (amini, alkoksidi, izvori hidrida, organolitijumova jedinjenja, itd.). C–H veze susedne karbonilu su slabo kisele, ali podležu deprotonaciji jakim bazama. Ovaj proces je onaj koji obično pokreće reakcije kondenzacije. Karbonil kiseonik u estrima je slabo bazičan, manje od karbonilnog kiseonika u amidima zbog rezonantne donacije elektronskog para iz azota u amidima, ali formira adukte.
Što se tiče aldehida, atomi vodonika na susednom ugljeniku (u „α poziciji「) karboksilnoj grupi u estrima su dovoljno kiseli da podležu deprotonaciji, što zauzvrat dovodi do raznih korisnih reakcija. Deprotonacija zahteva relativno jake baze, kao što su alkoksidi. Deprotonacija daje nukleofilni enolat, koji može dalje da reaguje, na primer, Klajazenovom kondenzacijom i njenim intramolekularnim ekvivalentom, Dikmanovom kondenzacijom. Ova konverzija se koristi u sintezi estra malonske kiseline,[148][149] pri čemu diestar malonske kiseline reaguje sa elektrofilom (npr. alkil halidom), a zatim se dekarboksilira. Druga varijacija je Frater-Sebahova alkilacija.[150][151][152][153][154]
Druge reakcije
- Estri se mogu direktno pretvoriti u nitrile.[155]
- Metil estri su često podložni dekarboksilaciji u Krapčovoj dekarboksilaciji.[156][157][158][159][160]
- Fenil estri reaguju na hidroksiarilketone u Frajesovom rearanžmanu.[161][162][163][164]
- Specifični estri su funkcionalizovani sa α-hidroksilnom grupom u Čanovom rearanžmanu.
- Estri sa β-atomima vodonika mogu se konvertovati u alkene u estarskoj pirolizi.[165][166][167]
- Parovi estara su spojeni da daju α-hidroksiketone u aciloinskoj kondenzaciji.[168][169][170]
Zaštitne grupe
Kao klasa, estri služe kao zaštitne grupe[171][172] za karboksilne kiseline. Zaštita karboksilne kiseline je korisna u sintezi peptida, da bi se sprečile samostalne reakcije bifunkcionalnih aminokiselina. Metil i etil estri su obično dostupni za mnoge aminokiseline; t-butil estar ima tendenciju da bude skuplji. Međutim, t-butil estri su posebno korisni jer, pod jako kiselim uslovima, t-butil estri se podvrgavaju eliminaciji dajući karboksilnu kiselinu i izobutilen, što pojednostavljuje obradu.
Remove ads
Esterski mirisi
Remove ads
Reference
Spoljašnje veze
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads