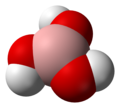
Борна киселина
From Wikipedia, the free encyclopedia
Борна киселина (хемијска формула или је супстанца која спада у слабе неорганске киселине.[3][4] Постоји у облику безбојних кристала или бијелог праха и растворљива је у води. Може се наћи и у минералном облику и тада се назива сасолит. У природи се може наћи у неким вулканским областима, у саставу разних минерала (нпр. боракс), у морској води, у биљкама и воћу.[5]
| |||
 | |||
| Називи | |||
|---|---|---|---|
| називs
Борна киселина Трихидроксидобор | |||
| Други називи
Ортоборна киселина, Борасична киселина, Сасолит, Оптибор, Борофакс | |||
| Идентификација | |||
3Д модел () |
|||
| 100.030.114 | |||
| Е-бројеви | E284 (конзерванси) | ||
| Својства | |||
| 33 | |||
| Моларна маса | 61,83 g·mol−1 | ||
| Агрегатно стање | Кристал бијеле боје | ||
| Густина | |||
| Тачка топљења | 1.709 °C (3.108 °F; 1.982 K) | ||
| Тачка кључања | 300 °C (572 °F; 573 K) | ||
| 2,52 4.72 g/100 mL (20°C) 5.7 g/100 mL (25°C) 19.10 g/100 mL (80°C) 27.53 g/100 mL (100°C) | |||
| Растворљивост у other solvents | Растворљива у нижим алкохолима умјерено растворљива у пиридину врло мало растворљива у ацетону | ||
| Киселост (pKa) | 5.2 | ||
| Структура | |||
| Облик молекула (орбитале и хибридизација) | Тригонално-планарни | ||
| Диполни момент | Нула | ||
| Опасности | |||
| Шкодљива (Xn) Repr. Cat. 2 | |||
| R-ознаке | R60 R61 | ||
| S-ознаке | S53 S45 | ||
| NFPA 704 | |||
| Тачка паљења | Незапаљива. | ||
| Смртоносна доза или концентрација (): | |||
50 (средња доза) |
2660 mg/kg, oral (rat) | ||
| Сродна једињења | |||
Сродна једињења |
Бор триоксид Боракс | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| верификуј (шта је ?) | |||
| Референце инфокутије | |||
Кристална структура
Молекул борне киселине је планаран. Атом бора у молекулу борне киселине је хибридизован, тј. три хибридне орбитале се налазе у истој равни а угао између њих је 120°. Бор са кисеоником гради ковалентне везе (посредством орбитала) и због тога је цијели молекул планаран. Борна киселина се у чврстом стању састоји од слојева молекула које на окупу држи водонична веза. Растојање између два сусједна слоја је 318 .
 | 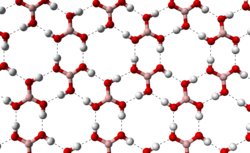 |
доводи да молекули борне киселине формирају паралелне слојеве у чврстом стању |
Добијање
Борна киселина се може добити у реакцији између боракса и неке неорганске киселине, као нпр. хлороводоничне киселине:
- .
Такође настаје као нуспроизвод хидролизе бор трихалида и диборана:[6]
- B
2H
6 + 6 H
2O → 2 B(OH)
3 + 6 H
2
- BX
3 + 3 H
2O → B(OH)
3 + 3 HX (X = Cl, Br, I)
Особине
Пиролиза
Борна киселина је растворљива у кључалој води. При загревању изнад 170 °C долази до реакције дехидратације при чему настаје борична киселина (HBO2):
- .
Борична киселина је бела, кристална супстанца и делимично је растворљива у води. Топи се на 236 °C, а при загревању преко 300 °C долази до даље дехидратације, при чему се формира тетраборична киселина или пироборична киселина:
- .
Даљим загревањем добија се бор(III)-оксид:
- .
Водени раствор
Борна киселина дисосује у воденом раствору:
- .
При томе се борна киселина понаша као Луисова киселина, тј. реагује са молекулом воде и прима електронски пар од групе, што је чини киселином по Луисовој теорији. Награђени јон има тетраедарски облик, тј. тетраедарски распоред атомских група око атома бора.
У растворима са вредношћу 7—10, и ако је концентрација бора већа од долази до стварања полиборатних јона. Најпознатији је тетраборатни јон који се налази у минералу бораксу:
- .
Када се ортоборна киселина раствори у води, она се делимично дисоцира дајући метаборну киселину:
- B(OH)
3 ⇌ HBO
2 + H
2O
Раствор је благо кисеo због јонизације киселина:
- B(OH)
3 + H
2O ⇌ [BO(OH)
2]−
+ H
3O+ - HBO
2 + H
2O ⇌ [BO
2]−
+ H
3O+
Међутим, Раманова спектроскопија јако алкалниh раствора је показала присуство [B(OH)
4]−
јона,[7] што је довело до закључка да је киселост искључиво последица апстракције OH−
из воде:[7]
- B(OH)
3 + HO−
⇌ B(OH)−
4
Еквивалентно,
- B(OH)
3 + H
2O ⇌ B(OH)−
4 + + (K = 7.3×10−10; pK = 9.14)
Или, тачније,
- B(OH)
3 + 2 H
2O ⇌ B(OH)−
4 + H
3O+
Ова реакција се одвија у два корака, са неутралним комплексом акватрихидроксибором B(OH)
3(OH
2) као интермедијером:[8]
- B(OH)
3 + H
2O → B(OH)
3(OH
2) - B(OH)
3(OH
2) + H
2O + HO−
→ [B(OH)
4]−
+ H
3O+
Ова реакција се може окарактерисати као Луисова киселост бора према [HO]−
, а не као Бренстедова киселост.[9][10][11] Међутим, нека од њених понашања према неким хемијским реакцијама сугеришу да је то и тробазна киселина у Бренстедовом смислу.
Борна киселина, помешана са бораксом Na
2B
4O
7·10H2O (тачније Na
2B
4O
5(OH)
4·8H2O) у тежинском односу 4:5, веома је растворљива у води, иако нису толико растворљиви одвојено.[12]
Раствор сумпорне киселине
Борна киселина се такође раствара у безводној сумпорној киселини према једначини[13]
- B(OH)
3 + 6 H
2SO
4 → [B(SO
4H)
4]−
+ 2 [HSO
4]−
+ 3 H
3O+
Естерификација
Борна киселина реагује са алкохолима и формира боратне естре, B(OR)
3 где је R алкил или арил. Реакцију обично покреће средство за дехидратацију, као што је концентрована сумпорна киселина:[14]
- B(OH)
3 + 3 ROH → B(OR)
3 + 3 H
2O
Са вициналним диолима
Киселост раствора борне киселине је знатно повећана у присуству цис-вициналних диола (органска једињења која садрже слично оријентисане хидроксилне групе у суседним атомима угљеника, (R
1,R
2)=C(OH)−C(OH)=(R
3,R
4)) као што су глицерол и манитол).[15][13][16]
Тетрахидроксиборатни анјон настао у растварању спонтано реагује са овим диолима да би се формирао релативно стабилан анјонски естар који садржи један или два петочлана −B−O−C−C−O− прстена. На пример, реакција са манитолом H(HCOH)
6H, чија су два средња хидроксила у цис оријентацији, може се написати као
- B(OH)
3 + H
2O ⇌ [B(OH)
4]−
+ H+ - [B(OH)
4]−
+ H(HCOH)
6H ⇌ [B(OH)
2(H(HCOH)
2(HCO−)
2(HCOH)
2H)]−
+ 2 H
2O - [B(OH)
2(H(HCOH)
2(HCO−)
2(HCOH)
2H)]−
+ H(HCOH)
6H ⇌ [B(H(HCOH)
2(HCO−)
2(HCOH)
2H)
2]−
+ 2 H
2O
дајући свеукупну реакцију
- B(OH)
3 + 2 H(HCOH)
6H ⇌ [B(H(HCOH)
2(HCO−)
2(HCOH)
2H)
2]−
+ 3 H
2O + H+
Стабилност ових анјона естра манитобората помера равнотежу удесно и на тај начин повећава киселост раствора за 5 редова величине у поређењу са оном чистог борног оксида, снижавајући pKa са 9 на испод 4 за довољну концентрацију манитола.[15][13][16] Добијени раствор се назива манитоборна киселина.
Додавање манитола првобитно неутралном раствору који садржи борну киселину или једноставне борате снижава pH довољно да се може титровати јаком базом као NaOH, укључујући и аутоматизовани потенциометријски титратор. Ово својство се користи у аналитичкој хемији за одређивање садржаја бората у воденим растворима, на пример за праћење исцрпљивања борне киселине неутронима у води примарног кола реактора лаке воде када се једињење додаје као неутронски отров током операције пуњења горива.[13]
Примена
Борна киселина налази примену као антисептик, инсектицид, за спречавање ширења ватре итд. У индустрији налази примену у производњи фибергласа, за прављење средстава за подмазивање дрвета. Користи се и у пиротехници. У фармакологији се користи као лек, односно, благи антисептик у виду 3% раствора, или као кератопластик у облику прашка који је 10% смеша са талком.[17]
Медицинска примена
Борна киселина се може користити као антисептик за мање опекотине или посекотине и понекад се користи у мелемима и завојима, као што је бораксна влакна. Борна киселина се примењује у веома разблаженом раствору као средство за испирање очију. Разређена борна киселина може да се користи као вагинални туш за лечење бактеријске вагинозе услед прекомерне алкалности,[18] као и кандидијазе због неалбикансне кандиде.[19] Борна киселина у великој мери поштеђује лактобациле унутар вагине.[20] Као TOL-463, то је у развоју као интравагинални лек за лечење бактеријске вагинозе и вулвовагиналне кандидијазе.[21][22][23] Као антибактеријско једињење, борна киселина се такође може користити за лечење акни. Користи се и као превенција развоја атлетског стопала, уносом пудера у чарапе. Различити препарати се могу користити за лечење неких врста спољашњег отитиса (инфекције уһа) и код људи и код животиња.[24] Конзерванс у боцама за узорке урина у УК је борна киселина.[25]
Познато је да су раствори борне киселине који се користе за испирање очију или на изгребаној кожи токсични, посебно за одојчад након вишекратне употребе; то је због његове споре стопе елиминације.[26]
Борна киселина је једна од најчешће коришћених супстанци која може да спречи штетне ефекте реактивне флуороводоничне киселине (HF) након случајног контакта са кожом. Она делује тако што форсира слободне F−
анјоне у инертни тетрафлуороборатни анјон. Овај процес поражава екстремну токсичност флуороводоничне киселине, посебно њену способност да секвестрира јонски калцијум из крвног серума што може довести до застоја срца и разградње костију; такав догађај може настати само од мањег контакта коже са HF.[27]
Референце
Литература
Спољашње везе
Wikiwand - on
Seamless Wikipedia browsing. On steroids.