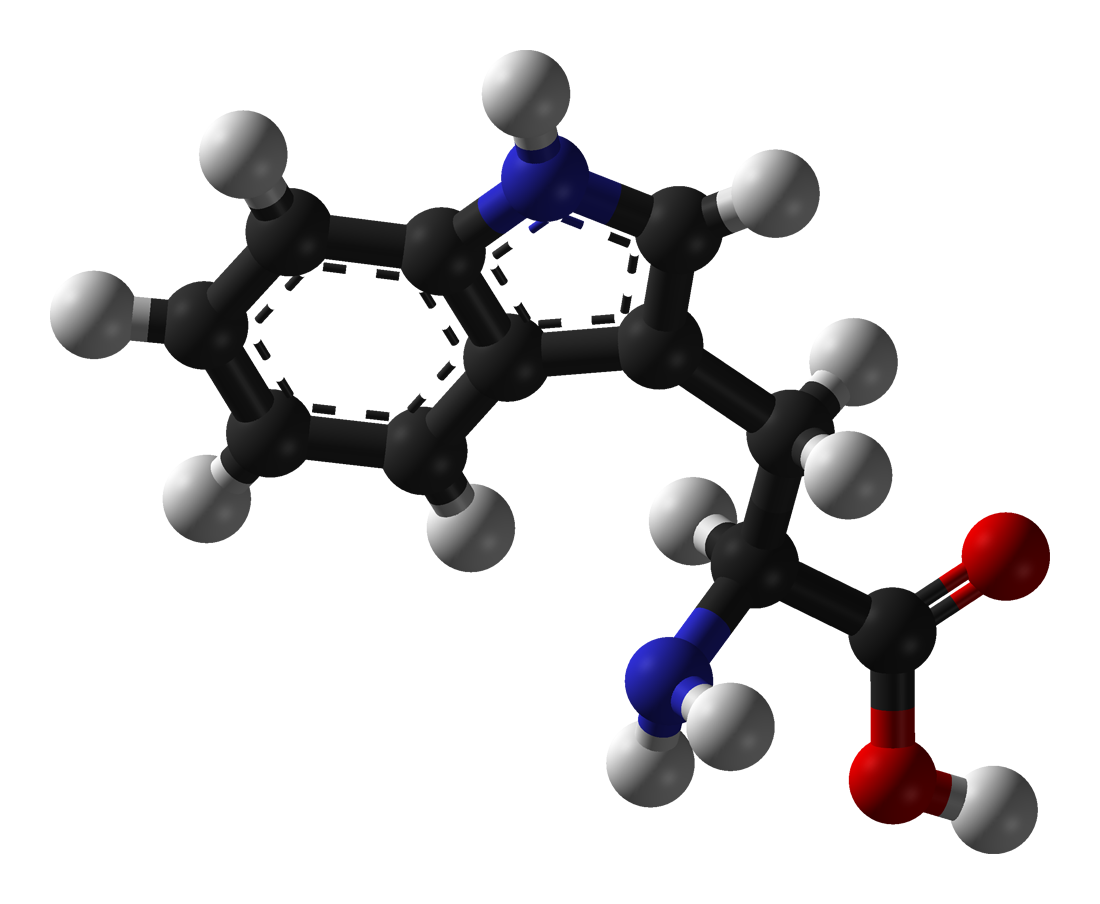
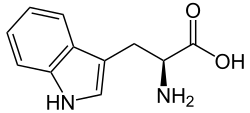
Triptofan (simbol Trp ili W)[1] je α–aminokiselina koji se koristi u biosintezi proteina. Triptofan sadrži α-amino grupu, α–karboksilnokiselinsku grupu i bočni lanac indola, što ga čini nepopularnom aromatskom aminokiselinom. Esencijalan je kod ljudi, što znači da ga organizam ne može sintetitiratipa se mora dobijati iz shrane. Triptofan je također prekursor za neurotransmiter serotonin, hormon melatonin i vitamin B3. Njegov kodon je UGG.[2]
| L-Triptofan | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | L-Triptofan |
| Druga imena | IUPAC-ime: Triptofan or (2S)-2-amino-3-(1H-indol-3-yl)propanoična kiselina ili 2-Amino-3-(1H-indol-3-il) propanoična kiselina |
| Molekularna formula | C11H12N2O2 |
| CAS registarski broj | 73-22-3 |
| SMILES | c1ccc2c(c1)c(c[nH]2)C[C@@H](C(=O)O)N |
| InChI | 1/C11H12N2O2/c12-9(11(14)15)5-7-6-13-10-4-2-1-3-8(7)10/h1-4,6,9,13H,5,12H2,(H,14,15)/t9-/m0/s1 |
| Osobine1 | |
| Gustoća | 1.424 g/cm3 |
| Tačka topljenja | 258 °C (sublimira) |
| Rastvorljivost | Rastvorljiv u alkoholu i alkalnim hidroksidima: 0.23 g/L at 0 °C, 11.4 g/L na 25 °C, nerastvorljiv u hloroformu |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Kao i ostale aminokiseline, triptofan je dvojni ion na fiziološkom pH gdje je amino-grupa protonirana (–NH3+; pKa = 9,39) a karboksilna kiselinaje deprotonirana (–COO−; pKa = 2,38).[3]
Funkcija

Aminokiseline, uključujući triptofan, koriste se kao gradivni blokovi u biosintezi proteina, a [proteini] su potrebni za održavanje života. Mnoge životinje (uključujući ljude) ne mogu sintetizirati triptofan: treba ih pribaviti u hrani, što ga čini esencijalnom aminokiselinom. Triptofan spada među manje uobičajene aminokiseline koje se nalaze u proteinima, ali ima važne strukturne ili funkcionalne uloge kad god se pojavi. Naprimjer, ostaci triptofana i tirozina imaju posebne uloge u "sidrenju" membranskih proteina unutar ćelijske membrane. Uz to, triptofan djeluje kao biohemijski prekursor za sljedeće spojeve:
- Serotonin (neurotransmiter), sintetiziran triptofan-hidroksilazom.[4][5]
- Melatonin ( neurohormon) se zauzvrat sintetizira iz serotonina, putem enzima N-acetiltransferaze i 5-hidroksindol-0-metiltransferaze.[6]
- Niacin, poznat i kao vitamin B3, sintetizira se iz triptofana, preko kinurenin a ikvinolinskih kiselina.[7]
- Auksini (jedna od klasa fitohormona) također nastaju od triptofana.[8]
Poremećaj malapsorpcija fruktoze uzrokuje nepravilnu apsorpciju triptofana u crijevima, smanjenu razinu triptofana u krvi[9] i depresiju.[10]
U bakterijama koje sintetiziraju triptofan, visoke ćelijske razine ove aminokiseline aktiviraju protein represora koji se veže na trp operon.[11] Vezanje ovog represora na triptofanski operon sprečava transkripcijsku moć nizvodne DNK , koja kodira enzime koji su uključeni u biosintezu triptofana. Tako visoke razine triptofana sprečavaju sintezu triptofana kroz negativnu povratnu informacijsku petlju, a kada se razine triptofana u ćeliji ponovo smanje, transkripcija iz trp operona se nastavlja. To omogućava čvrsto regulirane i brze reakcije na promjene u unutrašnjim i vanjskim količinama triptofana u ćeliji. .
Preporučeni dodatak prehrani
U 2002. Godini, Američki institut za medicinu odredio je preporučeni dijetalni dodatak (RDA) triptofana od 5 mg/kg tjelesne težine na dan, za odrasle od 19 godina i više.[12]
Prehrambeni izvori
Triptofan je prisutan u većini namirnica na bazi proteina ili dijetalnih proteina. Osobito je bogat u čokoladama, sušenoj zobi, datulama, mlijeku, jogurtu, siru, crvenom mesu, jajima, ribama, peradi, sezamu, kikiriki ju, leblebiji, bademima, suncokretovim sjemenkama, sjemenkama bundeve, heljdi, spirulin. Suprotno uvreženom mišljenju[13] da kuhana puretina sadrži obilje triptofana (ovo se koristi kao objašnjenje pospanosti nakon konzumiranja mesa), sadržaj triptofana u puretini uobičajen je za perad.[14]
| Hrana | Triptofan [g/100 g hrane] |
Proteini [g/100 g hrane] |
Odnos triptofan/protein [%] |
|---|---|---|---|
| Bjelance, sušeno | 1,00 | 81,10 | 1,23 |
| Spirulina, sušena | 0,92 | 57,47 | 1,62 |
| Atlantski bakalar, sušeni | 0,70 | 62,82 | 1,11 |
| Soja, sirova | 0,59 | 36,49 | 1,62 |
| Sir, parmezan | 0,56 | 37,90 | 1,47 |
| Susamove sjemenke | 0,37 | 17,00 | 2,17 |
| Sir, čedar | 0,32 | 24,90 | 1,29 |
| Suncokretove sjemenke | 0,30 | 17,20 | 1,74 |
| Svinjetina, sjeckana | 0,25 | 19.,27 | 1,27 |
| Tučje meso | 0,24 | 21,89 | 1,11 |
| Piletina | 0,24 | 20,85 | 1,14 |
| Govedina | 0,23 | 20,13 | 1,12 |
| Zobi | 0,23 | 16,89 | 1,39 |
| Salmonide | 0,22 | 19,84 | 1,12 |
| Janjetina i ovčetina, sjeckana | 0,21 | 18,33 | 1,17 |
| Smuđ | 0,21 | 18,62 | 1,12 |
| Leblebija, sirova | 0,19 | 19,30 | 0,96 |
| Jaja | 0,17 | 12,58 | 1,33 |
| Pšenica, brašno | 0,13 | 10,33 | 1,23 |
| Pečena čokolada, nezaslađena | 0,13 | 12,9 | 1,23 |
| Mlijeko | 0,08 | 3,22 | 2,34 |
| Riža, bijela, srednjezrna, kuhana | 0,028 | 2,38 | 1,18 |
| Kvinoa, nekuhana | 0,167 | 14,12 | 1,2 |
| Kvinoa, kuhana | 0,052 | 4,40 | 1,1 |
| Krompir, crveni | 0,02 | 2,14 | 0,84 |
| Tamarind | 0,018 | 2,80 | 0,64 |
| Banana | 0,01 | 1,03 | 0,87 |
Također pogledajte
Reference
Dopunska literatura
Vanjski linkovi
Struktura

Aminokiseline imaju i amino i karboksilnu grupu priključenu na prvi atom ugljika (alfa-ugljik), koji ima poseban značaj. One su poznate kao 2-, alfa, ili α-amino kiseline (generičkih formula H2–NCHRCOOH u većini slučajeva [3], gdje je R supstituent poznat kao "zamjena bočnog lanca",[4] a često je termin "aminokoselina" upotrebljavan da se na to specifično referira. One uključuju 23 proteinotvorne ("protein-gradivne") aminokiseline,[5][6][7] koje se kombiniraju u peptidne lance ("polipeptide").[8] Ovo su sve L-stereoizomeri ("ljevogirni" izomeri), a nekoliko D-stereoizomernih("desnogirnih") aminokiselina se javlja u bakterijskom omotaču i nekim antibioticima.[9] Dvadeset od proteinotvornih aminokiselina direktno kodiraju tripleti (kodoni) genetičkog koda i poznate su kao "standardne" aminokiseline. Ostale tri ("nestandardne" ili "ne-kanonske") su selenocistein (prisutan u mnogim ne-eukaryotima kao i u većini eukariota, ali nisu kodirane direktno sa DNK), pirolizin (nekih Archaea i jedne bakterije) i N-formilmetionin (koji je često početna aminokiselina proteina u bakterijama, mitohondrijama i hloroplastima). Pirolizin i selenocistein su kodirani preko varijantnih kodona; selenocistein je kodiran STOP kodonom i SECIS elementom.[10][11][12] Kombinacije kodona transfer RNK (tRNK) nisu nađene u prirodi što se također može koristiti za "proširenje" genetičkog koda i stvoriti mnoštvo proteina poznato kao aloproteini s aminokiselinama koje inače ne ulaze u sastav proteina.[13][14][15]
Biološka uloga
Mnogi važni proteinotvorne i druge aminokiseline također imaju kritične neproteinske uloge u organizmu. Naprimjer, u ljudskom mozgu, glutamat (glutaminska kiselina) i gama-amino-buterna kiselina ("GABA", nestandardna gama-amino kiselina) su, respektivno, glavni neurotransmiteri.[16] hidroksiprolin (glavna komponenta vezivnog tkiva kolagena) je sintetiziran iz prolina; standardna amino kiseline glicin se koristi za sintezu porfirina u crvenim krvnim zrncima; ne-standardni karnitin koristi se u transportu lipida.
Devet proteinotvornih aminokiselina se nazivaju "esencijalne" za ljude, jer oni ne mogu biti stvoreni iz drugih jedinjenj pa se moraju uzeti u hrani. Druge mogu biti uslovno bitne (uvjetno esencijalne) za određene dobi ili zdravstvena stanja. Esencijalne aminokiseline mogu se također razlikovati između vrsta. Na primjer, kod preživara, kao što su goveda, određeni broj aminokiselina dobijaju putem mikroba u prvoj komori želuca.
Osobiti značaj aminokoseline imaju kao gradivne jedinice enzima, koji su regulatori procesa razvoja svih elemenata građe i funkcije organizama.
Zbog svoje biološke važnosti, aminokiseline su važne u ishrani i najčešće se koriste kao dodatak ishrani i fertilizator u tehnologiji proizvodnje hrane. U industriji se uzimaju za proizvodnju lijekova, biorazgradljive plastike asimetrične katalize.
"Standardne" aminokiseline i njihova svojstva
| Aminokislina | 3. Slovo[17] | 1. Slovo[17] | Polarnost bočnog lanca[17] | pH bočnog lanca (pH 7.4)[17] | Hidropatski indeks[18] | Apsorbancija λmax(nm)[19] | ε pri λmax (mM−1 cm−1)[19] | MW(Molekulska masa)[20] |
|---|---|---|---|---|---|---|---|---|
| Alanin | Ala | A | Nepolarno | Neutralno | 1.8 | 89 | ||
| Arginin | Arg | R | Bazno polarno | Positivan | −4.5 | 174 | ||
| Asparagin | Asn | N | Polarno | Neutralno | −3.5 | 132 | ||
| Asparaginska kiselina | Asp | D | Kiselo polarno | Negativno | −3.5 | 133 | ||
| Cistein | Cys | C | Nepolarno | Neutralno | 2.5 | 250 | 0.3 | 121 |
| Glutaminska kiselina | Glu | E | Kiselo polarno | Negativno | −3.5 | 147 | ||
| Glutamin | Gln | Q | Polarno | Neutralno | −3.5 | 146 | ||
| Glicin | Gly | G | Nepolarno | Neutralno | −0.4 | 75 | ||
| Histidin | His | H | Bazno polarno | Pozitivno (10%)
Neutralno (90%) |
−3.2 | 211 | 5.9 | 155 |
| Izoleucin | Ile | I | Nepolarno | Neutralno | 4.5 | 131 | ||
| Leucin | Leu | L | Nepolarno | Neutralno | 3.8 | 131 | ||
| Lizin | Lys | K | Bazno polarno | Pozitivno | −3.9 | 146 | ||
| Metionin | Met | M | Nepolarno | Neutralno | 1.9 | 149 | ||
| Fenilalanin | Phe | F | Nepolarno | Neutralno | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165 |
| Prolin | Pro | P | Nepolarno | Neutralno | −1.6 | 115 | ||
| Serin | Ser | S | Polarno | Neutralno | −0.8 | 105 | ||
| Treonin | Thr | T | Polarno | Neutralno | −0.7 | 119 | ||
| Triptofan | Trp | W | Nepolarno | Neutralno | −0.9 | 280, 219 | 5.6, 47.0 | 204 |
| Tirozin | Tyr | Y | Polarno | Neutralno | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181 |
| Valin | Val | V | Nepolarno | Neutralno | 4.2 | 117 |
Dvije dodatne aminokiseline kod nekih vrsta su kodirane kodonima koji se obično interpretiraju kao stop kodoni:
| 21. i 22. Aminokiselina | 3. Slovo | 1. Slovo |
|---|---|---|
| Selenocistein | Sec | U |
| Pirolizin | Pyl | O |
Pored specifičnih kodova za aminokiseline, držači njihovih mjesta koriste se u slučajevima u kojima se proteini sekvenciraju hemijski ili za kristalografske analize peptida ili proteina ne može konačno determinirati identitet ostataka (rezidua) rudnika identitet ostatka.
| Dvosmislena minokiselina | 3. Slovo | 1. Slovo |
|---|---|---|
| Asparagin ili aspartinska kiselina | Asx | B |
| Glutamin ili glutaminska kiselina | Glx | Z |
| Leucin ili Izoleucin | Xle | J |
| Nespecifična ili nepoznata aminokiselina | Xaa | X |
Unk je ponekad unjesto Xaa, ali je manje standardno. Osim toga, mnoge nestandardne aminokiseline imaju specifični kod. Na primjer, nekoliko peptidnih droga (lijekova), kao što su Bortezomib i MG132, su umjetno sintetizirani i zadržavali svoje zaštitićujuću grupe koje imaju specifične kodova. Bortezomib je Pyz - Phe-boroLeu, a MG132 je karboksibenzil Z-Leu-Leu-Leu-al. Za pomoć u analizi strukture proteina, raspoloživi su foto-reaktivne analogne aminokiseline. To uključuje fotoleucin (pLeu) i fotometionin ( 'pMet' ).[21]
Najvažnija hemijska reakcija aminokiselina je formiranje peptidne veze koja omogućava povezivanje dvije aminokiseline i stvaranje lanca aminokiselina (peptidi i proteini). Peptidna veza je veza između karboksilne grupe jedne aminokiseline i amino grupe druge aminokiseline, u kojoj se atom ugljenika vezuje za atom azota uz oslobađanje molekula vode.
U sastav čovjekovog organizma ulazi ukupno 20 aminokiselina. 10 od njih mogu da se izgrade u samom organizmu, dok je preostalih 10 neophodno unijeti kroz ishranu. Aminokiseline koje čovjekov organizam nije u stanju da napravi, a neophodne su za njegovo funkcionisanje se nazivaju esencijalne aminokiseline.
Reference
- Wagner, Ingrid; Musso, Hans (novembar 1983). "New Naturally Occurring Amino Acids". Angewandte Chemie (jezik: engleski) (International izd.). 22 (22): 816–828. doi:10.1002/anie.198308161.
- Food and Agriculture Organization. "Human nutrition in the developing world" (jezik: engleski). United Nations. Arhivirano s originala, 6. 2. 2019. Pristupljeno 13. 11. 2023.
- "Introducing Amino Acids" (jezik: engleski). chemguide.co.uk.
- "Amino acids". Peptides from A to Z: A Concise Encyclopedia. John Wiley & Sons. 2008. ISBN 9783527621170.
- Pollegioni, Loredano; Servi, Stefano, ured. (2012). Unnatural Amino Acids. Humana Press. str. v. ISBN 978-1-61779-331-8.
- Hertweck, Christian (2011). "Biosynthesis and Charging of Pyrrolysine, the 22nd Genetically Encoded Amino Acid". Angew. Chem. Int. Ed. 50: 9540–9541. doi:10.1002/anie.201103769.
- "The Structures of Life". National Institute of General Medical Sciences. Arhivirano s originala, 7. 6. 2014.
- "Biochemical pathways: an atlas of biochemistry and molecular biology" – Michal, p.5
- Tjong, Harianto (2008). Modeling Electrostatic Contributions to Protein Folding and Binding. Florida State University. str. 1. Pristupljeno 13. 11. 2023.
- Atta-ur-Rahman & Caldwell, Gary W., ured. (13. 12. 2010). Frontiers in Drug Design and Discovery. 1. Bentham Science Publishers. str. 299.
- Elzanowski, Andrzej; Ostell, Jim (7. 4. 2008). "The Genetic Codes". National Center for Biotechnology Information (NCBI).
- Xie, Jianming; Schultz, Peter G. (decembar 2005). "Adding amino acids to the genetic repertoire". Current Opinion in Chemical Biology. 9 (6): 548–54. doi:10.1016/j.cbpa.2005.10.011. PMID 16260173.
- Wang, Qian; Parrish, Angela R.; Wang, Lei (27. 3. 2009). "Expanding the genetic code for biological studies". Chemistry & Biology. 16 (3): 323–36. doi:10.1016/j.chembiol.2009.03.001. PMC 2696486. PMID 19318213.
- Simon, Matthew (2005). Emergent Computation: Emphasizing Bioinformatics. New York: AIP Press/Springer Science+Business Media. str. 105–106. ISBN 0-387-22046-1.
- Petroff, Ognen A. C. (decembar 2002). "GABA and glutamate in the human brain". Neuroscientist. 8 (6): 562–573. doi:10.1177/1073858402238515. PMID 12467378. Arhivirano s originala, 24. 9. 2019. Pristupljeno 20. 4. 2015.
- Hausman, Robert E.; Cooper, Geoffrey M. (2004). The Cell: A Molecular Approach (3rd izd.). Washington, D.C: ASM Press. str. 51. ISBN 0-87893-214-3.
- Kyte, J.; Doolittle, R. F. (5. 5. 1982). "A simple method for displaying the hydropathic character of a protein". Journal of Molecular Biology. 157 (1): 105–32. doi:10.1016/0022-2836(82)90515-0. PMID 7108955.
- Freifelder, David (1983). Physical Biochemistry (2nd izd.). W. H. Freeman and Company. ISBN 0-7167-1315-2.
- "Lehninger, Principles of Biochemistry, 6e". Arhivirano s originala, 30. 5. 2016. Pristupljeno 23. 11. 2014.
- Suchanek, Monika; Radzikowska, Anna; Thiele, Christoph (1. 4. 2005). "Photo-leucine and photo-methionine allow identification of protein-protein interactions in living cells" [Foto-leucin i foto-metionina omogućavaju identifikaciju interakcija protein-protein u živim ćelijama]. Nature Methods (jezik: engleski). 2 (4): 261–7. doi:10.1038/nmeth752. PMID 15782218.
Također pogledajte
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.