En İyi Sorular
Zaman Çizelgesi
Sohbet
Bakış Açıları
Bakır
Atom numarası 29 olan, 1B geçiş grubundaki metalik element Vikipedi'den, özgür ansiklopediden
Remove ads
Bakır, Cu sembollü ve 29 atom sayılı bir kimyasal elementtir. Çok yüksek termal ve elektrik iletkenliği olan yumuşak, dövülebilir ve sünek bir metaldir. Yeni açığa çıkmış saf bakır yüzeyi pembemsi-turuncu renklidir. Bakır, ısı ve elektrik iletkeni olarak yapı malzemelerinde, çeşitli metal alaşımların bileşiminde, som gümüş gibi kuyumculukta, kupronikel denizcilik donanımı ve madenî para yapımında ve konstantan yük ölçerlerde (İngilizce: strain gauge) ve sıcaklık ölçen termokupllarda kullanılır.[2]
Bu madde, Vikipedi biçem el kitabına uygun değildir. (Kasım 2019) |
Bu maddedeki bilgilerin doğrulanabilmesi için ek kaynaklar gerekli. (Temmuz 2021) |
Bakır, doğada doğrudan kullanılabilir metalik formda (doğal metal) oluşabilen birkaç metalden biridir. Bakır çok erkenden, M.Ö. 8000'den itibaren birkaç bölgede insanlığın kullanımına yol açtı. Binlerce yıl sonra yaklaşık M.Ö. 5000'lerde sülfür cevherlerinden ergitme yapılan ilk metaldi; takriben M.Ö. 4000'lerde kalıpta şekle dökülen ilk metaldi; ve yaklaşık M.Ö. 3500'lerde bronz yapmak için başka bir metal, kalay ile bilerek alaşımlanana ilk metaldi.[3]
Roma dönemi'nde, bakır esas olarak metalin adının kökeni olan Kıbrıs'ta çıkarılmış, "aes сyprium"dan (Kıbrıs metali), daha sonra сuprum (Latince) olarak değiştirilmiştir. Coper (Eski ingilizce) ve copper bundan türetilmiştir daha sonraki yazım ilk olarak 1530 civarında kullanılmıştır.[4]
Yaygın olarak karşılaşılan bileşikler azurit, malakit ve turkuaz gibi minerallere sıklıkla mavi veya yeşil renkleri veren ve tarihte pigment olarak kullanılan bakır (II) tuzlarıdır.
Binalarda, genellikle çatı kaplamada kullanılan bakır, yeşil bakır pası (İngilizce:verdigris) veya patina oluşturmak üzere oksitlenir. Bakır bazen dekoratif sanatta hem temel metal formunda hem de bileşiklerde pigment olarak kullanılır. Bakır bileşikleri bakteriostatik etken maddeler, mantar öldürücüler ve ahşap koruyucular olarak kullanılır.
Bakır, solunum enzim kompleksi sitokrom C oksidaz temel bileşeni olduğundan, eser diyet minerali olarak tüm canlı organizmaları için gereklidir. Yumuşakçalar ve kabuklularda bakır, kan pigmenti hemosiyanin bileşenidir, balıklarda ve diğer omurgalılarda bunun yerini demir-kompleksli hemoglobin alır. İnsanlarda bakır esas olarak karaciğer, kas ve kemikte bulunur.[5] Yetişkin vücudu, vücut ağırlığının kilogramı başına 1.4 ile 2.1 mg arasında bakır içerir.[6]
Bakır, 1B geçiş grubunda yer alan kimyasal element. Bakır, dünyanın hemen hemen tüm bölgelerinde bulunması nedeniyle geniş ölçüde üretiminin yapılabilmesi, elektriği diğer bütün metaller içinde gümüşten sonra en iyi ileten metal olması ve endüstriyel önemi yüksek olan pirinç, bronz gibi alaşımlar yapması gibi nedenlerden ötürü geniş bir kullanım alanına sahiptir. Simyacılar tarafından element Venüs simgesi ile gösterilmiştir.
2022 yılı itibarıyla Küresel ölçekte toplam bakır rezervi 890 milyon tondur. En çok bakır rezervine sahip ülkeler Şili, Avustralya ve Peru'dur.
Remove ads
Etimoloji

Türkçede yer alan bakır kelimesi ise Eski Türkçe bakır sözcüğünden evrilmiştir ve tarihte geçtiği en eski kaynak olan ve 8. yüzyıla tarihlenen Yenisey Yazıtları'nda, "bakırı buŋsız erti" (bakırı sınırsız idi) şeklinde geçmektedir.[7]
Roma İmparatorluğu döneminde devletin temel bakır üretimi Kıbrıs'tan (Latince adı Cyprus) sağlandığı için bu metale aes сyprium (Kıbrıs'ın metali) adı verilmiş, elementin çoğu dildeki ismi de bu kelimeden türemiştir.[8] Bakır kelimesi İngilizcede copper, Almancada Kupfer, Fransızcada cuivre ve Latincede cuprum şekli ile bulunur. Bir başka görüşe ise metal adını Kıbrıs'tan değil, Kıbrıs adını metalden almıştır.[7]
Remove ads
Kullanım alanları
Elektrik ve elektronik sanayi

Termik (kömür, fuel-oil, motorin, doğalgaz, jeotermal), hidrolik ve nükleer gibi çeşitli enerjilerden yararlanılarak üretilen elektrik enerjisi, genelde uzun mesafelere iletilir; şehir ve köy gibi yerleşim bölgelerine, sanayi tesislerine dağıtılır ve buralarda tüketilir.
Çıplak iletkenler, baralar, yalıtılmış hava hattı ve yeraltı güç kabloları ve ek malzemeleri elektrik enerjisi iletim ve dağıtımının başlıca elemanlarıdır. Yakın zamana kadar, elektrik enerji iletim ve dağıtımında, bakır, uygun özellikleri nedeni ile bu alandaki ana iletken malzemesi olmuştu. Bakır, yüksek elektrik geçirgenliği, işlenebilme ve mekaniksel özellikleri iyi olan bir metaldir. Bakır, gümüşten sonra en iyi iletken metaldir.
İnşaat sanayii
Bakır, inşaatlarda beton, kiriş ve yüzeylerin güçlendirilmesinde kullanılır.
Kuyumculuk
Bakır, dünyada çok bulunan bir madde olduğu için takı yapımında da kullanılır.
Remove ads
Sınıflandırma

- Hidrotermal orijine sahip, emprenye olmuş bakır yatakları. Bunlara porfir yataklar da denmektedir. 1970 yılı itibarıyla Dünya üretiminin yaklaşık %50'si bu çeşit yataklardan elde edilmiştir. Bu tip yataklara ABD, Şili, Peru ve Kanada'da rastlanmaktadır.
- Sedimenter yapıdaki maden yatakları. Kalker veya dolomit mineralleri içinde bulunurlar. Daha ziyade Orta Afrika'da rastlanır. Dünya bakır üretiminin %17'si bu yataklardan sağlanır.
- Sıvı magma asıllı maden yatakları. Bakır ile birlikte çoğu zaman nikel de taşırlar. Bunlara volkanik-sedimenter yataklar da denir. Dünya'nın birçok ülkesinde, özellikle Kanada, Avustralya ve pek çok Avrupa ülkesinde rastlanılır.[9]
Üretim
Özetle
Bakış açısı
Rezervler ve fiyatlar
Bakır en az 10,000 yıldır kullanılmaktadır ancak şimdiye kadar çıkarılan ve ergitme yapılan tüm bakırın %95'inden fazlası 1900'den beri[10] ve yarısından fazlası da son 24 yılda çıkarıldı. Pek çok doğal kaynakta olduğu gibi, Dünya'daki toplam bakır miktarı çok büyük ve yerkabuğunun en üst kilometresinde yaklaşık 1014 tonla bakırın mevcut çıkarma hızıyla yaklaşık 5 milyon yıl değerindedir. Ancak, bu rezervlerin yalnızca çok küçük bir kısmı günümüz fiyatları ve teknolojileri ile ekonomik olarak uygulanabilir durumdadır. Madencilik için mevcut bakır rezervlerinin tahminleri, büyüme oranı gibi temel varsayımlara bağlı olarak 25 ila 60 yıl arasında değişir.[11]
Geri dönüşüm, modern dünyada önemli bir bakır kaynağıdır.[10] Bu ve diğer faktörler nedeniyle, bakır üretimi ve arzının geleceği, zirve petrol'e benzer zirve bakır kavramı da dahil olmak üzere pek çok tartışmanın konusudur.
Bakırın fiyatı tarihsel olarak istikrarsız oldu,[12] ve fiyatı Haziran 1999'da 60 yılın en düşük seviyesi olan 0.60 ABD$/lb (1.32 ABD$/kg) seviyesinden Mayıs 2006'da pound başına 3.75$'a (8.27$/kg) yükseldi. Şubat 2007'de 2.40$/lb (5.29$/kg)'a düştü ardından Nisan 2007'de 3.50$/lb (7.71$/kg)'a yeniden yükseldi.[13] 2009 yılının Şubat ayında, zayıflayan küresel talep ve emtia fiyatlarında bir önceki yılın en yüksek seviyelerinden bu yana yaşanan keskin düşüş, bakır fiyatlarını 1.51$/lb (3.32$/kg) seviyesinde bıraktı..[14] Eylül 2010 ile Şubat 2011 arasında, bakırın fiyatı metrik ton başına 5,000 Sterlin'den metrik ton başına 6,250 Sterlin'e yükseldi.[15]
Yöntemler

Cevherlerdeki bakır konsantrasyonu ortalama sadece %0.6'dır ve çoğu ticari cevher sülfit, özellikle kalkopirit (CuFeS2), bornit (Cu5FeS4) ve daha az oranda kovellit (CuS) ve kalkosittir (Cu2S).[16] Tersine, polimetalik nodüllerdeki ortalama bakır konsantrasyonu %1.3'te tahmin edilir. Bu nodüllerde bulunan diğer metallerin yanı sıra bakırı çıkarma yöntemleri arasında sülfürik liç (İngilizce:sulphuric leaching), ergitme ve Cuprion işleminin uygulaması vardır.[17][18] Kara cevherlerinde bulunan mineraller için, ezilmiş cevherlerden köpük flotasyon veya biyoliç ile %10-15 bakır seviyesine kadar konsantre edilirler.[19] Bu malzemenin izabe içinde silika ile ısıtılması, demirin çoğunu cüruf olarak uzaklaştırır. İşlem, demir sülfürleri oksitlere dönüştürmenin daha kolay olmasından yararlanır, bu da daha sonra silika ile reaksiyona girerek ısıtılmış kütlenin üzerinde yüzen silikat cürufu oluşturur. Sonuçta Cu2S'den oluşan "bakır mat", tüm sülfürleri oksitlere dönüştürmek için kavrulmuş olur:[16]
- 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
Bakır oksit, ısıtıldığında "kabarcıklı" bakıra dönüştürülür:
- 2 Cu2O → 4 Cu + O2
Sudbury mat işlemi, sülfürün sadece yarısını okside dönüştürdü ve daha sonra bu oksidi, sülfürün geri kalanını oksit olarak çıkarmak için kullandı. Daha sonra elektrolitik olarak rafine edildi ve içerdiği platin ve altın için anot çamuru kullanıldı. Bu adım, bakır oksitlerin bakır metale nispeten kolay indirgenmesini kullanır. Doğal gaz, kalan oksijenin çoğunu çıkarmak için kabarcık boyunca üflenir ve saf bakır üretmek için elde edilen malzeme üzerinde elektro arıtma gerçekleştirilir:[20]
- Cu2+ + 2 e− → Cu
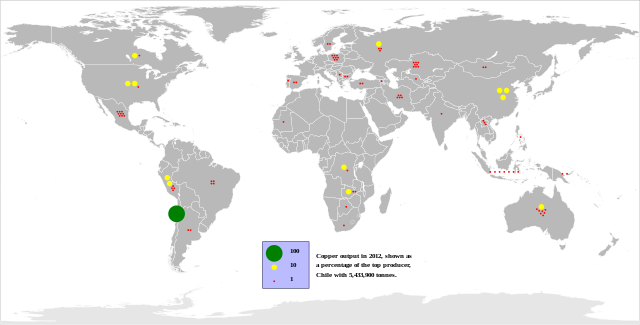
Bakır, çeşitli piro, hidro ve elektrometalurjik metotların kullanılmasıyla cevherlerinden saf olarak üretilmektedir. Pirometalurjik metotlar, sülfürlü, oksitli ve nabit bakır cevherlerine, hidrometalurjik metotlar ise düşük tenörlü oksitli bakır cevherlerine uygulanır. Elektrometalurji metotları da yukarıdaki yöntemlerin son kademesi olarak her ikisine de uygulanır. Böylece, pirometalurji metotlarıyla elde edilen saf olmayan bakır, elektrolitik arıtmaya tabi tutularak saf katot bakıra çevrilir. Benzer şekilde hidrometalurjik yollarla sulu çözeltiye alınan bakır, elektrokazanım yoluyla katotta saf olarak toplanabilmektedir. Dünya bakır üretiminin %80'i sülfürlü cevherlerden yapılır.
Bir elektrolit ile temas halinde bulunan elektrotlara dışarıdan bir elektromotor kuvvet uygulayarak kimyasal bir reaksiyonun gerçekleştirilmesi şeklinde tanımlanan elektroliz elektrokimyasal olayın tersidir. Burada elektrik enerjisi yardımıyla kimyasal reaksiyonlar gerçekleştirilir. Elektroliz hücreleri bir elektrolit ile temas halinde bulunan iki veya daha fazla elektrottan oluşur ve elektrotlar bir doğru akım kaynağına bağlıdır. Bağlantı anotun pozitif katotun negatif yükleneceği şekildedir. Yani elektrot dışında elektronlar anottan katota elektrolit içinde ise katottan anota doğru akarlar. Devreye akım verildiğinde çözeltideki negatif yükler pozitif kutup olan anota, pozitif yükler ise negatif kutup olan katoda yönelirler.

Elektroliz işleminde meydana gelen olaylar anodik ve katodik tepkimeler olup bunlar anotta yükseltgenme (oksidasyon), katotta ise indirgenme (redüksiyon) şeklindedir. Genel olarak üç çeşit elektroliz vardır. Bunlar rafinasyon, indirgenme ve ergimiş tuz elektrolizidir. Rafinasyon elektrolizi çözünebilir anotlarla yapılan elektroliz işlemine en güzel örnektir. Rafinasyon elektrolizinde anot ve katot aynı metalden oluştukları için parçalanma voltajı teorik olarak sıfırdır. Uygulanan hücre voltajı bu nedenle sadece elektrolitin direncinin biraz üstünde olmalıdır. Rafinasyon elektrolizini tarif edecek toplam bir reaksiyon anlamsızdır.
- Cu2+ + 2e- → Cu E° = 0.34 V (anot)
- Cu → Cu2+ + 2e- E° = 0.34 V (katot)
Anotta oluşan bir kısım bakır iyonları disproporsiyonlaşır. Burada oluşan bakır toz halinde anot yüzeyinde ve yüzeyden ayrılarak banyonun dibinde anot çamurunda birikir. Pb, Sn, Sb ve Bi anodik olarak çözünürler fakat elektrolit içinde oluşturdukları bileşikler nedeniyle şlam şeklinde yüzerler ve mekanik olarak katot kirliliği yaratabilirlerse de genelde çökerler ve anot çamuru içinde birikirler. Anodik olarak çözümlendirilemeyen Au, Ag ve Pt gibi elementler anodun yenilmesine paralel olarak anottan ayrılıp banyo dibine inerler ve burada anot çamuru içinde birikirler. Ortalama olarak Au, Ag, Se, Te ve Pb %98 oranında, Sb %60 civarında anot çamuruna geçer. Anot bileşimindeki nikelin %5'i çözünmez ve bakır-nikel karışık kristali halinde anot çamuruna geçer. Aynı şekilde 3 Cu2O·4NiO·Sb2O5'de büyük oranda çözünmeden anot çamuruna gider. Üçüncü grup metaller de bakırla karışık kristal halinde bulunurlar ve anodik çözünme potansiyeli bakıra yakındır. Ancak bu metaller çözünseler bile daha sonra sementasyon sonucu anot çamuruna giderler. Örneğin, gümüş:
- Cu + 2 Ag+ = Cu2+ + Ag
Dördüncü grupta yer alan metallerden Se ve Te'ün Cu2S ve Cu2Te halinde anot bakırında bulunduğu ve çözünmeden direkt anot çamuruna geçtiği kabul edilir. Kalay ise bakırla intermetalik bileşik olmasına rağmen tamamen çözünür, ancak CuSO4'lı çözeltilerde çözünürlüğü çok az olduğundan aşağıdaki tepkime uyarınca hidroliz olarak anot çamuruna geçer:
- Sn4+ + 2H2O = SnO2 + 4H+
Kurşun direkt olarak çözünmeyen PbSO4 oluşturarak anot yüzeyinde kalır. Anot bakırı fazla miktarda kurşun içerirse oluşan PbSO4 yüzeyi tamamen kaplayarak anodun pasifleşmesine neden olur.
Rafinasyon ve indirgenme elektrolizleri arasındaki temel fark anot tepkimeleridir. Rafinasyon elektrolizinde anot olarak kullanılan malzeme oksitlenip çözeltiye geçerken, indirgenme elektrolizinde çözünmeyen anotlar kullanılır. Çözünmeyen anotların indirgenme elektrolizindeki görevi iletkenliği sağlamaktır ve yüzeyinde oksijen çıkışı meydana gelir.
Oksitli bakır cevherlerin doğrudan, diğerlerinin bir ön işlemden sonra veya bakteriler yardımıyla çözümlendirilmesi sonucu değişen derisimlerde elde edilen sülfatlı çözeltilerden bakırın kazanılmasında uygulanan yöntemlerden bir tanesi de indirgenme elektrolizidir. indirgenme elektrolizinde katot ve anot reaksiyonu ise şu şekildedir:
- Cu2+ + 2e- = Cu E° = 0.34 V
- 2H2O = O2 + 4 H+ + 4e- E° = 1.229 V

İndirgenme elektrolizinde satılabilir kalitede katodik bakır üretimi elektrolitteki bakır derişimi litresinde 15 g civarına ininceye kadar mümkündür. 15 g'dan 8 g'a kadar olan derişimlerde yine satılabilir fakat toz veya sünger halde bakır üretilebilmektedir. Bu satılabilirlik sünger bakırın anot fırınında işleneceği açısından geçerlidir.
Bir elektroliz olayında elektrolizin hangi şartlarda nasıl gerçekleşeceği, hangi tip anot ve katotlara nasıl tepki vereceği, uygun sıcaklık, akım şiddeti ve gerilim değerlerinin neler olacağı bazı parametrelere bağlıdır. Bu parametrelerden bir tanesi polarizasyondur. Elektrolizi gerçekleştirmek için gerekli olan potansiyel teorik olandan daha yüksek olmak zorundadır. Teorik değer ile pratikte uygulanan değer arsındaki fark fazla voltaj adını alır. Elektrolizde katotta indirgenmeyi gerçekleştirmek için bu fazla voltaj değerlerini aşmak gerekir ve sisteme verilmesi gereken fazla voltajların tümü polarizasyon adını alır.
Anot ve katot polarizasyon toplamına parçalanma voltajı da denir. Diğer bir deyişle elektrolizin gerçekleşmesi için sisteme verilmesi gereken en düşük potansiyel değeridir.
Bu değer en az indirgenecek iyonun EMK değerine eşittir.
Termodinamik hücre potansiyelinin uygulanması ile bir elektroliz işleminin gerçekleşmeyeceği sisteme bazı fazla voltajların da verilmesi gerektiği yukarıdaki açıklamalarda belirtilmiştir. Bu fazla voltajlara ilaveten devredeki dirençleri aşabilecek ilave voltaja da ihtiyaç vardır. Bu dirençlerin başında anot -katot arasındaki elektrolitin direnci gelir. Elektrolitin direnci R, akım I olarak alınırsa Ohm kanunu gereğince uygulanacak potansiyel I*R büyüklüğündedir. Elektroliz esnasında ulaşılması gereken hücre voltajı, tüm fazla voltajlar, parçalanma voltajı ve dirençten kaynaklanan potansiyel düşüşlerin toplamına eşittir.
Bir elektroliz olayında kullanılan elektrik enerjisi ile yapılan kimyasal iş arasındaki ilişkiler Faraday Kanunu ile belirlenir.
- m : indirgenen metal miktarı (g)
- A : indirgenen metalin mol ağırlığı
- I : devreden geçen akım (A)
- t : zaman (s)
- h : akım verimi (%)
- z : elektron sayısı
- 96500 : Faraday sabiti
Parçalanma Voltajı, elektrolizin gerçekleşebilmesi için, yani örneğin bakır iyonlarının katodda toplanabilmesi için gereken en düşük potansiyeldir ve anotla kato polarizasyonlarının toplamına eşittir.
Ohm kanunu gereğince kablo bağlantılarında ve elektrot-kablo temas noktalarında, sistemden geçen akım miktarı ile doğru orantılı olarak direnç ortaya çıkar, bu direnç potansiyel düşüşlerine yol açar. Elektroliz sırasında ulaşılması gereken hücre potansiyeli bunların toplamına eşittir.
- UH = UZ + hT + I*R
- UH : hücre potansiyeli (V)
- UZ : parçalanma potansiyeli (V)
- hT : tüm fazla voltajlar (V) (derişim, aktivasyon, difüzyon, kristalizasyon vb.)
- I : akım (A)
- R : elektrolit direnci (ohm)
Voltaj arttıkça akım yoğunluğu da artmakta fakat belli bir noktadan sonra voltajın artması akım yoğunluğunda hiçbir değişikliğe sebep olmamaktadır ve bu akım değerine limit akım denmektedir. Limit akım uygulanabilecek maksimum akımdır. Genellikle limit akımın üçte biri değerinde çalışılmaktadır. Rafinasyon elektrolizinde aynı bir çözeltiye temas halinde olan aynı bir metal hem anotta hem katotta bulunduğundan, hücrenin elektromotor kuvveti pratik olarak sıfırdır, yani potansiyel farkı oluşmaz. Elektroliz sırasında indirgenecek metal iyonlarının çözeltinin iç taraflarından katot yüzeyine gelmeleri difüzyon, konveksiyon ve migrasyon yolu ile gerçekleşir. Katotun hemen yakınında metal iyonlarınca fakirleşmiş bir bölge oluşur. Buna "difüzyon tabakası" (Nernst diffusion layer) denmektedir. Bu tabaka kalınlığı elektrolizdeki akım şiddetine bağlı olmayıp, hücre potansiyelini artırmak suretiyle akım yükseltildiğinde faz sınırındaki derişim düşmektedir.
Remove ads
Bakır standartları

- Blister bakır: %97-98 saflıktadır. Fe, S, Au, Ag, Se, Te ve Ni içerir.
- Elektrolitik bakır: %99,9 saflıkta olması istenir.
- Ateşte rafine edilmiş bakır: %99,9 saflıkta olması istenir.
- OFHC (Oxygen-Free High Conductivity, oksijensiz yüksek iletkenlikte) bakır: %99,99 saflıkta olması istenir.
Canlı bilimleriyle ilişkisi
Askorbit asit, oksidaz, tirosinaz, laktoz ve monoamin oksidaz gibi yükseltgeyici enzimlerin bir parçası olarak birçok bitki ve hayvanda çok az miktarda bulunan bakır, bunların sağlıklı yaşamı için gereklidir. Bakır, bu proteinlerde, oksijen, kükürt ya da azot atomları içeren bağlanma bölgelerinde sıkıca bağlanır.
İnsanların normal beslenme rejimi her gün 2–5 mg arasında bakır gerektirir. Kalıtımsal protein seruloplazmin (kan plazmasında bulunan bir protein) eksikliği aşağı yukarı bütün dokularda, özellikle beyin ve karaciğerde bakır miktarının artmasıyla birlikte gelişir.
Remove ads
Tarihçe
Özetle
Bakış açısı

Bakır kendi başına doğada saf olarak metal formunda var olabildiğinden ötürü pek çok eski medeniyet tarafından bilinmiştir. Bakırın ilk kullanımı MÖ 9000'de Orta Doğu'da gözlemlenmiştir.[21] Kuzey Irak'ta MÖ 8700'e tarihlenen bakır bir kolye bulunmuştur.[22] Bakırın ilk başlarda ısıtılmadan soğuk olarak işlendiği, daha sonralarda tavlandığı, izabelendiği ve son olarak eritilerek döküldüğü düşünülmektedir. Tüm bu dört farklı yöntem de Güneydoğu Anadolu'da Neolitik Devir'in başladığı MÖ 7500'lerde aynı anda tespit edilmiştir.[23]
Bakır izabesi farklı bölgelerde birbirinden bağımsız olarak ortaya çıkmıştır. Çin'de MÖ 2800'de, Orta Amerika'da MS 600'de, Batı Afrika'da ise MS 9. veya 10. yüzyıllarda ortaya çıktığı düşünülmektedir.[24] Hassas döküm yönteminin Güneydoğu Asya'da MÖ 4500-4000 civarında bulunduğu ortaya konmuştur.[21] MÖ 3200-3300'de yaşamış Ötzi'nin %99,7 saflıkta bakır içeren bir balta başına sahip olduğu tespit edilmiştir. Ötzi'nin saçında bulunan yüksek arsenik miktarı, bireyin bakır izabesiyle ilişkili olduğunu göstermektedir.[25] Bakırın izabesinin diğer metallerin işlenmesinin, özellikle de demir izabesinin önünü açtığı öne sürülmektedir.[25]
Remove ads
Önemli bakır mineralleri ve içerikleri
Remove ads
Ek resimler
- Kalkopirit minerali.
- Azurit minerali.
- Kalkozit minerali.
- Kuprit minerali.
- Bornit minerali.
- Enargit minerali.
Kültürel önemi
Kur'an'da
Süleyman’ın emrine de sabahleyin bir aylık, akşamleyin bir aylık yol almakta olan rüzgârı verdik. Onun için bakır madenini eritip akıttık. Cinlerden de rabbinin izniyle onun maiyetinde çalışanlar vardı. Onlardan kim buyruğumuzdan sapsa, ona yakıcı ateşin azabını tattırırdık.
Ayrıca bakınız
Kaynakça
Dış bağlantılar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads









