Protein
polipeptitlerin işlevsellik kazanması sonucu oluşan canlıların temel yapı birimi Vikipedi'den, özgür ansiklopediden
Proteinler, bir veya daha fazla uzun amino asit artık zincirini içeren büyük biyomoleküller ve makromolekül'lerdir. Proteinler organizmalar içinde, hücrelere yapı ve organizmalar sağlayarak ve molekülleri bir konumdan diğerine taşıyarak metabolik reaksiyonları katalizleme, DNA kopyalama, uyaranlara yanıt verme dahil olmak üzere çok çeşitli işlevler gerçekleştirir. Proteinler, genlerinin nükleotit dizisi tarafından dikte edilen ve genellikle faaliyetini belirleyen özel 3D yapıya protein katlanmasıyla sonuçlanan amino asit dizilimlerinde birbirlerinden farklıdır.

Proteinler, açlık anında en son tüketilirler. Kimyasal sindirimleri midede başlar. Proteinler hayvansal proteinler ve bitkisel proteinler olarak ikiye ayrılır. Vejetaryenlar et yemezler ama sağlık için hayvansal ürünler yumurta, süt, yoğurt, peynir gibi benzer ürünleri tüketirler.
Hayvansal protein yoğurt, süt, mandıra ürünü, bal, yumurta, et, çökelek, lor peyniri, az yağlı peynir, tavuk eti, balık eti, diğer hayvan etleri gibi yiyeceklerde hayvansal protein oranı yüksektir.
Bitkisel protein bakliyat, hububat, tahıl, mercimek, fasulye, bezelye, kenevir, chia, karabuğday, ıspanak gibi yiyeceklerde bitkisel protein oranı yüksektir.
Proteinler, amino asitlerin polimerleşmesi sonucu oluşan polimerlerdir. Her proteinin kendisine has özelliklerinin olmasını sağlayan özel amino asit dizilimleri vardır. Proteinlerin işlevlerinin çoğu, kendisini oluşturan amino asitlerin özelliklerinin tayin edilmesiyle anlaşılabilir. İnsandan virüse proteinlerin oluşumunda en çok kullanılan 20 çeşit amino asit vardır.
Bu zincirde bir amino asitin karboksil grubunun bir diğerinin amino grubuna bağlanmasıyla oluşan bağ peptit bağı olarak adlandırılır. Her proteindeki amino asit dizisinin sırası bir gen tarafından tanımlanır ve genetik kod ile kodlanmıştır. Genetik kod 22 "standart" amino asit tanımlasa da proteinlerdeki amino asitler çevrim sonrası değişimle kimyasal olarak değişikliğe uğrar. Bu değişimler ya proteinin işlev görmeye başlamasından önce gerçekleşir ya da kontrol mekanizmalarının parçası olarak, proteinin işlevini değiştirmek için olur. Proteinler belli işlevleri yerine getirmek için beraberce de çalışabilirler ve bazıları bir araya gelip kararlı kompleksler oluşturabilir.
Polisakkaritler, nükleik asitler ve yağlar gibi biyolojik makromoleküllere benzer şekilde, proteinler de canlı organizmaların temel bileşenlerindendir ve hücrelerin içindeki her süreçte yer alırlar. Çoğu protein, biyokimyasal tepkimelerde katalizör işlevi olan enzimlerdir ve metabolizma için yaşamsal bir role sahiptir. Başka proteinlerin ise yapısal veya mekanik işlevleri vardır: örneğin hücre iskeletindeki proteinler, hücrenin şeklini koruması için bir iskele görevi yaparlar. Proteinler hücre haberleşmesi, bağışıklık yanıtı, hücre tutunması ve hücre bölünme döngüsünde yer alır.
Protein, insanların beslenmesinde önemli bir parçadır. Hayvanlar her amino asiti sentezleyemediklerinden, temel (esansiyel) aminoasitleri gıda yoluyla almak zorundadırlar. Sindirimde hayvanlar yedikleri proteini serbest amino asitlere parçalayıp bunlarla yeni proteinler sentezler.
"Protein" sözcüğünün kaynağı, Yunancanın "birincil öneme sahip" anlamını taşıyan πρώτα (prota) sözcüğüdür. Bu isim, proteinleri 1838'de ilk tanımlayan Jöns Jakob Berzelius tarafından verilmiştir. 1926'da James B. Sumner'in üreaz enziminin bir protein olduğunu göstermesine kadar, proteinlerin canlılar için ne derece önemli olduğu tam anlaşılmamıştır. Yapısı çözülen ilk proteinler arasında insülin ve miyoglobin bulunur ki, insülin için Sir Frederick Sanger 1958'de, miyoglobin için de Max Perutz ve Sir John Cowdery Kendrew 1962'de Nobel Kimya Ödülü kazanmıştır.[1] Her iki protein de kırınım analizi ile üç boyutlu yapıları çözümlenen ilk proteinlerdendir.[2]
Biyokimya
Özetle
Bakış açısı


Proteinler, 20 farklı L-alfa-amino asitten oluşmuş lineer polimerlerdir. Tüm amino asitler, bir alfa karbonuna birer karboksil ve amino grubu ve bir yan zincirin bağlanıyor olması gibi ortak yapısal özelliklere sahiptir. Bir tek prolin, yan zincirinin amino grubuyla bir halka oluşturması yüzünden biraz farklılık gösterir: bu yüzden, CO-NH amit dizisi sabit bir şekle zorlanır.[3] Standart amino asitlerin listesinde ayrıntıları verilmiş olan yan zincirlerin farklı kimyasal özellikleri proteinlerin üç boyutlu yapısını belirler ve dolayısıyla protein işlevine etki eder. Bir polipeptit zincirdeki amino asitler bir dehidrasyon tepkimesi sonucu oluşan peptit bağı ile birbirlerine bağlanırlar. Protein zincirine dahil olmuş amino asit birimlerine "kalıntı"; karbon, azot ve oksijen atomlarından oluşan tekrarlayan diziye de "ana zincir" ya da "protein omurgası" denir. Peptit bağının iki rezonans formu vardır ve bunlar ona kısmî çift bağ özelliği kazandırarak, ekseni etrafında dönmesini engeller. Bu yüzden de alfa karbonlar eşdüzlemseldir. Peptit bağdaki diğer iki dihedral açı protein omurgasının yerel şeklini belirler.
Her bir amino asitin kimyasal yapısı nedeniyle, protein zincirinin bir yönü vardır. Proteinin serbest bir karboksil grubuna sahip olan ucu, "karboksi ucu" (C ucu) ya da "karboksi terminali" (C terminali); serbest bir amino grubu olan ucu ise "amino ucu" (N ucu) ya da "amino terminali" (N terminali) olarak adlandırılır.
"Protein", "polipeptit" ve "peptit" sözcüklerinin kullanımında bir muğlaklık vardır. "Protein" genelde kararlı bir şekle sahip olan bütün biyolojik molekül için kullanılır. "Peptit" ise genelde kararlı bir üç boyutlu yapıya sahip olmayan, kısa amino asit oligomerleri için kullanılır. Ancak bu iki terim arasındaki sınır belirsizdir ve genelde 20-30 kalıntı dolayındadır.[4] "Polipeptit" ise, uzunluğundan bağımsız olarak, herhangi bir amino asit zinciri için kullanılır ve sıklıkla da tanımlı tek bir biçimin olmadığına işaret eder.
Sentez
Özetle
Bakış açısı
Proteinler genlerde kodlanmış bilgiye dayanarak amino asitlerden inşa olurlar. Her proteinin, kendisini kodlayan gendeki nükleotit dizisi tarafından belirlenen, kendine has bir amino asit dizini vardır. Genetik kod, kodon olarak adlandırılan üç nükleotitlik dizinlerden oluşan bir kümedir, her üç nükleotitli kombinasyon bir amino asite karşılık gelir, örneğin AUG metionine karşılık gelir. DNA dört nükleotitten oluştuğu için tüm kodonların sayısı 64'tür, dolayısıyla genetik kod bir miktar tekrar içerir ve bazı amino asitler birden fazla kodon tarafından belirlenir. DNA'da kodlanmış genler önce RNA polimeraz gibi bir protein tarafından transkripsiyon yoluyla bir ön mesajcı RNA (pre-mRNA) molekülünün sentezlenmesi şeklinde okunurlar. Çoğu canlı sonra bu pre-mRNA'yı çeşitli transkripsiyon sonrası değişim biçimleriyle (post-transcriptional modification) işlemden geçirip olgun mRNA oluştururlar, bu da protein sentezi için ribozom tarafından bir şablon olarak kullanılır. Prokaryotlarda mRNA üretildikten hemen sonra kullanılabilir veya bir ribozom tarafından bağlanılır. Buna karşın ökaryotlar mRNA'yı hücre çekirdeğinde imal ettikten sonra onu çekirdek zarından sitoplazmaya aktarırlar, protein sentezi orada yer alır. Prokaryotlarda protein sentezi ökaryotlardan daha hızlıdır ve saniyede 20 amino asiti bulabilir.[5]
Bir proteinin bir mRNA şablonundan sentezlenmesine translasyon denir. Ribozoma yüklenen mRNA dizinindeki her kodon, üçer nükleititlik birimler yani kodonlar olarak okunur. Bu işlemde o kodona karşılık gelen amino asiti taşıyan bir taşıyıcı RNA molekülünde bulunan antikodon ile mRNA'daki kodon baz eşleşmesi yoluyla eşleştirilir. Aminoasil tRNA sentetaz adı verilen enzim tRNA moleküllerine doğru amino asidi "yükler". Bu sentez sırasında Uzamakta olan polipeptide doğan zincir (İngilizce nascent chain) denir. Proteinler hep N-terminus'tan C-terminus'a doğru uzarlar.
Sentezlenen bir proteinin büyüklüğü dalton birimi (atom kütlesi ile eş anlamlıdır) veya ondan türemiş kilodalton (kDa) ile ifade edilen moleküler kütlesiyle ölçülebilir. Büyüklüğünü belirtmenin bir diğer yolu onu oluşturan amino asitlerin sayısıyladır. Maya proteinleri ortalama 466 amino asit uzunluğunda ve 53 kDA ağırlığındadır.[4] En büyük proteinler kas sarkomerinde bulunan titinlerdir, bunların moleküler kütlesi neredeyse 3000 kDA ve toplum uzunluğu yaklaşık 27000 amino asittir.[6]
Kimyasal sentez
Kısa proteinler laboratuvarda kimyasal yolla da sentezlenebilir. Peptit sentezi olarak adlandırılan yöntemler, kimyasal bağlama (ligation) gibi organik sentez tekniklerine dayandırılmıştır. Kimyasal sentez yoluyla polipeptit zincirlerine doğal olmayan aminoasitlerin de dahil edilmesi mümkündür, örneğin amino asit yan zincirlerine floresan işaretler takılabilir. Bu yöntemler laboratuvar biyokimyası ve hücre biyolojisi araştırmalarında faydalıdır ama genelde ticari uygulamalarda kullanılmazlar. 300 amino asitten uzun polipeptitler için kimyasal sentez verimsizdir ve sentezlenmiş protein kendiliğinden doğadaki üç boyutlu şeklini kazanmayabilir. Çoğu kimyasal sentez yöntemi, biyolojik reaksiyonun tersi yönde, yani C-uçtan N-uca doğru ilerler.
Proteinlerin yapısı
Özetle
Bakış açısı

Çoğu protein katlanarak kendine has üç boyutlu bir yapıyla şekil alır. Proteinin doğal olarak katlanıp oluşturduğu şekle onun doğal hali denir. Çoğu protein kendini oluşturan amino asitlerin yapısal eğilimleri yoluyla yardım görmeden katlanabilirse de, diğerleri doğal hallerine elde edecek şekilde katlanabilmek için moleküler şaperonlara gereksinim duyarlar. Biyokimyacılar çoğu zaman protein yapısının dört ayrı yönüne değinirler:
- Birincil yapı (primer yapı): Düz amino asit dizini.
- İkincil yapı (seconder yapı): hidrojen bağları ile kararlı kılınan, düzenli tekrarlanan yerel yapılardır. Bunların en yaygın örnekleri alfa sarmalı (alpha helix) ve beta yaprağıdır (beta sheet).[7] İkincil yapılar yerel olduğu için bir proteinin içinde farklı ikincil yapılara sahip pek çok bölge olabilir.
- Üçüncül yapı (tersiyer yapı): tek bir proteinin tamamının şekli, ikincil yapıların birbirleriyle olan uzaysal ilişkisi. Üçüncül yapı genelde yerel olmayan etkileşimler tarafından kararlı kılınır, bu en yaygın olarak bir hidrofobik çekirdeğin oluşmasıyla olur ama tuz köprüleri, hidrojen bağları, disülfür bağları ve hatta çevrim sonrası değişimler (İng. post-translational modifications) de olur. Üçüncül yapı ile katlama (İngilizce fold) eş anlamlıdır.
- Dördüncül yapı (kuaterner yapı): Birden fazla protein molekülünün birbiriyle etkileşmesiyle oluşan yapının şekline denir. Bu bağlamda söz konusu proteinlerin bir protein kompleksinin alt birimleri olduğu söylenir.
Yapıyı oluşturan bu seviyelere ek olarak, proteinlerin işlevlerini görürken birbiriyle ilişkili bir yapıdan başka bir yapıya dönüşmeleri de protein yapısının bir diğer boyutunu oluşturur. Bu işlevsel yeniden yapılanmalardan söz ederken üçüncül veya dördüncül yapılara proteinin "konformasyonları" denir ve bunlar arasındaki geçişlere konformasyonal değişim adı verilir. Bu tür değişimler çoğu zaman bir substrat molekülün bir enzime bağlanmasıyla tetiklenir.
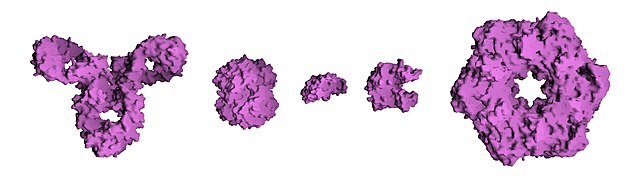
Tipik olarak görülen üçüncül yapılarla ilintili olarak proteinler kabaca üç ana sınıfa ayrılabilirler: küresel (globüler) proteinler, lifli (fibröz) proteinler ve zar (membran) proteinleri. Hemen bütün globüler proteinler suda çözünür ve çoğu enzimdir. Fibröz proteinler çoğunlukla yapısaldırlar; zar proteinleri ise sıkça reseptör olarak görev yapar veya suda çözünen küçük moleküllerin hücre zarından geçmeleri için kanal oluştururlar.
Proteinlerin içinde yer alan özel bir hidrojen bağı türüne dehidron denir, bunlar su molekülü saldırısından korunaklıdır ve kendi dehidrasyonlarını sağlarlar. Proteinlerin yapısının bozulmasına denatürasyon denir. Yapısının eski haline dönmesine renatürasyon denir.
Yapı belirlemesi
Özetle
Bakış açısı
Bir proteinin üçüncül yapısının veya onun parçası olduğu komplekslerin dördüncül yapısının keşfi, onun işlevi hakkında önemli ipuçları verebilir. Yapı belirlemek için kullanılan en yaygın deneysel teknikler X ışını kristalografisi ve NMR spektroskopisidir, her ikisi de atomik çözünürlükte bilgi sağlarlar.[7] Kriyoelektron mikroskopisi, çok büyük protein kompleksleri ve virüsler hakkında daha düşük çözünürlüklü yapısal bilgi üretmekte kullanılır;[7] bunun bir çeşitlemesi sayılan elektron kristalografisi de bazı durumlarda, özellikle membran proteinlerinin iki boyutlarının kristalleri için, yüksek çözünürlüklü bilgi üretebilir.[8] Çözülmüş yapılar genelde Protein Data Bank,[9] (PDB) adlı veritabanıına kaydedilir, bu ücretsiz kaynaktan binlerce proteinin yapısal verileri proteindeki her atomun Kartezyen koordinatları olarak elde edilebilir.
Yapısı çözülmüş protein sayısından çok daha fazla sayıda gen vardır. Ayrıca, yapısı çözülmüş proteinler, yapı çözmede kullanılan başlıca deneysel tekniklere kolayca tabi tutulabilenlere ağırlıklıdır. Özellikle, globüler proteinlerin X-ışını kristlografisi için kristalleştirilmeleri nispeten kolaydır. Buna karşın membran proteinlerinin kristalleştirilmesi zordur ve PDB'de az sayıda temsil edilirler.[10] Yapısal genomik girişimleri bu yetersizliklerin üstesinden gelmek amacıyla belli katlama sınıflarına ait yapıları sistematik olarak çözmektedirler. Protein yapı tahminleme yöntemleri, deneysel olarak yapısı belirlenmemiş proteinler hakkında makul yapıları üretmeyi amaçlar.
Hücresel işlevler
Özetle
Bakış açısı
Proteinler genlerde kodlanmış bilgiler tarafından belirlenmiş görevleri yerine getirirler.[4] Bazı RNA tipleri dışında hücrede bulunan çoğu diğer molekül, proteinlerin etki ettiği nispeten asıl elemanlardır. Proteinler bir E. coli hücresinin kuru ağırlığının yarısını oluştururlar, DNA ve RNA ise %3 ve %20'sini oluştururlar.[11] Belli bir hücre veya hücre tipinde bulunan proteinlerin tamamı onun proteomu olarak adlandırılır.

Proteinlerin çeşitli hücresel işlevlerini yürütmelerini sağlayan başlıca özellikleri başka moleküllere spesifik ve sıkı bir şekilde bağlanabilmeleridir. Proteinin başka bir moleküle bağlanmasından sorumlu bölgesi bağlanma yeri (İngilizce binding site) olarak bilinir ve genelde proteinin yüzeyinde bir çukur veya cep şeklindedir. Proteinin üçüncül yapısı bağlanma yerindeki cep ve etrafındaki amino asite yan zincirlerinin kimyasal özelliklerini belirler, bağlanma yeteneği onun tarafından oluşturulur. Protein bağlanması son derece sıkı ve spesifik olabilir; örneğin ribonükleaz inhibitör proteini insan anjiogenin'ine femtomolardan düşük bir ayrışma katsayısı ile bağlanır (<10−15) ama onun amfibi homoloğu olan onkonaz'a bağlanmaz (>1 M). Bağlanan molekülde çok ufak bir değişiklik, tek bir metil grubunun eklenmesi gibi, bağlanmayı neredeyse tamamen ortadan kaldırabilir; örneğin valin amino asidine spesifik olan aminoasil tRNA sentetaz ona çok benzeyen izolösin amino asidini ayırt edebilir.
Proteinler küçük moleküllere bağlanmanın yanı sıra başka proteinlere de bağlanabilirler. Proteinler kendilerinin diğer kopyalarına bağlandıkları zaman oligomerleşip ipliksi yapılar oluştururlar; bu süreç globüler monomerlerden oluşan, kendi kendisiyle birleşip bükülmez lifler meydana getiren yapısal proteinlerde sıkça görülür. Protein-protein etkileşimleri enzim etkinliğine de düzenler, hücre döngüsünde ilerlemeyi kontrol eder ve birbiriyle ilişkili pek çok reaksiyonu yürüten büyük protein komplekslerinin birleşmesini sağlar. Proteinler hücre zarına bağlanabilir veya ona entegre olabilir. Bağlanan bir proteinin konformasyon değişikliğine neden olma yeteneği karmaşık sinyalleşme ağlarının inşasına olanak sağlar.
Enzimler
Proteinlerin en iyi bilinen rolü kimyasal tepkimelerin katalizleyicisi olarak enzim görevleridir. Enzimler genelde bir veya birkaç tepkimeyi hızlandıran çok özgül katalizörlerdir. Enzimler metabolizma ve katabolizma ile ilgili çoğu tepkimeye etki eder, ayrıca DNA çoğalması, DNA onarımı ve RNA sentezinde de yer alırlar. Bazı enzimler çevrim sonrası değişim adı verilen bir süreç ile başka proteinler üzerinde etki ederler, kimyasal gruplar ekler veya çıkarırlar. Enzimlerin katalizlediği yaklaşık 4000 tepkime bilinmektedir.[12] Enzim katalizinin sağladığı hızlanma çoğu zaman muazzamdır. Orotat dekarboksilaz durumunda hızlanma 1017 kata ulaşabilir.[13]
Enzimler tarafından bağlanan ve etki gören moleküller substrat olarak adlandırılır. Enzimler yüzlerce amino asitten oluşsalar da substratla temas kuranlar bunların çok ufak bir bölümüdür, doğrudan kataliz reaksiyonuyla ilişkili olanlar daha da küçük bir bölümünü oluşturur.[14] Enzimin substrata bağlanan kısmına aktif yer (active site) denir.
Hücre sinyallemesi ve ligand taşıması

Çoğu protein hücre sinyallemesi ve sinyal aktarımı süreçlerinde yer alırlar. İnsülin gibi bazı proteinler, hücre dışı proteinler olup sentezlendikleri hücreden uzaktaki dokulardaki hücrelere bir sinyal taşırlar. Diğerleri reseptör olarak çalışan membran proteinleridir, ana işlevleri bir sinyal molekülüne bağlanmak ve hücre içinde bir biyokimyasal tepkiye yol açmaktır. Çoğu reseptör, bağlanma yeri hücre yüzeyinde bulunan ve hücre içinde bir etki bölgesi olan membran proteinidir. Etki bölgesinin bir enzim etkinliği olabilir veya hücredeki başka proteinlerce algılanabilen bir konformasyon değişimine uğrayabilir.
Antikorlar, adaptif bağışıklık sisteminin protein bileşkeleridir, ana işlevleri antijenlere, yani vücuda yabancı olan maddelere, bağlanıp onları imha edilmeleri için işaretlemektir. Antikorlar hücre dışı ortama salgılanabilirler veya plazma hücresi olarak adlandırılan özelleşmiş B lenfositlerinin membranlarına takılabilirler. Enzimlerin substratlarına bağlanma gücü (afinitesi) onun reaksiyonunu yürütme gereğinden dolayı sınırlı olmasına karşın, antikorların böyle bir sınırlaması yoktur. Bir antikorun hedefine bağlanma afinitesi olağanüstü yüksektir.
Çoğu ligand taşıma proteini küçük moleküllere bağlanıp onları çok hücreli bir canlının vücudunda başka bir yere taşırlar. Bu proteinler ligandları yüksek konsantrasyonda olduğu zaman yüksek bir afiniteye sahip olmalı ama konsantrasyonun düşük olduğu hedef dokuda ligandı salmalıdır. Ligand-bağlayıcı proteinin klasik örneği hemoglobindir, omurgalılarda oksijeni akciğerlerden diğer organ ve dokulara taşır ve her biyolojik alemde yakın homologları vardır.
Transmembran proteinler hücre membranının küçük molekil ve iyonlara olan geçirgenliğini değiştirerek ligand taşıyıcı protein olarak görev yapabilirler. Membranın hidrofobik olan içi polar ve yüklü moleküllerin difüzyonuna elvermez. Membran proteinlerinde bulunan kanallar bu küçük moleküllerin hücreye girip çıkmalarını sağlar. Çoğu iyon kanalı belli bir iyon için özelleşmiştir; örneğin potasyum ve sodyum kanalları bu iki iyondan yalnızca birini geçirirler.
Yapısal proteinler
Yapısal proteinler akışkan biyolojik yapılara bükülmezlik ve peklik sağlarlar. Çoğu yapısal protein fibröz proteindir, örneğin aktin ve tübülin monomerleri globüler ve çözülgen proteinler olmalarına rağmen polimerleştikleri zaman hücre iskeletinin parçası olan, uzun ve bükülmez lifler oluştururlar. Hücre iskeleti hücrenin şeklini ve büyüklüğünü korumasını sağlar. Kollajen ve elastin bağ dokunun önemli bileşkeleridir; keratin ise saç, tırnak, tüy ve bazı hayvanlarda kabuk gibi sert veya lifli dokularda yer alır.
Yapısal görev yapan diğer proteinler arasında miyozin, kinesin ve dinein gibi motor proteinler vardır, bunlar mekanik kuvvet yaratırlar. Bu proteinler eşeyli çoğalan çok hücreli canlılarda sperm hücrelerinin ve tek hücreli canlıların hareket yeteneği (motilitesi) için çok önemlidir. Kasların kasılmasında oluşan kuvvet de bu proteinler tarafından meydana gelir.
Araştırma yöntemleri
Özetle
Bakış açısı
Biyolojik moleküller arasında en fazla çalışılmış olanlardan olan proteinlerin etkinlikleri ve yapıları hem in vitro hem de in vivo olarak çalışılır. Saflaştırılmış proteinlerin kontrollü ortamlarda incelendiği in vitro çalışmalar bir proteinin nasıl işlev gördüğünü öğrenmeye yarar. Örneğin enzim kinetiği çalışmaları bir enzimin katalitik etkinliğinin kimyasal mekanizmasını ve olası substrat moleküllerine olan afinitesinin araştırılmasına yarar. Buna karşın, proteinlerin hücre içinde hatta bütün bür organizmadaki etkinlikleriyle ilgili in vivo deneyler bir proteinin nerede işlev gördüğü ve nasıl düzenlendiği hakkında tamamlayıcı bilgiler verir.
Protein saflaştırması
İn vitro analizler yapabilmek için bir proteinin diğer hücre bileşkelerinden saflaştırılması gerekir. Bu süreç genelde önce hücrenin parçalanmasıyla (sitoliz ile) başlar; hücre zarı bozulur ve hücrenin içeriği ham lizat (crude lysate) olarak adlandırılan bir sıvı halinde salınır. Bu karışım ultrasantrifigasyon ile hücrenin farklı kısımlarından oluşmuş bölümlere ayrılır; çözünür proteinler, membran lipitleri ve proteinler, hücre organelleri ve nükleik asitler bu şekilde birbirlerinden ayrılırlar. Tuzla çökeltme (salting out) yöntemi ile lizattaki proteinlerin konsantrasyonu artırılabilir. Bunun ardından, arzu edilen proteini saflaştırmak için onun büyüklüğü, elektrik yükü ve bağlanma afinitesi gibi özelliklerine dayanarak çeşitli kromatografi teknikleri kullanılır. Saflaştırmanın derecesini takip etmek için jel elektroforezi (eğer proteinin büyüklüğü biliniyorsa), spektroskopi (eğer proteinin ayırt edici spektroskopik özellikleri varsa) veya enzim ölçmeleri ile (eğer proteinin enzim etkinliği varsa) kullanılır.
Doğal bir proteinin laboratuvar uygulamaları için yeterince saf olarak elde edilebilmesi için bir seri saflaştırma aşamasından geçmesi gerekebilir. Bu süreci basitleştirmek için çoğu zaman genetik mühendislik kullanılarak proteinin yapı ve etkinliğine etki etmeden saflaştırılmasını kolaylaştıracak kimyasal özellikler eklenir. Belli bir amino asit dizisinden oluşan bir işaret, çoğu zaman bir seri histidin kalıntısı, proteinin bir ucuna eklenir. Bunun sonucunda, nikel içeren bir kromatografi kolonundan lizat geçirilince histidin kalıntıları nikele bağlanır ve kolonda tutulur, lizattaki işaretlenmemiş diğer her şey kolondan geçip gider.
Hücrede yerleşimi

Proteinlerin in vivo araştırılmalarında hücre içinde sentez ve yerleşimine (lokalizasyonuna) bakılır. Çoğu hücre içi protein sitoplazmada sentezlenir, çoğu membran proteini veya salgılanan protein ise endoplazmik retikulumda sentezlenir. Ancak, proteinlerin sentezlendikten sonra belli organellere veya hücre içi yapılara nasıl yollandıklarının ayrıntıları çoğu zaman bir araştırma konusu olur. Hücresel yerleşimi belirlemek için kullanılan faydalı bir teknik, genetik mühendislikle ilgilenilen protein flüoresan bir protein (Green Fluorescent Protein, GFP) ile birleştirerek bir füzyon protein oluşturulmasıdır. Füzyon proteinin hücre içindeki yeri, mikroskop kullanarak kolayca ve açık bir şekilde görüntülenebilir, bunun örnekleri yandaki şekilde görülebilir.
Yönlendirilmiş mutagenez (site-directed mutagenesis) olarak bilinen bir diğer genetik mühendislik yöntemi ile proteinin dizisi ve dolayısıyla onun yapısı, hücresel yerleşimi ve düzenlenmesi değiştirilebilir. Değiştirilmiş protein in vivo olarak GFP işaretlemesi ile, in vitro ise enzim kinetik ve bağlanma ölçümleri ile izlenebilir.
Proteomik ve biyoenformatik
Bir hücre veya hücre tipinde bulunan proteinlerin tamamına onun proteomu ade verilir, bu tür büyük boyutlu veri kümelerinin araştırılması da proteomik sahasının konusudur (bu dalın ismi ilgili bir saha olan genomikten türetilmiştir). Proteomikte kullanılan anahtar teknikler arasında protein mikrodizilimleri ve iki-hibrit taraması sayılabilir. Protein mikrodizilimleri hücredeki çok sayıda proteinin seviyelerinin belirlenmesini, iki-hibrit taraması ise protein-protein etkileşimlerinin sistematik olarak incelenmesini sağlar. Olası biyolojik etkileşimlerin tümüne interaktom (interactome) adı verilir. Mevcut olan her protein katlamasına sahip olan proteinlerin yapılarının sistematik olarak çözme girişimine yapısal genomik adı verilmiştir.
Çeşitli organizmalara ait genomik ve proteomik veriler sayesinde araştırmacılar evrimsel olarak birbirine uzak canlılarda bulunan homolog proteinleri dizi hizalaması ile verimli bir şekilde tanımlayabilmektedirler. Dizi profilleme programları ile nükleotit dizilerinde restriksiyon enzimi haritaları, açık okuma çerçevesi analizleri, protein dizilerinden ikincil yapı tahminleri gibi analizler yapılabilir. Bu verilerden ilogenetik ağaçlar inşa edilebilir ve ClustalW gibi özel yazılımlar kullanarak modern canlılar ve genlerinin ataları hakkında evrimsel hipotezler geliştirilebilir. Biyoenformatik sahası genomik ve proteomik verileri birleştirerek, anlamlandırmak ve analiz eder. Bu yolla biyolojik problemlere gen bulma ve kladistik gibi bilişsel teknikler uygular.
Yapı tahmini ve simülasyon
Yapısal genomik sahasını tamamlayıcı bir yaklaşım olarak protein yapı tahmini, yapısı çözülmemiş proteinler için makul modeller geliştirmeyi amaçlar. Yapı tahmininin en başarılı tipi olan homoloji modellemesi, modellenecek proteine dizin benzerliği olan "şablon" bir yapıya dayanır. Yapısal genomiğin amacı çözülmüş yapılar arasında yeterince çeşitlilik elde edip geri kalanları modellemektir. Mevcut şablon yapılar modellenecek proteine uzaktan ilişkili olduğu durumlarda güvenilir modeller üretmek zordur. Bu sorunun çözümü dizin hizalamasının en doğru şekilde yapılmasından geçmesi gerektiği öne sürülmüştür.[15] Yapı tahmin yöntemleri yeni bir saha olarak gelişmekte olan protein mühendisliğine yol göstermektedir, bu yolla yeni protein katlamaları tasarlanabilmiştir.[16] Moleküler yanaşma (molecular docking) ve protein protein etkileşimleri gibi moleküller arası etkileşimlerin tahmini bu sahada çözülmeye çalışılan daha karmaşık bir problemlerdendir.
Protein katlanması ve bağlanma süreci moleküler dinamik teknikleri ile simüle edilebilir. Moleküler dinamik yöntemlerle kuantum mekanik hesaplamalarının birleştirilmesi yoluyla da proteinlerin elektronik yapıları incelenmektedir.[17]
Beslenme
Çoğu mikroorganizma ve bitki standart amino asitlerin 20'sini de sentezleyebilmesine karşın hayvanlar bazı amino asitleri diyetlerinden elde etmek zorundadırlar.[11] Bazı amino asitlerin sentezlendiği biyosentetik yollarda yer alan anahtar enzimler, örneğin aspartattan başlayarak lizin, metionin ve treonin sentezinin ilk adımını katalizleyen aspartokinaz, hayvanlarda yoktur. Bir organizmanın sentezleyemediği amino asitler esansiyel amino asitler olarak bilinir (bu terim sıkça insanlar için gerekli olanları kastetmek için kullanılır). Eğer bir amino asit ortamda mevcutsa çoğu canlı enerji tasarrufu için biyosentetik yolu durdurarak amino asiti ortamdan içine alır. Laboratuvarda bakteriler çoğu zaman belli amino asitleri sentezlemek için gereken genlerden yoksun bırakılarak seçilebilir bir işaret (selectable marker) yaratılır. Bu yolla hücre içine yabancı DNA sokmanın (transfeksiyon) başarısı belirlenebilir.
Hayvanlarda amino asitler protein içeren besinlerin tüketilmesi yoluyla elde edilir. Yenen proteinler sindirim yoluyla parçalanırlar, bu süreç zarfında protein önce mide asitlerinin etkisiyle doğal yapısı bozulur (denatüre olur) ve ardından proteaz olarak adlandırılan enzimler tarafından yıkıma uğrar. Esansiyel amino asitlerin vücuda alınması canlının sağlığı için çok önemlidir çünkü bu amino asitleri içeren proteinlerin sentezi onların düşük konsantrasyonda olmaları halinde ketlenir (inhibe olur). Amino asitler önemli bir azot kaynağıdır. Vücuda alınan bazı amino asitler, özellikle esansiyel olmayanlar, protein sentezi için doğrudan kullanılmazlar. Onun yerine glukoneogenez yoluyla karbonhidratlara dönüşürler. Glukoneogenez açlık durumunda vücudun kendi proteinlerinden, özellikle kas proteinlerinden, glikoz elde edilmesinde de kullanılır. Protein için gerekli amino asitler; peynir, süt, et gibi hayvansal gıdalardan alınabileceği gibi mercimek, baklagiller, buğday gluteni, tam tahıl, tohumlar (ör: susam/tahin) ve tofu gibi bitkisel besinlerden yeterli miktarda alınabilir.
Tarih
Özetle
Bakış açısı
Proteinlerin ayrı bir sınıf biyolojik molekül olduğu On sekizinci yüzyılda Antoine Fourcroy ve diğerleri tarafından fark edilmiştir. Bu sınıftaki maddeler ("albüminoid", Eiweisskörper veya matières albuminoides olarak adlandırılmışlardı) asit veya ısının etkisiyle pıhtılaşma veya topaklanma özellikleriyle tanınmışlardı. 19 yy. başlarında bunların iyi bilinen örnekleri yumurta beyazında bulunan albümen, serum albümini, fibrin ve buğday gluteniydi. Yumurta beyazının pişmesi ile sütün kesilmesi arasındaki benzerlik eski çağlarda da fark edilmişti, örneğin yumurta beyazı için albümen adı Yaşlı Plinius tarafından yumurta beyazı anlamına gelen Latince albus ovi 'den türetilmişti.
Jöns Jakob Berzelius'un tavsiyesi üzerine Hollandalı kimyager Gerhardus Johannes Mulder yaygın hayvan ve bitki proteinleri üzerinde element analizi yapmıştır. Herkesi şaşırtan bir sonuç, tüm proteinlerin yaklaşık aynı empirik formüle sahip olduklarıydı: birkaç fosfor ve kükürt atomunun yanı sıra yaklaşık olarak C400H620N100O120. Mulder sonuçlarını 1837 ve 1838 tarihlerinde iki makale olarak yayınladı ve "Grundstoff" olarak adlandırdığı bir temel protein maddesi olduğunu, bunun bitkiler tarafından sentezlendiği, hayvanların da onu sindirim yoluyla elde ettiğini hipotezledi. Berzelius bu teorinin ilk savunucularındandı ve 10 Temmuz 1838 tarihli bir mektupta bu madde için "protein" adını önerdi:
- Fibrin ve albüminin organik oksidi için önerdiğim protein ismini (Yunanca) πρωτειος'dan türetmek istedim, çünkü hayvan beslenmesinin temel veya esas bir maddesi olarak görünmektedir.
Mulder protein yıkımı sonucu ortaya çıkan amino asitleri tanımlamaya girişmiş, lösin için (yaklaşık olarak doğru) molekül ağırlığı olan 131 Da bulmuştur.
Mulder'in analizlerinden proteinler için ortaya çıkan en küçük molekül ağırlığı yaklaşık 9 kDa idi, bu rakam o zamanlar üzerinde çalışılan diğer moleküllerden yüzlerce kere daha büyüktü. Bu yüzden proteinlerin kimyasal yapısı (birincil yapıları) 1949'a kadar önemli bir araştırma konusuydu, o tarihte Fred Sanger insülinin dizisini çözdü. Proteinlerin peptit bağlarıyla bağlanmış amino asitlerin lineer polimerleri olduğu teorisi 1902'de bir konferansta Franz Hofmeister ve Emil Fischer tarafından aynı zamanda ve birbirlerinden bağımsız olarak sunuldu. Ancak, bazı bilim adamları bu kadar uzun makromoleküllerin çözelti halinde kararlı olabilecekleri konusunda şüpheciydiler. Bu yüzden protein birincil yapısına dair çeşitli alternatif teoriler de geliştirildi, örneğin proteinlerin küçük moleküllerden oluşan kümeler olduğunu öne süren kolloid hipotezi, Dorothy Wrinch'in siklol hipotezi, Emil Abderhalen'in diketopiperazin hipotezi ve Troensgard'ın pirrol/piperidin hipotezi (1942). Bu teorilerin çoğu, proteinlerin yıkımı sonucunda peptit ve amino asit oluşumunu açıklamakta zorlanıyordu. Nihayet Theodor Svedberg, analitik ultrasantrifüjleme tekniği ile proteinlerin tanımlı terkibi olan makromoleküller olduğunu, kolloid karışımlar olmadığını gösterdi. Bazı proteinlerin daha küçük proteinlerin kovalent olmayan birleşimleri olabileceği Gilbert Smithson Adair tarafından (hemoglobinin osmotik basıncını ölçerek), daha sonradan da Frederic M. Richards tarafından (Ribonükleaz S üzerindeki çalışmaları ile) gösterildi. Proteinlerde translasyon sonrası değişimlerin tanımlanmasında kullanılan faydalı bir teknik kütle spektrometrisi olmuştur, bu teknik yakın zamanda protein dizini çözmekte de kullanılmıştır.
Çoğu proteinin modern tekniklerle dahi milligram miktarlardan daha fazla saflaştırılması zordur. Bu yüzden ilk çalışmalar bol miktarda saflaştırılması kolay olan proteinler üzerine odaklanmıştı, bunlar örneğin kan proteinleri, yumurta beyazı ve mezbahalardan elde edilebilen çeşitli sindirim ve metabolizma enzimleriydi. İkinci Dünya Savaşı'nda Edwin Joseph Cohn tarafından başlatılan, amacı askerleri sağ tutacak kan proteinlerinin saflaştırılması olan, bir proje sırasında protein saflaştırılmasıyla ilgili pek çok teknik geliştirildi. 1950 sonlarında Armor Hot Dog Company adlı bir sosis imalatçısı, 1 kg pankreatik ribonükleaz A saflaştırıp bunu dünyadaki tüm bilim insanlarının hizmetine sundu. Bu cömertliğin sonucu olarak RNaz A, izleyen birkaç on yıl boyunca temel araştırmada kullanılan başlıca protein olmuş ve birkaç Nobel Ödülü'ne yol açmıştır.
Protein katlanmasının araştırılması 1910'da Henrietta Chick ve C.J. Martin tarafından yazılmış ünlü bir makale ile başlamıştır. Bu çalışmada topaklanma sürecinin iki adımdan oluştuğu, proteinin çökelmesinden evvel denatürasyon olarak adlandırılan bir adımın geldiğini göstermişlerdir. Denatürasyonda protein az çözünür hale gelir, enzim aktivitesin kaybeder ve kimyasal olarak daha etkin hale gelir. 1920 ortalarında Tim Anson ve Alfred Mirsky denatürasyonun tersinir olduğunu öne sürdüler; doğru olan bu hipotez baştan bazı bilimciler tarafından "yumurtanın pişmesini geri alınması" olarak alaya alındı. Anson ayrıca denaturasyonun iki halli ("ya var ya yok") bir süreç olduğunu, moleküler bir geçiş sonucunda çözünürlük, enzim etkinliği ve kimyasal etkinlikte büyük bir değişiklik meydana geldiğini de önermişti. 1929'da Hsien Wu denatürasyonun aslında bir protein katlanması olduğunu, bazı amino asit yan zincirlerinin çözücüye maruz kalmalarına neden olan bir konformasyon değişikliği olduğunu hipotezledi. Bu (doğru olan) hipoteze göre, alifatik ve reaktif yan zincirlerin suya maruz kalması proteini daha az çözünür ve daha reaktif hale getirmekteydi. Wu'nun hipotezi makul sayılmakla beraber hemen kabul görmedi çünkü o dönemde protein yapısı, enzimoloji ve gözlemlenen değişikliklere neden olabilecek diğer etmenler hakkında çok az şey biliniyordu. 1960'ların başlarında Chris Anfinsen ribonükleaz A'nın katlanmasının hiçbir dış faktöre gerektirmeden tamamen tersinir olduğunu göstererek protein katlanmasıyla ilgili "termodinamik hipotezi" doğruladı. Bu hipoteze göre proteinin katlanmış hali, protein serbest enerjisinin global minimum noktasına karşılık gelmektedir.
Protein katlanma hipotezinin ardından katlanmış proteini kararlı kılan fiziksel etkileşimler konusunda araştırmalar başladı. Hidrofobik etkileşimlerin son derece önemli olduğu Dorothy Wrinch ve Irving Langmuir tarafından siklol yapılarının stabilize edebilecek bir mekanizma olarak daha evvelden hipotezlenmişti. Siklol hipotezi 1930'larda Linus Pauling ve diğerleri tarafından çürütülünce bu (doğru olan) hipotez de onunla beraber kenara atılmıştı. Pauling protein yapısının hidrojen bağları tarafından stabilize olduğunu savunuyordu, bu fikir ilk William Astbury tarafından 1933'te öne sürülmüştü. İlginç bir şekilde, Pauling'in H-bağları hakkında hatalı olan teorisi protein ikincil yapı elemanları (alfa sarmal ve beta yaprak) konusunda onun doğru modeller oluşturmasını sağlamıştır. 1959'da Walter Kauzman tarafından denatürasyon hakkında yazılan, kısmen Kaj Linderstrom-Lang'ın çalışmalarına da dayalı olan, ünlü bir makale hidrofobik etkileşimi bilimdeki doğru konumuna getirdi. Proteinlerin iyonik yapısı Bjerrum, Weber ve Arne Tiselius tarafından kanıtlandı ama Linderstrom-Lang, 1949'da iyonik grupların genelde çözücü tarafından ulaşılabilir olduğunu ve birbirlerine bağlı olmadıklarını gösterdi.
Globüler proteinlerin ikincil ve düşük çözünürlüklü üçüncül yapıları önceleri analitik ultrasantrifügasyon ve akı çift kırılması (flow birefringence) gibi hidrodinamik yöntemlerle araştırıldı. Protein yapısını yoklamak için kullanılan sprektroskopik yöntemler (dairesel dikroizm (circular dichroism), flüoresans, yakın-morötesi ve kizilütesi soğurganlığı (absorpsiyonu)) 1950'lerde geliştirildi. Proteinlerin atom çözünürlüklü ilk yapıları X-ışını kristalografisi ile 1960'larda, NMR ile de 1980'lerde çözüldü. 2006 yılı itibarıyla Potein Data Bank'da yaklaşık 40.000 atom çözünürlüklü protein yapısı bulunmaktadır. Yakın zamanlarda kriyo-elektron mikroskopisi ve hesapsal protein yapı tahminleri de atomsal çözünürlüğe yaklaşan iki yöntem olmuştur.
Ayrıca bakınız
- Amino asit
- Proteinler listesi
- Protein (besin)
- Protein biyosentezi
- Protein çözümleme
- Peynir altı suyu proteini
- Protein tozu
- Protein bar
- Protein fosforilasyonu
- Protein agregasyonu
- Protein dizileme
- Protein-protein etkileşimi
- Süt proteini
- Kan proteinleri
- Retinoblastoma protein
- Telomer bağlanıcı protein
- Transmembran protein
Kaynakça
Dış bağlantılar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
