ბორი
From Wikipedia, the free encyclopedia
ბორი[3][4] (ლათ. Borum; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეორე პერიოდის, მეცამეტე ჯგუფის (მოძველებული კლასიფიკაციით — მესამე ჯგუფის მთავარი ქვეჯგუფის, IIIა) ქიმიური ელემენტი. მისი ატომური ნომერია 5, ატომური მასა — 10.81; tდნ — 2076 °C, tდუღ — 3927 °C, სიმკვრივე (თხევად მდგომარეობაში) — 2.08 გ/სმ3; მონაცისფრო-შავი კრისტალები; სიმაგრე მინერალოგიური სკალის მიხედვით — 9. კრისტალური ბორი ნახევრად გამტარია, ჩვეულებრივ პირობებში ელექტრულ დენს ცუდად ატარებს. 800°C-მდე გაცხელებისას ბორის ელექტროგამტარობა მატულობს; ბუნებრივი ბორი ორი სტაბილური იზოტოპისაგან შედგება: (19.65%) და (80.35%). ხელოვნური გზით მიღებულია ბერილიუმის არამდგრადი ნუკლიდები, რომელთა მასური რიცხვი მერყეობს 6-21-ის შუალედში.
| ბორი |
| 5B |
| 10.81 |
| 2s2 2p1 |
 | ||||||||||||||||||
| ზოგადი თვისებები | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | მონაცისფრო-შავი კრისტალები | |||||||||||||||||
| სტანდ. ატომური წონა Ar°(B) |
[10.806, 10.821][1] 10.81±0.02[2] (დამრგვალებული) | |||||||||||||||||
| ბორი პერიოდულ სისტემაში | ||||||||||||||||||
| ||||||||||||||||||
| ატომური ნომერი (Z) | 5 | |||||||||||||||||
| ჯგუფი | 13 | |||||||||||||||||
| პერიოდი | 2 პერიოდი | |||||||||||||||||
| ბლოკი |
| |||||||||||||||||
| ელექტრონული კონფიგურაცია | [He] 2s2 2p1 | |||||||||||||||||
| ელექტრონი გარსზე | 2, 3 | |||||||||||||||||
ელემენტის ატომის სქემა | ||||||||||||||||||
| ფიზიკური თვისებები | ||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | |||||||||||||||||
| დნობის ტემპერატურა |
2076 °C (2349 K, 3769 °F) | |||||||||||||||||
| დუღილის ტემპერატურა |
3927 °C (4200 K, 7101 °F) | |||||||||||||||||
| სიმკვრივე (ლ.წ.) | 2.08 გ/სმ3 | |||||||||||||||||
| დნობის კუთ. სითბო | 50.2 კჯ/მოლი | |||||||||||||||||
| აორთქ. კუთ. სითბო | 508 კჯ/მოლი | |||||||||||||||||
| მოლური თბოტევადობა | 11.087 ჯ/(მოლი·K) | |||||||||||||||||
ნაჯერი ორთქლის წნევა
| ||||||||||||||||||
| ატომის თვისებები | ||||||||||||||||||
| ჟანგვის ხარისხი | −5, −1, 0, +1, +2, +3 | |||||||||||||||||
| ელექტროდული პოტენციალი |
| |||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 2.04 | |||||||||||||||||
| იონიზაციის ენერგია |
| |||||||||||||||||
| ატომის რადიუსი | ემპირიული: 90 პმ | |||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 84±3 პმ | |||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 192 პმ | |||||||||||||||||
|
ბორის სპექტრალური ზოლები | ||||||||||||||||||
| სხვა თვისებები | ||||||||||||||||||
| მესრის სტრუქტურა |
რომბიედრული  | |||||||||||||||||
| მესრის პერიოდი | 10.17 Å | |||||||||||||||||
| ბგერის სიჩქარე | 16.200 მ/წმ (20 °C) | |||||||||||||||||
| თერმული გაფართოება | 5–7 µმ/(მ·K) (25 °C) | |||||||||||||||||
| თბოგამტარობა | 27.4 ვტ/(მ·K) | |||||||||||||||||
| კუთრი წინაღობა | ~106 ნომ·მ (20 °C) | |||||||||||||||||
| მაგნეტიზმი | დიამაგნეტიკი | |||||||||||||||||
| მაგნიტური ამთვისებლობა | −6.7×10−6 სმ3/მოლ | |||||||||||||||||
| მოოსის მეთოდი | ~9.5 | |||||||||||||||||
| CAS ნომერი | 7440-42-8 | |||||||||||||||||
| ისტორია | ||||||||||||||||||
| აღმომჩენია | ლუი გეი-ლუსაკი და ლუი ჟაკ ტენარი (30 ივნისი, 1808) | |||||||||||||||||
| პირველი მიმღებია | ჰემფრი დევი (9 ივლისი, 1808) | |||||||||||||||||
| ბორის მთავარი იზოტოპები | ||||||||||||||||||
| ||||||||||||||||||
| • | ||||||||||||||||||
თავისუფალი სახის ბორი — არის უფერო, რუხი ან წითელი კრისტალური ან მუქი ამორფული ნივთიერებაა. ცნობილია ბორის 10-ზე მეტი ალოტროპიული მოდიფიკაცია. ბორი წარმოადგენს ტრივიალურ მეტალოიდს, რომელიც დიდი რაოდენობით გვხვდება ბორაქსის და ალექსისტის აქროლად საბადოებში.
ამორფული ბორი - მურა ფერის ფხვნილია, კრისტალური ბორი კი შავი ფერისაა, რომელიც საკმაოდ მძიმეა (~ 9.5 მოხის სკალის მიხედვით) და ოთახის ტემპერატურაზე სუსტი გამტარია. ბორი გამოიყენება დანამატების სახით ნახევარგამტარების ინდუსტრიაში, ხოლო მისი ნაერთები უმნიშვნელოვანეს როლს ასრულებენ როგორც მსუბუქი სტრუქტურული მასალები, ინსექტიციდები (მწერების საწინააღმდეგოდ), კონსერვანტები და რეაგენტები ორგანული სინთეზისათვის.
ისტორია და სახელწოდების წარმომავლობა
პირველად მიღებულ იქნა 1808 წელს ფრანგი ფიზიკოსის ლუი გეი-ლუსაკის და ლუი ჟაკ ტენარის მიერ, ბორის ანჰიდრიდის B2O3-ის გახურებით ლითონურ კალიუმთან ერთად. რამდენიმე თვის შემდეგ ბორი მიიღი ჰემფრი დევიმ B2O3-ის განალღვობის ელექტროლიზით.
ელემენტის სახელი მოდის არაბული სიტყვიდან ბურაკი (არაბ. بورق) ან სპარსულიდან ბურაჰ (სპარს. بوره)[5], რომლებიც გამოიყენებოდა მინერალის ბურას აღსანიშნავად[6]
იზოტოპები
სტანდარტული ატომური მასა
ბორის სტანდარტული ატომური მასად მიღებულია — 10.81 (10.813518), რომელიც როგორც წესი იანგარიშება ბუნებაში არსებულ ყველა სტაბილურ იზოტოპტთა საშუალო შეწონილი მასით, მათი დედამიწის ქერქსა და ატმოსფეროში გავრცელების პროპორციულად.
| იზოტოპი | Z | N | ატომური მასა (მ.ა.ე.) |
% ბუნებაში | საშუალო შეწონილი |
|---|---|---|---|---|---|
| 10B | 5 | 5 | 10.012936862(16) | 19.65 % | 1.967542 |
| 11B | 5 | 6 | 11.009305167(13) | 80.35 % | 8.845976 |
| Ar°(B) | 100 % | 10.813518 |
ბუნებაში
დედამიწის ქერქში ბორის საშუალო შემცველობაა 4 გრ/ტ. ამის მიუხედავად, ცნობილია ბორის საკუთარი მიახლოებით 100 მინერალი; «სხვის» მინერალებში ის თითქმის არ გვხვდება. ეს აიხსნება უპირველეს ყოვლისა, იმით რომ ბორის კომპლექსურ ანიონებს (კერძოდ ამ სახით ის შედის უმრავლეს მინერალებში) არ აქვს ფართოდ გავრცელებული ანალოგები. თითქმის ყველა მინერალში ბორი დაკავშირებულია ჟანგბადთან, ხოლო ფტორშემცველი ნაერთების ჯგუფი ძალიან მცირერიცხოვანია. ელემენტარული ბორი ბუნებაში არ გვხვდება. ის შედის ბევრ ნაერთში და ფართოდაა გავრცელებული, განსაკუთრებით მცირე კონცენტრაციებით; ბოროსილიკატების და ბორატებისს სახით, ასევე იზომორფული მინარევების სახით შედის ბევრი ამოფრქვეული და დანალექი ქანების მინერალებში. ბორი არის ნავთობში და ზღვის წყალში (ზღვის წყალში 4,6 მგრ/ლ[7]), მარილიან ტბებში, ცხელ წყაროებში და ტალახის ვულკანებში.
ბორის მინერალების ძირითადი ფორმები:
- ბოროსილიკატები: დატოლიტი CaBSiO4OH, დანბურიტი CaB2Si2O8
- ბორატები: ბურა Na2B4O7 • 10H2O, აშარიტი MgBO2(OH), ჰიდრობორაციტი (Ca, Mg)B6O11 • 6H2O, ინიოიტი Ca2B6O11 • 13H2O, კალიბორიტი KMg2B11O19 • 9H2O.
ასევე განასხვავებენ ბორის საბადოების რამდენიმე ტიპს:
- ბორატების მაგნეზიური საბადოები:
- ლუდვიგიტური და ლუდვიგიტ-მაგნეტიტური მადნები;
- კოტოიტური მადნები დოლომიტურ მარმარილოებში;
- აშარიტული და აშარიტულ-მაგნეტიტური მადნები.
- ბოროსილიკატების კირული საბადოები (დატოლიტური და დანბორიტული მადნები);
- ბოროსილიკატების გრეიზენების საბადოები, მეორად კვარციტებში და ჰიდროთერმულ ძარღვებში (ტურმალინის კონცენტრაციები);
- ვულკანოგენურ-დანალექი:
- ბორის მადნები, ვულკანური მოქმედების პროდუქტების დანალექები;
- დანალექი ბორატული მადნები ტბის ნალექებში;
- ჩამარხული დანალექი ბორატული მადნები.
- ჰალოგენ-დანალექი საბადოები:
- ბორატების საბადოები ჰალოგენურ დანალექებში;
- ბორატების საბადოები მარილოვანი გუმბათების თაბაშირის ქუდებში.
მიღება
ყველაზე სუფთა ბორს იღებენ ბაროწყალბადების პიროლიზით. ასეთი ბორი გამოიყენება ნახევარგამტარ მასალებში და ქიმიურ სინთეზებში.
1. მეტალოთერმიის მეთოდი (აღდგენა მაგნიუმით ან ნატრიუმით):
2. ბორის ბრომიდის ორთქლის თერმული დაშლით გავარვარებულ (1000—1200 °C) ვოლფრამის მართულზე წყალბადის თანდასწრებით (ვან-არკელის მეთოდი):
ფიზიკური თვისებები
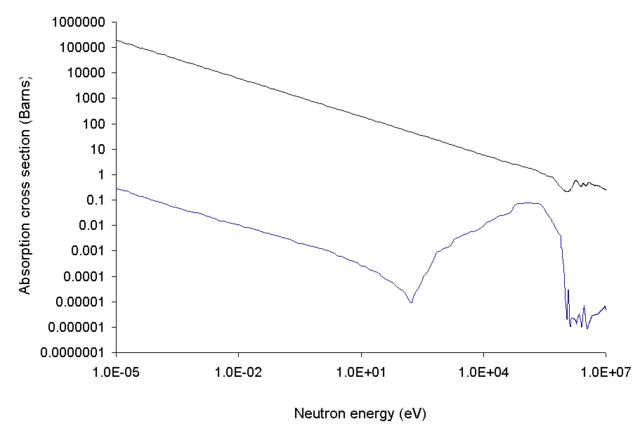
არის ძალიან მაგარი ნივთიერება (ჩამორჩება მხოლოდ ალმასს, ნახშირბადის ნიტრიდს, ბორის ნიტრიდს (ბორაზონი), ბორის კარბიდს, ბორი-ნახშირბად-სილიციუმი შენადნობს, სკანდიუმ-ტიტანის კარბიდს). არის მყიფე და აქვს ნახევარგამტარის თვისებები.
ბუნებაში ბორი გვხვდება ორი იზოტოპის სახით 10В (20 %) და 11В (80 %)[8].
10В აქვს მეტად დიდი სითბული ნეიტრონების შთანთქმის განიკვეთი, ამიტომაც 10В ბორმჟავას შემადგენლობაში გამოიყენება ბირთვულ რეაქტორებში რეაქტიულობის რეგულირებისათვის.
ქიმიური თვისებები

ბევრი ფიზიკური და ქიმიური თვისებებით არალითონი ბორი ძალიან ჰგავს სილიციუმს.
ქიმიურად ბორი საკმაოდ ინერტულია და ოთახის ტემპერატურაზე ურთიერთქმედებს მხოლოდ ფთორთან:
.
გახურებისას ბორი რეაგირებს სხვა ჰალოგენებთან, აზოტთან ბორის ნიტრიდის BN წარმოქმნით, ფოსფორთან — ფოსფიდის BP, ნახშირბადთან — სხვადასხვა შემადგენლობის კარბიდის (B4C, B12C3, B13C2) წარმოქმნით. ჟანგბადის ატმოსფეროში ან ჰაერზე გახურებისას ბორი იწვის სითბოს დიდი რაოდენობის გამოყოფით, წარმოიქმნება ოქსიდი B2O3:
წყალბადთან ბორი პირდაპირ არ ურთიერთქმედებს, თუმცა ცნობილია სხვადასხვა შემადგენლობის ბევრი ბორწყალბადი, რომელსაც მიიღებენ ტუტე ლითონების ან ტუტემიწა ლითონების მჟავეებით დამუშავებისას:
ძლიერი გახურებისას ბორი ავლენს აღმდგენ თვისებებს. ის მაგალითად, აღადგენს სილიციუმს და ფოსფორს მათი ოქსიდებიდან:
ბორის ეს თვისება შეიძლება ავხსნათ B2O3-ის ქიმიური ბმების მეტად მაღალი სიმტკიცით.
მჟანგავების არარსებობის დროს ბორი მდგრადია ტუტების ხსნარების მოქმედების მიმართ. ცხელ აზოტმჟავაში, გოგირდმჟავაში და სამეფო წყალში ბორი იხსნება ბორმჟავის წარმოქმნით.
ბორის ოქსიდი — ტიპური მჟავა ოქსიდია. ის რეაგირებს წყალთან ბორმჟავის წარმოქმნით:
ბორმჟავის ურთიერთქმედებით ტუტეებთან წარმოიქმნება არა თვითონ ბორმჟავის მარილები — ბორატები (რომლებიც შეიცავენ ანიონს BO33−), ხოლო ტეტრაბორატები, მაგალითად:
გამოყენება
ელემენტარული ბორი
ბორი (ბოჭკოების სახით) ბევრ კომპოზიციურ მასალებში გამოიყენება, როგორც გამამტკიცებელი მასალა.
ასევე ბორი ხშირად გამოიყენება ელექტრონიკაში სილიციუმის გამტარობის ტიპის შესაცვლელად.
ბორი გამოიყენება მეტალურგიაში როგორც მიკრომალეგირებელი ელემენტი, მნიშვნელოვნად ზრდის ფოლადების გლინვადობას.
ბორი გამოიყენება მედიცინაში ბორ ნეიტრონ-მიტაცების თერაპიაში (ავთვისებიანი სიმსივნის უჯრედების ამორჩევითი განადგურების მეთოდი)[9].
ბორის ნაერთები
ბორის კარბიდი გამოიყენება კომპაქტური სახით გაზოდინამიკური საკისრების დასამზადებლად.
პერბორატები / პეროქსობორატები (შეიცავენ იონებს [B2(O2)2(OH)4]2−) ტექნიკური პროდუქტი შეიცავს 10,4 % -მდე «აქტიურ ჟანგბადს», მის საფუძველზე აწარმოებენ მათეთრებელს, «რომლებიც არ შეიცავენ ქლორს» («პერსილი», «პერსოლი» და სხვა).
ცალკე აღსანიშნავია რომ შენადნობი ბორ-ნახშირბად-სილიციუმი ხასიათდება ძალიან მაღალი სიმაგრით და შეუძლია შეცვალოს ყველანაირი აბრაზიული მასალა (მიკროსიმაგრით ალმასის და ბორის ნიტრიდის გარდა), ხოლო ღირებულებით და ეფექტურობით ყველა ცნობილ აბრაზიულ მასალაზე უკეთესია.
ბორისა და მაგნიმის შენადნობს (მაგნიუმის დიბორიდი MgB2) აქვს, ამ მომენტისათვის, რეკორდულად მაღალი ზეგამტარობაზა გადასვლის კრიტიკული ტემპერატურა, ყველა პირველი სახის ზეგამტარს შორის[10]. ზემოთაღნიშნულმა სტატიამ სტიმული მისცა ამ თემატიკაზე მუშაობის ზრდას[11].
ბორმჟავა (H3BO3) ფართოდ გამოიყენება ატომურ ენერგეტიკაში ВВЭР (PWR) ტიპის «სითბურ» («ნელ») ნეიტრონების ბირთვულ რეაქტორებში როგორც ნეიტრონების მშთანთქმელი. თავისი ნეიტრონ-ფიზიკური თვისებების და წყალში გახსნის შესაძლებლობის გამო, ბორმჟავა გამოიყენება შესაძლებელს ქმნის ბირთვული რეაქტორის სიმძლავრის რეგულირებას მდორედ ნელა (და არა საფეხურებლივად), მისი კონცენტრაციის ცვლილებით სითბოს მატარებელში — ე. წ. «ბორით რეგულირება».
ბორის ნიტრიდი აქტივირებული ნახშირბადით წარმოადგენს ლუმინოფორს რომელიც ანათებს ულტრაიისფერი ლურჯიდან ყვითელ ფერამდე და აქვს სიბნელეში დამოუკიდებელი ფოსფორესცენცია და აქტივირდება ორგანული ნივთიერებებით 1000 °C-მდე გახურებისას. ბორის ნიტრიდით ლუმინოფორების დამზადება, BN/C შემადგენლობით არ ააქვს სამრეწველო მნიშვნელობა, მაგრამ ფართოდ გამოიყენებოდა XX საუკუნის პირველი ნახევრის მოყვარულების მიერ.
ბორწყალბადები და ბორორგანული ნაერთები
ბორის მთელი რიგი წარმოებულები (ბორწყალბადები) წარმოადგენენ ძალიან ეფექტურ სარაკეტო საწვავს (დიბორანი B2H6, პენტაბორანი, ტეტრაბორანი და სხვა), ხოლო ზოგი პოლიმერული ნაერთი წყალბადითა და ნახშირბადით წარმოადგენენ მეტად მდგრადს ქიმიური ზემექმედების და მაღალი ტემპერატურების მიმართ (როგორც ფართოდაა ცნობილი პლასტიკი კარბორან-22).
ბორაზონი და მისი ჰექსაჰიდრიდი
ბორის ნიტრიდი (ბორაზონი) მსგავსია (ელექტრონების შემადგენლობით) ნახშირბადის. მის საფუძველზე წარმოიქმნება ნაერთების ფართო ჯგუფი, რაღაცით ორგანულის მსგავსი.
ბორაზონის ჰექსაჰიდრიდი (H3BNH3, ჰგავს ეთანს აღნაგობით) ჩვეულებრივ პირობებში მყარი ნაერთი რომლის სიმკვრივეა 0,78 გრ/სმ³, შეიცავს მასის მიხედვით თითქმის 20 % წყალბადს. ის შეიძლება გამოიყენონ წყალბადის საწვავ ელემენტებმა, რომლებიც კვებავენ ელექტრომობილებს[12].
ბიოლოგიური როლი
ბორი — მნიშვნელოვანი მიკროელემენტია, რომელიც აუცილებელია მცენარეების ნორმალური ცხოველმყოფელობისათვის. ბორის ნაკლებობა აჩერებს მათ განვითარებას, კულტურულ მცენარეებში იწვევს სხვადასხვა დაავადებებს. ამის საფუძველს წარმოადგენენ ქსოვილებში ჟანგვითი და ენერგეტიკული პროცესების დარღვევები, საჭირო ნივთიერებების ბიოსინთეზის შემცირება. ნიადაგში ბორის დეფიციტის დროს სოფლის მეურნეობაში გამოიყენებენ ბორის მიკროსასუქებს (ბორმჟავა, ბურა და სხვა), რომლებიც ზრდიან მოსავლიანობას, აუმჯობესებენ პროდუქციის ხარისხს და აკეთებს ზოგიერთი მცენარის დაავადების პრევენციას.
ბორის როლი ცხოველების ორგანიზმში ბოლომდე არაა გამოკვლეული. ადამიანის კუნთოვანი ქსოვილები შეიცავენ (0,33—1)×10−4 % ბორს , ძვალის ქსოვოილები (1,1—3,3)×10−4 % , სისხლში — 0,13 მგრ/ლ. ყველდღიურად ადამიანი საკვებთან ერთად იღებს 1—3 მგრ ბორს. ტოქსიკური დოზაა — 4 გრ.
ერთერი ყველაზე იშვიათი ტიპის რქოვანას დისტროფია დაკავშირებულია გენთან, რომელიც აკოდირებს ცილა-ტრანსპორტერს, რომელიც სავარაუდოდ არეგულირებს ბორის შიდაუჯრედულ კონცენტრაციას[13].
ღირებულება
10В იზოტოპით 80 %-ით გამდიდრებული ბორის ფასია 2-3 ათასი $ აშშ/კგ.
რესურსები ინტერნეტში
- ბორი Webelements-ზე
- ბორი ქიმიური ელემენტების პოპულარულ ბიბლიოთეკაში დაარქივებული 2006-11-07 საიტზე Wayback Machine.
- სტატია დ.ს.ე.-ში დაარქივებული 2009-05-01 საიტზე Wayback Machine.
სქოლიო
Wikiwand - on
Seamless Wikipedia browsing. On steroids.















