Loading AI tools
maladie De Wikipédia, l'encyclopédie libre
Le cancer désigne l'ensemble des maladies provoquées par la transformation de cellules qui deviennent anormales et prolifèrent de façon excessive. Ces cellules déréglées finissent parfois par former une masse qu'on appelle tumeur maligne. Les cellules cancéreuses ont tendance à envahir les tissus voisins et à se détacher de la tumeur initiale. Elles migrent alors par les vaisseaux sanguins et les vaisseaux lymphatiques pour aller former une autre tumeur nommée métastase. Les métastases sont responsables de 90 % des décès[1],[2].
| Causes | Causes du cancer (en) ou cancer d'origine infectieuse (en) |
|---|
| Médicament | Prednisolone, dexaméthasone, cholécalciférol, prednisone, méthylprednisolone, acide alpha-linolénique et anticancéreux |
|---|---|
| Spécialité | Oncologie |
| CISP-2 | A79 |
|---|---|
| CIM-10 | C00-C97 |
| ICD-O | 8000/3 |
| DiseasesDB | 28843 |
| MedlinePlus | 001289 |
| MeSH | D009369 |
Les cancers sont un ensemble de pathologies de formes et conséquences diverses mais partageant des caractéristiques. Le pronostic dépend beaucoup du stade auquel est diagnostiqué un cancer. Dans les cas les plus graves, la survie du patient est menacée — en particulier le stade dit terminal implique que le patient est condamné à mourir des conséquences directes ou indirectes de son cancer à plus ou moins brève échéance. C'est pourquoi le dépistage du cancer doit être le plus précoce possible. Il est possible de guérir d'un cancer. Il est aussi possible d'avoir des récidives (parfois plusieurs années après), ou d'avoir un cancer peu agressif dont le traitement peut générer plus d'effets indésirables que de bénéfices pour le patient, d'où le maintien d'un contrôle régulier sur plusieurs années. Par exemple, certains gliomes évoluent peu et peuvent ne jamais menacer la survie du patient bien qu'ils soient une éventuelle cause de troubles : le plus souvent des céphalées.
La prévalence des cancers varie fortement dans la population. Ce sont des maladies typiquement multifactorielles[3] alliant terrain individuel et histoire/environnement personnel. Dans le terrain, on retrouve en particulier des mutations génétiques qui peuvent être héréditaires ou sporadiques — 31 localisations chromosomiques de mutation potentiellement cancéreuse[4] s'expliquent par des mutations aléatoires et concernent les 2/3 de la variation du risque (et non pas les 2/3 des cas de cancers comme l'ont souvent rapporté les médias[5]), le reste se partageant entre facteurs environnementaux et prédispositions génétiques.
Des facteurs hormonaux, et épigénétiques sont possibles. Des études scientifiques concluent que seuls 5 à 10 % des cas de cancer sont uniquement attribués à des facteurs génétiques contre 25 à 30 % au tabagisme, 30 à 35 % aux régimes alimentaires (ex. : alcoolisme, viandes trop cuites), 15 à 20 % aux infections, et 10 à 25 % à d'autres facteurs environnementaux (rayons ionisants, stress, activité physique insuffisante, pollution de l'environnement)[6]. Les recherches actuelles ont du mal à identifier des facteurs de risques uniquement liés à un facteur environnemental ou comportemental[7]. Certaines études mettent par exemple en relief certaines prédispositions génétiques du cancer qui ne favoriseraient l'apparition de la maladie qu'en cas de facteur externe : les obèses diabétiques ne seraient pas tous égaux face au risque de cancer selon leurs gènes[8]. Des études futures vont sans doute permettre de mieux comprendre l’interaction entre l'environnement et la génétique[9].
La fréquence de plusieurs types de cancers est en augmentation dans le monde, en particulier chez les jeunes[10]. Cette hausse est souvent liée à des facteurs de risque identifiés (tabac, alcool, polluants industriels reconnus cancérogènes, obésité, sédentarité, exposition au soleil) ou facteurs génétiques, et parfois sans facteurs précis identifiés. L'amélioration des outils de diagnostic[11] et le vieillissement de la population[12] expliquent une part importante de la progression de l'incidence de certains cancers. Seuls quelques types de cancers ont régressé en France entre 1980 et 2000 (selon l'Institut de veille sanitaire) : les cancers de l'estomac, de l’œsophage (chez l'homme), du col de l'utérus et le lymphome de Hodgkin[13].
Le mot latin cancer (« crabe, chancre, cancer ») est apparenté au grec καρκίνος / karkínos, « écrevisse, chancre, tumeur ». Selon le livre sur la chirurgie du médecin de l'Antiquité, Paul d'Égine, ce nom aurait été donné par Hippocrate, parce que le cancer « a des veines étendues de tous côtés, de même que le crabe a des pieds »[14] : la zone centrale arrondie de certaines tumeurs se prolonge par des ramifications en rayon, comme les pattes de ce crustacé. Paul d'Égine fait également référence à l'adhérence de la tumeur aux tissus voisins en ajoutant que le nom du cancer « lui vient, selon quelques-uns, de ce que quand il s'est emparé d'un organe, il ne le lâche plus, de même que fait le crabe quand il s'est attaché à quelque chose »[15].
L'oncologie (ou cancérologie) est la spécialité médicale qui étudie les cancers, leur diagnostic et leur traitement. Les oncologues ou cancérologues peuvent être spécialisés, comme les chimiothérapeutes ou radiothérapeutes[réf. souhaitée].
Les cancers sont de plusieurs types, précisés par la terminologie médicale : tumeur maligne, néoplasie, néoplasme, polymitose, carcinome, etc..

Le cancer est un organe complexe[16]. Les tumeurs sont des agrégats de plusieurs types de cellules interagissant avec l’ensemble de l’organisme via leur microenvironnement. Un paradigme de longue date consiste à considérer le cancer comme une maladie uniquement génétique, étant donné la complexité des modifications génétiques associées à la tumorigenèse. Cependant, les tumeurs se comportent comme un système beaucoup plus complexe, incorporant une variété de cellules non dérivées de tumeurs, et pas seulement des cellules tumorales génétiquement modifiées[16]. Certaines caractéristiques de l'oncogenèse ressemblent à des processus de développement d'organes et de remodelage tissulaire ; en particulier le microenvironnement tumoral, qui subit des changements environnants favorables à la croissance et à la prolifération cellulaires[17]. Les technologies capables d’exploiter toutes les caractéristiques de l’interaction complexe entre les cellules cancéreuses et l’ensemble du corps, localement et systémiquement, y compris les réponses mutationnelles, métaboliques et immunitaires, pourraient être essentielles à la détection précoce du cancer.
Les caractéristiques du cancer peuvent être définis comme les principes qui forment ensemble un cadre organisé de caractéristiques significatives aptes à décrire les mécanismes et les processus contribuant à la formation néoplasique à la fois au niveau génétique et métabolique[18],[19]. Néanmoins, l’interaction du système immunitaire dans la formation du cancer est considérée comme une caractéristique émergente, jouant un rôle important dans la promotion d’un état inflammatoire qui peut encourager, mais aussi inhiber, la formation de néoplasie[18],[20]. Les mécanismes qui se produisent dans le corps humain autour du microenvironnement tumoral ne sont pas encore entièrement compris, ce qui présente de nombreux défis dans la quête d'une détection précoce et de thérapies efficaces[21],[22],[23].

L’attribut cardinal du cancer consiste à entretenir une prolifération chronique de cellules tumorales. Les signaux d'activation sont généralement transmis par des ligands de facteurs de croissance se liant aux récepteurs de la surface cellulaire, via des voies de signalisation intracellulaires, qui régulent le cycle cellulaire et le développement, la survie et le métabolisme cellulaire. Malgré la nature complexe de ces signaux dans les tissus normaux et cancéreux, le mécanisme de signalisation proliférative dans le microenvironnement tumoral a été étudié et compris de manière approfondie[18] ; les cellules cancéreuses peuvent auto-produire des ligands de facteurs de croissance ou stimuler les cellules normales pour recevoir des apports en facteurs de croissance[24],[25],[26],[27].
Des ajustements du métabolisme énergétique sont nécessaires pour maintenir la prolifération incontrôlée des cellules tumorales, car les cellules doivent être alimentées en énergie pour subir des cycles de croissance et de division. Les cellules normales subissent une glycolyse dans des conditions aérobies pour produire un rendement élevé en adénosine triphosphate (énergie métabolique) ; dans des conditions anaérobies, la glycolyse peut toujours se produire, mais le rendement énergétique est plus faible. Les cellules tumorales utilisent systématiquement la glycolyse anaérobie, ce qui entraîne une absorption constante de glucose pour compenser la production réduite d'adénosine triphosphate ; cette caractéristique du métabolisme des cellules cancéreuses prend le nom d’« effet Warburg »[18],[28]. D’autres cellules tumorales utilisent le lactate (c’est-à-dire un sous-produit de la glycolyse anaérobie) comme principale source d’énergie, créant ainsi un système symbiotique fonctionnant parfaitement[29]. Outre le glucose et le lactate, les acides aminés ont également été récemment revendiqués comme d'importantes sources de carburant opportunistes pour le développement du cancer ; la glutamine et les acides aminés à chaîne ramifiée contribuent spécifiquement au soutien du cycle acide citrique (ou cycle de l'acide tricarboxylique)[30].
Les gènes suppresseurs de tumeurs codent généralement pour la protéine du rétinoblastome et la protéine tumorale 53 (TP53), qui contrôlent à la fois la prolifération cellulaire et l'activation de la sénescence (c'est-à-dire l'état de dormance) et de l'apoptose (c'est-à-dire la mort cellulaire)[18] . La protéine du rétinoblastome est un gardien du cycle cellulaire et des défauts dans la protéine peuvent entraîner une prolifération persistante[31]. De la même manière, la protéine P53 contribue aux circuits de régulation en arrêtant la progression du cycle cellulaire lorsque les capteurs de stress/anomalies signalent un niveau élevé de dommages génomiques ; sa carence peut permettre à la cellule cancéreuse de progresser dans sa croissance[18] . De plus, la corruption de la voie du facteur de croissance transformant antiprolifératif β contribue à la croissance cellulaire et est considérée comme étant la clé du développement de traits cellulaires de haut grade associés à une malignité[18],[32].
Les dommages génomiques arrêtent le cycle cellulaire pour réparer la séquence altérée ou envoyer des signaux d’activation de la mort cellulaire lorsque les dommages sont trop importants. Certaines cellules cancéreuses peuvent résister à cette barrière naturelle, évitant ainsi la mort cellulaire programmée par apoptose. Cependant, toutes les cellules ne sont pas immunisées contre l’apoptose ; de nombreuses cellules cancéreuses subissent encore la mort cellulaire en raison du stress physiologique provoqué par la tumorigenèse et/ou le traitement anticancéreux[18]. Les cytochromes c, la protéine Bax et la protéine Bak sont les protéines régulatrices de la famille Bcl-2 chargées de contrebalancer les signaux pro et anti-apoptotiques ; des dommages à la transcription de ces protéines entraîneront des déséquilibres dans les processus de régulation des cellules[33]. L'autophagie et la nécroptose sont également déclenchées par un stress/des dommages génomiques[34],[35],[36].
Toutes les cellules immunitaires ne favorisent pas les tumeurs, la plupart des cellules du système immunitaire sont capables de défendre l’organisme contre les agents pathogènes, et les cellules cancéreuses sont souvent considérées comme l’une d’entre elles, activant la cascade immunitaire[18]. Initialement présentée comme une caractéristique émergente, la capacité des cellules cancéreuses à éviter activement l'élimination du système immunitaire a été confirmée par Hanahan, et de nombreuses expériences ont été menées pour étudier cette caractéristique[18],[37]. L'importance du système immunitaire dans la lutte contre la formation et la prolifération du cancer a été étudiée en comparant des sujets immunodéprimés et des porteurs de greffe, montrant comment les cancers se forment plus facilement dans des environnements immunogènes faibles[38],[39],[40].
La capacité des cellules cancéreuses à acquérir une immortalité réplicative peut être décrite comme la capacité de subir un nombre suffisant de cycles cellulaires successifs de croissance et de division pour générer des tumeurs macroscopiques[18]. Les télomères, qui sont des structures ADN-protéines spécifiques situées aux extrémités des chromosomes et qui protègent leur séquence génomique de divers événements de réplication négative, sont cruciaux pour cette caractéristique[41]. Leur longueur dicte la quantité de cycles de croissance et de division qu'une cellule peut supporter, c'est pourquoi l'immortalité réplicative est rendue possible par des cellules variantes qui maintiennent l'ADN télomérique à des longueurs suffisantes pour éviter le déclencheur de sénescence/apoptose[18].
Au cours de la croissance néoplasique, de nouveaux vaisseaux sanguins germent à partir de ceux existants (c'est-à-dire l'angiogenèse) pour faciliter l'expansion de la tumeur, constituant un interrupteur angiogénique établi qui semble être activé et maintenu uniquement pendant la tumorigenèse[42]. Il existe une variété de facteurs considérés comme proangiogéniques et contribuant à l’activation du commutateur angiogénique. Un inducteur angiogénique bien connu est le gène du facteur de croissance de l’endothélium vasculaire (VEGF-A), qui code pour des ligands aptes à la croissance de nouveaux vaisseaux à plusieurs étapes de la progression individuelle et du maintien de la santé, depuis la promotion du développement embryonnaire jusqu’aux situations pathologiques de l'adulte[18]. La signalisation oncogène régule positivement l'expression du gène VEGF[43].
Une fois la tumeur primitive formée, le processus en plusieurs étapes d'invasion et de métastases se produit. La combinaison des processus qui conduisent à l'invasion des cellules tumorales et à la formation et à la colonisation de métastases est complexe, il existe donc de nombreuses hypothèses. concernant leur fonctionnement et leur importance[18]. Il a été démontré que certains cancers peuvent métastaser à des stades précoces de la maladie ; les micro-métastases peuvent se disperser à partir de tumeurs de nature non invasive et la faible capacité à retenir les cellules cancéreuses dans leur système sanguin/lymphatique entraîne une invasion plus facile du parenchyme[44],[45].

La formation d'une métastase est un processus comportant plusieurs étapes.
La plasticité phénotypique fait référence à la capacité des cellules à modifier leur réponse comportementale en fonction des impulsions environnementales. La plasticité cellulaire est généralement bien construite et les cellules suivent un chemin préfixé depuis la cellule d'origine jusqu'à une cellule terminale différenciée, dans laquelle une cellule change pour se spécialiser dans une fonction spécifique. La capacité d'un état cancéreux à débloquer cette plasticité phénotypique entraîne une différenciation cellulaire dérégulée où elles échappent à la différenciation prédéterminée[37],[46]. Les altérations de la voie de différenciation sont retrouvées dans divers types de cancer au cours de la formation de la tumeur primaire, de l'évolution vers une tumeur maligne et, dans certains cas, en réponse à des traitements thérapeutiques[37].
La capacité des cellules cancéreuses à échapper au stade de sénescence et à permettre l'immortalité réplicative a été décrit par Hanahan et[18]. Le composants du phénotype sécrétoire associé à la sénescence (Senescence-associated secretory phenotype) comprennent des facteurs de croissance et pro-inflammatoires, tels que les cytokines, parmi une variété d'enzymes et de protéines[47]. Le composant du phénotype sécrétoire associé à la sénescence est responsable des cellules sénescentes sécrétant des niveaux plus élevés de facteurs favorisant la croissance, qui déclenchent la formation de néoplasie en donnant accès également à d'autres caractéristiques importantes du cancer comme une prolifération cellulaire continue, une immortalité, une accélération de l'angiogenèse et la formation de métastases[37],[48],[49].

Pour que les cellules cancéreuses acquièrent les dix caractéristiques, quatre conditions semblent nécessaires : une mutation génomique, une reprogrammation épigénétique non mutationnelle, un contexte inflammatoire favorisant les tumeurs et une perturbation des microbiotes[18].
Les cellules tumorales peuvent subir un certain niveau de mutation génomique[18] ; de nombreuses technologies génétiques impliquent le séquençage de l'ADN et sont basées sur l'individuation de mutations génomiques pour évaluer leur impact sur le corps humain, depuis la prédiction de la prédisposition au cancer jusqu'à l'évaluation du meilleur mode de traitement pour une tumeur maligne active. Cependant, les cellules cancéreuses peuvent évoluer en raison de changements purement épigénétiquement régulés dans l'expression des gènes, qui n'impliquent pas de mutations. Par conséquent, la « reprogrammation épigénétique non mutationnelle » peut contribuer au développement et à la progression du cancer et est actuellement évaluée pour divers tests génétiques, tels que les tests de méthylation de l'ADN ou le séquençage de l'ARN[37],[50].
L’état inflammatoire est également vital pour favoriser la progression tumorale. Même si le système immunitaire a toujours été considéré comme un outil de protection du corps humain, des études ont démontré comment l'inflammation fournit des molécules bioactives au microenvironnement tumoral, qui sont vitales pour permettre la progression du cancer[18],[51],[36]. Un lien significatif avec l’inflammation est donné par le rôle des microbiotes. Les microbiomes polymorphes – notamment ceux de l’intestin, des poumons, de la cavité buccale, du vagin/col de l’utérus et de la peau – sont tous connus pour avoir un impact sur la croissance tumorale, la capacité d’évasion immunitaire, l’instabilité génomique et la résistance thérapeutique[37],[52]. Le microbiome intestinal est extrêmement important pour le bien-être humain et il a déjà été prouvé qu’il influence l’incidence et la pathogenèse du cancer du côlon[53].
La cancérogenèse est fondamentalement un processus évolutif[54], faisant intervenir des processus darwiniens et non darwiniens tels que la mutation, la dérive génétique et la sélection clonale, en particulier sur les oncogènes et les gènes suppresseurs de tumeur, ainsi que des processus de dédoublement du génome et d’anomalies chromosomiques[55],[56]. La carcinogenèse peut également être comparée à un événement de spéciation[57].
Selon une théorie apparue au début du XXIe siècle, le cancer peut être décrit comme un processus atavique, soit la résurgence d’un caractère ancestral[58]. En particulier, le cancer résulte d'une régression de la multicellularité vers une dynamique de population unicellulaire, les cellules se comportant comme si elles étaient isolées en favorisant leur propre valeur sélective plutôt que celle de l'organisme. La dynamique de population des cellules cancéreuses se rapproche ainsi de celles d’organismes unicellulaires, comme les protistes[59]. De fait, de nombreux gènes responsables de la mise en place de la multicellularité animale, et dont l’origine évolutive remonte à celle des métazoaires, sont dérégulés dans les processus cancéreux, notamment des gènes contrôlant la signalisation cellulaire, l’adhésion et la différentiation cellulaire[60]. Une étude phylostratigraphique a permis d’identifier deux pics d’apparition de domaines protéiques associés aux processus cancéreux, l’un associé aux processus de contrôle de l’intégrité du génome, remontant a l’origine du vivant, et l’autre associé aux processus de contrôle de la croissance et de la signalisation cellulaire, remontant à l’origine de la multicellularité animale[61]. Une étude phylogénomique des gènes actifs dans sept types de cancers solides montrent que leur origine remonte à des organismes unicellulaires[62]. Inversement, dans ces cancers, les gènes remontant à l'origine des animaux, qui sont impliqués dans le contrôle des processus unicellulaires de manière à permettre la multicellularité[63] étaient devenus silencieux. Selon les auteurs de ce travail, certains de ces gènes, connus pour être responsables de cancers, ont en outre tant de liens avec d'autres gènes que les traitements contre le cancer, ne ciblant qu'une seule de ces connexions ne peuvent qu'avoir des effets limités.
Les cellules cancéreuses acquièrent d'un mécanisme d'élongation ou d'entretien de l'ADN télomérique, ce qui leur permet de se diviser indéfiniment (immortalisation). C'est une étape-clé de l'immortalisation cellulaire qui est utilisée comme marqueur lors d’un diagnostic. La télomérase, un complexe enzymatique rallongeant les télomères par addition de séquences de télomères répétées aux extrémités des chromosomes est activée dans environ 80 % des tumeurs[64]. La plupart des cancers produisent la télomérase, mais souvent à un stade tardif, la cancérogénèse débutant par une érosion importante des télomères[65],[66]. La formation d'un cancer – au sens strict – comporte deux étapes distinctes et nécessairement successives : cancérogenèse et tumorogenèse.

Le stade cancérogenèse de la transformation cancéreuse nécessite deux étapes : l'initiation et la promotion. Ces deux étapes sont obligatoirement successives et l'initiation précède toujours la promotion, sans quoi le processus cancéreux s'arrête.
L'initiation correspond à l'accumulation des anomalies génétiques.
L'initiation (ou transformation cellulaire) comporte deux éléments majeurs :
L'initiation est la conséquence de la carcinogenèse. L'action des carcinogènes mute des gènes importants dans le maintien de l'intégrité et des caractéristiques de chaque type cellulaire.
Il en résulte des pertes ou gains de fonctions cellulaires :
La promotion recouvre la réception par la cellule de facteurs de prolifération qui vont entraîner les divisions. Ces signaux vont donc pérenniser les anomalies au cours des divisions, et ainsi assurer la descendance de la cellule anormale, qui va de surcroît accumuler de nouvelles anomalies génétiques (voir Transformation cellulaire).
La promotion est caractérisée par une grande instabilité génomique et une augmentation de la perte d'homéostasie.
L'instabilité génomique est due à des mutations de deux types de gènes :
Ces points de contrôle et de réparation altérés, la cellule cancéreuse a désormais perdu la capacité à « reconnaître sa vieillesse », initier sa mort et réparer les dommages de son ADN. La réponse aux signaux de croissance physiologiques est en outre disproportionnée.
Ensuite, la cellule commence à produire ses propres signaux de prolifération (cf. infra) : la croissance incontrôlée d'un pool de cellules n'a alors plus de limite.
À ce stade, le cancer est infraclinique : c'est une masse de cellules qui survit dans l'organisme. L'environnement des cellules cancéreuses (ou stroma, microenvironnement) est dit non coopératif : il ne fournit pas aux cellules cancéreuses les nutriments et le soutien que leur développement réclame. Cette phase est critique dans le développement clinique du cancer : si le stroma reste non permissif, le cancer n'évolue pas, ou alors très lentement. Si, en revanche, il peut s'établir une réciprocité de maintien entre cancer et stroma, le cancer envoie des signaux permissifs au stroma, qui se modifie en faveur du cancer et va lui apporter nutriments et soutien. Ainsi le cancer grossit, produit de plus en plus de signaux permissifs, etc. Dans le cas où la réciprocité s'établit, l'évolution du cancer reprend et passe à un stade clinique.
Le stroma devient permissif à deux conditions :

La tumorigenèse est un processus en plusieurs étapes, dans lequel l'étape initiale est l'apparition d'une mutation oncogène dans une seule cellule somatique. La mutation confère aux cellules des avantages clonaux, permettant au clone mutant de se développer et d’accumuler des altérations génétiques et épigénétiques supplémentaires, aboutissant finalement à une lésion irréversible, hautement hétérogène et invasive[69]. Les mutations seules ne suffisent pas à la formation de tumeurs, les humains ont développé diverses stratégies pour maintenir l’homéostasie et lutter contre la transformation oncogène. Cependant, les agressions environnementales et le vieillissement perturbent souvent cet équilibre et augmentent le risque de formation de cancers[70],[71].
Il s'agit du développement du cancer donnant des conséquences cliniques : il grossit dans des limites histologiques précises (on parle de cancer in situ), puis les dépasse et devient donc invasif avec dissémination très probable de métastases.
La néoangiogenèse et la mise en place d'une circulation sanguine stable et relativement efficace sont les préalables indispensables[réf. souhaitée] à cette phase : la croissance tumorale est telle qu'elle ne peut plus se contenter d'une diffusion à partir d'un stroma non permissif, mais nécessite des apports importants et dédiés.
La tumeur grossit jusqu'à atteindre la lame basale : le cancer est dit in situ et son risque de métastase est faible.
La croissance tumorale continue et la membrane basale se rompt, le cancer devenant alors invasif : les cellules cancéreuses ont de grandes facilités à atteindre les courants métastatiques (circulation lymphatique pour les carcinomes et circulation veineuse pour les sarcomes), et la dissémination dans le corps débute.
De son foyer initial, le cancer va (en dehors de tout traitement ou si le traitement n'est pas efficace) :
L'évolution dépend du type du cancer et de sa prise en charge : certains ne font que très peu de métastases et sont très sensibles aux traitements permettant d'aboutir dans la grande majorité des cas à une rémission complète et prolongée (ce terme de rémission est spécifique de la cancérologie et diffère de guérison par l'absence de certitude quant à une récidive à court, moyen ou long terme). D'autres sont difficilement maîtrisables et peuvent entraîner le décès à court terme. Une évaluation précise du type du cancer auprès d'un médecin spécialisé est donc indispensable.
Le cancer interagit avec le système nerveux à toutes les étapes de son développement (invasions périneurales et recrutement de nouveaux nerfs). Les relations sont complexes : dans certains cancers (comme celui du pancréas) les nerfs sympathiques favorisent la croissance de la tumeur tandis que les nerfs parasympathiques en enrayent la progression, dans d'autres (comme celui de l'estomac) c'est le contraire, et dans d'autres encore (comme celui de la prostate) les deux populations de nerfs contribuent au développement de la tumeur. Des essais cliniques visent à freiner le développement des tumeurs en bloquant leur communication avec le système nerveux[72],[73].
Les métastases sont responsables de 90% des décès dans le cancer[1]. Du point de vue cellulaire, un cancer est incurable quand les mécanismes de la mort cellulaire sont bloquées par la cellule cancéreuses permettant à la tumeur de croître sans limite[74].
La réponse est que la vie dépend de la bonne marche d'un certain nombre de fonctions, dont la respiration (au sens large, en incluant la distribution d'oxygène par la circulation sanguine), la digestion et l'excrétion (reins, foie). Selon celui des trois systèmes qui est altéré par les cellules cancéreuses, par exemple, le patient meurt — si l'on n'arrive pas à juguler la progression du mal :
Le cancer est fondamentalement une maladie génétique. La cancérogenèse est causée par un rayonnement ou des substances cancérogènes entraînant des anomalies génétiques touchant l'architecture ou la séquence de l'ADN. À ce stade, le cancer en formation n'est cliniquement pas observable et n'a pas de conséquence fonctionnelle. Des études américaines[75],[76],[77] de Christian Tomasetti et Bert Vogelstein ensuite rejoints par Lu Li, publiées en 2014 et 2017 parviennent à la conclusion que deux cancers sur trois sont dus à des mutations génétiques aléatoires et ne seraient donc pas liés à des causes héréditaires ou environnementales[78]. Ces résultats ont néanmoins suscité la controverse[79] et ne font pas consensus à l'heure actuelle. L'OMS estime que 30% à 50% des cancers peuvent être évités, en s'appuyant sur les causes actuellement connues[80].
Les facteurs de risque du cancer peuvent être endogènes (provenant de l'organisme) ou exogènes (extérieurs à l'organisme). L'étude sur des registres de vrais jumeaux ou des changements de taux de cancer chez les populations migrantes permet de démontrer la part environnementale de nombreux cancers.
Dans certains cas, l'apparition d'un cancer a une composante héréditaire. C'est le cas de quelques-uns comme certains cancers du sein[81]. Certains cancers induits par certains comportements transmis de génération en génération (consommation d'alcool ou de tabac) peuvent être confondus avec un risque génétique vrai, et inversement, certains gènes prédisposant au cancer pourraient n'être activés que dans certaines circonstances (obésité, alcoolisme, etc.).

Les facteurs exogènes de risque (facteurs non génétiques ou « environnementaux ») dépassent le seul champ de l'environnement (au sens français du terme), puisque recouvrant aussi, par exemple, les bactéries et virus inducteurs de cancers. Ils sont pour partie liés à l'environnement et pour partie aux comportements à risque qui augmentent l'exposition de l'individu à ces facteurs.
Pour l'Académie nationale française de médecine (rapport 2007), le tabac reste la principale cause de cancer. Viennent ensuite l'alcool, le surpoids et l'insuffisance d'exercice physique, puis les expositions professionnelles et les traitements hormonaux de la ménopause chez la femme. La moitié des origines du cancer demeure inexpliquée[82].
Le tabac est un facteur de risque majeur pour différents cancers (80 % des cancers du poumon, 75 % du larynx, 50 % de la vessie), il est aussi impliqué dans certains cancers du foie, du pancréas, de l'estomac, du rein, du col de l'utérus, du sein, du côlon-rectum, de l'ovaire et de certaines leucémies. C'est la première cause de mortalité évitable par cancer avec près de 47 000 décès par an en France[83], soit environ 25 % de la mortalité totale par cancer[84].
L'alcool est en France « la deuxième cause de mortalité évitable par cancer après le tabac. » L'éthanol (alcool) - même à dose modérée[85] est classé dans la liste des cancérogènes du groupe 1 du CIRC ; il augmente le risque de plusieurs cancers, d'autant plus que la dose ingérée est importante - il n'y a pas de dose sans effet[86]. Les cancers les plus favorisés par l'alcool incluent le cancer du foie et le cancer du pancréas[85] ; les cancers des voies aérodigestives supérieures : cancer de la bouche (langue, rhinopharynx, lèvres), cancer de l'œsophage, cancer de l'estomac[85] ; et le cancer du sein, une femme augmente son risque de cancer du sein de 10 % par 10 g d'alcool par jour. Le rapport du Circ (Iarc, 2007) estime la part attribuable à l'alcool à 10,8 % de l'incidence des cancers et 9,4 % des décès par cancers chez l’homme et à respectivement 4,5 % et 3 % chez la femme. En 2015, on estime que la consommation d'alcool est responsable de plus de 15 000 décès par cancer par an en France[87], sur un total de 148 000 décès par cancer[88]. L'alcool est un facteur de risque pour de nombreux accidents et maladies. Il a été estimé, pour l'année 2015, que 49 000 décès (toutes causes confondues) étaient attribuables à l'alcool[89],[90] par an en France, sur un total de 570 000 décès toutes causes confondues.
L'alimentation joue un rôle dans la survenue ou la prévention de cancers, elle serait particulièrement impliquée dans la forte prévalence du cancer colorectal qui touche environ 37 000 personnes et en tue 17 000 par an en France[91]. Selon le Fonds mondial de recherche contre le cancer, 30 à 40 % des cancers seraient imputables à l'alimentation[92]. Outre l'alcool cité plus haut, la consommation excessive de viandes rouges, de charcuterie ou de sel et les mycotoxines[93] pourraient augmenter le risque de cancer[94],[95] et des ovaires[96], mais le lait réduirait le risque de cancer colorectal[97].
La consommation de viandes rouges est souvent citée comme un facteur probable des cancers colorectaux[98],[99], sauf dans le cas d'une consommation modérée (50 g par jour)[100]. Plusieurs méta-études jugent cependant les données statistiques insuffisantes pour conclure[101],[102],[103], mais l'OMS et le CIRC ont jugé en 2015 que la viande rouge devait être classée en cancérigène probable (groupe 2A) et les charcuteries en cancérigène (groupe 1)[104]. Le lien entre la consommation de viandes transformées (charcuteries par exemple) et certains cancers (colorectal[105], œsophage[106] et estomac[107],[108]) semble mieux établi. Plusieurs études attribuent l'effet cancérigène des viandes transformées à l'ajout d'agents de conservation à base de nitrites[109],[110],[111] absents dans la viande fraîche[112]. Les nitrites sont des précurseurs d'une famille de composés cancérigènes, les nitrosamines[113],[114]. L'exposition aux nitrosamines, associée à la consommation de viande et de poisson transformés - dont en particulier les produits fumés[115] - augmente le risque de cancer de l'estomac[116]. La consommation de légumes conservés en saumure acide (de type pickles) augmente le risque de cancer de l'estomac[117] et de l’œsophage[118], ils contiennent eux aussi de grande quantité de précurseurs de nitrosamines.
Il existe aussi un lien entre consommation de viandes rouges ou transformées avec le cancer du pancréas, sans que les graisses saturées ne puissent être incriminées ; pour les auteurs, l'effet du mode de cuisson sur le sur-risque est à explorer[119]. Le mode de cuisson de la viande comme des aliments végétaux semble effectivement jouer un rôle important dans leur potentiel cancérigène. Deux composés, l'acrylamide et le benzopyrène, produits par les cuissons à hautes températures (friture[120],[121],[122], en particulier pour les produits de pomme de terre frits ; cuisson au contact de la flamme[123], en particulier pour les viandes) sont plus particulièrement cités parmi les facteurs de risques reconnus.
Une forte consommation de sel est corrélée à un risque plus élevé de cancer de l'estomac[124],[125]. Les consommations de maté[126] et de noix de bétel[127] sont corrélées à un risque plus élevé de cancer de l'œsophage et/ou du pharynx.
La consommation de matières grasses saturées pourrait aussi être un facteur de risque, en particulier pour le cancer colorectal[128],[129], certaines matières grasses pouvant toutefois avoir un effet protecteur comme les huiles de poisson et l'huile d'olive[130], les méta-analyses étant cependant moins catégoriques[131].
Outre les mycotoxines évoquées plus haut (dont en particulier l'aflatoxine), d'autres contaminants cancérigènes peuvent être présents dans les aliments, parfois naturellement (hydrazines[132] dans les champignons frais par exemple), parfois à des teneurs anormalement élevées pour cause soit de concentration tout au long de la chaîne alimentaire (métaux lourds dont en particulier le cadmium[133],[134] - par exemple dans le foie de bœuf ou l'hépatopancréas des crustacés, soit de contamination de l'environnement : métaux lourds de nouveau dont en particulier l'arsenic[135] dans les eaux de certains pays comme le Bangladesh, hydrocarbures aromatiques polycycliques, furfural, dioxine[136] - par exemple dans le lait et les produits laitiers).
Sur le plan des facteurs protecteurs, la consommation régulière de fruits et légumes diminue le risque de survenue d'un cancer[137],[138],[139]. Une étude publiée dans Food and Chemical Toxicology estime qu'une augmentation de la consommation de fruits et légumes éviterait 20 000 cas de cancer par an aux États-Unis en ne générant que dix cas liés aux résidus de pesticides[140]. En revanche, la consommation en quantité élevée d'agrumes (plus de six fois par semaine) augmenterait le risque de cancer de la peau[141]. La recherche met en évidence le lien entre plusieurs substances d'origine végétale et la réduction de risque de certains cancers : brassicacées (choux, brocolis, etc.)[142], ail[143], lycopène[144] et autres caroténoïdes, flavonoïdes, huile d'olive[145], mais c'est bien la consommation de fruits et légumes en général - et non de compléments alimentaires - qui est encouragée par les pouvoirs publics[146]. La consommation de fibres[147],[148] - typiquement apportées par les fruits, les légumes et les céréales entières[149] - réduit aussi le risque de cancer. La pratique du jeûne intermittent[150], de la diète cétogène[150],[151],[152], et de la restriction calorique[153], les régimes pauvres en glucides et riches en protéines[154],[155] et Atkins[156] pourraient avoir un effet protecteur et améliorer les chances de survie des malades. L'apport en oméga-3 - souvent mis en avant dans la littérature grand public - pourrait avoir un effet. Une étude stipule que, après étude des données relatives à 48 essais randomisés et contrôlés et à 41 études de cohortes, « les oméga-3 ne montrent qu'un léger bénéfice sur la mortalité totale, les événements cardiovasculaires ou le cancer »[157].
Enfin, et parce qu’ils contribuent à l’obésité, des apports énergétiques excessifs (alimentation trop riche c’est-à-dire trop dense en calories, une consommation excessive de boissons sucrées ou de grandes tailles de portion) sont une cause indirecte de cancer[158],[159],[160].
L'obésité jouerait un rôle dans près de 4 % des cancers, et pour beaucoup des cancers hormono-dépendants (du sein et de l'utérus, et semble-t-il colorectal, de la vésicule biliaire, de la prostate, du pancréas et des reins ; à cause d'une production œstrogénique anormale et accrue dans les tissus gras).
Un indice de masse corporelle de 30 à 35 (seuil de l'obésité) augmente d'un tiers le risque de mourir du cancer[161]. 100 000 cancers auraient été causés par l'obésité par an entre 2000 et 2010[161][source insuffisante]. Une étude américaine récente a conclu que 9 % des cas de cancer colorectal, 17 % des cas de cancer du sein, 21 % des cas de cancer de la vésicule biliaire, 24 % des cas de cancer du rein, 28 % des cas de cancer du pancréas, 35 % des cas de cancer de l'œsophage et une écrasante majorité de 49 % des cas de cancer de l'endomètre avaient l'obésité comme cause probable[161],[162]. De plus, les chances de survie sont moindres chez l'obèse, car leur cancer est souvent détecté plus tardivement. Aux États-Unis où l'obésité a fortement progressé (touchant 15 % des enfants et adolescents de 6 à 19 ans en 2000[163], avec 65 % des adultes étant soit en situation d'embonpoint, soit obèses[163], soit 3 fois plus qu'en 1980), elle serait même déjà la cause de 14 % des décès par cancer chez les hommes et 20 % chez les femmes (devant le tabagisme)[164].
Probablement pour les mêmes raisons (hormonales), l'obésité de la mère aggrave aussi le risque de cancer du testicule chez le futur enfant (il y en avait déjà un indice avec un taux plus faible de cancer des testicules observé chez les hommes conçus durant la dernière guerre mondiale en Europe de l'Ouest, alors que la nourriture était rationnée). Pourtant, environ 40 % des gens sondés sur tous les continents ne connaissaient pas le lien entre obésité et cancer[165]. Le message de la campagne mondiale 2009 contre le cancer de l'UICC[166] était qu'environ un cancer sur trois parmi les cancers les plus communs pourrait être évité par un poids normal, entretenu par une alimentation saine et équilibrée et une activité physique suffisante.
Une étude récente[167] a conclu que le risque de cancer du pancréas double pour ceux qui étaient obèses ou en surpoids à l'adolescence, par rapport à ceux qui n'ont jamais été obèses ou en surpoids. Sur tous les cas de cancer étudiés, 27 % ont été attribués à l'obésité (les autres facteurs de risque pour ce type de cancer sont surtout le tabagisme - 25 % des cas -, puis le diabète).
L'activité physique pratiquée au quotidien a un effet protecteur vis-à-vis du cancer[168]. Cet effet est plus marqué pour le cancer du côlon, du sein, de l'utérus et des poumons[169].
Le rôle exact des polluants dans la genèse des cancers reste difficile à évaluer, sauf dans le cas des expositions professionnelles où de nombreuses reconnaissances officielles confirment le lien entre cancer et exposition aux polluants. Les risques associés au contact en milieu professionnel avec des produits cancérogènes sont reconnus pour de nombreuses substances : amiante[170], benzène, trichloréthylène, arsenic, formaldéhyde, gaz moutarde, iode 131, les poussières de bois, le goudron de houille et la suie[171]. Les mycotoxines peuvent être inhalées dans des locaux insalubres, l'effet à long terme est cependant mal quantifié[172]. L'exposition aux pesticides[173],[174] est responsable de certains cancers (lymphome, leucémie, prostate) chez les agriculteurs, en particulier les arboriculteurs et viticulteurs[175]. L'incidence d'autres cancers chez les agriculteurs est moindre que dans l'ensemble de la population, notamment en raison d'un mode de vie plus sain (vie active, moins de fumeurs). L'OMS estime à 10 % la proportion de cancers liés au travail, ce qui correspond à plus de 200 000 décès annuels dans le monde. En France 2,5 à 3 millions de travailleurs seraient exposés, générant 11 à 23 000 nouveaux cas de cancer par an, dont seulement 15 à 30 % seraient officiellement reconnus[176]. Une autre étude comptabilise environ 12 000 cancers dus à l'exposition professionnelle en France en 2015[177]. Néanmoins, ces comptabilisations sont partielles car elles reposent sur les causes actuellement avérées de cancers et sur les données d'exposition dont on ne dispose que pour une partie d'entre eux[178]. Par construction, il s'agit donc d'une sous-estimation.

Les UV du soleil sont cancérigènes. Il est notamment important d'éviter une surexposition au soleil, ou d'utiliser des crèmes solaires dont l'effet protection est démontré[179] lors d'une exposition prolongée au soleil.
Les microorganismes (comme les bactéries) et les virus, font partie des facteurs exogènes du cancer. Certains cancers peuvent être induits par des virus, tels le cancer du col de l'utérus provoqué par le VPH[180].
Mimant les hormones naturelles, certains perturbateurs endocriniens sont fortement soupçonnés[181] d'initier des cancers dits « dépendants des hormones » (par exemple, le cancer du sein) ; la perturbation peut se produire in utero et donner par exemple des cancers du testicule, ou d'autres types de cancers susceptibles d'être induits par des molécules telles que le distilbène.
L'éclairage artificiel est évoqué, et parfois assimilé à la catégorie pollution lumineuse (pour le cancer du sein au moins), via une perturbation endocrinienne chez les femmes exposées à une lumière artificielle la nuit[182]. Les femmes travaillant en équipe de nuit ont un risque de cancer du sein plus élevé[183].
Les rayonnements ionisants, artificiel ou naturel[184], sont cancérigènes au-delà d'un seuil estimé à 100 à 2 000 mGy[185]. Les risques associés à des doses dites faibles (inférieures à 100 mSv) sont mal connus[186]. Une étude publiée en 2015, coordonnée par le Centre international de recherche sur le cancer, conclut que le risque existe aussi pour de faibles expositions[187]. Les risques de pollution radioactive militaire, industrielle ou accidentelle sont encadrés par des règles de radioprotection.
Certains nanomatériaux ont une toxicité avérée, et/ou une génotoxicité potentielle, aggravée par la taille infime de ces particules qui peuvent ainsi atteindre l'ADN et le génome[réf. nécessaire]. Ils sont suspectés de contribuer à certains cancers. Un projet européen Nanogenotox[188] doit pré-évaluer cette question, ou au moins proposer des outils de mesure du risque[188], sur la base de tests faits sur 14 matériaux à base de dioxyde de titane, silice et nanotubes de carbone. Ces trois nanomatériaux ont été choisis car déjà utilisés dans des cosmétiques, aliments, produits de consommation courante[188].
Les rapports sexuels de toutes natures qui ne sont pas protégés en raison des risques de contamination par certaines souches du VPH qui peuvent causer des verrues génitales ou anales, et d’autres encore peuvent évoluer en cancer du col utérin, de l’anus, du pénis ou de la gorge[189].
Il convient de faire la différence entre la prévention, qui cherche à diminuer la survenue de la maladie en luttant contre ses facteurs favorisants, et le dépistage, qui cherche à mettre en évidence une maladie de manière précoce pour la traiter plus facilement.
La prévention du cancer se fonde sur :
En France, le « Plan Cancer » (2003-2007/2009-2013) prévoit une réorganisation de la recherche médicale, le renforcement de la prévention primaire, des efforts de dépistage, une amélioration de la prise en charge des maladies, des aides à l'insertion sociale des malades et des actions pour améliorer l'environnement.
Il consiste en la détection la plus précoce possible de lésions précancéreuses ou de cancers, chez des personnes ne présentant pas encore de symptômes évidents. Le but est de trouver, dans une population donnée, des lésions que l'on peut encore traiter facilement : si l'on attend les symptômes, il est souvent nécessaire d'avoir recours à des traitements plus « lourds » pour traiter la maladie.
Cela se fait par la clinique (l'examen du patient) : palpation des seins, toucher rectal, etc. et des examens paracliniques (scanner, IRM, tomographie optique ou parfois échographie). Certains dépistages ont prouvé leur intérêt en diminuant le nombre de décès par cancer : le frottis du col utérin, pour dépister les lésions précancéreuses et les petits cancers du col utérin et les examens colorectaux. La mammographie, pour dépister des cancers du sein à un stade précoce, a fait l'objet de plusieurs controverses, en raison d'un fort accroissement des faux-positifs dans la population de moins de 50 ans, et il existe un consensus pour ne la pratiquer de façon systématique qu'au-delà de cet âge[193]. Pour autant, si tous les acteurs en rejettent l'idée avant 50 ans, tous n'adhèrent pas au principe d'un dépistage systématique après cet âge[194].
L'intérêt de la recherche de saignements minimes dans les selles (test hémocult) fait encore l'objet de discussions pour le dépistage des polypes et des petits cancers du côlon.[réf. nécessaire]
Pour Sorensen et al.[195], les fièvres prolongées non expliquées (FPI) sont un marqueur de néoplasies occultes.
Des outils comme MRD-EDGE permet l'analyse par intelligence artificielle de l'ADN tumoral circulant (ADNtc) par séquençage de l'ADN à partir d'un prélèvement sanguin[196].
Même s'il existe des éléments permettant d'identifier un cancer avec une grande probabilité, le diagnostic de certitude ne se fait que sur analyse au microscope (anatomopathologie) d'un échantillon de la tumeur (éventuellement aidé par d'autres techniques comme le scanner, l'IRM voire parfois l'échographie). Cet échantillon vient soit d'une biopsie (simple prélèvement d'un morceau de la tumeur) qui peut être faite, suivant la localisation, suivant différentes procédures (fibroscopie, ponction à travers la peau…), soit d'une pièce opératoire (tumeur enlevée par le chirurgien). La biopsie liquide ne remplace pas la biopsie standard qui reste le standard pour le diagnostic du cancer.
De nouvelles méthodes de diagnostic basées sur l'intelligence artificielle sont maintenant utilisées pour l'analyse, la détection et le suivie des patients. En se basant sur les images radiologiques, histologique ou les caractéristiques biologiques du patient, le modèle peut prédire avec une bonne précision le type de cancer et le stade de la maladie (gliome[197], cancer du sein[198], cancer du poumon[199], etc.).
Cet historique est surtout basé sur la revue MIT Technology Review[200] :
Le traitement est effectué en milieu spécialisé, en règle sur une stratégie définie par une équipe médicale pluridisciplinaire (c'est-à-dire comportant des médecins de plusieurs spécialités : oncologie, radiothérapie, chirurgie, gynécologie, gastro-entérologie, etc.).
Il nécessite d'avoir un diagnostic de certitude et de connaître le type du cancer ; d'évaluer son extension locale, régionale et la présence ou non de métastases ; et d'évaluer l'état général du patient (âge, fonctions cardiaque et rénale, présence d'autres maladies).
Suivant les cas, il repose sur :
Certains cancers peuvent bénéficier également :
Souvent, plusieurs de ces types de traitements sont nécessaires chez un même patient. Il ne faut pas oublier le traitement des conséquences de la tumeur, la prise en charge des effets secondaires du traitement et le traitement de la douleur.
L’exérèse est une technique nécessitant des équipes entrainées à traiter le cancer diagnostiqué. Pour ce faire, en France, les ARS délivrent des habilitations aux établissement habitués à traiter tel ou tel cancer et pratiquant un nombre d’intervention annuel suffisant. Toutefois, des établissements ne disposant pas de cette habilitation pratiquent ces opérations prétextant une situation d'urgence qui n'est généralement que relative. De ce fait, un transfert vers un établissement spécialisé reste possible[206],[207].
L'infographie publiée par France Info récapitule le nombre d'opérations par cancer et par établissement en moyenne annuelle entre 2016 et 2018[208].
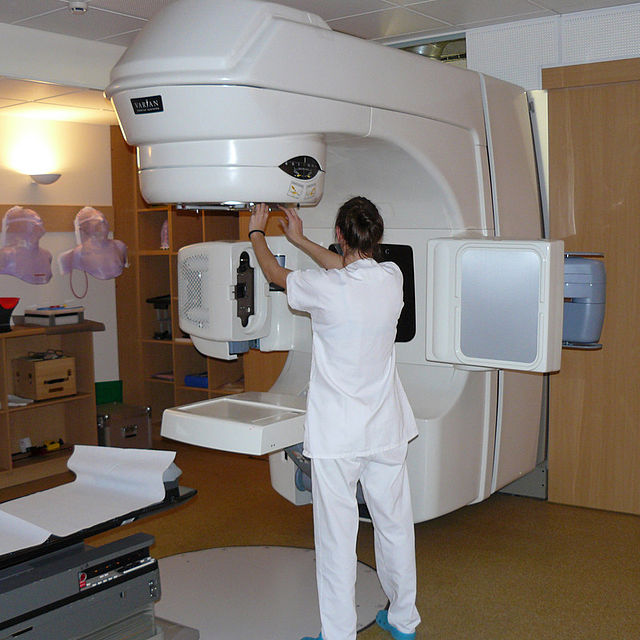
La radiothérapie est une méthode de traitement locorégional des cancers, utilisant des radiations pour détruire les cellules cancéreuses en bloquant leur capacité à se multiplier. L'irradiation a pour but de détruire toutes les cellules tumorales tout en épargnant les tissus sains périphériques.
La radiothérapie est utilisée chez plus de la moitié des patients ayant un cancer. Elle est, avec la chirurgie, le traitement le plus fréquent des cancers et peut entraîner une rémission nette à elle seule. Elle peut être utilisée seule ou associée à la chirurgie et à la chimiothérapie. Ses indications sont liées au type de la tumeur, à sa localisation, à son stade et à l'état général du patient. Elle peut être faite en ambulatoire, c'est-à-dire sans hospitalisation, car les séances sont de courte durée et les effets secondaires moindres que lors d'une chimiothérapie, hormis chez certains patients victimes d'une hypersensibilité individuelle aux rayonnements ionisants, hypersensibilité qui peut être diagnostiquée par des « tests de dépistage d'effets indésirables potentiels de la radiothérapie ». Des tests permettent de diagnostiquer une plus grande susceptibilité que la moyenne aux cancers radio-induits[209],[210].
Le cancer est la multiplication incontrôlée de cellules (dégénérescence cellulaire), due à des mutations génétiques (ADN endommagé) et, de façon occasionnelle, à une prédisposition héréditaire à développer certaines tumeurs.
La majorité des substances chimiothérapeutiques fonctionnent par arrêt de la mitose (division du noyau des cellules), en ciblant efficacement les cellules se divisant trop rapidement. Comme ces substances peuvent endommager les cellules, elles sont dites « cytotoxiques ». Certaines de ces molécules provoquent un véritable « suicide cellulaire » : l'apoptose.
La plupart des antinéoplasiques utilisés aujourd'hui ne sont pas des médicaments récents, ni à effet spécifique sur les cellules néoplasiques, si bien qu'ils touchent également les cellules saines. Les progrès thérapeutiques observés viennent en partie des modalités d'administrations des médicaments et de leurs combinaisons.
À ce jour, les chercheurs ne sont malheureusement pas capables de localiser des caractéristiques particulières des cellules malignes, qui les rendraient précisément identifiables (mis à part quelques exemples récents tels le « chromosome de Philadelphie » ciblé par le mésilate d'imatinib). Cela implique que d'autres cellules à division rapide, telles les cellules responsables de la pousse des cheveux ou de la régénération de l'épithélium intestinal, ou les cellules sanguines, sont également affectées. Ceci explique les effets secondaires couramment rencontrés, comme la perte des cheveux, les infections dues a la neutropénie (manque de globules blancs), anémies (destruction des globules rouges) et les hémorragies (destruction des plaquettes). Cela nécessite parfois des moyens de lutte contre ces effets secondaires : mise en chambre stérile, transfusions sanguines, injections d'érythropoïétine (EPO) ou de facteurs de croissance (Lenograstim), etc.
Cependant, certaines molécules produisent moins d'effets secondaires que d'autres, autorisant les médecins à ajuster les régimes à l'avantage de certains patients, dans certains cas.
L'hormonothérapie des cancers ne concerne principalement que le cancer du sein et le cancer de la prostate. Dans la plupart des cas, les molécules employées servent à empêcher l'action des hormones ou à freiner leur production par l'organisme. Dans le cas du cancer du sein, les molécules employées bloque le récepteur des estrogènes empêchant la liaison de l'estrogène avec son récepteur empêchant la propagation du signal. Il ne peut être utilisé que dans le cas du cancer du sein dit à récepteurs estrogènes positifs (RE+).

Après des décennies de déceptions dans le traitement du cancer, l'utilisation de l'immunothérapie a finalement atteint l'âge de maturité et a entraîné un véritable changement de paradigme dans le traitement du cancer pour de nombreux types de tumeurs. Avec l'avènement de nouvelles immunothérapies basées sur une compréhension croissante du système immunitaire humain, la guérison est devenue une possibilité réelle pour de nombreux patients[211]. Contrairement aux chimiothérapies qui permettent parfois de détruire 99 % de la tumeur mais où le 1 % restant résiste à la chimiothérapie et cause souvent une rechute, les immunothérapies permettent souvent d'éliminer durablement les tumeurs. Une molécule, appelée PD-1, a rapidement été identifiée et ciblée avec succès par des inhibiteurs de points de contrôle. Le Yervoy développé par Bristol-Myers Squibb a été le premier traitement approuvé en 2011 par la Food and Drug Administration (FDA) des États-Unis pour le traitement du mélanome. Trois ans plus tard, la FDA a approuvé le pembrolizumab (Keytruda) et le nivolumab (Opdivo) deux inhibiteurs de PD-1 respectivement de Merck et de Bristol-Myers Squibb. L'un et l'autre ont été approuvés pour traiter certains types de cancer du poumon, de cancer du rein et de lymphome de Hodgkin, créant la plus importante nouvelle classe de médicaments contre le cancer depuis un siècle[200].
Le renouveau de l'immunothérapie comprend différentes stratégies parfois associées dont des virus anti-cancer, des lymphocytes T génétiquement reprogrammés[212] (notamment à l'aide de récepteur antigénique chimérique, voir aussi : transfert adoptif de cellule) et des vaccins conçus pour susciter une réponse immunitaire contre la tumeur.
En , plus de 166 736 patients étaient recherchés pour participer à des études pour des médicaments ciblant une seule protéine appelée PD-1. Le nombre total d'essais d'immunothérapie en cours dépasse en vraisemblablement 3 000, d’après Jeff Bluestone, immunologiste à l'Université de Californie à San Francisco[200].
Même si ces nouvelles thérapies font naître de grands espoirs, les traitements ne sont pas encore efficaces pour tous les malades. En effet, pour un grand nombre de patients, les traitements n'apportent pas les effets escomptés. Par exemple, dans le cas du Yervoy seuls 20 % des patients atteints de mélanome métastatiques peuvent être guéris[200]. Le protocole Keytruda remplace cependant désormais la chimiothérapie pour certains types de cancers du poumon[213]. Des essais cliniques basés en particulier sur des lymphocytes T et sur les lymphocytes NK, paraissent cependant très prometteurs[214].
L'INSERM a mis en évidence que les vaisseaux HEV étaient le principal moyen d'accès des lymphocytes tueurs aux tumeurs. Ainsi, dans le cas du mélanome métastatique, les tumeurs irriguées par un grand nombre de vaisseaux HEV répondent mieux à l’immunothérapie anti-PD-1 plus anti-CTLA-4. Un traitement visant à augmenter la proportion de vaisseaux HEV dans les tumeurs pourrait être une voie d’amélioration de l’efficacité de l’immunothérapie[215].
Le taux de réponse d'un patient aux immunothérapies peut être estimé en réalisant une analyse moléculaire complète de la tumeur par profilage moléculaire des tumeurs.
Les thérapies ciblées visent à bloquer certains mécanismes spécifiques des cellules cancéreuses comme leur vascularisation ou leur croissance, ou à déclencher leur mort programmée (apoptose)[216]. D’importants progrès thérapeutiques ont été réalisés au cours de la dernière décennie grâce aux thérapies ciblant les voies de signalisation impliquées dans la croissance et la survie des cellules tumorales, et ces traitements ont démontré leur efficacité pour une partie des patients[217]. Ces traitements créent moins de dommages aux cellules et tissus sains environnant les tumeurs et composant l'organisme du malade[218].
Il existe plusieurs critères d'évaluation pour mesurer le bénéfice d'un traitement sur le bien-être, la santé et la survie d’un patient. On en distingue deux types : les critères d'évaluation cliniques (par exemple l'efficacité d'un traitement contre la douleur) et non cliniques (par exemple l'évaluation du taux d'un marqueur tumoral dans le sang).
La médecine personnalisée permet à l'aide du développement des diagnostics moléculaires de cibler les anomalies spécifiques à chaque tumeur. Elle comprend les traitements d'immunothérapie des cancers et les thérapies ciblées[219].
Le profilage moléculaire des tumeurs, permet en analysant en profondeur l'ADN, l'ARN et les protéines des tumeurs de proposer des options thérapeutiques plus adaptées à chaque patient.
Chaque cancer et chaque patient est différent, il est donc indispensable d’utiliser les armes les plus adaptées à chaque cas. C’est ce que l’on appelle la médecine personnalisée[220].
La médecine propose une avancée majeure dans ce sens en permettant l’analyse très précise des tumeurs solides (profilage moléculaire).
En effet, chaque cancer possède ce que l’on pourrait comparer à une empreinte digitale, les biologistes peuvent la lire à travers son ADN et ses protéines. Ces signatures renseignent sur les forces et faiblesse de chaque tumeur et permettent de dresser la liste des médicaments les plus susceptibles d’affaiblir le cancer efficacement. Grâce à l’analyse complète (ADN et protéines) des tumeurs, les oncologues peuvent donc proposer à leurs patients atteints de cancers métastatiques des traitements personnalisés, et parfois même encore en phase d’essai clinique. Objectif : lutter de manière hautement ciblée contre le cancer.
Souvent, les oncologues n’ont accès qu’à quelques analyses restreintes remboursées par la Sécurité sociale et ne peuvent pas proposer ce profilage complet.
Profiler une tumeur cancéreuse exige la maîtrise d’une batterie de tests en laboratoire et d’analyses pointues, qui chiffrent le coût de l’opération à plusieurs milliers d'euros.
Il ne s’agit pas d’un test pour détecter un cancer ou un risque de développer un cancer. Cette analyse profonde de la tumeur n’est indiquée que pour les patients adultes déjà diagnostiqués pour un cancer solide avancé (stade III ou stade IV). Un cancer solide veut dire un cancer d’un ou de plusieurs organes, à l’opposé d'un cancer liquide, c’est-à-dire du sang ou de la moelle.
Les cancers moins avancés, les leucémies, les myélomes ou les cancers chez l’enfant ne sont malheureusement pas concernés par ce remboursement car les techniques sont différentes et les bénéfices pour les patients moins clairs.
Effectuer un profilage moléculaire n’est malheureusement pas une garantie pour trouver une solution pour tout le monde. Dans le cancer métastatique avancé, une étude scientifique a montré qu’une option thérapeutique était trouvée pour 92 % des patients. Mais comme chaque cancer est différent, il peut arriver qu'aucune alternative ne soit trouvée. Cela dépend du type de cancer, de sa gravité, du traitement déjà pris et de nombreux autres paramètres. Seul un oncologue peut évaluer les chances de chaque cas.
L’oncologue, après avoir commandé une analyse spécifique chez une firme spécialisée, recevra un kit pour transport d'échantillon. Le médecin enverra gratuitement une biopsie récente (petite partie de la tumeur ou de l’échantillon de sang) à cette société.
L’analyse sera faite dans un délai de 7 à 10 jours et les résultats seront transmis à l’oncologue. Il obtiendra ainsi de nombreuses informations sur la carte d'identité spécifique de la tumeur avec, dans de nombreux cas, des recommandations de traitement personnalisés.
Une liste de médicaments potentiellement efficaces du monde entier et pour de nombreux types de cancer est fournie au docteur. Ces traitements ne sont pas nécessairement disponibles ou remboursés dans votre pays. Dans certains cas, si un médicament n’est pas officiellement disponible ou remboursé, il peut vous être suggéré de prendre part à un essai clinique ou un usage compassionnel. Si vous êtes dans le cas, demandez à l’oncologue quelles sont les meilleures options. Dans une publication récente, l'oncologue a pu prescrire un traitement dans 60,4 % des cas, conformément à la recommandation de l’analyse moléculaire.
Chaque patient est différent et un traitement peut réagir différemment selon les patients. Les tests peuvent suggérer des médicaments potentiellement plus efficaces ou d’informer sur certains traitements inefficaces ou toxiques pour le patient. Si le traitement s’avère en effet efficace, cela peut améliorer l’espérance de vie ou la qualité de vie. Dans des publications récentes, la moitié des patients présentait une nette amélioration de la survie. L’oncologue est le meilleur conseil pour orienter vers le choix le plus judicieux au cas par cas.
En médecine, les traitements reposent sur des études scientifiques de bonne qualité, qui sont nécessaires avant qu'un traitement puisse être considéré comme efficace. Il existe de nombreux traitements alternatifs, mais l'évaluation scientifique de leur efficacité est souvent soit inexistante, soit non validée en pratique clinique, c'est-à-dire validées dans des modèles expérimentaux ou animaux, mais pas chez l'humain. Par exemple, de nombreuses substances tuent les cellules cancéreuses en laboratoire ou chez l'animal, mais fonctionnent mal chez l'humain[221].
De nombreuses personnes se tournent vers des traitements alternatifs pensant qu'ils n'ont pas d'effets négatifs, ce qui n'est pas toujours le cas, certains étant nocifs et pouvant même entraîner la mort[221]. D'autre part, le simple fait de retarder un traitement reconnu peut permettre au cancer de se développer et d'atteindre d'autres parties du corps[221].
Certains traitements alternatifs sont assimilables à du charlatanisme ou de la fraude, ces méthodes étant souvent basées sur des théories de la maladie qui sont contraires aux idées scientifiques reconnues, de simples témoignages de patients étant parfois utilisés comme preuves[221]. Ces « remèdes miraculeux » prétendent souvent soigner d'autres maladies que le cancer.
Quelques exemples de traitements alternatifs :
La supplémentation de très fortes doses de vitamine C en médecine orthomoléculaire, dont l'idée initiale a été donnée par Irwin Stone, reprise par Linus Pauling (mort d'un cancer de la prostate, à l'âge honorable de 93 ans toutefois) et notamment Matthias Rath (dont les travaux sont très controversés). Un effet favorable semble exister chez les cultures cellulaires ou chez des animaux, mais aucune preuve satisfaisante n'existe chez l'être humain à titre curatif[222], ou préventif[223]. La Société Suisse de lutte contre le cancer souligne en particulier les faiblesses du dossier scientifique de Matthias Rath[224].
Il existe de nombreux régimes alimentaires censés lutter contre le cancer, par exemple[225] : la cure de raisin de Johanna Brandt, la cure anticancer de Rudolf Breuss, l'instinctothérapie de Guy-Claude Burger, des régimes végétariens, le régime cétogène[226], la méthode de Gerson-Kelley, la diététique de Kousmine, le régime et la thérapie du Dr Moerman, la thérapie de Livingtone-Wheeler, le zen macrobiotique. Certaines théories utilisent le jeûne thérapeutique dans le but de « détoxifier » l'organisme ou pour faire « maigrir » les tumeurs. Les preuves scientifiques disponibles ne soutiennent pas une efficacité significative contre le cancer chez l'humain[221]. Des périodes de jeûne même de courte durée peuvent avoir des effets négatifs sur certaines personnes affaiblies, sur de longues périodes, les effets peuvent être plus graves et même entraîner la mort[221].
D'autres méthodes[225] font appel à la guérison par la foi et la prière, depuis l'Antiquité, il existe notamment aux États-Unis des évangélistes guérisseurs. La chirurgie psychique est pratiquée par des guérisseurs aux Philippines, la méthode très controversée de Hamer en Allemagne et en France, etc.
Voir aussi les travaux de Mirko Beljanski. Par ailleurs, G. Edward Griffin prétend que le cancer résulterait notamment d'une carence en vitamine B17 ordinairement appelée amygdaline ou laetrile[227]. Le professeur Didier Raoult a exposé dans Le Point en 2014 les travaux de William Coley[228], qui ont fait l'objet d'un article dans la revue Nature[229].
Un autre traitement alternatif, ou plutôt une approche alternative, est la chronothérapie. Elle consiste à administrer les agents anti-cancers à des moments spécifiques de la journée pour maximiser les bénéfices du traitement et réduire les effets secondaires. Elle se dirige plus vers une médecine spécialisée pour les rythmes endogènes de chaque patient.
Une étude de l'Institut national du cancer publiée en 2020 se donne pour objectif d'évaluer scientifiquement l'intérêt de différents régimes alimentaires étudiés — en termes de mortalité globale et spécifique, récidive, second cancer primitif, progression et qualité de vie — chez les personnes souffrant ou ayant souffert d'un cancer[230]. Cette étude compile 63 méta-analyses, 22 analyses poolées, 65 essais d'intervention et 93 études de cohorte. Les résultats validés sont classés en trois niveaux de confiance : suggéré, probable, convaincant.
Cette étude confirme les facteurs de risques suivants :
Concernant l'alimentation, les résultats validés scientifiquement font défaut :
L’intérêt potentiel du soja ou d'extraits de Coriolus versicolor est à prendre avec précautions du fait d'absence de précisions sur les doses et la fréquence de consommation.
Cette étude fait suite à deux autres qui avaient mis en évidence les bénéfices de l’activité physique et de l’arrêt du tabac.
Le diagnostic et les traitements contre le cancer génèrent une grande détresse chez le patient et ses proches. Ils altèrent profondément la vie du malade (par exemple, son parcours scolaire ou professionnel, ses relations sociales, etc.)[232]. Dans les années 1970, la discipline de psycho-oncologie s'est développée pour répondre aux besoins psychologiques particuliers des personnes souffrant du cancer[233]. La psycho-oncologie est pluridisciplinaire et a plusieurs objectifs allant de la diminution de la détresse du patient, du traitement de certains symptômes secondaires comme les nausées ou les troubles cognitifs, en passant par l'aide aux survivants dans le long-terme[234]. Elle s'avère un complément efficace dans le traitement médical des patients, améliorant la tolérance aux traitements et la qualité de vie durant et après les traitements[234],[235].
Le nombre de patients survivant au-delà du traitement actif du cancer est en forte augmentation en France comme aux États-Unis[236], l'ensemble des malades représentant 3,8 millions de personnes en France en 2020[237]. Ils doivent parfois suivre un traitement plus léger, pendant plusieurs années ou à vie. L'identité d'ancien malade est plus ou moins assumée par les jeunes, certains choisissant leur métier en fonction de cette expérience quand d'autres tentent de mener une vie normale[238].
La plupart des patients souffrent de séquelles du cancer et/ou de son traitement, qui peuvent être physiques, psychologiques et sociales[239]. Leur prise en charge est souvent moins structurée que celle des patients en phase active de traitement, le suivi systématique étant contesté par certains praticiens qui préfèrent réagir aux symptômes des patients[240]. La peur de la rechute est le principal facteur de risque psychologique, présent chez 50 à 75 % des malades[241].
La chimiothérapie et la chirurgie lourde, ainsi que les traitements au long cours font du cancer une des maladies financièrement les plus coûteuses pour la société. Le coût social du cancer est difficile à évaluer, mais est important et ne cesse d'augmenter[242]. Avec l'industrialisation des pays pauvres et l'évolution de leur mode de vie et de l'espérance de vie, le cancer tend à se globaliser sur la planète[243]. En 2010, plus de 50 % des nouveaux cas de cancer et près des 2/3 des décès par cancer touchent des personnes à faible revenu, à revenu inférieur à la moyenne et des pays en développement à revenu intermédiaire du monde (à titre de comparaison, en 1970, les pays en développement ne représentaient que 15 % des cancers nouvellement signalés[244]). En 2030, le monde en développement sera censé supporter 70 % du fardeau mondial du cancer[244].
En France, dans les années 2000, environ 280 000 nouveaux cas étaient détectés par an[245], avec une augmentation régulière du nombre de cas (358 000 nouveaux cas attendus en 2010 selon les modélisations de l'INVS, rendues nécessaire par le fait qu'en France, seule environ 20 % de la population est concernée par un registre du cancer[246]), dont le coût annuel est estimé à 30 milliards d'euros pour 2004[245]. 730 millions d'euros ont été accordés au 2d Plan cancer (2009-2013), dont 95 millions pour la recherche et 400 millions pour les soins[245]. La recherche porte aussi sur les moyens de diminuer les coûts socio-économiques de la maladie et des soins. Les 6es Rencontres parlementaires sur le Cancer (jeudi ) à l'Assemblée nationale ont porté sur le thème : « Cancer : quels coûts pour la société ? »[245]. Certaines réflexions de la littérature internationale suggèrent « d'accepter, sans se poser de question, les stratégies thérapeutiques dont les coûts marginaux pour le système de santé par année de vie gagnée demeurent inférieurs à deux fois le PNB par tête », soit moins de 50 000 euros[247].
Force est de rapprocher ce chiffre du fait que la moyenne des années de vie perdues est de quinze ans sur l'ensemble des cancers[248].
Des médecins et ONG telles le MDRGF et le réseau européen HEAL[249] protestent contre le fait que ces types d'approche, ne portant que sur les coûts du soin, omettent de poser la question des causes environnementales et comportementales du cancer. Mieux les traiter permettrait selon eux d'importantes économies, plus durables, avec peut-être une forte réduction du nombre et de la gravité des cancers[250].
Selon une étude publiée par les chercheurs de l'université d'Oxford (et rapportée dans le quotidien Direct Matin du ), le coût financier pour l'Union européenne s’élève à 26 milliards d'euros par an, ce chiffre inclut les coûts de la maladie pour les systèmes de santé, le manque à gagner lié à l'incapacité de travailler des malades, ainsi que les soins fournis par les proches des malades[Quoi ?].
Le cancer, même guéri, peut avoir des implications économiques à long terme. En France, par exemple, les patients ont, jusqu'en 2015 des difficultés à avoir certains prêts jusqu'à l'instauration, le , du « droit à l'oubli ». Ce droit permet aux personnes guéries de certains cancers ou d'une hépatite C de contracter un emprunt sans avoir à déclarer leur ancienne maladie après une période définie[251].

En 2012, le cancer a causé la mort de 8,8 millions de personnes, surtout dans les pays en voie de développement, en raison d'un diagnostic tardif et l'inaptitude à proposer un traitement dans un système de santé adapté, selon une étude de l'Organisation mondiale de la santé[253]. En 2008, 56 % des 12,7 millions de nouveaux cas de cancer et 63 % des 7,6 millions de décès associés à un cancer dans le monde sont survenus dans les pays en développement, selon une étude fondée sur 27 formes de cancer[254].
Les cancers les plus fréquemment diagnostiqués dans le monde sont ceux du poumon (12,7 %), du sein (10,9 %) et le cancer colorectal (9,7 %). Les décès les plus fréquents sont provoqués par le cancer du poumon (18,2 %), de l'estomac (9,7 %) et le cancer du foie (9,2 %). Les cancers du col utérin et du foie sont beaucoup plus fréquents dans les régions en développement, tandis que ceux de la prostate et du côlon-rectum sont plus fréquents dans les régions développées.
En prenant en compte le nombre d'habitants de chaque pays, ce sont les pays d'Amérique du Nord, ceux d'Europe de l'Ouest et l'Australie qui enregistrent les taux de mortalité les plus élevés.
| Source: https://www.ligue-cancer.net/article/26089_les-chiffres-cles-des-cancers | ||
« Depuis 2004, le cancer est la première cause de mortalité prématurée en France, devant les maladies cardiovasculaires. Le cancer est la première cause de mortalité chez l'homme et la deuxième chez la femme »[255]. Son incidence diffère selon le sexe (chiffres 2012 et 2017) : le cancer de la prostate est le plus fréquent des cancers métastatiques[256] chez l'homme (28 % des nouveaux cas de cancers masculins), nettement devant celui du poumon (14 %) et du côlon-rectum (12 %). Chez la femme, le plus fréquent est le cancer du sein (31 %), devant le cancer colorectal (12 %) et le cancer du poumon (7 %)[257],[258].
Il existe une augmentation du nombre de certains cancers. Les cancers du poumon, mésothéliomes, hémopathies malignes, tumeurs cérébrales et cancers du sein, de l'ovaire, du testicule, de la prostate et de la thyroïde sont en augmentation très significative depuis les années 1980[259],[260]. Ceci est en partie lié au vieillissement et à la croissance de la population et touche différemment l'homme et la femme. De 1980 à 2005 (en tenant compte de la démographie), le taux de cancers s'est élevé de 35 % pour les hommes et de 43 % pour les femmes[261]. En 2008, l'INSERM a conclu d'une revue de la littérature scientifique mondiale relative aux liens entre ces neuf cancers en augmentation et exposition passive à des cancérogènes, avérés ou suspectés dans l'environnement (incluant donc le tabagisme passif, mais non le tabagisme actif), que ni les améliorations du dépistage ni l'évolution de la démographie ne pouvaient expliquer cette augmentation. L’exposition aux cancérigènes de l'environnement est donc supposée, mais reste mal évaluée, bien que des liens de causalité soient déjà établis par exemple entre cancer du poumon et pollution particulaire de l’air par le trafic automobile, le chauffage et l’industrie (« Environ 1 300 à 1 900 décès par cancer du poumon pourraient être évités chaque année dans vingt-trois villes européennes si les niveaux de PM2,5 particules fines étaient ramenés respectivement à 20 et à 15 microgrammes par millimètre cube (µg/mm3) ». Mais la norme européenne sur les PM2,5 (max de 25 µg/mm3 en 2010) ne sera en vigueur qu'en 2015.
| Cancer | Incidence | Mortalité |
|---|---|---|
| Tous les cancers | 319 380 | 145 762 |
| Prostate | 62 245 | 9 202 |
| Sein | 49 814 | 11 201 |
| Côlon-rectum | 37 413 | 16 865 |
| Poumons | 30 651 | 26 624 |
| Cavité buccale et pharynx | 12 270 | 4 000 |
| Lymphome non hodgkinien | 10 224 | 4 203 |
| Vessie | 9 679 | 4 482 |
| Rein | 7 949 | 3 684 |
| Mélanome (peau) | 7 401 | 1 440 |
| Pancréas | 7 218 | 7 787 |
| Estomac | 6 794 | 4 756 |
| Thyroïde | 6 672 | 403 |
| Foie | 6 433 | 7 390 |
| Utérus (corps) | 5 774 | 1 800 |
| Œsophage | 4 721 | 3 850 |
| Myélome | 4 516 | 2 789 |
| Ovaire | 4 375 | 3 180 |
| Système nerveux | 4 120 | 3 019 |
| Larynx | 3 735 | 1 406 |
| Leucémie lymphoïde chronique | 3 224 | 1 059 |
| Leucémies aiguës | 3 082 | 2 733 |
| Col de l'utérus | 3 068 | 1 067 |
| Testicule | 2 002 | 82 |
| Maladie de Hodgkin | 1 544 | 218 |
| Plèvre | 906 | 1 090 |
Il est essentiel de bien noter la différence entre l'incidence d'un cancer (la fréquence annuelle calculée sur une durée précise) et la mortalité. Ce tableau montre bien que certains cancers très fréquents (prostate) ont une mortalité faible contrairement à des cancers plus rares (pancréas) qui ont une mortalité très élevée.
La France est parfois présentée comme étant le pays ayant la plus longue survie après cancer[263]. Mais concernant la survie à 5 ans après le diagnostic, elle serait le second en Europe derrière la Suède, avec environ 52 % de survie (63 % pour les femmes, 44 % pour les hommes)[264]. Cela cache de grandes disparités selon les cancers. On atteint des chances de survie de 95 % pour le cancer de la thyroïde ; chez les hommes, on atteint 80 % de survie à 5 ans pour le cancer de la prostate, et quasiment 100 % pour les cancers des testicules et, chez les femmes, 85 % pour le cancer du sein entre 15 et 44 ans, mais 78 % au-delà de 75 ans. En revanche, les cancers profonds sont diagnostiqués plus tardivement et sont très souvent mortels : cancer du pancréas (10 % de survie), du poumon, etc.
En France, outre l'InVS et l'INPES, l'INSERM, les ARS et ORS, l'Institut de recherche et documentation en économie de la santé (IRDES) et la Direction de la recherche, des études, de l'évaluation et des statistiques (DREES) dépendant du ministère chargé de la Santé, existent plus spécifiquement :
Dans le cadre du Plan cancer 2009-2013, depuis 2007, l'Institut national du cancer publie annuellement une synthèse des données sur le cancer.
En 2015, selon un rapport InVS réalisé dans le plan cancer 2014-2019 : en France métropolitaine, les registres des cancers ne couvrent que 20 % de la population[272]. Pour la période 2008-2010 et pour 8 cancers chez l'homme et 8 chez la femme, des disparités départementales persistent pour certains cancers (liés au tabac, à l'alcool, à l'environnement) et « qui semblent correspondre aux variations d'exposition des populations à ces facteurs de risque »[272]. Chez les hommes, l'incidence des cancers des lèvres-bouche-pharynx, du larynx, du poumon et de l’œsophage plus élevée dans les départements du nord, avec une incidence très élevée (dans le Pas-de-Calais, le Nord et la Seine-Maritime notamment) alors que les départements de l'ouest et du sud sont en sous-incidence. Les femmes sont plus victimes du cancer du poumon dans le sud et l'Île-de-France, plus particulièrement dans les départements urbanisés (Alpes-Maritimes : 18,6 ; Hérault : 19,0 ; Haute-Garonne : 18,6 et dans une moindre mesure Var : 17,4) et en Île-de-France (17,5), mais avec une sous-incidence dans le nord. Pour les autres cancers étudiés, les différences départementales sont moins nettes[272].
En 2018, selon les données de l'Institut national du cancer, 382 000 nouveaux cas de cancer sont diagnostiqués, et 157 400 personnes en sont mortes[273].
En France, le nombre des cancers a doublé depuis 1990, selon les données de Santé Publique France et de l'INC[274]. En 2023, 433 136 nouveaux cas de cancers devraient être déclarés[Passage à actualiser], dont 57% chez l'homme et 43% chez la femme. Cette hausse observée s'explique principalement par l'accroissement et le vieillissement de la population pour près de 80% chez l'homme, et 57% chez la femme ; les autres cas sont liés au mode de vie (alcool, tabac, surpoids) et à l'environnement.
| Cancer | Incidence | Mortalité |
|---|---|---|
| Tous les cancers | 399 626 | 150 303 |
| Prostate | 48 427 | 8 207 |
| Sein | 58 968 | 11 883 |
| Côlon-rectum | 44 872 | 17 684 |
| Poumons | 49 109 | 30 991 |
| Cavité buccale et pharynx | 12 044 | 2 925 |
| Vessie | 13 338 | 5 013 |
| Rein | 14 139 | 4 668 |
| Mélanome (peau) | 15 404 | 1 783 |
| Pancréas | 14 220 | non indiqué |
| Estomac | 6 616 | 4 440 |
| Thyroïde | 10 605 | 351 |
| Foie | 10 705 | 8 651 |
| Utérus (corps) | 8 367 | 2 336 |
| Œsophage | 4 839 | 3 225 |
| Ovaire | 4 714 | 3 111 |
| Système nerveux | 5 551 | 3 806 |
| Larynx | 3 220 | 698 |
| Col de l'utérus | 2 835 | 1 084 |
| Testicule | 2 353 | 83 |
Le taux de survie des cancers n'a cessé de s'améliorer au cours des décennies : dans les années 2010, la survie à 10 ans est similaire, en Angleterre et en Écosse, à la survie à un an en 1970[276].
Le taux de survie dépend aussi de l'âge. Cinq ans après le diagnostic, 70 % des 15–45 ans survivent (99 % en population générale[277]). Alors que seuls 40 % des malades cancéreux âgés de 75 ans survivront plus de 5 ans ; compte tenu du risque de métastases, on ne parle pas de guérison pour un cancer, mais de rémission (voir Évolution plus loin). En France et au Canada, le cancer est la première cause de mortalité chez les plus de 65 ans[278].
Pour estimer l'efficacité du dépistage et des soins, on utilise le taux de survie et la surmortalité à une certaine durée après le diagnostic.
En Europe, selon l'étude « Eurocare-5 » (publié dans The Lancet Oncology en 2013, il varie beaucoup selon le type de cancer, avec par exemple un taux de survie élevé à cinq ans — plus de 80 % — pour les tumeurs ou cancers des testicules, des lèvres, de la thyroïde ou encore de la prostate[279]. Les chances de survie varient aussi significativement selon le pays[279] et l'âge ; les pays de l'Ouest (Autriche, Belgique, France, Allemagne, Suisse, Italie, Espagne, Portugal) ont de meilleurs taux de survie après cancer. La Bulgarie, les Pays baltes, la Pologne la Slovaquie ont les scores les plus bas, tandis que le Royaume-Uni et le Danemark ont des résultats moyens[279].
En France, d'après La Ligue nationale contre le cancer, le taux de survie à cinq ans après diagnostic en France, pour des patients suivis entre 1989 et 1997 était, en 2006 :
| Hommes | Femmes | ||
|---|---|---|---|
| 75 % et + | |||
| Lèvre | 96 % | Thyroïde | 95 % |
| Testicule | 95 % | Maladie de Hodgkin | 92 % |
| Thyroïde | 88 % | Mélanome de la peau | 89 % |
| Maladie de Hodgkin | 85 % | Lèvre | 88 % |
| Mélanome de la peau | 83 % | Sein | 85 % |
| Prostate | 80 % | Corps utérin | 76 % |
| 50 à 74 % | |||
| Pénis | 67 % | Col utérin | 70 % |
| Rein | 63 % | Rein | 64 % |
| Vessie | 60 % | Os, articulations et cartilages articulaires | 62 % |
| Os, articulations et cartilages articulaires | 59 % | Larynx | 59 % |
| Côlon | 56 % | Rectum | 58 % |
| Rectum | 55 % | Côlon | 57 % |
| Larynx | 54 % | Vulve et vagin | 52 % |
| Lymphome malin non hodgkinien | 54 % | Vessie | 50 % |
| 25 à 49 % | |||
| Nasopharynx | 45 % | Langue | 45 % |
| Intestin grêle | 45 % | Myélomes multiples | 43 % |
| Myélomes multiples | 42 % | Intestin grêle | 42 % |
| Cavité orale | 38 % | Ovaire | 40 % |
| Langue | 33 % | Fosses nasales, sinus annexes de la face, oreille moyenne et oreille interne |
37 % |
| Hypopharynx | 34 % | ||
| Leucémie aiguë lymphoblastique | 29 % | ||
| Estomac | 28 % | ||
| 25 % et − | |||
| Estomac | 23 % | Système nerveux central | 19 % |
| Système nerveux central | 20 % | Poumon | 18 % |
| Poumon | 13 % | Œsophage | 14 % |
| Œsophage | 11 % | Mésothéliome de la plèvre | 13 % |
| Foie | 7 % | Foie | 9 % |
| Mésothéliome de la plèvre | 6 % | Pancréas | 7 % |
| Pancréas | 5 % | ||
En France, selon un rapport conjoint de l'Institut de veille sanitaire (InVS), du réseau Francim des registres des cancers, de l'Institut national du cancer (INCa) et des Hôpitaux de Lyon, la durée de survie des patients atteints d'un cancer de la prostate, du sein ou du côlon-rectum, a augmenté dans la période allant de 2005 à 2010 comparativement à la période allant de 1989 à 1993[281].
Chez les personnes diagnostiqué pour un cancer, on doit distinguer celles mortes des suites de ce cancer, et celles mortes d'une autre cause. La surmortalité à une durée t (par exemple de 10 ans) liée au cancer est la probabilité de mourir du seul fait du cancer durant la durée t qui suit le diagnostic. On ne peut toutefois pas connaître les causes de tous les décès des personnes diagnostiquées ; pour un groupe de personnes du même sexe et du même âge, on parle donc « survie relative », mesurée par le rapport entre :
La surmortalité est alors le complément à 1 de cette survie relative.
Les études montrent une surmortalité d'environ 2 % au-delà de 10 ans après le diagnostic dans les pays développés, ce qui pointe l'irrationalité de la ségrégation que subissent les patients ayant eu un cancer de la part des assurances et des banques (surtaxes, refus de prêt, etc.).
Les résultats ci-après sont issus du document Cancers — Pronostics à long terme de l'INSERM[282].
L'étude Eurocare s'est penchée sur une vingtaine de pays européens pour des cas diagnostiqués durant trois périodes (les malades étudiés durant une période forment une « cohorte ») : 1978-1985, 1985-1989 et 1990-1994. Cette étude ne distingue pas le stade du diagnostic.
| délais après diagnostic | surmortalité | ||
|---|---|---|---|
| deux sexes confondus | femmes | hommes | |
| 0–1 an | 27 % | 20 % | 33 % |
| 2e année | 15 % | ||
| 5e année | 5 % | ||
| 10e année | 2,27 % | 1,95 % | 3,18 % |
| 11-12e année | 2 % | moins de 2 % | un peu plus de 2 % |
| délais après diagnostic | surmortalité par classe d'âge | ||||
|---|---|---|---|---|---|
| toutes classes d'âge confondues | 15–44 ans | 45–54 ans | 54–65 ans | 65–74 ans | |
| 0–1 an | 27 % | 12 % | 33 % | ||
| 4e année | moins de 5 % | ||||
| 10e année | 2,27 % | 1,24 % | 2,06 % | 2,42 % | 3,03 % |
| 11-12e année | 2 % | un peu plus de 1 % | plus de 3 % | ||
| surmortalité | localisation du cancer |
|---|---|
| < 2 % |
|
| 2–5 % |
|
| > 5 % |
|
L'étude américaine SEER s'est intéressée au stade du cancer au moment de son diagnostic, selon trois catégories :
| surmortalité | localisation du cancer |
|---|---|
| < 1 % |
|
| 1–3 % |
|
| 3–5 % | larynx (2,90 %) |
| > 5 % | poumon (7,20 %) |
Selon Heidi Ledford (Nature, mars 2024)[10] : « Les statistiques du monde entier sont désormais claires : les taux de plus d'une douzaine de cancers augmentent chez les adultes de moins de 50 ans. Cette augmentation varie d'un pays à l'autre[283] et d'un cancer à l'autre, mais les modèles basés sur des données mondiales prédisent que le nombre de les cas de cancer à apparition précoce augmenteront d'environ 30 % entre 2019 et 2030[284]. Aux États-Unis, le cancer colorectal – qui frappe généralement les hommes dans la soixantaine ou plus – est devenu la principale cause de décès par cancer chez les hommes de moins de 50 ans[285]. chez les jeunes femmes, il est devenu la deuxième cause de décès par cancer »[10].
Statistiquement, rien qu'aux Etats-Unis, en 2024, 9 620 enfants (0-14 ans) devraient déclarer un cancer, et 1 040 en mourront ; Le cancer y est la 2nde cause de décès chez les enfants de 1 à 14 ans (derrière les accidents)[285]. La leucémie y est le cancer infantile le plus courant (28 % des cas) devant les tumeurs du cerveau et du système nerveux (25 % dont près d'un tiers sont bénignes ou presque malignes)[285].
En Europe, selon une grande étude[286] publiée fin 2004 basée sur les registres du cancer, l'analyse d'une base de données financée par l'Union européenne regroupant 80 registres de cancers et couvrant environ la moitié des enfants (jusqu'à 14 ans) et un quart des adolescents (15 à 19 ans) : le taux moyen de l'incidence du cancer par classe d'âge dans les années 1990, calculé sur près de 50 000 cas, s'établit à 140 cancers par million d'enfants, contre 118 dans les années 1970 et 124 dans les années 1980. Les cancers de l'enfant sont donc en augmentation.
Dans les pays industrialisés, environ 1 enfant sur 500 déclare un cancer avant l'âge de 15 ans (presque 1 500 nouveaux cas par an en France, dont 50 % avant l'âge de 6 ans). Chez les adolescents, ce taux est de 193 par million au cours des années 1990, contre 147 dans les années 1970 et 165 dans les années 1980[286]. Dans les années 1990, le taux de cancer chez l'enfant était en Europe un peu plus important à l'Est qu'à l'Ouest, à cause de cancers de la thyroïde plus fréquents (attribués aux retombées de Tchernobyl)[286].
Si les cancers des enfants ne comptent que pour moins de 1 % du nombre total de cancers. Dans les pays économiquement affluents, bien que les cancers soient guéris dans environ 70 % des cas[282], ils restent la seconde cause de mortalité de l'enfant[287][source insuffisante].
En France, les leucémies sont les cancers les plus fréquents chez l'enfant (450 cas nouveaux par an)[288]. Suivent (principalement) :
Les tumeurs embryonnaires sont plus fréquentes les premières années de la vie, et des sarcomes osseux et des tissus mous chez les grands enfants[réf. nécessaire].
| délais après diagnostic | surmortalité (%) |
|---|---|
| 0–1 an | > 10 |
| 4e année | 2 |
| 7e année | 1 |
En raison d'une évaluation difficile des expositions indirectes et des effets de synergies possibles, des relations certaines de cause à effet sont difficiles à établir[289], mais les pesticides (ingérés ou inhalés par l'enfant, ou ses parents avant la naissance) semblent être l'une des causes d'augmentation, notamment pour les tumeurs du cerveau, avec 9 études sur 16 qui concluent à une relation causale possible en cas d'emploi de sprays insecticides ou d'autres pesticides par les parents, (OR 1,5 ; 2,2) ou par la manipulation de pesticides agricoles (RR 2,0 ; 2,9 ; 3,3)[290] (dans de mêmes conditions environnementales, les enfants sont significativement plus exposés que les adultes aux pesticides[291],[292],[293],[294],[295],[296],[297],[298], alors même qu'ils y sont a priori plus vulnérables). D'autres cancers de l'enfant semblent induits ou co-induits par des pesticides (leucémie[290], neuroblastome[290], tumeur de Wilms[290], sarcomes des tissus mous[290], sarcomes d'Ewing[290], lymphome non hodgkinien[290], cancer colorectal[290] et cancer des testicules[290])[290]. Dans ce dernier cas, un effet perturbateur endocrinien est probable.
Par exemple, une étude suggère que l'exposition de la femme enceinte aux pesticides domestiques augmente le risque de cancers hématopoïétiques (cancer du sang) de l'enfant[299]. Cette étude a exploité le RNHE, le « Registre national des hémopathies malignes de l'enfant » (antérieurement dénommé « Registre national des leucémies de l'enfant »)[300] qui enregistre les cas signalés d'hémopathie maligne ou à la limite de la malignité, chez les enfants habitant en France métropolitaine ayant moins de 15 ans au moment du diagnostic.
Dans le monde, sur environ 14 millions de personnes diagnostiquées avec un cancer chaque année, 300 000 environ sont des enfants ou des adolescents de moins de 19 ans[10]. Les cancers précoces sont plus fréquents, mais avec des différences selon la géographie et le contexte socio-ethnique[301] et « Aux États-Unis, où les données sur l’incidence du cancer sont particulièrement rigoureuses, le cancer de l’utérus a augmenté de 2 % chaque année depuis le milieu des années 1990 chez les adultes de moins de 50 ans »[302] ; et le cancer précoce (chez les 20-49 ans) du sein a augmenté de 3,8 % par an de 2016 à 2019[301].
Rien qu'aux Etats-Unis, en 2024, 5 290 adolescents (âgés de 15 à 19 ans) devraient déclarer cancer, et 550 en mourront ; le cancer y est la 4e cause de décès à l'adolescence[285]. Un enfant et un adolescent sur 257 recevra un diagnostic de cancer avant l’âge de 20 ans[285]. Les types et répartition de cancer varient : les tumeurs du cerveau et du système nerveux sont les plus fréquents (21 %, dont plus de la moitié sont bénignes ou presque malignes) devant le lymphome (19 %) et la leucémie (13 %) ; et on trouve deux fois plus de lymphome hodgkinien que non hodgkinien chez les adolescents (alors que c'est le contraire chez les enfants)[285]. Le carcinome de la thyroïde (en forte augmentation) et le mélanome de la peau sont 12 % et 3 % des cancers de l'adolescent aux USA, mais ils ne sont que 2 % et 1 % respectivement chez les enfants[285].
En France où les 15-25 ans font l'objet d'un suivi particulier, environ 1 700 adolescents et jeunes adultes (dits "AJA") sont diagnostiqués d’un cancer chaque année en France[303].
Le cancer est la 3e cause de mortalité chez eux (après les accidents et les suicides).
Les 5 cancers principaux chez les AJA sont les lymphomes, les sarcomes, les tumeurs germinales, les leucémies aiguës et les tumeurs du système nerveux central.
Le taux de patients vivants 5 ans après le diagnostic dans la population AJA atteinte d'un cancer est en constante progression.
Des centres de soins et structures d'accompagnement social (comme Cheer Up !) leur sont dédiés.
Le cancer paraît être une maladie aussi vieille que le genre humain[304] : des traces d'ostéosarcomes sont décelées dans des ossements datés du Néolithique[305]. Des cancers sont déjà décrits dans des textes égyptiens (papyrus Ebers[306], papyrus Edwin Smith rédigés au XVIe siècle avant notre ère et qui évoquent l'ablation de tumeurs[307]). C'est le médecin antique grec Hippocrate qui donne la première définition de la maladie, distinguant la tuméfaction bénigne (carcinos), le cancer curable (squirrhos) et le cancer entraînant la mort (carcinoma) : une tumeur (gonflement) dure, non inflammatoire, ayant tendance à récidiver et se généraliser jusqu'à la mort[308]. Le médecin grec Galien utilise le terme oncos pour désigner les tumeurs, estime qu'elles sont dues à un excès de bile noire dans l'organisme et préconise l'administration de purges pour dissoudre la bile solidifiée. Cette théorie des humeurs perdure jusqu'à la Renaissance qui voit le développement de chirurgiens comme Ambroise Paré qui jugent l'exérèse utile lorsque le cancer est petit[309].
Le médecin français Xavier Bichat propose en 1797 la « théorie tissulaire » du cancer, affirmant que les tumeurs se présentent sous la forme de tissu. En 1858, le médecin allemand Rudolf Virchow publie sa théorie de la pathologie cellulaire d'après laquelle les maladies ont leurs origines dans des altérations des cellules du corps. Il impose rapidement l'idée dans la communauté scientifique qu'il existe des caractéristiques propres à la cellule cancéreuse. Il affirme notamment que même cancéreuse, toute cellule naît d'une autre cellule (« Omnis cellula a cellula »), favorisant l'essor de la chirurgie cancéreuse comme traitement curatif[310].
Les premiers succès thérapeutiques sont réalisés à la fin du XIXe siècle grâce à des chirurgiens comme Theodor Billroth qui réussit en 1881 la première ablation d'un cancer de l'estomac ; William Halsted prévient les métastases en mettant au point en 1890 la mastectomie élargie appliquée au cancer du sein ; Ernst Wertheim (en) réalise en 1898 la première hystérectomie radicale appliquée au cancer du col utérin[311].
Parallèlement se développe la radiothérapie avec des précurseurs comme Victor Despeignes qui, en 1896, traite aux rayons X un cancer de l'estomac. Les historiens des sciences créditent Emil Grubbe (en) comme le premier à avoir utilisé ces irradiations, non pas en complément, mais comme traitement principal du cancer du sein[312].
En 1906, la première conférence internationale pour l'étude du cancer se réunit à Heidelberg et à Francfort, en Allemagne, sur convocation du Comité central allemand pour l'étude du cancer. On y déclare pour la première fois le cancer comme fléau de l'humanité[313],[314].
La chirurgie et la radiothérapie n'agissent que sur des cancers localisés. Une nouvelle méthode est mise au point au début du XXe siècle pour combattre les métastases : la chimiothérapie cytotoxique. L'immunologiste August von Wassermann teste en 1911 le sélénium sur un sarcome de souris et obtient une complète rémission mais la cytotoxicité de ce traitement se révèle trop forte[315]. Les travaux des pharmacologues Louis S. Goodman (en) et Alfred Zack Gilman (en) sur les effets cytotoxiques du gaz moutarde conduisent à la mise sur le marché du Mustargen, premier chimiothérapique anticancéreux commercialisé dans l'histoire médicale[316]. En montrant en 1948 que des enfants leucémiques bénéficient de rémissions relativement longues à la suite de l'utilisation de l'aminoptérine, le pédiatre Sidney Farber est considéré comme le « père de la chimiothérapie anticancéreuse »[317]. Dans les années 1950, les médecins Emil Frei (en), Emil J. Freireich (en) et James F. Holland (en) proposent de ne plus employer seul un médicament (monothérapie induisant souvent des phénomènes de résistance) mais de l'associer à d'autres médicaments (chimiothérapie combinée appelée polychimiothérapie)[318].
Depuis les années 1980 se développent d'autres traitements conventionnels généraux de chimiothérapie adjuvante, notamment l'hormonothérapie additive et l'immunothérapie[319].

Les cancers sont présents chez presque tous les animaux, sauvages comme domestiques. Seules quelques espèces semblent épargnées, requins et rats-taupes nus notamment. On pourrait s'attendre à ce que le risque de cancer augmente avec le nombre de cellules de l'organisme : cette corrélation est bien vérifiée au sein d'une même espèce (petits chiens vs grands chiens, par exemple), mais pas du tout d'une espèce à l'autre (paradoxe de Peto). Les mécanismes développés par les espèces immunes et par les espèces de grande taille (éléphants et baleines, notamment) pour restreindre l'incidence des cancers sont étudiés per se, et aussi dans l'optique de thérapies futures[320].
Les animaux domestiques, dont les chiens et les chats[321], sont fréquemment victimes de cancers semblables à ceux des humains[321] (en particulier : ostéosarcomes, cancer des mamelles, mélanomes buccaux, carcinomes épidermoïdes, tumeurs nasales, carcinome du poumon, sarcomes des tissus mous, et tumeurs malignes non hodgkiniennes, etc.[321]). Ces cancers semblent également de plus en plus fréquents ; c'est même la 1re cause de mortalité des chiens dans le monde[322] (chiens dont l'espérance de vie est en moyenne de 11 ans et trois mois[322]). 27 % des chiens meurent d'un cancer, alors que 18 % meurent d'une affection cardiaque, sachant aussi que les maladies dominantes des chiens adultes sont infectieuses bactériennes, virales ou parasitaires, et que 50 % des chiens seraient obèses (facteurs qui peuvent contribuer à augmenter le risque de certains cancers).
Une médication et des moyens spécifiques (incluant chimiothérapie et radiothérapie) ont été développés pour les animaux, sur la base des mêmes molécules et moyens.
Les animaux de laboratoires sont utilisés comme modèle en cancérologie humaine, y compris en épidémiologie[323] ou pour tester de manière statistiquement significative des médicaments à grande échelle[324].
Le , un cas de cancer osseux chez un dinosaure a été confirmé par une équipe canadienne chez un Centrosaurus apertus adulte mort il y a plus de 75 millions d'années[325].
Le prion cellulaire PrPC, (à distinguer de la forme pathogène PrPSc), naturellement présent dans le corps humain dès l'embryogenèse, est impliqué dans divers aspects de la biologie du cancer. Sa surexpression pourrait favoriser la prolifération des cellules cancéreuses selon différents mécanismes dans les cancers de l'estomac, du pancréas, du colon, du sein et du poumon, y compris dans les métastases, et entrainer une résistance aux médicaments en inhibant l'apoptose et l'autophagie des cellules cancéreuses. Sa régulation a donc été proposée comme cible thérapeutique[326],[327],[328],[329],[330],[331],[332],[333].
En novembre 2014, une équipe de chercheurs du centre hospitalier universitaire de Nice (France) montre que le Test ISET a permis d'obtenir des résultats majeurs pour le dépistage des cancers du poumon[334],[335]. C'est une technologie récente permettant d'isoler les cellules tumorales circulantes présentes dans le sang. Très simple pour le patient, sa mise en œuvre consiste en une simple prise de sang. En 2016, tous les types de cancer excepté les leucémies et les lymphomes peuvent être détectés par cette méthode. À l'été 2016, ce test est disponible en France, mais il n'est pas remboursé par la Sécurité sociale[336].[pertinence contestée]
Les métastases du cancer maternel dans le placenta et chez le fœtus existent[337], mais sont si rares, qu'elles laissent penser qu'il existe des mécanismes de protection biologiques pour l'unité placentofetale, peut être liées à des réponses circulatoires ou immunologiques[338] ou à une propriété trophoblastique intrinsèque dont la compréhension pourrait éclairer le mécanisme des métastases pour mieux les traiter[339].
Des découvertes concernant les cellules souches pourraient faire mieux comprendre la cancérogenèse. Jusqu'à récemment, un unique modèle « stochastique » était proposé pour l'expliquer, en faisant l'hypothèse que toute cellule capable de se diviser peut voir son information génétique perturbée (via les mutations dans l'ADN) et acquérir ainsi des caractéristiques tumorales lui conférant un pouvoir cancérogène[340]. Plus spécifiquement, ce modèle suppose que n'importe quelle cellule capable de se diviser peut être à l'origine d'un cancer, les cancers ne touchant pas les cellules incapables de se diviser comme les neurones.
Un deuxième modèle se base sur le fait que ce sont les cellules souches qui acquièrent des caractéristiques tumorales, et qui donc donnent sans cesse des cellules cancéreuses différenciées[341]. Dans ce modèle, les cellules souches sont placées en tête dans la hiérarchie de la formation de tout cancer. Pour certaines leucémies (cancers du sang), ce sont les cellules souches hématopoïétiques par exemple qui deviennent anormales et qui prolifèrent en trop grand nombre, donnant des cellules différenciées anormales et trop nombreuses. Une autre tentative d'explication a été fournie, qui suppose qu'une cellule déjà différenciée peut se dédifférencier de façon anormale, revenir au stade de cellule souche et commencer à proliférer comme décrit ci-dessus, pour redonner des cellules différenciées anormales et en grand nombre. Des cellules souches existant dans tous les tissus renouvelables, cette théorie n'est donc pas valable seulement pour les leucémies, mais aussi pour d'autres types de cancers concernant des tissus renouvelables. Cette nouvelle théorie est appuyée par l'observation de certaines tumeurs dites « hétérogènes » (hétérogénéité tumorale), qui possèdent à la fois des cellules assez différenciées et ces cellules indifférenciées que sont les cellules souches cancéreuses (CSC). Il y a donc un gradient de différenciation observé[342].
Toutefois, il se pourrait que certains cancers aient pour origine une seule de ces deux explications (« modèle stochastique » ou « modèle des cellules souches ») ou bien les deux, la formation d'un cancer ne serait également pas identique à celle d'un autre cancer, ce qui rend les recherches difficiles.
D'autres voies s'ouvrent, toujours au stade de la recherche fondamentale, notamment l'oncologie physique, qui permet de mesurer les paramètres mécaniques qui régissent les rapports entre la matrice extracellulaire, le tissu cancéreux et les tissus normaux[343],[344].
En sciences humaines et sociales, la socio-oncologie désigne un modèle innovant de recherche-action du travail social dans le domaine de la lutte contre les cancers. C'est également une discipline fondamentale des soins oncologiques de support.
En 2023, en France métropolitaine, plus de 433 000 nouveaux cas de cancers diagnostiqués sont extrapolés à partir des données recueillies lors des six premiers mois de l'année[345].
La section Caractéristiques du cancer est une traduction partielle de Sala, A., Cameron, J.M., Brennan, P.M. et al. Global serum profiling: an opportunity for earlier cancer detection. J Exp Clin Cancer Res 42, 207 (2023). https://doi.org/10.1186/s13046-023-02786-y paru sous license Creative Commons Attribution 4.0 International
L'association Sparadrap propose sur son site une liste d'ouvrages jeunesse sur un parent malade ou décédé du cancer[346].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.