Top Qs
Chronologie
Chat
Contexte
Méthanal
formaldéhyde De Wikipédia, l'encyclopédie libre
Remove ads
Le méthanal ou formaldéhyde ou aldéhyde formique ou formol est un composé organique de la famille des aldéhydes, de formule chimique CH2O. C'est le membre le plus simple de cette famille. À température ambiante, c'est un gaz inflammable. Synthétisé pour la première fois par le Russe Alexandre Boutlerov en 1859, il fut formellement identifié par l'Allemand August Wilhelm von Hofmann en 1867.
Le formaldéhyde est un gaz ubiquitaire, principalement issu de la combustion incomplète de substances contenant du carbone. Il est donc présent dans la fumée de feux de forêt, dans les rejets de centrales électriques thermiques, d'incinérateurs, de raffineries, de chaudières industrielles et dans les gaz d'échappement de véhicules[15],[16] automobiles, et dans la fumée du tabac. Il est aussi produit dans l'atmosphère sous l'action des rayons solaires et du dioxygène sur le méthane atmosphérique ainsi que sur d'autres hydrocarbures[15],[16] ; les processus de décomposition de matières organiques (végétaux ou cadavre) en produisent aussi[17].
Dans l'air intérieur, il est notamment émis par divers types de colles. L'air intérieur en contient généralement plus que l'air extérieur[17].
De faibles quantités de méthanal sont produites par le métabolisme de la plupart des organismes, dont l'organisme humain.
Le formaldéhyde fait aussi partie des molécules détectées dans le milieu interstellaire[18].
Remove ads
Nomenclature, formes et composés proches
Résumé
Contexte
Le terme « formaldéhyde » est issu de « aldéhyde formique » (dérivant de l'acide formique, lui-même ainsi nommé car isolé pour la première fois à partir d'un distillat de fourmis). En nomenclature systématique, le terme correct est méthanal (méth- pour un squelette à un seul atome de carbone, terminaison -al pour un aldéhyde), mais l'usage de « formaldéhyde » reste prépondérant pour des raisons historiques.
Le formaldéhyde est plus compliqué que la plupart des composés carbonés simples, en ceci qu'il peut adopter plusieurs formes. Ces composés peuvent souvent être utilisés de manière interchangeable et se convertir l'un en l'autre.
- Le formaldéhyde moléculaire. À température ambiante, c'est un gaz incolore à l'odeur irritante caractéristique. Il est stable jusqu'à environ 150 °C, mais polymérise lorsqu'il est condensé sous forme de liquide.
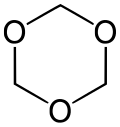
- Le 1,3,5-trioxane, de formule (CH2O)3. Trimère du formaldéhyde moléculaire, c'est un solide blanc soluble dans les solvants organiques.
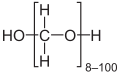
- Le paraformaldéhyde, polymère du formaldéhyde, de formule HO(CH2O)nH. Solide blanc, il est insoluble dans la plupart des solvants. Quand le degré de polymérisation n est supérieur à 100, on parle plutôt de polyoxyméthylène.
- Le méthanediol, de formule CH2(OH)2. Ce composé coexiste, à l'équilibre, avec divers oligomères, en fonction de la température et de la concentration.
En raison de ces diverses formes, une faible quantité d'un stabilisant (généralement du méthanol) est souvent ajouté aux solutions de formaldéhyde commercialement disponibles, pour éviter les réactions d'oxydation et de polymérisation.
- Principales formes de formaldéhyde
- Molécule de formaldéhyde, ou méthanal.
- Trioxane, trimère cyclique stable du formaldéhyde.
- Paraformaldéhyde.
- Méthanediol, l'espèce majoritaire dans les solutions aqueuses diluées de formaldéhyde.
Le terme « formol » est généralement réservé aux solutions aqueuses diluées de formaldéhyde (d'une concentration typique de 3,7 % à 4 % en formaldéhyde).
La formaline est une solution aqueuse dans laquelle le méthanal est dissous à 37 % en masse[19]. Cette appellation tire son origine d'un produit commercial mais s'est depuis étendue par abus de langage aux autres solutions de méthanal à cette concentration[20].
Remove ads
Propriétés

Le méthanal est à température ambiante un gaz, très soluble dans l'eau. Il y forme en solution : le formol.
Le méthanal polymérise dans l'eau, ce qui fait que le formol contient peu de méthanal sous forme de monomères. Le méthanal polymérise sous forme de polyoxyméthylène (appelé paraformaldéhyde ; succession de groupes -O-CH2-) ou de 1,3,5-Trioxane (trimère cyclique). La dépolymérisation est possible par distillation en présence de traces acides. Généralement, le formol vendu dans le commerce contient aussi du méthanol pour limiter la polymérisation du méthanal.
Le méthanal possède la plupart des propriétés chimiques des aldéhydes, hormis qu'il est plus réactif. Remarquablement électrophile, il peut réagir par substitution électrophile aromatique avec les composés aromatiques ou par addition électrophile sur les alcènes. En présence d'un catalyseur basique, le méthanal subit une réaction de Cannizzaro et se transforme en acide formique et en méthanol.
Enfin, le formol (méthanal) est facilement oxydé par le dioxygène de l'air pour former de l'acide formique. C'est pourquoi il faut le conserver dans des récipients étanches.
Remove ads
Production
Résumé
Contexte
Le méthanal est fabriqué industriellement par l'oxydation catalytique du méthanol, et plus précisément par action de l'oxygène de l'air sur le méthanol, en phase vapeur, en présence de catalyseur.
Sur la base du rapport air-méthanol du procédé, on distingue deux types de fabrication : l'oxydation partielle de méthanol et l'oxydation totale de méthanol.
Procédés d'oxydation partielle de méthanol
L'oxydation partielle de méthanol s'effectue au-dessus de la limite (haute) d'explosivité, soit 30 % en volume de méthanol. Dans ce cas, les catalyseurs sont à base d'argent ou de l'argent métallique pur ; on parle donc aussi de « procédé à l'argent »[21]. La catalyse à base d'argent nécessite une température élevée (650 °C environ). On utilise un réacteur adiabatique dans lequel deux réactions produisent simultanément du méthanal :
- oxydation ménagée : CH3OH + ½ O2 → H2CO + H2O (R1) ;
- déshydrogénation : CH3OH → H2CO + H2 (R2).
La première réaction est exothermique alors que la seconde est endothermique, (R1) fournit donc l'énergie nécessaire pour que la réaction (R2) puisse avoir lieu[22].
En sortie de réacteur, les gaz sont refroidis et le formaldéhyde est absorbé dans de l'eau. On effectue ensuite une distillation pour séparer le formaldéhyde, l'eau et le méthanol qui n'a pas réagi.
Procédés d'oxydation totale de méthanol
L'oxydation totale de méthanol qui s'effectue sous la limite inférieure d'explosivité, soit 7 % en volume de méthanol. Les catalyseurs sont alors un mélange d'oxydes de fer, de molybdène et de vanadium ; on parle donc aussi de « procédé aux oxydes ». Dans ce cas, le méthanol et le dioxygène réagissent à 400 °C selon l'équation (R2). La réaction étant exothermique, il est nécessaire de refroidir le réacteur catalytique. Le traitement des gaz en sortie de réacteur est similaire à celui utilisé pour le procédé à l'argent.
Autres méthodes
Le méthanal peut également être produit lors de l'ozonolyse d'un alcène terminal, ou en ajoutant de l'hexaméthylènetétramine au milieu réactionnel suivant la réaction :

.
L'oxydation prolongée du méthanal conduit à la formation d'acide formique, que l'on trouve en faible concentration dans les solutions industrielles de méthanal.
Production artisanale
Le méthanal se dégage avec l'ajout de permanganate de potassium (KMnO4) dans les proportions de 1 g de permanganate pour 2 ml de formaline. C'est une réaction exothermique, dont la chaleur générée est importante.
Cette méthode est utilisée par certains aviculteurs pour les fumigations d'œufs.
À une échelle réduite, le formol peut être produit grâce à diverses réactions comme la conversion de l'éthanol.
Remove ads
Utilisation
Résumé
Contexte
Synthèses industrielles
Le formaldéhyde est un précurseur pour la fabrication de nombreuses résines : résine urée-formaldéhyde, mélamine, résine phénol-formaldéhyde.
On emploie le méthanal pour produire de nombreux autres produits chimiques, dont la plupart sont des polyols comme le pentaérythritol, utilisé dans la fabrication de peintures et d'explosifs. On compte aussi d'autres dérivés du méthanal comme le méthylène diphényle diisocyanate, un constituant important des peintures et des mousses de polyuréthane, ainsi que l'hexaméthylènetétramine, utilisée dans les résines phénol-méthanal et pour fabriquer du RDX (un explosif).
Autres utilisations

Le méthanal est utilisé :
- comme désinfectant, notamment en médecine vétérinaire (ex : pédiluves de désinfection) ;
- comme fixateur et conservateur de cadavres ou de certains échantillons biologiques[23] d'animaux ou d'humains (pour les dissections d'écoles de médecine par exemple) ou pour la conservation ou fixation d'échantillons ou de certains prélèvements biologiques, comme dans le cadre d'analyses IBGN, IBMR ou IOBS ;
- comme conservateur dans certains vaccins ;
- pour assécher ou tuer la peau (pour le traitement médical des verrues par exemple) ;
- en dentisterie, sous forme directe (formaldéhyde) ou dérivée (paraformaldéhyde, polyoxyméthylène), intégré dans un grand nombre de spécialités destinées à obturer les canaux des dents dévitalisées. Contrairement aux médicaments, les produits et matériaux employés en art dentaire ne sont pas soumis à une autorisation de mise sur le marché, ce qui explique qu'ils échappent à la réglementation évoquée au paragraphe suivant ; l'usage pour les dentifrices est encore autorisé en Union européenne, mais a été interdit aux États-Unis au début des années 1980 ;
- pour embaumer les corps, donc par thanatopraxie, par exemple en attente d'un enterrement ;
- pour produire des polymères et des produits chimiques (plus de 50 % du total des usages du méthanal) ;
- pour coller les tapisseries ;
- illégalement, pour la conservation des aliments[24] ;
- comme inhibiteur de corrosion dans l'industrie d'extraction du gaz de schiste, où le méthanal est dilué dans un mélange d'eau, associé à d'autres produits chimiques et du sable, pour l'injection dans les puits d'extraction du gaz de schiste comme liquide d'hydrofracturation ;
- sous forme de formol pour faire sortir les vers de terre du sol, à des fins de comptage[25] ;
- pour fabriquer des phénoplastes, en le combinant au phénol, à l'urée ou à la mélamine (fabrication d'aminoplastes). Le méthanal forme alors des résines thermodurcissables. Ces résines sont souvent utilisées dans les colles permanentes, comme celles utilisées dans la fabrication d'agglomérés, de contreplaqués, de la laine de verre, de tapis, ou bien pour former des mousses synthétiques ;
- comme désinfectant en remplaçant l'atmosphère de l'usine par un mélange de formaldéhyde sur certains sites de production pharmaceutique.
Remove ads
Réglementation
Résumé
Contexte
Le règlement CLP de l'Union européenne no 1272/2008 classe le formaldéhyde de la manière suivante[26] :
- cancérogénicité, catégorie 1B ;
- mutagénicité sur les cellules germinales, catégorie 2 ;
- toxicité aiguë par contact avec la peau ou par ingestion, catégorie 3 ;
- corrosion cutanée, catégorie 1B ;
- sensibilisation cutanée, catégorie 1.
L'utilisation du formaldéhyde est limitée par son statut de produit cancérigène, mutagène et reprotoxique suivant le règlement UE no 552-2009. En tant que produit biocide, il est soumis aux articles L.522-1 et suivants du code de l'environnement. L'aldéhyde formique est une substance identifiée et notifiée à l'annexe II du Règlement Délégué (UE) no 1062/2014[27] pour différents types de produits biocides. Il peut être présent dans les produits suivants :
- produits biocides destinés à l'hygiène humaine ;
- désinfectants utilisés dans le domaine privé et dans le domaine de la santé publique et autres produits biocides ;
- produits biocides destinés à l'hygiène vétérinaire; désinfectants pour eau de boisson ;
- produits de protection des fibres, du cuir, du caoutchouc et des matériaux polymérisés ;
- produits de protection des denrées alimentaires destinés à l'alimentation humaine ou des aliments pour animaux ;
- fluides utilisés pour l'embaumement et la taxidermie ;
- et lutte contre d'autres vertébrés.
Le Comité des Biocides de l'Agence européenne des produits chimiques (ECHA) a évalué en 2015 l'utilisation du formaldéhyde en tant que produit de désinfection et d'hygiène vétérinaire (type 3 - PT3)[28] dans un but de prévention des maladies animales dans les bâtiments où les animaux sont élevés, gardés ou transportés[29]. Ce comité a jugé que dès lors que les mesures de protection collective et individuelles étaient respectées, l'utilisation de formaldéhyde était acceptable pour la santé humaine et l'environnement dans le cadre :
- de la désinfection par nébulisation des bâtiments d'élevage de cochons ou de volailles, et par désinfection humide de petites surfaces de ces bâtiments ;
- de la désinfection des œufs dans les couvoirs par nébulisation ou fumigation.
L'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (Anses) a publié le un rapport d'expertise collective pour l'élaboration de valeurs techniques de référence (VTR) pour le formaldéhyde[30]. En annexe de ce rapport, et concernant la réglementation européenne les experts affirment que le formaldéhyde est enregistré dans le règlement (CE) no 1907/2006 (REACH) et n'est « soumis à aucune restriction »[31]. Concernant le règlement CLP, les experts confirment les catégories ci-dessus, ainsi que l'utilisation industrielle qui en est faite. Les diverses tentatives de substitution du formaldéhyde par d'autres molécules se sont avérées jusqu'à aujourd'hui infructueuses dans ces industries. Aussi, des mesures de protection collective et individuelles sont mises en place suivant les principes généraux de prévention énoncés dans l'article L.4121-2 du code du travail[32] afin de protéger la santé des salariés exposés au formaldéhyde. Le , une proposition de Directive du Parlement européen et du Conseil modifiant la Directive 2004/37/CE concernant la protection des travailleurs contre les risques liés à l'exposition à des agents cancérigènes ou mutagènes au travail a été publiée et s'intéresse à cinq molécules, dont le formaldéhyde. Une observation sensibilisation cutanée pour le formaldéhyde y est recommandée.
La Commission a aussi demandé à l'ECHA de préparer un dossier « annexe XV » en vue d'une éventuelle harmonisation des règlements nationaux et limitation du formaldéhyde et des rejets de formaldéhyde dans les mélanges et articles destinés aux consommateurs, en particulier ceux produits par la transformation du bois[33].
L'ECHA est aussi invitée à recueillir les informations existantes afin d'évaluer l'exposition potentielle au formaldéhyde et aux rejets de formaldéhyde sur le lieu de travail, y compris les utilisations industrielles et professionnelles. Enfin, le Règlement d'exécution (UE) 2018-183 a refusé d'autoriser le formaldéhyde en tant qu'additif pour l'alimentation animale appartenant aux groupes fonctionnels des conservateurs et des améliorateurs de conditions d'hygiène[34].
Remove ads
Recherche, détection et mesures quantitatives
Dans les années 1950, des tests colorimétriques ont été créés par la chimie analytique pour détecter ce produit via la réaction de Hantzsch[35], puis au moyen de l'alcool méthylique[36] puis via la formation de radicaux[37], puis (dans les années 1990) par réaction avec l'acétylacétone[38] ou par d'autres méthodes[39].
Depuis diverses méthodes, plus fines ont été développées, dont utilisant le méthanol ou l'éthanol[40].
L'acide chromotropique permet le dosage spectrométrique du formaldéhyde[41].
Remove ads
Santé
Résumé
Contexte
Exposition de l'être humain
Le formaldéhyde est employé dans nombre de matériaux synthétiques ; ceux-ci relâchent au cours du temps des quantités non négligeables de formaldéhyde.
C'est un des polluants les plus répandus de l'air intérieur des habitations et lieux fermés de travail.
Les enfants y sont notamment exposés. En 2009, une association de médecins, l'Association santé environnement France, s'est intéressée au formaldéhyde en testant des lits pour bébé[42] vendus en grande distribution. Il a été démontré que tous les lits analysés, et ce quel qu'en soit le prix, émettent du formaldéhyde. En comparant les résultats de l'étude et les valeurs guide[43] de référence édictées par les autorités de contrôle sanitaires françaises, les taux émis par les lits représentent plus d'un quart de la valeur toxique de référence.
Métabolisation
Chez les mammifères, le formaldéhyde semble assez rapidement dégradé par l'organisme en s'associant au glutathion (demi-vie du formaldéhyde = une minute pour les analyses de plasma sanguin faites chez le rat[15]). Ce seraient donc surtout ses métabolites[44] (hydroxyméthylglutathion, S-formylglutathion puis formiate), qui contribueraient à sa toxicité.
Organes cibles
- Les yeux ; avec un caractère irritant du formaldéhyde au-delà de certaines doses[45].
- Certaines muqueuses (nez, gorge, pharynx) sont les premières touchées lors d'exposition chroniques ou d'exposition temporaires à des taux plus élevés de vapeurs de formaldéhyde, selon des études contrôlées d'exposition humaine à court terme de formaldéhyde (à des niveaux de départ de 0,5 à 1 ppm pour les études retenues par l'IARC 1995)[45].
- Les poumons sont touchés avec de possibles crises d'asthme, généralement pour une teneur de l'air dépassant 3 ppm chez les individus normaux (c'est-à-dire dans ce contexte « individus non sensibilisés ») selon l'IARC-2005). Dans la plupart des études portant sur la fonction pulmonaire, le formaldéhyde seul ou en combinaison avec d'autres agents (concentration de formaldéhyde : moins de 0,02 à 5 ppm) a provoqué des baisses transitoires, réversibles de la fonction pulmonaire, sans preuve d'effet durable sur la fonction pulmonaire chronique (IARC 1995[45]).
- Peau : des phénomènes d'allergies et sensibilisation de la peau sont possibles (dermatite de contact allergique)[45].
Des métaplasies squameuses et dysplasies légères ont été observées en cas d'exposition professionnelle[45].
Toxicologie
- Irritant : au-dessus d'une concentration de 0,1 mg/kg dans l'air, il peut irriter les yeux et les muqueuses, causant des conjonctivites, des maux de tête et des difficultés à respirer accompagnées de douleurs dans la gorge[45],[46] ;
- Neurotoxicité ; selon la NASEM (2023) les effets étudiés chez l'homme incluent des effets neurocomportementaux (sur l'apprentissage et la mémoire), neurochimiques et neuropathologiques. Chez l'animal, ils ont porté sur l'activité motrice, l'anxiété, l'habituation, l'apprentissage et la mémoire, et la sensibilisation chimique. L'EPA pour sa dernière évaluation, parmi 4338 articles examinés en a retenu 147 pour l'identification des dangers (40 humains, 60 animaux et 47 in vitro), en attribué un faible niveau de confiance à certaines études humaines examinant des effets neurocomportementaux tels que l'altération de la mémoire et les troubles de la concentration ; certaines études présentent en outre un possible biais confusion due à la coexposition au méthanol, surtout pour les expositions élevées (>10 mg/m3). L'EPA, d'après les études basées sur une exposition professionnelle supposée n'a pas trouvé de preuves d'associations entre le formaldéhyde et la sclérose latérale amyotrophique (SLA) ou la mortalité par maladie neurologique chez l'Homme, mais il existe des preuves suffisantes, chez l'animal, montrant un lien causal entre le formaldéhyde inhalé et les effets neurotoxiques. Un comité acédémique d'évaluation a en 2023 recommandé à l'EPA d'inclure les études avec le mal de tête comme critère d'évaluation ou de fournir une meilleure justification pour son exclusion[47] ;
- Reprotoxicité : selon le CIRC (2005), plusieurs études ont évalué directement ou indirectement les effets sur la reproduction de l'exposition professionnelle au formaldéhyde. Les résultats examinés dans ces études ont inclus des avortements spontanés, des malformations congénitales, une chute du poids à la naissance, l'infertilité et l'endométriose[45]. Les données et rapports restent contradictoires concernant le niveau de risque d'avortement spontané et d'abaissement du poids à la naissance rapportés chez les femmes exposées professionnellement au formaldéhyde. Quelques études faites sur l'animal de laboratoire exposé à ce produit via l'inhalation ont porté sur les effets du formaldéhyde sur les testicules[48],[49], la grossesse et le développement fœtal, n'ayant pas clairement mis en évidence de tels effets quand l'exposition est inférieure aux doses toxiques pour la mère ;
- Cancérogénicité : après avoir été d'abord considéré comme « cancérigène probable », le formaldéhyde a été classé comme « cancérigène certain » par le Centre international de recherche sur le cancer (CIRC), qui dépend de l'Organisation mondiale de la santé (OMS) et en 2011 l'Anses a demandé son classement comme cancérigène reconnu au niveau européen, de manière qu'il soit obligatoirement classifié et étiqueté comme tel. Il cause de manière certaine le cancer du nasopharynx.
Et en 2006, son implication dans les cancers des fosses nasales et des sinus est suspectée, mais des biais dans les études faites en milieu professionnel ne permettaient pas encore de conclusion certaine[50] (ces travailleurs exposés étaient généralement aussi exposés à un grand nombre d'autres polluants potentiellement cancérigènes (poussières de bois dans l'industrie du bois – aussi responsable de cancer des fosses nasales –, benzène – responsable de leucémies –, et d'autres aldéhydes comme l'acétaldéhyde) ; un rôle propre du formaldéhyde dans ces cancers est plausible, mais difficile à isoler[51],[52]. L'évaluation IRIS close en 2011 décrivait l'hypothèse que le formaldéhyde pourrait atteindre la moelle osseuse et y avoir des effets mutagènes conduisant aux cancers notés, mais les auteurs précisent que malgré l'utilisation de méthodes analytiques sensibles et sélectives susceptibles de différencier les expositions endogènes des apports exogènes, de nombreuses études ont démontré que les doses acquises de formaldéhyde dépasseraient rarement celles qui ne permettraient pas au métabolisme de dégrader la molécule[17]. Une autre hypothèse, également citée par ce Rapport est que les cellules souches hématopoïétiques circulantes qui percolent dans le lit capillaire nasal ou dans les tissus lymphoïdes associés au nez pourraient y muter sous l'effet du formaldéhyde, puis conduire aux cancers notés, mais en 2011, aucune preuves expérimentales n'avait démontré ce mécanisme[17].
De nouvelle données sur le risque de leucémie devait être étudiées par l'EPA avec les académies des sciences entre 2016 et début 2018[53]
Les animaux de laboratoire soumis à d'importantes doses de méthanal durant leur vie voient le risque de cancer du nez et de la gorge augmenter.
Des études suggèrent qu'au taux moyen de l'air intérieur des habitations, le formaldéhyde n'a pas d'effet cancérigène ; son potentiel cancérigène (« à seuil »), ne s'exprimerait qu'au-delà de 5 mg m−3, concentrations qui ne sont retrouvées qu'en milieu professionnel[54] et rarement dans l'habitat, où les taux moyens sont nettement plus bas (exemple : moyennes françaises proches des 20 µg m−3, soit 250 fois moins que les taux déclenchant des cancers chez l'animal de laboratoire[55],[56]).
Son implication dans la survenue de cancers du sang (leucémies) est fortement suspectée[51] et pourrait être confirmée par une réévalution par l'EPA (attendue début 2018, mais dont la publication semble avoir été retardée[53]) ; - Génotoxicité : le CIRC (2005) estime qu'il existe des preuves de génotoxicité pour plusieurs modèles in vitro ainsi que chez les personnes exposées et les animaux de laboratoire. Les études faites chez des travailleurs exposés au formaldéhyde ont révélé des cassures ou réagencements (cross-link) des molécules d'ADN, ce qui est cohérent avec les observations faites chez les animaux de laboratoire (rats, singes), chez lesquels le formaldéhyde inhalé a causé, de manière reproductible, des perturbations de l'ADN extrait de muqueuses nasales après exposition à inhalation[45].
Une étude rapporte des anomalies cytogénétiques de la moelle osseuse de rats ayant été exposés par inhalation, mais d'autres études n'ont pas détecté cet effet[45] ; - En dentisterie, les quantités faibles incorporées aux « pâtes canalaires » causent parfois des réponses allergiques graves (urticaire jusqu'à l'œdème de Quincke survenant dans les heures suivant l'introduction de la pâte dans les canaux dentaires, selon la littérature[57]) ;
- Le formaldéhyde ne fait pas partie des produits listés par la stratégie communautaire sur les perturbateurs endocriniens (E.C., 2004) ni par le rapport d'étude de la DG ENV sur la mise à jour de la liste prioritaire des perturbateurs endocriniens à faible tonnage[58].
Vers une réévaluation toxicologique et écotoxicologique du formaldéhyde ?
En Europe et aux États-Unis, l'évaluation toxicologique et écotoxicologique des produits chimiques doit être périodiquement mise à jour, avec relecture par des pairs, afin de bénéficier des avancées scientifiques sur le sujet.
En 2017, à la suite des lacunes ou incertitudes de l'évaluation précédente qui s'est déroulée aux États-Unis de 1998 à 2011[59],[60],[61], et en intégrant les recommandations du Conseil national de la Recherche des NAS (National Academy of sciences), une nouvelle évaluation du formaldéhyde était lancée au sein du programme IRIS (Integrated Risk Information System) de l'EPA[53].
Durant cette période Donald Trump a été élu Président et a nommé une nouvelle administration[53].
Début , la presse américaine cite des informations laissant penser que l'Administration Trump, sous l'autorité de Scott Pruitt et son adjoint Andrew Wheeler aurait freiné, voire bloqué toutes les phases du processus de réévaluation de la toxicité et cancérogénicité de plusieurs produits chimiques, dont le formaldéhyde.
Le journal Politico note qu'Andrew Wheeler (qui vient alors de remplacer S. Pruitt comme directeur intérimaire de l'EPA, jouant donc le rôle de ministre intérimaire de l'environnement) était en outre en 2004 directeur du personnel du Comité sénatorial de l'environnement et des travaux publics alors que son président (Jim Inhofe) cherchait aussi à retarder une nouvelle évaluation de la dangerosité du formaldéhyde[53]. Les fonctionnaires nommés par l'administration Trump exigent des fonctionnaires de carrière chargés de l'évaluation qu'ils ne commencent pas d'études internes (dont sur l'évaluation du formaldéhyde) sans leur permission formelle, et ils ont annulé des réunions qui l'auraient avancé. Ces pressions et interférences du politique sur le scientifique sont survenues après que les scientifiques de carrière de l'EPA aient commencé en 2017 à mettre à jour les données sur le formaldéhyde, pour l'isoler de la controverse politique selon les administrateurs.
Dans une déclaration, un porte-parole de l'EPA a nié que l'évaluation était bloquée, ajoutant que l'EPA continuait de discuter de cette évaluation avec ses partenaires du programme et n'avait « pas d'autres mises à jour à fournir pour le moment »[53]. Pourtant alors qu'en , S. Pruitt estimait devant un panel sénatorial que le projet de rapport d'évaluation était complet et suivait son cours[62], en juillet il n'était toujours pas publié, mis en consultation ni envoyé aux relecteurs académiques prévus. L'ébauche révisée de cette nouvelle évaluation IRIS du formaldéhyde aurait normalement dû être publiée pour recevoir d'éventuels commentaires publics puis envoyée pour relecture par des pairs et pour avis aux Académies nationales des sciences, qui constituent pour l'EPA un panel indépendant regroupant des scientifiques parmi les meilleurs du pays. Selon le journal Politico, l'EPA a préparé un budget pour cela (500 000 dollars, le maximum autorisé pour ce type de travail) mais mi-2018 les Académiciens n'avaient toujours pas reçu le projet de rapport. Des documents internes de l'EPA montrent selon le journal Politico qu'un groupe de représentants des lobbys industriels susceptibles d'être concernés par de nouvelles réglementations si l'étude était publiée « ont eu des contacts fréquents avec des hauts responsables de l'EPA en les pressant de la garder l'étude secrète ou d'en modifier les conclusions », affirmant notamment que « près d'un million d'emplois dépendent de l'utilisation du formaldéhyde »[63]. Ce groupe d'intérêt comprend notamment une filiale de Koch Industries (Georgia-Pacific Chemicals LLC) qui pourrait voir ses bénéfices affectés par une réglementation plus stricte[53].
En août 2023, une revue d'étude intitulée “Review of EPA’s 2022 Draft Formaldehyde Assessment” est publiée par le NASEM (National Academies of Sciences, Engineering, and Medicine)[64]. Ce document (étiqueté “Rapport d’étude consensuel”, Consensus Study Report) évalue et critique la qualité et la rigueur scientifique de l’évaluation des risques sanitaires liés à l’exposition au formaldéhyde, telle que réalisée par l’EPA dans le cadre de son programme IRIS (Integrated Risk Information System). Après avoir examiné les méthodes, l’organisation et le forces et faiblesses de l’évaluation faite par l’EPA, ainsi que les analyses des effets (non cancéreux et cancéreux du formaldéhyde) sur la santé, ce rapport émet des recommandations pour combler les lacunes de ce travail d'évaluation et le rendre plus rigoureux et crédible, plus transparent, et plus cohérente avec les données scientifiques existantes. Les Académie critiquent en particulier le manque de justification et d’explication des choix méthodologiques de l’EPA, un recours excessif à des modèles mathématiques complexes et incertains, une sélection arbitraire des études retenue pour dériver les valeurs de référence, et une présentation confuse et redondante des résultats. Ce rapport invite l’EPA à revoir son évaluation du formaldéhyde, en tenant compte les études publiées depuis 2022 et des commentaires du comité d’experts chargé du rapport, en améliorant les points suivant :
- clarifier la méthodologie d’évaluation des risques : l'EPA devrait la justifier et l'expliquer clairement, en tenant compte des incertitudes et des variabilités (p. 6) ; en utilisant des outils plus adaptés à la synthèse des données probantes, tels que les revues systématiques et les méta-analyses (p. 7) ; en impliquant mieux et davantage les parties prenantes dans le processus d’évaluation, dont en sollicitant leurs commentaires et leurs contributions (p. 8) ;
- améliorer l’analyse des effets non cancéreux : l'EPA devrait sélectionner les études les plus pertinentes et les plus fiables pour dériver ses valeurs de référence (grâce à des critères plus transparents et plus cohérents, p. 9) ; avec une présentation plus claire et concise des résultats, en évitant les redondances et les incohérences (p. 10). Les valeurs de référence pour certains effets (ex. : toxicité respiratoire, toxicité développementale) seraient à revoir en tenant compte des nouvelles études publiées depuis 2022 (p. 11).
- améliorer l’analyse des effets cancéreux : l’EPA devrait pour cela réduire le recours aux modèles mathématiques complexes et incertains et privilégier les données épidémiologiques humaines (p. 12) ; clarifier la justification et la plausibilité biologique des associations entre le formaldéhyde et certains types de cancer (ex. : leucémie, cancer du sein) (p. 13) ; reconsidérer la classification du formaldéhyde comme cancérogène humain avéré, en tenant compte des incertitudes et des controverses scientifiques (p. 14).
Remove ads
Santé au travail
Résumé
Contexte
Le risque d'absorber du formaldéhyde semble plus élevé :
- dans la production de colles et de panneaux agglomérés, contreplaqués, de meubles et d'autres produits du bois recomposé ;
- dans la fabrication de diverses matières plastiques, certains fertilisants et résines utilisées dans les moules de fonderie en sable, ainsi que de certaines peintures et vernis ;
- parfois dans l'industrie du textile qui utilise ces résines comme apprêts pour rendre des tissus infroissables ;
- dans les processus de synthèse d'autres produits chimiques ;
- via l'utilisation de produits bactéricides en contenant (nombreuses formulations de produits désinfectants, de cosmétiques, de liquides d'embaumement et de solutions de conservation de tissus biologiques) ;
- dans le domaine de la science (conservation d'espèces animales, dans l'échantillonnage de la faune en vue de son analyse/identification…).
Voies d'exposition
En milieu de travail, l'exposition au formaldéhyde se produit par différentes voies.
Inhalation : le formaldéhyde gazeux est absorbé par les voies respiratoires. L'exposition professionnelle au formaldéhyde par inhalation provient principalement de trois types de sources :
- La décomposition thermique ou chimique des résines à base de formaldéhyde, et plus spécifiquement, la combustion du polyoxyméthylène ;
- L'évaporation de formaldéhyde à partir de solutions aqueuses (par exemple, les liquides d'embaumement) ;
- La formation de formaldéhyde résultant de la combustion d'une variété de composés organiques (par exemple, via les gaz d'échappement ou dans les blocs opératoires via les fumées chirurgicales produites par les bistouris électriques).
Passage percutané et contact avec la peau.
- Ce risque est le plus élevé pour des métiers utilisant ou produisant des solutions aqueuses de formaldéhyde. Il cause des irritations, des dermites de contact (irritatives et allergiques).
Les symptômes sont des démangeaisons, des picotements et des rougeurs. Une sensibilisation cutanée est susceptible d'apparaître après un contact avec des solutions aqueuses de formaldéhyde de concentration égale ou supérieure à 2 %.
- Un contact fréquent avec des solides contenant du formaldéhyde libre ou avec des résines (surtout si elles sont mal polymérisées) peut entraîner une sensibilisation allergique. Ces effets sont a priori facilement évitables en protégeant les régions de la peau exposées, par exemple, en portant des gants et tenues appropriées.
Les effets sanitaires d'une exposition à cette substance varient selon la voie d'exposition et la concentration ou dose absorbée, et probablement selon l'âge du patient.
Lorsqu'une personne est sensibilisée, les manifestations de l'allergie cutanée (érythème) risquent de se produire à chaque contact avec des solutions de concentrations de plus en plus faibles (à partir de 0,5 % de formaldéhyde).
En situation d'accident, du formaldéhyde peut être présent dans l'air en fortes concentrations. Il constitue alors un danger immédiat considérable.
- Des concentrations égales ou supérieures à 20 ppm peuvent induire des œdèmes pulmonaires graves et éventuellement causer la mort.
- Par contact important et direct avec la peau, le formaldéhyde peut entraîner des lésions.
Le formol est couramment utilisé en pisciculture pour le traitement des parasites externes (costia entre autres).
Remove ads
Alimentation
Le formaldéhyde peut être présent à faible dose dans l'alimentation humaine : il apparaît naturellement dans certains aliments, tels que des fruits et des légumes, à des concentrations pouvant varier de 3 à 60 mg/kg[65]. Répertorié comme additif (conservateur) sous le code E240, il est désormais interdit en tant que tel dans l'Union européenne[65].
Prévention, traitement de l'air intérieur
- Une ventilation suffisante et un renouvellement de l'air intérieur sont recommandés surtout dans les logements neufs ou contenant des planchers, murs, plafonds ou meubles contenant de l'aggloméré, des moquettes ou dalles synthétiques collées.
- Certaines plantes (chlorophytum par exemple) se sont montrées en laboratoire, dans le cadre du programme Phyt'air par exemple, capables de dégrader de façon modérée certains aldéhydes. Mais avec des rendements qui ne permettent pas d'apurer l'air d'un logement de façon significative[66]. L'ADEME considère que l'argument « plantes dépolluantes » n'est pas validé scientifiquement au regard des niveaux de pollution généralement rencontrés dans les habitations et des nouvelles connaissances scientifiques dans le domaine[67].
- Depuis 2013, au moins une peinture détruisant le formaldéhyde est commercialisée, qui en laboratoire absorbe 40 % du formaldéhyde en six heures et 60 % en 24 h (dans les conditions de la norme Iso 16 000).
- On commence à trouver sur le marché des agglomérés et meubles ou planchers garantis sans formaldéhyde.
Remove ads
Colles alternatives
Des colles ou résines biosourcées et/ou sans formaldéhydes ou à moindre teneur en formaldéhydes apparaissent sur le marché pour les agglomérés ou contreplaqués (OSB, MDF/HDF…), dont un produit à base de déchets (tourteaux) de soja.
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads