Top Qs
Chronologie
Chat
Contexte
Télomère
extrémité des chromosomes De Wikipédia, l'encyclopédie libre
Remove ads
Remove ads
Un télomère est une région hautement répétitive, donc a priori non codante, d'ADN à l'extrémité d'un chromosome. À chaque fois qu'un chromosome en bâtonnet d'un eucaryote est répliqué, lors de la réplication, qui précède la mitose (division cellulaire), le complexe enzymatique de l'ADN polymérase s'avère incapable de copier les derniers nucléotides : l'absence de télomère signifierait la perte rapide d'informations génétiques nécessaires au fonctionnement cellulaire. De récents travaux suggèrent cependant que l'ADN répétitif des télomères pourrait être transcrit en ARN répétitifs qui joueraient un rôle dans la stabilisation du télomère[1]. Télomère provient du grec telos, la fin, et meros, partie, donc la partie à l'extrémité de l'ADN.
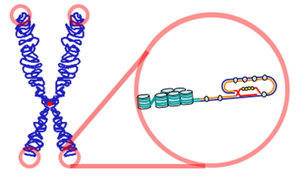
Les télomères raccourcissent avec l’âge, l’inflammation et le stress. Des études ont montré que des télomères courts sont associés à un risque plus élevé de maladies liées à l’âge[2].
Remove ads
Historique
En 1971, le biologiste russe Alekseï Olovnikov émet pour la première fois l'hypothèse que la durée de vie maximale des cellules en culture (limite de Hayflick) est corrélée à la perte progressive de séquences télomériques. En effet, lors de chaque division cellulaire, les télomères s'érodent jusqu'à atteindre une taille critique qui déclenche alors une entrée en sénescence de la cellule. Les télomères agissent comme une horloge biologique régissant la durée de vie des cellules. Cette théorie est connue sous le nom de théorie télomérique du vieillissement. Elle prédit également l'existence d'une enzyme capable d'inverser le processus en synthétisant de nouvelles séquences d'ADN télomériques : il s'agit de la télomérase. L'identification de la télomérase est réalisée en 1985 par Elizabeth Blackburn, Carol Greider[3] et Jack Szostak. Ce travail est récompensé par le prix Nobel de physiologie ou médecine en 2009.
Remove ads
Structure et fonctions
Résumé
Contexte
Chez la plupart des procaryotes, les chromosomes sont circulaires (plasmides), et ne possèdent donc pas d'extrémité susceptible d'être altérée par une réplication incomplète. Une petite proportion des chromosomes bactériens, (comme ceux de Streptomyces et Borelia), sont en forme de bâtonnet et possèdent des télomères dont la structure et la fonction diffèrent notablement de ceux des chromosomes des eucaryotes. En période interphasique du cycle cellulaire, les télomères sont localisables dans les zones les plus éloignées du centre du noyau.
Les télomères comportent des séquences répétitives d'ADN, qui assurent une protection des terminaisons chromosomiques. Ils évitent que le chromosome ne s'effiloche et que son extrémité ne soit considérée comme une rupture du double brin d'ADN, ce qui pourrait conduire à des soudures de chromosomes par fusion de leurs télomères respectifs[4]. De plus, la réplication de l'ADN (par l'ADN polymérase) n'est pas parfaite à ses extrémités : le segment répliqué est en règle générale plus court que l'original. La présence de télomères, sans information génétique, préviendrait ainsi la perte de données[5]. Ces séquences sont répétées plusieurs centaines de fois sur chaque chromosome humain[5]. Les télomères sont recouverts de protéines, les « shelterines »[6].
Les télomérases, enzymes transcriptases inverses spécialisées, assurent la synthèse et la croissance des télomères, chez l'humain et chez la plupart des autres organismes[7]. Ces enzymes sont très actives surtout pour les cellules qui se divisent de nombreuses fois (exemple : les cellules-souches).
Les cellules somatiques de mammifères (et d'autres) sans télomérase perdent progressivement des séquences télomères à la suite de réplications incomplètes[8]. À mesure que les télomères des mammifères se raccourcissent, les cellules atteignent finalement leur limite réplicative et progressent vers la sénescence ou la vieillesse. La sénescence implique des voies p53 et pRb et conduit à l'arrêt de la prolifération cellulaire[9]. La sénescence peut jouer un rôle important dans la suppression de l'apparition du cancer, bien que l'héritage de télomères plus courts ne protège probablement pas contre le cancer[10]. Avec des télomères grandement raccourcis, une prolifération cellulaire est possible par inactivation des voies p53 et pRb. Les cellules entrant dans la prolifération après l'inactivation des voies p53 et pRb subissent une « crise ». Cette crise est caractérisée par des réarrangements chromosomiques grossiers et l'instabilité du génome. La quasi-totalité des cellules n’y survivent pas.
Ainsi, dans beaucoup de types cellulaires humains, la réplication de l'ADN et l'expression du gène TERT, codant la télomérase inverse transcriptase, sont réprimés, les télomères de ces cellules se raccourcissent donc progressivement à chaque division : on dit qu'ils constituent des horloges biologiques. Au contraire, dans les tissus à multiplication cellulaire intense, comme les cellules-souches ou les globules blancs du sang, le gène TERT est exprimé et la longueur des télomères reste constante.
Chez l'humain, la séquence répétitive des télomères est TTAGGG pour un brin orienté de l'extrémité 5'P vers l'extrémité 3'OH, sur une longueur de 3 à 20 kilobases. Pour le brin complémentaire, orienté de l'extrémité 3'OH vers 5'P, la séquence sera donc AATCCC. De 100 à 300 kilobases supplémentaires de répétition relient le télomère au reste du chromosome. Ces répétitions varient d'une espèce à l'autre mais comportent beaucoup de bases guanine-cytosine.
Remove ads
Télomérase
Résumé
Contexte
La télomérase est une enzyme naturelle qui favorise l'allongement des télomères. Elle est active dans les cellules souches, les cellules germinales, les follicules pileux, dans 90 % des cellules cancéreuses, mais son expression est faible ou absente dans les cellules somatiques (cellules n'appartenant pas à la lignée germinale c’est-à-dire l'immense majorité des cellules des organismes multicellulaires). La télomérase fonctionne en ajoutant des bases aux extrémités des télomères. Les cellules ayant une activité de télomérase suffisante sont considérées comme immortelles en ce sens qu'elles peuvent se diviser au-delà de la limite de Hayflick sans entrer dans la sénescence ou l'apoptose. Pour cette raison, la télomérase est considérée comme une cible potentielle pour les médicaments anticancéreux[11].
Des études utilisant des souris knock-out ont démontré que des télomères peuvent à la fois limiter la croissance tumorale d’un cancer et favoriser la tumorigénèse, selon le type cellulaire et le contexte génomique[12],[13].
La télomérase est un « complexe ribonucléoprotéique » composé d'un composant protéique et d'une séquence d'amorces d'ARN qui protègent les extrémités terminales des chromosomes contre l’action des enzymes qui sinon les dégraderaient. Les télomères et la télomérase sont nécessaires pour la réplication de l’ADN.
ALT
Dans certaines cellules la longueur des télomères reste constante sans que la télomérase ne soit exprimée, dans ce cas le processus de maintien des télomères implique l'action d'une machinerie cellulaire appelée « ALT » pour « Alternative Lengthening of Telomeres ». Ce système utilise pour ceci la recombinaison homologue.
Remove ads
Télomères et télomérases en médecine
Résumé
Contexte
Télomères et vieillissement
Chez la majorité des eucaryotes multicellulaires, les télomérases ne sont actives que dans les cellules germinales. Le raccourcissement progressif des télomères des cellules somatiques est une cause possible de la sénescence et favoriserait l'apparition de cancer[14].
Quand le télomère devient trop court, il ne joue plus son rôle protecteur : la partie enroulée se déroule. La cellule va interpréter ceci comme une corruption de son ADN, entrer en sénescence et stopper sa croissance. De tels télomères trop raccourcis peuvent aussi provoquer une fusion de deux chromosomes. Comme de telles altérations ne sont pas réparables dans les cellules somatiques ordinaires, elles peuvent provoquer une apoptose.
Plusieurs maladies du vieillissement (dont la progeria, caractérisée par un vieillissement très précoce) sont provoquées par un raccourcissement télomérique excessif. Les organes se détériorent d'autant plus que leurs cellules constitutives meurent ou entrent en sénescence.
Un raccourcissement plus important des télomères serait un marqueur de risque de maladies cardiovasculaires chez les hommes d'âge moyen[15]. Une étude portant sur 143 sujets âgés de plus de 60 ans a montré un risque 3,38 fois plus élevé de mortalité par maladie cardiovasculaire et 8,54 fois par une infection lorsque les télomères sont plus courts[16].
Une activation (ou réactivation) de la télomérase pourrait être le mécanisme d'action de certains composés psychopharmaceutiquement actifs[17].
Facteurs responsables de la diminution de taille des télomères
Une étude danoise portant sur près de 65 000 personnes suivies pendant 7 ans a montré que la réduction de taille des télomères était associée à tous les facteurs suivants : âge, sexe masculin[18], indice de masse corporelle, pression systolique, consommation de tabac et d'alcool, temps d'inactivité physique[19], cholestérol[20], facteurs environnementaux, le stress[21], certaines maladies (exemple : le cancer), etc.
Le sexe : la taille des télomères diminue plus rapidement chez l'homme que chez la femme
Les vitesses de raccourcissement des télomères sont différentes entre les hommes et les femmes. En effet, une étude a démontré que chez un groupe d’hommes et de femmes de 48 ans, il y avait une différence significative de longueur de télomères d’environ 320 pb (l'équivalent à environ 8 à 10 années de différence !). Le raccourcissement des télomères est plus rapide chez les hommes que chez les femmes. La longueur des télomères étant associée à l’âge biologique et au vieillissement, cette différence de vitesse de raccourcissement est le facteur expliquant que l’espérance de vie soit en moyenne plus grande chez les femmes que chez les hommes : les femmes vieillissent un peu plus lentement que les hommes et, par conséquent, vivent 5 à 8 ans de plus en moyenne que les hommes)[18].
Cancer
Les télomères sont essentiels au maintien de l'intégrité génomique. Des études montrent que le dysfonctionnement ou le raccourcissement des télomères est communément acquis au cours du processus de développement des tumeurs cancéreuses[22].
Le cancer
Les télomères courts peuvent conduire à une instabilité génomique, à la perte des chromosomes et à la formation de translocations non réciproques. Il a été observé que les télomères des cellules tumorales et des lésions précurseures des tumeurs sont significativement plus courtes que les télomères des tissus normaux environnants[23],[24]. Une taille réduite des télomères est associée a une plus grande mortalité notamment en cas de cancer[20].
Des études observationnelles ont révélé des télomères raccourcis dans de nombreux cancers : notamment dans le cas des cancers touchant le pancréas, les os, la prostate, la vessie, les poumons, les reins et la tête et le cou. De plus, il a été constaté que les personnes atteintes de nombreux types de cancer avaient des télomères de leucocytes plus courts que les témoins sains[25]. Des méta-analyses récentes suggèrent un risque de cancer de 1,4 à 3,0 fois plus élevé chez les patients ayant les télomères les plus courts que chez les patients ayant les télomères les plus longs[26],[27]. Cependant, l'augmentation de risque varie selon l'âge, le sexe, le type de tumeur et les différences de style de vie (facteurs environnementaux).
Certains facteurs de style de vie associés à un risque accru de développer un cancer ont également été associés à des télomères raccourcis. Parmi ces facteurs on peut citer le stress, le tabagisme, l'inactivité physique et un régime alimentaire riche en sucres raffinés[27]. L'alimentation et l'activité physique influencent l'inflammation et le stress oxydatif. On pense que ces facteurs influent la conservation des télomères[28]. Le stress psychologique est également lié à un vieillissement cellulaire accéléré, notamment une diminution de l'activité télomérase et des télomères courts[29]. Il a été suggéré qu'une combinaison de modifications du mode de vie, y compris une alimentation saine, de l’exercice et une réduction du stress ont le potentiel d'augmenter la longueur des télomères, d’inverser le vieillissement cellulaire et de réduire le risque de maladies liées au vieillissement. Dans un essai clinique récent avec des patients atteints de cancer de la prostate au stade précoce, des changements de style de vie complets ont entraîné une augmentation à court terme de l'activité télomérase et une modification à long terme de la longueur des télomères[30],[31]. Les modifications du mode de vie ont le potentiel de réguler naturellement l'entretien des télomères sans promouvoir la tumorigénèse.
Les cellules cancéreuses développent souvent un mécanisme pour maintenir leur ADN télomérique afin de continuer à se diviser indéfiniment (immortalisation). Ce mécanisme d'élongation ou d'entretien des télomères est l'une des étapes clés de l'immortalisation cellulaire et peut être utilisé comme marqueur lors d’un diagnostic. La télomérase est un complexe enzymatique responsable de l'allongement des télomères par l'addition de séquences de télomères répétées aux extrémités des chromosomes. La télomérase est activée dans environ 80 % des tumeurs[32]. La plupart des cancers produisent de la télomérase, mais souvent à un stade tardif, la cancérogenèse débutant par une érosion importante des télomères[33],[14]. Cependant, une fraction importante de cellules cancéreuses emploie un allongement alternatif des télomères (ALT)[34], une voie non-conservatrice d'allongement des télomères impliquant le transfert des répétitions en tandem des télomères entre les chromatides sœurs[35].
Cancer du sein
Dans un sein féminin en bonne santé, certaines cellules appelées progéniteurs luminales qui bordent les conduits de lait ont un potentiel de prolifération et de différenciation élevé et la plupart d'entre eux présentent des télomères critiquement courts avec des foyers d'endommagement de l'ADN. On pense que ces cellules sont de possibles loci cellulaires où des cancers de la poitrine impliquant un dérèglement des télomères pourraient avoir leur origine[36]. En outre, l'activité de la télomérase est inhabituellement élevée dans ces cellules lorsqu'elles sont isolées chez des femmes jeunes, mais cette activité diminue avec l'âge[37].
Mutations de la télomérase
Ces mutations sont constatées dans certaines maladies. C'est le cas de la dyskératose congénitale associant une anémie centrale (par absence de formation de globules rouges dans la moelle), des anomalies au niveau des muqueuses de la bouche, des ongles et de la peau[38].
Une mutation est également retrouvée dans un peu moins de 10 % des fibroses pulmonaires idiopathiques[39].
Remove ads
Aspects évolutifs
Puisque des télomères plus courts sont considérés par certains comme une cause du vieillissement, cela soulève la question de savoir pourquoi les télomères plus longs n'ont pas été sélectionnés pour profiter de ces effets protecteurs. Une possible explication suggère que l'héritage des télomères plus longs causerait des taux de cancer accrus[40]. De plus, une analyse de la littérature scientifique[10] souligne le fait que la mortalité par cancer est la plus élevée après la période de reproduction et n’est donc que faiblement soumise à la sélection naturelle. Une autre explication de la non sélection des télomères plus longs est que les effets de prolifération cellulaire dues aux télomères plus longs entraîneraient des dépenses énergétiques accrues[10]. Dans les environnements de limitation énergétique, les télomères plus courts pourraient être un mécanisme d'économie d'énergie.
Remove ads
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
