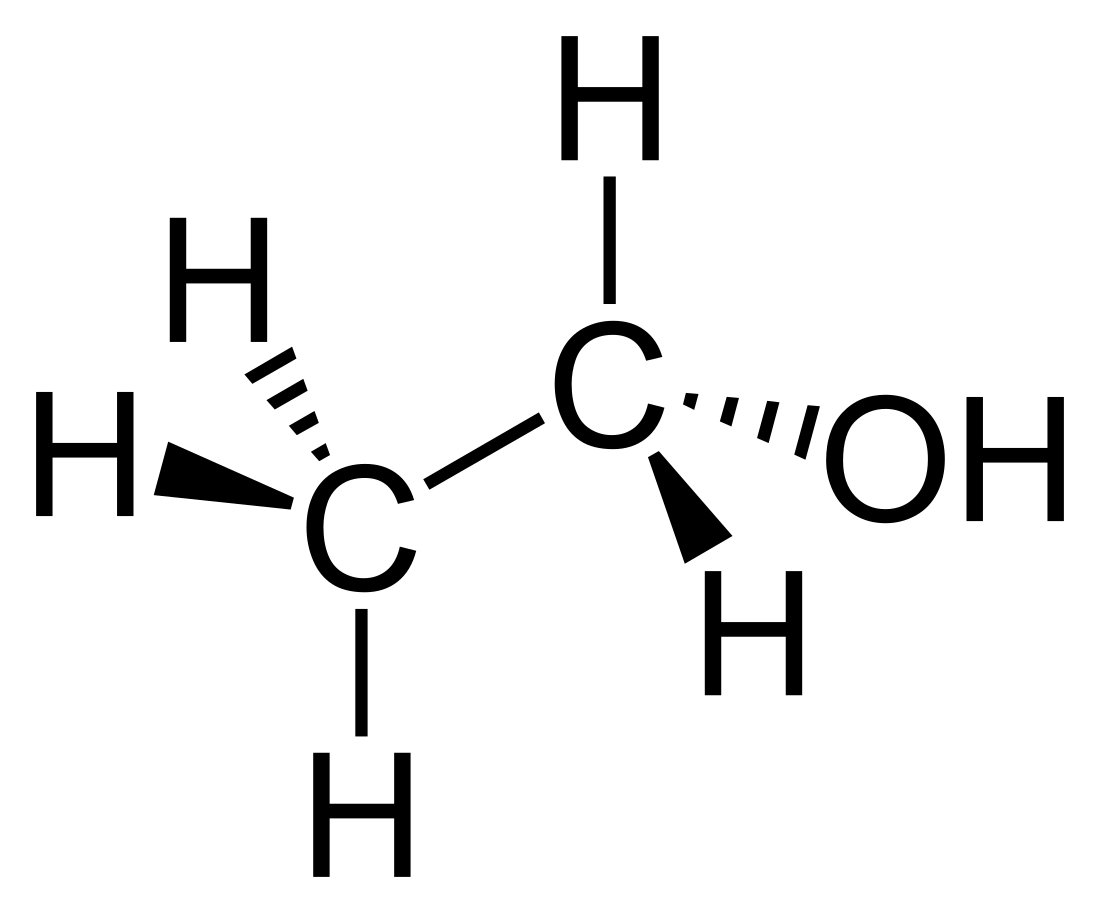
Éthanol
composé chimique, alcool De Wikipédia, l'encyclopédie libre
L’éthanol, aussi appelé alcool éthylique (Écouter) ou alcool, est un alcool de formule semi-développée CH3-CH2-OH. C'est un liquide incolore, volatil, inflammable et miscible à l'eau en toutes proportions. C'est un psychotrope, et l'une des plus anciennes drogues récréatives, sous la forme de boisson alcoolisée. L'éthanol est utilisé par l'industrie agroalimentaire (pour la production de spiritueux notamment), la parfumerie et la pharmacie galénique (comme solvant) ainsi qu'en biocarburant (bioéthanol). Il est en outre utilisé dans les thermomètres à alcool.
| Éthanol | |
  Molécule d'éthanol |
|
| Identification | |
|---|---|
| Nom UICPA | Éthanol |
| Synonymes |
alcool éthylique |
| No CAS | |
| No ECHA | 100.000.526 |
| No CE | 200-578-6 |
| Code ATC | D08, V03, V03 |
| DrugBank | DB00898 |
| PubChem | 702 |
| ChEBI | 16236 |
| No E | E1510 |
| FEMA | 2419 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | C2H6O [Isomères] |
| Masse molaire[2] | 46,068 4 ± 0,002 3 g/mol C 52,14 %, H 13,13 %, O 34,73 %, |
| Moment dipolaire | 1,66 D[3] |
| Diamètre moléculaire | 0,469 nm[4] |
| Propriétés physiques | |
| T° fusion | −114 °C[1] |
| T° ébullition | 79 °C[1] |
| Solubilité | dans l'eau : miscible[1], Complète dans les solvants polaires et apolaires (acétone, éther diéthylique) |
| Paramètre de solubilité δ | 26,0 MPa1/2 (25 °C)[5]; 11,2 cal1/2·cm-3/2[6] |
| Masse volumique | 0,789[7]
|
| T° d'auto-inflammation | 361,4 à 376,2 °C[9],[7] |
| Point d’éclair | coupelle fermée : 13 °C pur 17 °C 95 %vol. 21 °C 70 %vol. 49 °C 10 %vol. 62 °C 5 %vol[7]. |
| Limites d’explosivité dans l’air | Inférieure : 3,3 %vol[1] Supérieure : 19 %vol[1] |
| Pression de vapeur saturante | à 20 °C : 5,8 kPa[1]
|
| Viscosité dynamique | 1,20 × 10−3 Pa s à 20 °C |
| Point critique | 240,85 °C, 6,14 MPa, 0,168 l mol−1[10] |
| Vitesse du son | 1 162 m s−1 à 20 °C[11] |
| Thermochimie | |
| S0liquide, 1 bar | 159,86 J·mol-1·K[12] |
| ΔfH0gaz | −235,3 kJ mol−1 |
| ΔfH0liquide | −277,0 kJ mol−1[13] |
| Cp | 111 J·K-1·mol-1
|
| PCS | 1 366,8 kJ·mol-1[15] (liquide) |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,43 ± 0,05 eV (gaz)[16] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | Pc[17] |
| Paramètres de maille | a = 5,377 Å b = 6,882 Å |
| Volume | 298,57 Å3[17] densité = 0,7893[18] |
| Propriétés optiques | |
| Indice de réfraction | 1,3594[4]. |
| Précautions | |
| SGH[19] | |
| H225, H302, H332, H350, P305+P351+P338, P370+P378 et P403+P235 |
|
| NFPA 704 | |
| Transport | |
| Classification du CIRC | |
| Groupe 1 : Cancérogène pour l'homme[20] | |
| Inhalation | ébriété, nausée, vomissements |
| Peau | aucun effet |
| Yeux | dangereux |
| Ingestion | ébriété, nausée, vomissements, coma éthylique (pouvant entraîner la mort) |
| Écotoxicologie | |
| DL50 | 5 à 20 g kg−1[7] |
| CL50 | 20 000 à 30 000 ppm pendant 4 à 6 heures[7] |
| LogP | -0,32[1] |
| Seuil de l’odorat | bas : 49 ppm haut : 716 ppm[21] |
| Données pharmacocinétiques | |
| Métabolisme | au niveau du foie en éthanal puis acide acétique, à ~100 mg kg−1 par heure[7] |
| Caractère psychotrope | |
| Catégorie | Dépresseur |
| Mode de consommation |
Ingestion |
| Autres dénominations |
Alcool (voir Boisson alcoolisée) |
| Risque de dépendance | Élevé |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
Formule
L'éthanol est un alcool primaire à deux carbones de formule brute C2H6O et de formule semi-développée CH3CH2OH ou CH3-CH2-OH, indiquant que le carbone du groupe méthyle (CH3-) est attaché au groupe méthanediyle (-CH2-) lui-même attaché au groupe hydroxyle (-OH). C'est un isomère de constitution de l'éther méthylique[22]. L’éthanol est usuellement désigné par l’abréviation « EtOH », le groupe éthyle (C2H5-) étant communément abrégé « Et » en chimie organique.
Nom
Éthanol est le nom systématique défini par la nomenclature des composés organiques pour une molécule avec deux atomes de carbone (préfixe éth-) ayant une liaison simple entre eux (suffixe -ane) et attaché à un groupe hydroxyle (suffixe -ol).
Histoire
Résumé
Contexte
La fermentation des sucres en éthanol est l'une des plus anciennes biotechnologies employée par l'humain, notamment dans l'industrie de l'alcool et a été utilisée depuis la Préhistoire pour obtenir des boissons alcoolisées. Des analyses chimiques de composés organiques absorbés dans des jarres datant du Néolithique trouvées dans un village de la province du Henan en Chine, ont révélé que des mélanges de boissons fermentées composés de riz, de miel et de fruits étaient produits dès le VIIe millénaire av. J.-C.[23]
Bien que la distillation soit une technique connue des alchimistes gréco-égyptiens (comme Zosime de Panopolis), les premières traces écrites de production d'alcool à partir du vin ne remontent qu'au XIIe siècle avec les travaux des alchimistes de l'école de médecine de Salerne[24]. La première mention de la distinction entre alcool absolu et mélanges eau-alcool est rapportée elle au XIIIe siècle par Raymond Lulle[24]. Cependant, le savant persan Rhazès aurait isolé l'éthanol dans le courant du Xe siècle[25].

En 1796, Johann Tobias Lowitz obtient de l'éthanol pur en filtrant sur du charbon actif de l'éthanol distillé. Antoine Lavoisier détermine que l'éthanol est composé de carbone, d'oxygène et d'hydrogène, et en 1808, Nicolas Théodore de Saussure détermine sa formule brute[26]. En 1858, Archibald Scott Couper publie la structure chimique de l'éthanol, qui est l'une des premières structures déterminées[27].
L'éthanol est pour la première fois préparé de façon synthétique en 1826 par les travaux indépendants de Georges Serullas en France et de Henry Hennel au Royaume-Uni[28]. En 1828, Michael Faraday synthétise de l'éthanol par l'hydratation en catalyse acide de l'éthylène, une synthèse similaire au procédé industriel utilisé de nos jours.
L'éthanol a aussi été utilisé comme combustible dans les lampes, et comme carburant pour les automobiles jusque dans les années 1930. Par exemple, la Ford T pouvait fonctionner jusqu'en 1908 avec de l'éthanol pur[29],[30].
Présence naturelle
Résumé
Contexte
L'éthanol est un sous-produit volatil du métabolisme des levures. Il est donc présent dans l'habitat de ces organismes et dans notre atmosphère. On le trouve aussi émis par les fruits murs[31], et dans de nombreuses plantes du fait de l'anaérobiose naturelle durant la germination ou quand les plantes manquant d'oxygène (en cas d'inondation par exemple[32]) tirent de l'énergie de la fermentation[33],[34].
Au début des années 2000, son cycle atmosphérique est encore mal compris. On cherche à quantifier l’éthanol émis par les végétaux et levures, ses taux dans l'atmosphère et son taux de conversion via l'hydroxyle de l'air (par titrage du méthylchloroforme). Une première estimation, grossière, donnait un taux d'émission d'éthanol par les végétaux comprise entre de 10 et 38 Tg/an, soit une contribution majeure au total estimé d'éthanol introduit dans l'atmosphère annuellement (entre 25 et 56 Tg/an). Puis de nouveaux travaux ont revu les émissions par les végétaux à la hausse : 70 Tg/an (de 50 à 90Tg/an), 75 % environ de l’éthanol introduit de l'air étant en réalité détruit par réaction avec des radicaux hydroxyles dans l'air sec ou humide. Des dépôts secs et humides sur la terre ferme existent aussi[35].
De l'éthanol a aussi été détecté dans l'espace, recouvrant sous forme solide des grains de poussière dans les nuages interstellaires[36].
Propriétés physico-chimiques
Résumé
Contexte
L'éthanol est un liquide volatil, incolore et qui a une odeur. Sa combustion est sans fumée et donne une flamme bleutée. Les propriétés physico-chimiques de l'éthanol proviennent principalement de la présence du groupe hydroxyle et de la courte chaîne carbonée. Le groupe hydroxyle peut former des liaisons hydrogène, rendant l'éthanol plus visqueux et moins volatil que des solvants organiques de masses moléculaires équivalentes. L'indice de réfraction de l'éthanol est plus élevé que celui de l'eau (1,3594 à 25,0 °C[4]). Le point triple de l'éthanol est observé à −123,15 °C pour une pression de 4,3 × 10−4 Pa.
Propriétés comme solvant
L'éthanol est un solvant polaire protique. Il est miscible avec de nombreux solvants organiques, comme les solvants chlorés (tétrachlorure de carbone, chloroforme, trichloroéthane, tétrachloroéthylène), les hydrocarbures aliphatiques (pentane, hexane), les solvants aromatiques (benzène, toluène, pyridine), l'acide acétique, l'acétone, l'éther diéthylique, l'éthylène glycol ou encore le nitrométhane[37]. Néanmoins la miscibilité de l'éthanol avec les hydrocarbures aliphatiques tend à diminuer avec l'augmentation de la longueur de la chaîne carbonée de l'alcane et la diminution de la température, la limite de miscibilité étant par exemple de 13 °C pour le dodécane[38].
Du fait de la nature polaire du groupe hydroxyle, l'éthanol peut aussi dissoudre des composés ioniques, comme les hydroxydes de sodium et de potassium, les chlorures de magnésium, de calcium et d'ammonium ou encore les bromures d'ammonium et de sodium[37]. Les chlorures de sodium et de potassium ne sont eux que légèrement solubles dans l'éthanol[37].
La partie apolaire de l'éthanol lui permet de dissoudre des substances hydrophobes, et notamment des huiles essentielles et de nombreux composés odorants, colorants et médicinaux[37].
L'éthanol peut être utilisé comme solvant dans de nombreuses réactions chimiques lors de synthèses, comme dans les substitutions nucléophiles SN1, lors des hydrogénations catalytiques, lors des réactions d'aldolisation, lors des réactions de Wittig, lors des réactions de Diels-Alder ou lors de réactions de diazotation[39].
L'éthanol est inerte vis-à-vis de la quasi-totalité des surfaces plastifiées de la vie courante, les vernis (hormis les vernis cellulosiques, et ceux à la gomme laque), les peintures acryliques et glycérophtaliques tout en étant un très bon solvant. Ceci en fait un solvant de nettoyage très utilisé seul ou en mélange avec d'autres composés.
Miscibilité avec l'eau
Les mélanges eau-éthanol occupent un volume inférieur à la somme des volumes des deux composants pris individuellement. Le mélange d'un volume d'eau et d'un volume d'éthanol donne par exemple un volume équivalent de 1,92[40]. La réaction de mélange de l'eau et de l'éthanol est exothermique, et à 24,85 °C jusqu'à 777 J mol−1 peuvent être libérées[41]. Le caractère polaire de l'éthanol le rend hygroscopique, à tel point que, pur, il absorbe l'humidité de l'air.
Un azéotrope se forme avec l'eau à 89,47 %mol d'éthanol et 10,53 %mol d'eau à pression atmosphérique. Le point d'ébullition de l'éthanol est de 78,4 °C et de 100 °C pour l'eau, mais l'azéotrope bout lui à 78,2 °C, ce qui est inférieur aux points d’ébullition de chacun des constituants[42]. Les proportions du mélange azéotropique varient en fonction de la pression[43].
| Pression | Point d'ébullition | Fraction molaire d'éthanol |
|---|---|---|
| 0,1 MPa | 78,35 °C | 0,894 |
| 0,344 MPa | 112,6 °C | 0,882 |
| 0,689 MPa | 135,7 °C | 0,874 |
| 1,378 MPa | 164,2 °C | 0,862 |
| 2,068 MPa | 182,6 °C | 0,852 |
L'ajout de quelques pour cent d'éthanol dans l'eau diminue de façon drastique la tension superficielle de l'eau. Cette propriété permet d'expliquer le phénomène des larmes de vin. Lorsque l'on fait tournoyer le vin dans un verre, l'éthanol s'évapore plus rapidement dans le film mince le long des parois du verre. La proportion d'éthanol diminue, donc la tension de surface augmente et le film se transforme en gouttelettes. Ce phénomène est appelé effet Marangoni, et a été décrit et expliqué en 1855 par James Thomson[44].
Le titre alcoométrique volumique, aussi appelé degré alcoolique, est le rapport entre le volume d'alcool contenu dans le mélange et le volume total de ce mélange à 20 °C. On l'utilise pour déterminer la proportion d'alcool, c'est-à-dire d'éthanol, dans une boisson alcoolisée. L'unité utilisée pour exprimer le titre est la fraction volumique (%vol) ou degré (noté « ° »).
Les mélanges eau-éthanol contenant plus de 50 % d'éthanol sont inflammables à température ambiante, mais en chauffant un mélange contenant moins de 50 % d'éthanol peut s'enflammer. La technique de flambage en cuisine fait appel à cette propriété. L'alcool ajouté dans une poêle chaude se consume en flammes et donne une réaction complexe. La température de l'alcool qui brûle peut alors dépasser les 240 °C et conduit à la caramélisation des sucres présents.
Production
Résumé
Contexte
L'éthanol peut être produit industriellement à partir de la pétrochimie par hydratation de l'éthylène, et par fermentation alcoolique de levures ou de cellulose[45]. Le procédé le plus économique dépend principalement du marché pétrolier.
Catalyse directe
Ce procédé développé dans les années 1970 a complètement supplanté les autres méthodes de production. L'éthanol ainsi produit est utilisé par l'industrie comme matière première ou comme solvant. Il est produit grâce à la pétrochimie, en utilisant l'hydratation par catalyse acide de l'éthylène, suivant la réaction : H2C=CH2 + H2O ↔ CH3CH2OH
Le catalyseur le plus communément utilisé est l'acide phosphorique, adsorbé sur un support poreux comme un gel de silice ou de la célite[40]. Une augmentation de la pression aide à déplacer l'équilibre vers la production d'éthanol, suivant le principe de Le Chatelier, et il est donc pertinent d'utiliser un catalyseur sous haute pression de vapeur d'eau pour approcher l'équilibre rapidement. Le produit final est un mélange eau-éthanol contenant entre 10 %m et 25 %m d'éthanol.
Catalyse indirecte
Un procédé plus ancien, mais aujourd'hui obsolète, est développé dans les années 1930 par Union Carbide, et sera utilisé durant une grande partie du XXe siècle[40]. L'éthylène est estérifié par l'acide sulfurique pour produire du sulfate d'éthyle, qui est ensuite hydrolysé pour donner de l'éthanol et de l'acide sulfurique, qui sert donc de catalyseur lors de cette réaction :
H2C=CH2 + H2SO4 → CH3CH2SO4H
CH3CH2SO4H + H2O → CH3CH2OH + H2SO4
Ce procédé consomme de grandes quantités d'acide sulfurique et nécessite en entrée un mélange gazeux de bonne qualité.
Fermentation
L'éthanol utilisé dans les boissons alcoolisées est produit par la fermentation alcoolique. De même, la majeure partie du bioéthanol provient du traitement par fermentation de plantes sucrières, comme la betterave et la canne à sucre, ou de céréales, comme le maïs et le blé. Certain types de levures, comme Saccharomyces cerevisiae, métabolisent les sucres en éthanol et dioxyde de carbone, suivant ces réactions :
C6H12O6 → 2 CH3CH2OH + 2 CO2
C12H22O11 + H2O→ 4 CH3CH2OH + 4 CO2
La fermentation est le processus de culture de levures dans des conditions favorables pour produire de l'alcool, à une température d'environ 35 à 40 °C. Les souches de levures les plus résistantes peuvent survivre à une concentration d'environ 15 %vol d'éthanol[46]. La toxicité de l'éthanol pour la levure limite la concentration d'alcool qui peut être obtenue par brassage, et des concentrations plus élevées peuvent être obtenues par mutage ou distillation. Lors de la fermentation, des produits secondaires sont formés, comme du glycérol, de l'acide succinique, de l'acide acétique et de l'alcool amylique.
Pour produire de l'éthanol à partir d'amidon, provenant par exemple de graines de céréales, celui-ci doit tout d'abord être transformé en sucres. Lors du brassage de la bière, on laisse une graine germer (le maltage), ce qui permet la production de certaines enzymes, comme les cytases, les amylases, les phosphatases ou les peptidases, nécessaires à la saccharification de l'amidon. Pour le bioéthanol, ce processus peut être accéléré en utilisant de l'acide sulfurique ou en utilisant une amylase produite à partir de champignons[47].
Éthanol cellulosique
La fermentation alcoolique peut aussi être obtenue à partir de la cellulose[48],[49], mais jusqu'à récemment le coût de la cellulase, une enzyme capable de décomposer la cellulose, n'a pas permis à la filière de se développer industriellement. En 2004, la compagnie canadienne Iogen Corporation a construit la première usine basée sur la production d'éthanol à partir de cellulose[50]. Le développement de cette technologie pourrait permettre d'utiliser et de recycler de nombreux déchets végétaux provenant de l'agriculture contenant de la cellulose, comme la sciure de bois ou la paille. D'autres entreprises de biotechnologie développent actuellement des champignons capables de produire de larges quantités de cellulase et de xylanase afin de permettre de convertir d'autres résidus agricoles en cellulose, comme les déchets de maïs ou la bagasse de la canne à sucre[51].
Purification
Les différents procédés de production de l'éthanol produisent des mélanges eau-éthanol. Pour une utilisation dans l'industrie ou comme carburant, l'éthanol doit être purifié[40]. La distillation fractionnée permet de concentrer l'éthanol jusqu'à 95,6 %vol (89,5 %mol) et forme un mélange azéotropique avec l'eau dont le point d'ébullition est de 78,2 °C. Les méthodes usuelles pour obtenir de l'éthanol absolu incluent l'utilisation de desséchants, tels que l'amidon, le glycérol ou les zéolithes, la distillation azéotropique et la distillation extractive.
Qualités de l'éthanol
Différentes qualités d'éthanol sont disponibles pour différents emplois :
- l'alcool dénaturé est généralement de l'éthanol auquel est ajouté un dénaturant pour rendre le mélange impropre à la consommation alimentaire. Les dénaturants utilisés peuvent être l'alcool isopropylique, le méthanol, le phtalate de diéthyle, le thiophène, le diéthyléther ou encore des condensats de gaz naturels. Il est utilisé pour l'entretien ménager, le nettoyage, la désinfection et dans les réchauds à alcool. Solvant de l'ébéniste pour ses vernis à la gomme laque, il est aussi un dégraissant dans l'industrie, apprécié pour sa basse toxicité sur la peau. Généralement à 95 %vol ;
- l'alcool à brûler est un mélange composé d'éthanol et de méthanol. L'alcool à brûler est hautement toxique du fait de la présence de méthanol (en général 5 à 10 %vol). Il est utilisé pour nettoyer les vitres et les surfaces plastiques ;
- l'alcool rectifié est un distillat titrant au maximum à 96 % en volume d'éthanol grâce au procédé de distillation fractionnée. La concentration maximale qui puisse être obtenue par distillation d'alcool brut est de 96 % vol du fait de la formation d'un azéotrope eau-éthanol. Il est utilisé dans l'industrie agroalimentaire, notamment pour la réalisation de boissons spiritueuses, mais également dans le secteur médical et l'industrie pharmaceutique ainsi que pour l'entretien ménager, le nettoyage, la désinfection ;
- l'éthanol absolu est de l'éthanol contenant au maximum 1 % d'eau mais la plupart des grands fournisseurs en chimie vendent sous le terme éthanol absolu de l'éthanol à 99,8 %. Il est employé comme solvant pour des applications dans les laboratoires et dans l'industrie, et comme combustible ;
- l'éthanol anhydre est de l'éthanol dont l'eau a été éliminée autant que possible. Par exemple, la réaction d'éthanol absolu avec du magnésium métallique suivie d'une distillation à pression atmosphérique produit de l'éthanol à 50 ppm d'eau (0,005 % d'eau en masse soit 1/20 000). Cette qualité d'éthanol permet de l'utiliser dans des réactions sensibles à l'humidité.
Réactivité et réactions
Résumé
Contexte
L'éthanol est un alcool primaire et un acide faible (pKa = 15,5[52]) dont la base conjuguée est l'éthanolate. C'est aussi un bon nucléophile, du fait de la réactivité des doublets non liants de l'oxygène. Sa réactivité, principalement due à la présence du groupe hydroxyle, peut impliquer des réactions de déshydratation, de déshydrogénation, d'oxydation et d'estérification.
Chimie acido-basique
L'éthanol est une molécule neutre, et le pH d'une solution d'éthanol dans l'eau est de 7,00. L'éthanol peut être converti quantitativement en sa base conjuguée, l'ion éthanolate, en le faisant réagir avec un métal alcalin, comme le sodium : 2 CH3CH2OH + 2 Na → 2 CH3CH2ONa + H2
ou avec une base forte, comme l'hydrure de sodium : CH3CH2OH + NaH → CH3CH2ONa + H2
Estérification
L'éthanol réagit avec les acides carboxyliques en présence d'un acide fort (catalyse) pour donner des esters éthyliques et de l'eau selon la réaction suivante : RCOOH + CH3CH2OH → RCOOCH2CH3 + H2O
Cette réaction est réversible et l'équilibre est atteint lentement, nécessitant l'utilisation de catalyseurs acides, comme l'acide sulfurique, l'acide chlorhydrique, le trifluorure de bore ou l'acide paratoluènesulfonique[53]. Pour atteindre des rendements corrects, cette réaction, qui est utilisée dans l'industrie à grande échelle, nécessite l'élimination de l'eau du mélange réactionnel au fur et à mesure qu'elle se forme. L'éthanol peut aussi former des esters avec les acides inorganiques, et permet de préparer des composés très utilisés en synthèse organique, comme le sulfate de diéthyle (C2H5)2SO4 ou le triéthylphosphate (C2H5)3PO4[40]. Le nitrite d'éthyle CH3CH2O-N=O peut de même être préparé à partir d'éthanol et de nitrite de sodium, et a été couramment utilisé comme diurétique ou de remède contre la grippe ou le rhume, avant d'être retiré du marché au début des années 1980[54].
La réaction de saponification, qui permet de reformer de l'éthanol à partir d'esters éthyliques en présence d'un acide ou d'une base pour donner un carboxylate, est utilisée pour la préparation des savons[55].
Déshydratation
L'utilisation d'acides forts peut permettre de déshydrater l'éthanol pour former de l'éther diéthylique[40], et plusieurs tonnes d'éther diéthylique sont produites chaque année en utilisant de l'acide sulfurique comme catalyseur. La réaction peut être décrite comme suit : 2 CH3CH2OH → CH3CH2OCH2CH3 + H2O (à 120 °C)
L'éthylène est le produit majoritaire lorsque la température excède 160 °C : CH3CH2OH → H2C=CH2 + H2O
Combustion

La combustion de l'éthanol est sans fumée et donne une flamme bleutée. La réaction de combustion forme du dioxyde de carbone et de la vapeur d'eau : CH3CH2OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g)
Le pouvoir calorifique (ΔcH°) de la combustion de l'éthanol est de 1 366,8 kJ mol−1 à 25 °C[56], et la capacité thermique massique (Cv) est de 2,438 kJ kg−1 K−1[57].
Oxydation
L'oxydation (ou déshydrogénation) de l'éthanol en présence de catalyseurs permet d'obtenir de l'éthanal (ou acétaldéhyde), suivant la réaction suivante[40] : CH3CH2OH → CH3CHO + H2
Dans les hépatocytes du foie, l'enzyme alcool déshydrogénase convertit de même l'éthanol en éthanal. L'éthanal est plus toxique que l'éthanol, et pourrait être responsable de nombreux symptômes de la gueule de bois, même s'il n'est pas présent dans le sang pendant les symptômes[58]. Dans le cerveau, l'alcool déshydrogénase a un rôle mineur lors de la conversion de l'éthanol en éthanal, et c'est l'enzyme catalase qui catalyse principalement cette réaction[59].
Les dernières étapes de la fermentation alcoolique impliquent la conversion du pyruvate en éthanal par l'enzyme pyruvate décarboxylase, suivie de la réduction (ou hydrogénation) de l'éthanal en éthanol par l'enzyme alcool déshydrogénase, catalysant dans ce cas la réaction opposée. En tant que métabolite endogène l'éthanal est toxique et c'est un cancérigène suspecté[60]. Il endommage les cellules souches hématopoïétiques (chargées de constamment renouveler le sang) ; d'une part il est source de cassures de l'ADN double-brin de ces cellules (ce qui favorise leur déclin et crée des réarrangements chromosomiques), et d'autre part il empêche la bonne réparation (p. 53) de ces dommages, ce qui provoque des malignités[61].
Halogénation
L'éthanol réagit avec les acides halogénohydriques pour produire des halogénoalcanes, comme le chloroéthane et le bromoéthane, via une réaction SN2 : CH3CH2OH + HCl → CH3CH2Cl + H2O
Cette réaction nécessite l'emploi d'un catalyseur, comme le chlorure de zinc. Les halogénoalcanes peuvent aussi être synthétisés en utilisant des agents halogénants, comme le chlorure de thionyle ou le tribromure de phosphore : CH3CH2OH + SOCl2 → CH3CH2Cl + SO2 + HCl
Réaction haloforme
La réaction haloforme est une réaction chimique consistant à synthétiser un trihalogénométhane, comme le chloroforme (CHCl3), le bromoforme (CHBr3) ou l'iodoforme (CHI3), et est l'une des plus vieilles réaction organique décrite en tant que telle[62]. En 1822, Georges Serullas rapporte la réaction de l'éthanol avec du diiode et de l'hydroxyde de sodium dans l'eau, formant du formiate de soude et de l'iodoforme, appelé alors « hydroïodide de carbone »[63].
L'éthanol réagit avec l'hypochlorite de sodium pour donner le chloroforme, suivant la synthèse suivante[40] :
CH3CH2OH + NaClO → CH3CHO + NaCl + H2O
CH3CHO + 3 NaOCl → CCl3CHO + 3 NaOH
CCl3CHO + NaOH → CHCl3 + HCO2Na
De même, le bromoforme, et l'iodoforme sont obtenus respectivement à partir d'hypobromite de sodium et d'hypoiodite de sodium. L'éthanol est le seul alcool primaire qui permet cette réaction.
Utilisation
Résumé
Contexte
Carburant
L'éthanol produit dans le monde est principalement utilisé comme carburant[40]. La quantité d'éthanol peut varier de quelques pour cent dans l'essence en Europe de l'Ouest à 95 %vol dans l'essence au Brésil, où 90 % des nouveaux véhicules utilisent la technique Flex fuel et peuvent rouler avec ce mélange. Plus de 66 % de l'éthanol utilisé comme carburant provient de la fermentation alcoolique.
Le carburant E85 distribué en France contient entre 65 % et 85 % de bioéthanol, le reste étant de l'essence ; le taux varie entre 65 % et 75 % en hiver, et atteint 85 % en été[64].
Associé à l'eau, il était le carburant de bon nombre d'avions (moteurs à combustion interne) et fusées pendant la Deuxième Guerre mondiale, pour les pays disposant de peu de ressources pétrolifères.
En France, 1 % des terres sont consacrées au bioéthanol. Sur les dix-huit millions d'hectolitres produits en France annuellement, douze millions sont utilisés pour fabriquer du biocarburant dont 30 % sont commercialisés hors de France. Sur les huit millions d’hectolitres de bioéthanol destinés au biocarburant en France, un million (soit 12 %) est utilisé dans le carburant E85. Une faible quantité d'éthanol est également utilisée pour fabriquer du ED95 (95 % de bioéthanol et 5 % d'additif pro-cétane) pour poids lourds (y compris autobus et autocars) spécifiquement motorisés[64].
Boissons alcoolisées
La contenance en éthanol (ou degré d'alcool) des boissons alcoolisées varie avec le mode de production et la matière première. La plupart des boissons alcoolisées peuvent être classées entre boissons fermentées et boissons spiritueuses. Les boissons fermentées principales sont les bières, produites à partir de céréales ou d'autres plantes produisant de l'amidon, les vins et les cidres, produits à partir de jus de fruits, et l'hydromel, produit à partir de miel. Les boissons spiritueuses sont produites par distillation de boissons fermentées. On peut distinguer différents types de boissons spiritueuses, comme le whisky, distillés à partir de graines de céréale fermentée, les eaux-de-vie, distillées à partir de fruits fermentés, ou le rhum, distillé à partir de mélasse ou de jus de canne à sucre. De nombreux spiritueux sont aussi préparés par macération et/ou infusion de fruits, d'herbes et d'épices dans un alcool de base (eau-de-vie ou alcool rectifié), comme les liqueurs ou le gin.
D'autres méthodes peuvent être employées afin d'augmenter le degré d'alcool, comme la solidification fractionnée, qui est utilisée pour la préparation de l'applejack à partir de jus de pomme. Le vin muté est lui préparé en ajoutant de l'eau-de-vie ou d'autres boissons spiritueuses à du vin partiellement fermenté, ce procédé tuant les levures tout en conservant une partie des sucres.
Les boissons alcoolisées sont utilisées en cuisine pour leurs parfums et du fait que l'alcool dissout les composés odorants hydrophobes. On utilise aussi l'éthanol de ces boissons pour produire du vinaigre, de la même manière que l'éthanol industriel est utilisé pour la production d'acide acétique.
Matière première
L'éthanol est un intermédiaire de synthèse important dans l'industrie chimique. Il est notamment utilisé lors de la préparation des halogénures d'éthyle, des esters éthyliques, des amines éthyliques, du diéthyléther, de l'acide acétique, et dans une moindre mesure du butadiène[40].
Antiseptique
L'éthanol est utilisé dans le domaine médical dans les compresses comme antiseptique. Il est aussi employé dans les solutions hydroalcooliques à une concentration d'environ 60 %vol. L'éthanol tue les organismes en dénaturant leurs protéines et en dissolvant leurs lipides. Il est efficace contre la plupart des bactéries et champignons, de nombreux virus, mais est inefficace contre les spores[65].
Solvant
L'éthanol est miscible avec l'eau, et est un bon solvant. On peut le trouver dans les peintures, les teintes industrielles, les vernis traditionnels, les alcoolatures, les marqueurs, et dans les produits cosmétiques comme les parfums et les déodorants.
Utilisation médicale
L'éthanol absolu est parfois injecté dans des tumeurs afin de provoquer leur nécrose. Il n'a toutefois pas une activité ciblée puisqu'il provoque indifféremment la nécrose des tissus sains et des tissus cancéreux.
L'éthanol est aussi utilisé pour traiter les intoxications au méthanol ou à l'éthylène glycol. Dans ces cas, l'éthanol entre en compétition avec les autres alcools pour être métabolisé par l'enzyme alcool déshydrogénase, diminuant ainsi les dérivés toxiques qui résultent de leur métabolisation en aldéhydes et acides carboxyliques[66], et réduit les effets toxiques dus à la cristallisation de l'oxalate de calcium (issu de éthylène glycol) dans les reins.
Utilisations historiques
Avant le développement des médecines modernes, l'éthanol était utilisé pour différents usages médicaux, et il était notamment employé pour le traitement de la dépression et comme anesthésique. Il est aussi connu comme pouvant servir de sérum de vérité[67].
Comme carburant, il a été utilisé dans les moteurs de fusée combiné à de l'oxygène liquide. Durant la Seconde Guerre mondiale, le missile « V2 » allemand utilisait de l'éthanol mélangé à 25 %vol d'eau pour diminuer la température de la chambre de combustion[68],[69]. Le missile balistique « PGM-11 Redstone » américain, inspiré par la conception du V2 allemand, utilisait lui aussi de l'éthanol mélangé à de l'oxygène liquide[70]. Les carburants à base d'alcool pour les fusées et les missiles sont par la suite tombés en désuétude alors que de nouveaux carburants étaient développés[69].
Pharmacologie
Les deux voies principales du métabolisme de l'éthanol dans le foie sont l'alcool déshydrogénase et le système d'oxydation de l'éthanol microsomal (en)[71]. À de faibles concentrations d'éthanol, l'alcool déshydrogénase oxyde l'éthanol en acétaldéhyde, mais à de plus fortes concentrations, ou lors de prises répétées d'éthanol, c'est le système d'oxydation de l'éthanol microsomal qui prédomine.
Dans la pharmacopée européenne, « éthanol » désigne l’éthanol anhydre, c'est-à-dire pur à 100 %[72], en opposition à l'éthanol à 95 %vol ou 70 %vol que l'on peut trouver en pharmacie. À cela, s'ajoute la qualité « alcool Ph. Eur. » (pour Pharmacopée européenne), qui désigne une qualité d'éthanol dont on a quantifié de nombreuses traces et impuretés.
Propriétés physiologiques
Résumé
Contexte
La prise de boissons alcoolisées entraine différents effets, l'alcoolisme étant la consommation excessive de boissons contenant de l'éthanol qui entraîne une dépendance, ce qui classe l'éthanol parmi les drogues. Celle-ci serait la plus nocive des drogues pour les sociétés[73].
| Alcoolémie (g·l–1) | Alcoolémie (%vol) | Symptômes |
|---|---|---|
| 0,5 | 0,05 | Euphorie, relaxation |
| 1,0 | 0,1 | Dépression, nausées, vomissements, diminution des capacités sensorielles et des fonctions de motricité, ralentissement de la cognition |
| > 1,4 | > 0,14 | Diminution du flux de sang vers le cerveau |
| 3,0 | 0,3 | Perte de connaissance |
| 4,0 | 0,4 | Mort possible |
| 5,5 | 0,55 | Mort |
Alcoolémie
L'alcoolémie est la quantité d'éthanol dans le sang ; elle est généralement exprimée en grammes par litre de sang. Un taux d'alcool dans le sang dépassant 4,0 g L−1 peut entraîner la mort, et le taux devient létal au-dessus de 5,5 g L−1[74]. Des faibles doses d'éthanol, en dessous de 0,5 g L−1, provoquent un sentiment d'euphorie, les personnes devenant plus loquaces, moins inhibées, et montrant une capacité d'analyse diminuée. À plus hautes doses, au-dessus de 1,0 g L−1, l'éthanol agit comme dépresseur sur le système nerveux central, les symptômes impliquant un ralentissement de la cognition, une diminution des capacités sensorielles et des fonctions de motricité, perte de la conscience, jusqu'à la mort.
Effets sur le système nerveux central
L'éthanol est un dépresseur du système nerveux central, et il est considéré comme une drogue psychotrope. Il agit sur le système nerveux central en interagissant principalement avec les récepteurs GABAA, augmentant l'effet d'inhibiteur du neurotransmetteur acide γ-aminobutyrique (ou GABA). Le GABA est un ralentisseur de l'activité des neurones (à l'opposé du glutamate qui est lui un accélérateur de l'information) ; ainsi, en se fixant sur les récepteurs du GABA, l'éthanol exagère le ralentissement du cerveau. Il agit donc comme un modulateur allostérique positif[75]. L'éthanol agit aussi sur les récepteurs de la sérotonine, du glutamate, de l'acétylcholine et de la dopamine. Ses effets négatifs peuvent être exacerbés par le plomb qui renforce le stress oxydatif. Le plomb potentialise l'effet de l'alcool sur le système nerveux central (SNC)[76].
Une consommation prolongée d'éthanol peut ainsi provoquer des lésions permanentes au cerveau et aux autres organes. Le sevrage alcoolique peut provoquer divers symptômes, comme le trouble du déficit de l'attention, une augmentation de la transpiration, de la tachycardie, des trémulations (tremblement des extrémités), parfois des nausées ou des vomissements, une déshydratation, des malaises, de l'hypertension artérielle. Parfois il s'accompagne d'une crise d'épilepsie, d'hallucinations visuelles, tactiles ou auditives, c'est le delirium tremens dans sa forme la plus sévère. Éventuellement, et dans de rares cas, des douleurs du niveau de la mâchoire jusqu'au crâne peuvent apparaître. Il a aussi été mis en évidence que l'éthanol entrainait des modifications visibles à l’œil nu de la taille de la matière grise[77],[78].
Effets sur le métabolisme
En tant que tel, l'éthanol est un nutriment. Dans le corps humain, il est métabolisé en acétaldéhyde par l'enzyme alcool déshydrogénase. L'acétaldéhyde est par la suite converti par l'acétaldéhyde déshydrogénase en acétyl-coenzyme A, qui est le produit final des métabolismes des glucides et des lipides. Cependant, l'acétaldéhyde est en lui-même bien plus toxique que l'éthanol[79], et est en partie responsable de la plupart des effets cliniques dus à l'alcool, comme la gueule de bois. Il a été notamment démontré qu'il augmente le risque de cirrhose du foie et est lié à de nombreuses formes de cancer.
Effets à long terme
L'éthanol est classé comme agent tératogène, et peut induire le syndrome d’alcoolisation fœtale, qui est une intoxication alcoolique de l'embryon ou du fœtus due à la consommation d'alcool par la mère pendant la grossesse, et qui perturbe le développement des organes.
La consommation régulière d'alcool est aussi un facteur contribuant à l'augmentation dans le sang des triglycérides qui favorise l'apparition de maladies cardiovasculaires.
L'éthanol dans les boissons alcoolisées est considéré comme cancérigène certain et fait donc partie des cancérogènes du groupe 1 du CIRC.
Interactions médicamenteuses
L'éthanol peut augmenter le phénomène de sédation causé par les médicaments dépresseurs agissant sur le système nerveux central, comme les barbituriques, les benzodiazépines, les opioïdes, les phénothiazines et les antidépresseurs[74].
Adaptation biologique
De nombreux animaux consomment naturellement de faibles concentrations d'éthanol malgré sa toxicité inhérente. Pourtant, même les espèces bien adaptées à la consommation d'éthanol subissent des effets néfastes lorsqu'elles sont exposées à des concentrations supérieures à 4 %. Sous l’effet de la sélection naturelle, le Frelon oriental peut consommer des quantités extrêmement élevées de fortes concentrations d'alcool sans subir d'effets néfastes sur sa durée de vie ou son comportement. Cette remarquable tolérance à l'éthanol résulte de son taux élevé de métabolisme de l'éthanol, probablement rendu possible par ses multiples copies du gène de l'alcool déshydrogénase[80].
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.