典型的現代羥醛加成反應如上圖所示,即酮的烯醇負離子對醛的親核加成。反應後,羥醛產物在一定條件下可以失一分子水形成α,β-不飽和羰基化合物,這時的羥醛反應及脫水過程可稱「羥醛縮合反應」。在羥醛反應中可以參與反應的親核試劑有:烯醇、烯醇負離子、酮的烯醇醚、醛和其他羰化物。與之反應的親電試劑通常是醛或酮(包括許多反應變種,如曼尼希反應)。若親核試劑和親電試劑不同,反應稱「交叉羥醛反應」;若親核試劑和親電試劑相同則稱「羥醛二聚反應」。

發現與發展歷程
羥醛反應首先由法國化學家查爾斯-阿道夫·武爾茨[8]和俄國化學家亞歷山大·波菲里耶維奇·鮑羅丁[9][10]於1872年分別獨立發現,最初以氫氧化鈉為乙醛加成反應之條件,產物是有羥基的醛化物,羥醛即由此得名。由於羥醛反應的產物控制方法學還未出現,交叉羥醛反應總會產生大量無任何合成價值的副產物,除了利用簡單醛酮分子的羥醛縮合反應可用於合成共軛不飽和醛酮之外,該反應在發現後的近一個世紀內一直沒有廣泛用處[11]。
羥醛反應第一件具里程碑意義的事件出現於1957年,當時美國西北大學的H.E.齊默曼(Zimmerman)和M.D.特拉克斯勒(Traxler)為解釋格氏試劑介導的伊萬諾夫反應中反式產物占優勢的問題,提出了著名的六元環過渡態模型,後人常稱之齊默曼-特拉克斯勒模型。[12]該模型首次從立體化學角度剖析羥醛反應,指出烯醇鹽構型與產物立體化學之間的對應關係,成為羥醛反應歷史上的第一個理論突破並在很長一段時間內成為後續研究的關鍵指導理論。以後眾多的實驗結果也證明這模型的準確度,依據模型設計的實驗大多得到模型預期的立體化學結果[13]。
二十世紀六十年代,核磁共振和X單晶衍射技術大力推動了立體化學的發展[14],也為羥醛反應研究帶來了極大便利。通過氫譜中獲得的大量積分、化學位移、偶合常數等數據,可方便快捷地分析鑑定產物的立體化學結構;X單晶衍射可以通過晶體衍射來分析化合物的絕對構型,而在此背景下羥醛反應的研究也開始逐步升溫[15][16][17]。
1973年日本北里大學教授向山光昭發現了用硅醚形態穩定烯醇以促成羥醛反應的新方法[18][19],該發現為羥醛反應研究揭開新一頁。向山羥醛反應通過預先製備烯醇硅醚與醛酮混合後在路易斯酸催化下反應得到羥醛產物。由於產物的立體化學與烯醇硅醚的構型之對應關係不再符合齊默曼-特拉克斯勒模型,因此提出向山開鏈過渡態理論以解釋相關反應結果。通過路易斯酸在向山羥醛反應中的研究,羥醛反應立體化學控制技術得以發展,並成為該羥醛反應立體化學三大控制方向之一[20][21]。
二十世紀六十年代到八十年代是有機化學發展史上的重要時期,出現了眾多不對稱合成技術和著名的有機化學家,如:野依良治,巴里·夏普萊斯和威廉·斯坦迪什·諾爾斯。羥醛反應立體控制技術同樣在這段期間發生了重大的突破[22]。1981年哈佛大學教授大衛·埃文斯[23][24]發明了手性噁唑烷酮配體介導的不對稱羥醛反應技術,第一次實現高對映選擇率的不對稱羥醛反應。此外日本的向山光昭、克里明斯等都在這段時間在羥醛反應立體控制技術有重大貢獻。
近年來,化學家對於羥醛反應的研究集中在催化劑的發現領域[25]。許多更新穎的催化劑出現,包括酶類與抗體型催化劑[26]:pp. 273–310[27][28][29][30][31][32][33]、手性金屬絡合物催化劑[34],以及眾多小分子催化劑[35][36]。
有機合成中的地位和意義
羥醛結構單元存在於許多分子(包括天然產物和合成分子)中[37][38][39]。例如,通過羥醛反應大規模合成的日用化學品季戊四醇[40]及心臟病藥物阿托伐他汀[41][42][43]。羥醛反應之所以應用廣泛,是因為它將兩粒相對簡單的分子結合成一粒較複雜的分子,且通過形成兩粒新的手性中心(於羥醛產物的α-碳原子上,在下述分子式當中標註)使分子更複雜。現代化學方法學不僅可以做到高收率的羥醛反應,而且能夠控制反應產物的相對和絕對立體化學構型(見下文立體選擇性一節)。選擇性合成特定的手性異構體對於現代藥物化學非常重要,因為不同的手性異構體可能有完全不同的臨床藥理學特性[44]。
手性羥醛單元在聚酮化合物中較常見,聚酮是在生物有機體發現的分子。在大自然,酶催化聚酮發生多重克萊森縮合反應。這些反應產生的1,3-二羰基化合物可衍生出各式各樣有趣的結構,其中一些有強效生物活性,如強效免疫抑制劑他克莫司[45][46]、抗癌藥物盤皮海綿內酯[47][48]及抗真菌藥物兩性黴素B[49][50]。不對稱羥醛反應在合成方法學的應用,使許多傳統的天然產物分子合成成為可能,且在許多合成中成為關鍵步驟,如合成littoralisone[51],福司曲星[52][53]及callipeltoside[54][55]。
反應機理
羥醛反應的具體機理還不確定,但現今廣泛認可的機理有兩種[56][57][58][59]:羰化物如醛或酮可轉化為烯醇或烯醇醚。它們的α-碳原子都親核,可以進攻活潑的質子羰化物,如質子化醛,稱「烯醇機理」[60][61]。
羰化物或碳原子有活潑氫的有機物,可於羰基α位去質子形成烯醇負離子,而該離子形態比烯醇和烯醇醚更親核,可直接進攻親電試劑。常見的親電試劑為醛類化合物,而酮活性較低,這類反應機理稱「烯醇負離子機理」[62][63][64]。
若反應條件特別劇烈,如:甲醇鈉作鹼,甲醇為溶劑的回流條件下,則會發生縮合反應;為了避免這種情況可以降低溫度並使用溫和鹼如二異丙基氨基鋰,並使用四氫呋喃為溶劑,在−78 °C反應。雖然羥醛加成反應通常能完全反應,卻並非不可逆。用強鹼處理羥醛加成產物,可逆向裂解羥醛而得到起始原料。羥醛縮合通常認為不可逆,但交叉羥醛反應動力學研究表明其實際可逆[65]。
在酸催化條件下,反應機理的首步是酸催化羰基異構成烯醇,並加質子啟動另一分子羰基,使其高度親電。烯醇的α碳原子親核,能進攻質子化羰化物,而後脫質子形成羥醛。羥醛產物最後通常還會繼續脫水得到不飽和羰化物[66]。以下展示典型酸催化醛自身縮合反應[67]:
若催化劑是溫和的鹼,如氫氧根離子或醇負離子,則羥醛反應可通過形成共振穩定的烯醇負離子而親核進攻另一分子羰化物,形成羥醛產物醇鹽,而後自身脫水得到不飽和羰化物[68]。反應式展示了鹼催化醛自身羥醛反應的機理[67]:
圖例使用−OCH3做鹼
此反應通常錯寫為簡單一步,見E1cB消除反應
某些情況下反應僅需要催化量的鹼,但大多數反應都需要等當量的強鹼介導反應,如二異丙基氨基鋰(LDA)或二(三甲基硅基)氨基鈉(NaHMDS)。這情況下烯醇負離子的形成是不可逆的,直到羥醛產物的金屬醇鹽在酸化處理後質子化,羥醛產物才得以形成。[69]
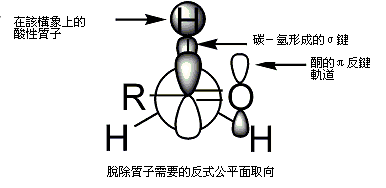
有機反應過渡態是控制反應的關鍵要素之一。羥醛反應的第一個過渡態模型是1957年由霍華德·齊默曼和馬喬里·特拉克斯勒提出的六元環過渡態模型[12],即如下圖所示齊默曼-特拉克斯勒模型,M是由鹼帶入的金屬離子。運用建立在環己烷上的構象分析理論可以看出,醛分子在受烯醇進攻時的構象形態主要是使羰基兩側較大的取代基處於六元環平伏鍵的位置,因為可以使各官能團之間空間位阻最小,過渡態的能量也最小,而導致優先形成相應立體構型的產物。[70]
從圖中同樣可以看出,α-碳上的立體構型由烯醇鹽的構型決定。Z型烯醇主要生成順式羥醛,而E型烯醇生成以反式羥醛為主的產物。值得注意的是,上面的順反構型是相對構型,因為存在兩種順式產物和兩種反式產物。換言之,上面每個產物對應兩種可能的絕對構型。[71]
交叉羥醛反應的反應物控制
羥醛反應的一個主要研究方向是如何「控制」反應產物,如以下假定反應的兩粒不對稱酮以乙醇鈉為條件縮合。乙醇鈉的鹼性不能將其中任意一粒酮的鄰位氫完全脫去,但可以將兩種酮都形成少量的烯醇鈉鹽。這意味着兩種酮分子不僅都是潛在的親電試劑,而且都可以通過形成烯醇負離子成為親核試劑。最後反應的結果是兩種親電試劑和兩種親核試劑形成的四種產物[72]。
所以,若希望得到交叉羥醛反應-產物中的一種就必須嚴格的控制其中一個羰基分子成為親核試劑,另一個羰基分子保持親電的分子形式。[73][74]
最常用的控制方法是:兩種參與反應的羰基分子中只有一種具有α氫原子,而只有這種分子才能異構化成為烯醇式成為親核試劑。例如,丙二酸酯和苯甲醛反應則只會形成一種產物。因為只有丙二酸酯具有α氫原子而成為親核試劑,不能進行烯醇化的苯甲醛則只能成為親電試劑:[75]
丙二酸酯非常易脫質子形成烯醇負離子,因為其羰基α位連接另外一組羰基。1,3-二羰基形式能讓形成的烯醇負離子更穩定,所以不需要很強的鹼就能烯醇化。此效應可以引申出另外一種情況:即使羰基旁有兩種α氫原子,卻仍然可以控制形成哪種烯醇式。若兩種α氫原子酸性差異夠大,鹼就會中和較酸的質子形成烯醇,而酸性較弱的α氫原子則不受鹼影響[76][77]。這種控制方法,只存在於酸性差異夠大而鹼不過量的情況下。其應用在亞甲基臨近於兩組羰基或者氰基的分子中較常見,如Knoevenagel縮合反應和丙二酸酯合成的第一步[78][79][80]。
另一種常用控制選擇性的解決方案是先讓其中一種羰化物形成烯醇負離子,然後在動力學控制下加入另一羰化物。[81]動力學控制決定了正向羥醛加成反應必須明顯快於反向羥醛反應。要達成這目的必須滿足其他兩項條件:1、量化形成其中一種烯醇負離子;2、正向羥醛反應明顯快於烯醇離子的交換過程。常見的動力學控制操作是使用二異丙基氨基鋰在−78 °C下和酮反應得到烯醇負離子,而後緩慢加入醛[82]。
烯醇和烯醇負離子
烯醇是醛或酮的異構體[83]。在存在少量酸或鹼的條件下烯醇和醛酮可以相互轉化,屬於一種互變異構[84][85][86],或稱之為烯醇和醛酮互為互變異構體。酸性或中性條件下烯醇不穩定,互變異構的反應平衡有利於醛酮而不利於烯醇,所以醛酮中只含有微量的烯醇異構體[87]。如下圖所示:

相比酮式,通常烯醇式是一種不穩定的互變異構形態,有三種較穩定的烯醇化合物:一、形成烯醇的雙鍵與分子內其他雙鍵共軛[88]。二、形成的烯醇式與較大的芳香基團連接[89]。三、形成的烯醇式的雙鍵碳原子直接連接多粒氟原子[90]。而烯醇負離子可通過兩種方法獲得:1、強鹼(「硬條件」) 2、路易斯酸和弱鹼(「軟條件」)[91]。
如果不對稱酮與鹼反應,有生成兩種「區域異構」烯醇的傾向(忽略烯醇本身的立體化學)[來源請求],如:
三取代烯醇認為是「動力學控制」的烯醇,而四取代烯醇則認為是熱力學控制的烯醇。α氫原子脫質子後形成的動力學烯醇相對位阻更小,脫質子更快。總體來說,四取代烯烴由於超共軛,比三取代烯烴更穩定。烯醇區域異構體的比例很大程度受反應中鹼的影響。以上述為例,動力學控制可以通過二異丙基氨基鋰在−78 °C下得到,且有99:1的動力學產物;而熱力學烯醇可以通過三苯基甲基鋰在室溫得到1:9的熱力學產物[93]。一般來說,動力學烯醇更傾向於在低溫下形成相對離子化的金屬-氧鍵,而反應中快速脫質子須使用略過量的鹼,該鹼需是強且高位阻的鹼。體積大的鹼只會中和位阻小的氫原子,低溫條件和過量的鹼能防止在初步烯醇化時平衡轉化為更穩定的烯醇式。熱力學烯醇更傾向於長的平衡時間與更高溫,這種條件形成了相對共價的金屬-氧鹼而且使用少量強鹼。不足量的鹼能同時脫去所有羰基分子的質子,不同的烯醇負離子和羰基之間交換質子並形成平衡,從而形成更穩定構型。這種選擇可以由挑選金屬離子和溶劑來控制[94]。
關於不同條件下烯醇化的擴展研究已經開始。當代有機化學在大多數情況下,已經可以得到想要的烯醇構型:[95]
醛酮羰基的α氫pKa一般為23左右。為了避免自身發生羥醛加成則需要使用如二異丙基氨基鋰的強鹼,才可迅速地使整個反應體系完全烯醇化。由於使用強鹼,且提高脫質子的選擇性,通常在丙酮乾冰浴的低溫下反應,溶劑則通常用四氫呋喃、二氯甲烷等非質子極性溶劑。由於二異丙基氨基鋰(LDA)這類強鹼屬於硬鹼,所以這種方法屬於硬式烯醇化。如果使用路易斯酸先與醛酮羰基絡合,則能極大地提高α氫的酸性,就可以使用諸如三乙胺的弱鹼反應,從而實現脫質子烯醇化,這種方法就屬於軟式烯醇化[96]。
烯醇或烯醇鹽相當於烯烴的衍生物而有順反異構體。一般用E表示反式,Z表示順式。[97]見圖:

該烯醇的命名法與烯烴體系有區別,規則是:只要是羰基氧原子烯醇化後與雙鍵另一端的大基團處在一端的都認為是順式,而與另一個R'的基團大小無關[98]。如:

圖例之烯醇鹽按照普通規則屬反式,因硫的原子序數比氧大而基團優先,但在羥醛反應的研究中屬順式。而對於酮化物,大多數烯醇化條件都是得到Z烯醇。而對於酯化物,大多數烯醇化條件得到的是E烯醇。而在加入六甲基磷酰胺後,該脫質子過程的立體選擇性可以與上述相反[99][64]。

烯醇形成的立體選擇性可用Ireland模型解釋,[100][101][102][103]雖然這種模型的準確度還未確定,如在大多數情況下無法得知在中間體是單體或是低聚體;即使如此Ireland模型仍然是理解烯醇化過程的有用工具。[104]
Ireland模型中,去質子化過程可能有六元環過渡態。兩個親電取代基團當中偏大的基團(在例子當中,甲基比氫原子大)在過渡態中傾向於採取平伏鍵的位置,導致優先得到E構型的烯醇。在以下情況模型失效:溶劑體系從四氫呋喃變為23%的六甲基磷酰胺-四氫呋喃會造成烯醇的立體化學發生逆轉。[105]
立體選擇性
羥醛反應非常重要,因為其過程能生成兩粒手性中心。許多相關研究已經了解反應機理並能通過不同的條件提高反應選擇性。順反轉化通常使用α和β碳原子上的相對構型表示。

文獻也用過赤式/蘇式來命名一些碳水化合物的立體構型。而有機化學家們一直感興趣的問題是如何控制羥醛反應,使四種可能產物中的一種成為主要產物,並儘量減少其他異構體的生成。
每一個烯醇的雙鍵構型都確定了主要產物的相對立體構型,E型雙鍵得到反式產物;Z型雙鍵得到順式產物:[95]
烯醇鹽的順反異構直接影響羥醛產物的立體化學,故須控制烯醇鹽的順反異構以期獲得特定結構的烯醇鹽。在胺類鹼作用下,烯醇化的結果傾向於生成反式烯醇鹽,如果在反應體系內添加六甲基磷酰胺(HMPA),則可以使上述結果相反。此現象可用「Ireland模型」解釋:

生成反式烯醇鹽的六元環過渡態大取代基間相互積壓程度小、能量低,容易形成過渡態,進而得到反式烯醇鹽;同理,生成順式的過渡態存在大取代基1,3-豎鍵相互左右,擠壓程度高、能量上不利於形成過渡態,故順式含量低。
羥醛反應研究的發展產生了更為可靠的烯醇化技術,通過選擇不同的鹼和路易斯酸催化劑,可以有效地產生97%以上的單一烯醇鹽。基本上而言,使用小位阻硼硬路易斯酸三氟甲磺酸二正丁基化硼(Bu2BOTf)和大位阻鹼N,N-二異丙基乙基胺(DIPEA)有利於生成順式烯醇鹽;反之,大位阻軟路易斯酸氯代二環己基硼烷(Cy2BCl)和小位阻鹼的搭配則有利於生成反式烯醇鹽。見下圖:
烯醇金屬離子的在確定羥醛反應的立體選擇性上有很重要作用。硼試劑[106][106]就常用於選擇羥醛反應的立體產物,因為其鍵長遠比其他金屬離子(如鋰,鋁或者鎂)短。
硼-碳和硼-氧鍵長分別為1.4–1.5Å和1.5–1.6Å,而典型金屬-碳和金屬-氧鍵長分別為1.9–2.2Å和2.0–2.2Å。硼試劑讓金屬原子「收緊」過渡態而讓反應有更高的立體選擇率。[107]這樣,上述反應使用烯醇鋰負離子得到的順反比為4:1;而使用二丁基硼烯醇則得到97:3的高選擇性。
羥醛反應可發生「受質介導的立體化學控制」,也就是反應受質的手性可影響產物的手性。若烯醇受質有α位手性中心,則可完美控制立體化學。
E烯醇之主要控制因素為1,3-烯丙位張力;而Z烯醇,主要控制因素則是防止1,3-位的雙直立鍵相互作用。總模型如下:
為了讓圖解更清晰易懂,烯醇分子的立體化學被差向異構化;而在實際反應中,醛的差向異構面也可發生親核進攻反應。兩例中,1,3-順式的非對映體都有利。此類立體化學控制的例子有許多:[108]

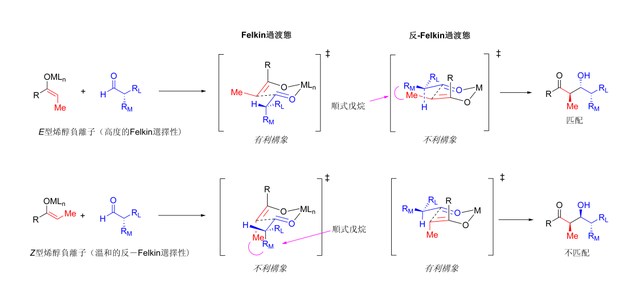
當烯醇進攻的受質醛有α位手性中心,同樣可以完美控制立體化學。大多數的研究表明E式烯醇參與了Felkin非對映體的選擇;Z烯醇參與反Felkin的選擇性。總模型[109][110]如下所示:
由於Z烯醇必須通過有不穩定的順戊烷中間體或反Felkin旋轉異構體來反應,所以Z式烯醇在這例子中降低了非對映選擇率,如下:[111][112]
若烯醇和醛分子本來有手性,則可使用統一的立體化學模型以預測該「雙重手性區分」的羥醛反應,而該模型需要同時考慮兩個因素:烯醇分子的空間位阻和立體化學的對於反應的影響,以及醛的空間位阻對於反應的影響。[113]一些關於此模型的應用如下所示:[112]
埃文斯噁唑烷酮化學
現代有機合成化學需要合成光學純的化合物。然而羥醛反應生成兩粒手性中心,即形成四種手性異構體:
現今已發展出許多用於控制相對手性(如順或反)和絕對手性化學(如R S構型)的方法。
一種廣泛使用的方法為埃文斯酰基噁唑烷酮法,[23][24]由大衛·埃文斯和同事於二十世紀七八十年代發現,這種方法通過添加手性助劑來暫時建立手性烯醇。這手性助劑通過非對映選擇性反應將「手性」轉移至產物,之後脫除助劑,得到需要的對映體。
在埃文斯的方法中,引入的手性助劑為噁唑烷酮,而形成的羰化物是一種酰亞胺。許多噁唑烷酮試劑現在都已商品化,且可買到兩種對映體,其售價約每克10至20美元。
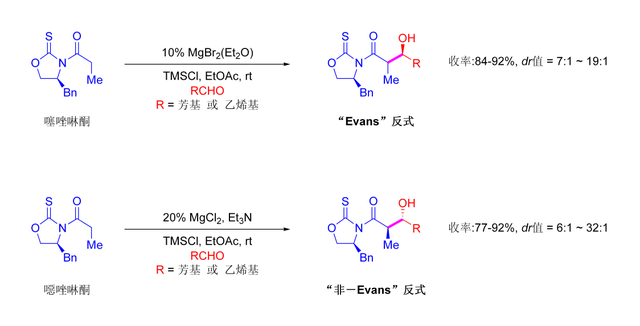
噁唑烷酮的酰化反應操作過程簡單。Z型烯醇可以通過「硼介導軟性烯醇化」得到順羥醛加合物。[114]
通常單種非對映體可以羥醛加成物結晶獲得。儘管成本高且只能得到「順」產物,埃文斯羥醛可靠,用途廣泛。一些斷裂助劑的方法如下:[115]
構建酰亞胺結構都可發生選順和選反羥醛加成反應,其允許形成四種當中三種手性組合:選順[116]和選反:[117]
在選順反應中,兩種烯醇化方法都如預期的得到Z烯醇,然而反應的手性化學並非受到噁唑烷酮而是甲基手性中心控制。該法還允許選擇組建聚酮的手性(一類有反合成子的天然產物)。
現代方法與變化
羥醛反應的現代化學方法學發展出了許多不對稱羥醛反應,這些不對稱反應常使用催化量的手性配體。當反應使用少量的光學純配體,即可誘導形成光學純的羥醛反應產物,該反應也屬於一種「催化的非對稱」反應。根據催化劑的不同可以將非對稱反應分類為以下幾種羥醛反應類型:
向山羥醛反應是在路易斯酸,如三氟化硼或四氯化鈦的催化下,硅烯醇醚對醛的親核加成反應。[118][119]向山羥醛反應並不符合齊默曼-特拉克斯勒模型。後來卡雷拉(Carreira)發現了一種實用的利用硅烯酮縮醛的不對稱合成法:使用含鈦的西弗鹼催化反應(見下圖)。這種催化劑有高度的對映選擇性及廣泛的受質適用性,在優化條件下,只需0.5%摩比的催化劑便可以得到高收率且高對映體過剩(ee)的加成產物[120][121][122]。該方法常應用於非支鏈脂肪族醛,由於在對映面兩側的電性和手性差別較小,該受質的親電性對於催化不對稱反應的通常較弱。[123]
插烯物的向山羥醛過程還可以發生催化非對稱性反應。下圖展示了僅對芳香醛的有效反應,認為其機理與金屬鍵合的手性二烯醇有關。[124][125]
近期[何時?]發現的埃文斯助劑按其發現化學家命名為可理民斯(Crimmins)噻唑硫酮催化劑[126][127],雖然不及埃文斯的反應實例中的數據,但這種催化劑能夠使反應的收率、非對映選擇性和對映選擇性都大大提高。而優於早期的埃文斯助劑,噻唑硫酮對於乙酰羥醛反應同樣有效,[128]且克里明斯發現可以通過使用少量的(-)-金雀花鹼得到「埃文斯順式」或「非埃文斯順式」的加成產物。該機理認為是形成鈦-鍵合六元環過渡態反應,而該過渡態機理類似於埃文斯助劑。
羥醛反應的另一最新進展發現了可用手性二級胺催化反應。這種二級胺和酮反應會先形成烯胺中間體,並與合適的醛加成對映選擇性產物。[129][130][131][132][133]胺與羰化物反應得到的烯胺(類似於烯醇)可作為親核試劑參與反應,而胺又會從產物脫落重新進入催化循環。烯胺催化法大多基於有機小分子受質,屬有機催化。在下圖中,脯氨酸對於催化三酮的環化反應非常有效[134][135]:
該反應也稱Hajos-Parrish反應[136][137](還稱Hajos-Parrish-Eder-Sauer-Wiechert反應)[138]H-P條件僅需催化量的脯氨酸(3%摩量)。由於過渡態的烯胺中間體比酮(前體)的烯醇式更親核,因此該反應沒有諸如非手性反應的問題。這種策略實用價值很高,因為它提供了簡單促成對映選擇性反應的方法,而且不需要使用昂貴或有毒的過渡金屬催化劑。在2000年BarbasIII和同事在前人的基礎改善了該方法,發現30%摩量脯氨酸催化可使羥醛反應對映體過剩99%以上;而羥基丙酮受質則可以得到高選擇性的順式雙羥基產物[139][140]。
值得一提的是脯氨酸催化的羥醛反應沒有任何「非線性效應」(線性效應指產物對映選擇性的比例直接與催化劑的光學純度相關)。結合同位素標記得到的證據及計算化學研究,假定的脯氨酸催化的羥醛反應機理如下:[141]
這種策略允許有競爭雙醛交叉羥醛反應。通常兩醛之間的交叉羥醛反應都有競爭,因此它們很容易聚合或有隨機反應而得到混合產物。第一例如下:[142]
基於烯醇的羥醛加成反應會優先形成順式產物,而有機催化形成的加成產物是選反的。許多實例中,有機催化條件可以非常溫以防止多聚化。然而由於兩種親電試劑都能產生烯醇化質子,所以為了提高選擇性就必須使用注射泵緩慢滴加親電試劑加以控制。如果其中一種原料沒有烯醇化的α氫原子或β側鏈就可實現可控制的加成反應。
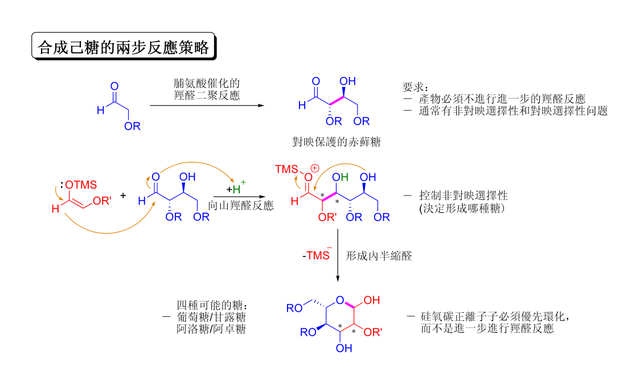
麥克米倫和同事於2004年發現了一個很好的展示不對稱有機催化羥醛反應的例子,他們通過不同的方法保護碳水化合物(糖類)。傳統合成己糖的方法是使用多步保護、脫保護,共需8至14步完成,而有機催化法能夠作用於許多相同受質,且僅用兩步就可順利完成。該反應使用了脯氨酸催化的α羥基醛的二聚反應,然後幾步向山羥醛環化反應完成合成。
α羥醛的二聚化反應要防止羥醛加成物繼續加成反應。[143]早期的研究表明能耐受α-烷氧或α-硅氧的保護基適用於此反應,因為能耐受吸電子基團(如乙酰基)的醛都沒反應。保護後的赤蘚糖產物通過向山羥醛加成,之後半內縮醛化轉化為四種糖分子。這須在向山加成中適當控制非對映體,並且產物硅氧碳正離子會優先環化,而不是繼續羥醛反應,葡萄糖、甘露糖、阿洛糖等都可以此法製備:
普通的羥醛反應中,羰化物都脫質子形成烯醇。烯醇加入到醛或酮化合物中形成醇鹽,然後酸化和後處理。有更好的方法,理論上能夠不需多步操作,而可「直接」一步反應,想法是用金屬催化劑在羥醛加成過程中釋放。而問題在於反應產生的醇鹽比原料更鹼。產物和金屬離子緊密鍵合,以致阻礙了它與羰基原料繼續反應[144][145][120]。
埃文斯發現了用硅基化羥醛加成物反應的方法,[146][147]如硅試劑三甲基氯硅烷參與反應用於代替金屬離子結合醇鹽,並允許金屬催化劑的循環利用。該法減少了反應步數,降低了試劑消耗,使反應更經濟且適用於工業領域。
一種最近由Shair發現的仿生合成法,使用β-硫酮酸作為親核試劑。[148]其中一半酮酸在反應中脫羧。其過程非常類似於通過聚酮合成酶來應用丙二-輔酶A。示例中的手性配體為雙噁唑啉配體。有趣的是,芳香族和支鏈脂肪族醛在此例中無法很好地反應。
生物的羥醛反應

生物化學中的羥醛反應,如糖酵解反應的第二階段:1,6-二磷酸果糖分解成3-磷酸甘油醛和二羥基丙酮,該反應是由醛縮酶A催化的逆向羥醛反應[149]。又如:萜類在生物中間體甲瓦龍酸中的合成[150]等。
參見
註解
參考文獻
外部連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.