热门问题
时间线
聊天
视角
手性
来自维基百科,自由的百科全书
Remove ads
手性,又稱對掌性(英語:chirality、/kaɪˈrælɪtiː/)一詞源於希臘語詞幹「手」χειρ(ch[e]ir),在多種學科中表示一種重要的對稱特點。

如果某物體與其鏡像不同,則其被稱為「手性的(英語:chiral)」,且其鏡像是不能與原物體重合的,就如同左手和右手互為鏡像而無法疊合。手性物體與其鏡像被稱為對映體(enantiomorph,希臘語意為「相對/相反形式」);在有關分子概念的引用中也被稱為對映異構體。可與其鏡像疊合的物體被稱為非手性的(achiral),有時也稱為雙向的(amphichiral)。
化學上的手性
若一個手性分子或離子存在於互為鏡像的兩種立體異構體中,該兩個異構體稱為對映異構體;他們通常根據絕對配置或其他一些標準被區分為「右手性」或「左手性」。這兩種對映體具有相同的化學性質,除了與其他手性化合物反應時。它們通常具有相反的光學性質,除此以外其他物理性質相同。兩種對映體等份的均勻混合物被稱為外消旋體,它通常在化學和物理上與純對映體不同。
手性分子通常具有產生手性的立體異構元素。最常見的立體元素類型是立體中心。在有機化合物的情況下,立體中心最常見的形式是一個碳原子,四個不同的基團以四面體幾何形狀連接在它上面。一個立體中心有兩種可能的構型,在具有一個或多個立體中心的分子中產生立體異構體(非對映異構體和對映異構體)。對於具有一個或多個立構中心的手性分子,對映異構體對應於其中每個立構中心具有相反構型的立體異構體。只有一個立體異構碳的有機化合物總是手性的。另一方面,具有多個手性碳的有機化合物通常但不總是手性的。特別是,如果立體中心的配置方式使分子具有內部對稱平面,則該分子是非手性的,稱為內消旋化合物。不太常見的是,其他原子如 N、P、S 和 Si 也可以用作立體中心,前提是它們有四個不同的取代基(包括孤對電子)連接到它們上。
由一個或多個立體中心產生的具有手性的分子被歸類為具有中心手性。還有兩種其他類型的立體元素可以產生手性,立體軸(軸手性)和立體平面(平面手性)。最後,分子的固有曲率也能產生手性(固有手性 inherent chirality)。這些類型的手性遠不如中心手性常見。1,1'-聯-2-萘酚是軸手性分子的典型例子,而反式環辛烯是平面手性分子的常見例子。最後,螺旋烯具有螺旋手性,這是一種固有手性。
手性是立體化學和生物化學的一個重要概念。大多數與生物學相關的物質都是手性的,例如碳水化合物(醣、澱粉和纖維素)、構成蛋白質的氨基酸和核酸。在活生物體中,人們通常只發現手性化合物的兩種對映異構體中的一種。出於這個原因,消耗手性化合物的生物體通常只能代謝其一種對映體。出於同樣的原因,手性藥物的兩種對映異構體通常具有截然不同的效力或作用。
Remove ads
定義
分子的手性基於其構象的分子對稱性。一個分子的構象是手性的當且僅當它屬於 Cn、Dn、T、O、I 點群(手性點群)。然而,分子本身是否手性取決於它的手性構象是否持久(即至少在原則上異構體可以分離並獨立存在),或者在給定的溫度和時間尺度下是否能夠通過低能構象快速相互轉換變化(使分子非手性)。例如,儘管丁烷具有屬於 C2 點群的手性左旋構象異構體,但丁烷在室溫下被認為是非手性的,因為圍繞中心 C-C 鍵的旋轉會迅速相互轉化對映異構體(3.4 kcal/mol 勢壘)。同樣,順-1,2-二氯環己烷由不同鏡像的椅型構象組成,但兩者可以通過環己烷椅子翻轉(~10 kcal/mol 勢壘)相互轉換。作為另一個例子,具有三個不同取代基 (R1R2R3N:) 的胺也被視為非手性分子,因為它們的對映體金字塔構象異構體能通過平面過渡態(~6 kcal/mol 勢壘)快速反轉和相互轉化。
然而,如果所討論的溫度足夠低,則與給定的時間尺度相比,相互轉換對映體手性構象的過程會變得緩慢。然後該分子將被認為在該溫度下具有手性。相關時間尺度在某種程度上是任意定義的:有時使用 1000 秒,因為這被認為是實際意義上對映異構體的化學或色譜分離所需時間量的下限。由於單鍵旋轉受限(旋轉勢壘 ≥ 約 23 kcal/mol)而在室溫下呈手性的分子被認為表現出阻轉異構現象。
手性化合物不能包含不正當的旋轉軸 (Sn),其中包括對稱面和反轉中心。不對稱分子總是手性的。[1]
Remove ads
立體中心
若某原子上兩個配體(連接的基團)的位置交換後會產生與原始分子立體異構的分子,則該原子為所屬分子的立體中心。例如,一個常見的情況是四面體碳與四個不同的基團 a、b、c 和 d(Cabcd)鍵合,其中交換任何兩個基團(例如 Cbacd)會產生原始的立體異構體,因此中心 C 是立體中心。許多手性分子具有點手性,即與原子重合的單個手性立體中心。這個手性中心通常有四個或更多鍵連接到不同的基團,可能是碳(如在許多生物分子中)、磷(如在許多有機磷酸酯中)、矽或金屬(如在許多手性配位化合物中)。然而,手性中心也可以是鍵不在同一平面上的三價原子,例如 P-手性膦 (PRR'R″) 中的磷和 S-手性亞碸 (OSRR') 中的硫,此時中心原子存在一孤電子對而不是第四個鍵。
類似地,立體軸(或平面)被定義為分子中的軸(或平面),使得連接到軸(或平面)的任何兩個配體的交換產生立體異構體。例如,C2 對稱物質1,1'-聯-2-萘酚(BINOL)和 1,3-二氯丙二烯具有手性軸並表現出軸手性,而 (E)-環辛烯和許多帶有兩個或多個取代基的二茂鐵衍生物則具有立體平面並表現出平面手性。
手性也可能源於原子之間的同位素差異,例如在氘代苯甲醇 PhCHDOH 中;它具有手性和光學活性([α]D = 0.715°),即使非氘代化合物 PhCH2OH 不是。[2]
如果兩種對映異構體容易相互轉化,則純對映異構體實際上可能無法分離,只能觀察到外消旋混合物。例如,大多數具有三個不同取代基 (NRR'R″) 的胺就是這種情況,因為氮轉化的能壘較低。
手性物質不必具有手性元素。例子包括某些螺烯、杯芳烴和富勒烯,它們具有固有手性。此外,分子的手性中心可能位於不對應原子中心(因此,立體中心)的位置,例如1,3,5(,7)-取代的金剛烷(例如顯示在側框中的 (1S,3R,5R,7S)-3-甲基-5-苯基金剛烷-1-羧酸)。

當對映體的旋光度對於實際測量來說太低時,該物質被認為表現出隱手性。
系統標準名會包括分子絕對配置的詳細信息。由於手性是分子身份的固有部分,因此亦會被包含在標準名內(R/S、D/L 或其他名稱)。
結構及特性
手性及手性物質分子的絕對構型分為兩類:「左手性」和「右手性」。有時為了對比,另外加上一種無手性(也稱「中性手性」)。左手性用S表示,右手性用R表示,中性手性用M表示。此外,手性分子亦可根據其將偏振光旋轉的方向可以分為右旋對映體(用(+)-、d-前綴來表示)和左旋對映體(用(-)-、l-前綴來表示)。
分子的絕對構型(R、S 構型)是通過順序規則確定,與其旋光性無絕對對應關係,必須通過實驗測量或計算機模擬來確定二者的聯繫[4]。
除了利用偏光照射所產生的角度偏差正負值相反外,對映異構體的物理特性大致相同。除了與其他手性化合物反應時外,對映異構體的化學特性亦基本相同。
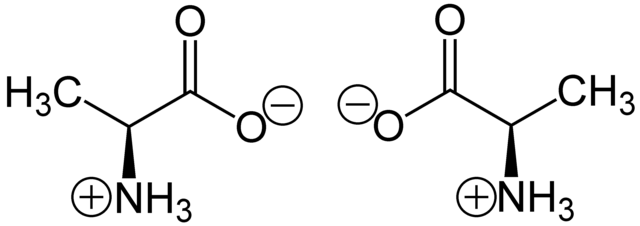
例子:碳的四個鍵結以接近(看所鍵結原子不同而有稍微偏差)正四面體分布,如右圖。以丙氨酸的甲基(CH3-)為縱軸旋轉可發現兩分子無法重疊,互為對映異構體。
 |
 |
大多數的化學反應,如生成物可能含有對映異構體,則生成物會含有兩種或以上的對映異構體。而絕大多數的藥物都只含一個對映異構體,因為另一對映異構體可能有不良的效果、或沒有效果。例如:維生素C的對映異構體並不為身體所吸收,而會被排出體外,所以一片含有化學生產的1000毫克維生素C片,可能實際可吸收的維生素C只有一半份量。
Remove ads
手性的實際表現
應用
手性分子廣泛用於生命科學,也用於藥物的生產,2001年,三位利用手性催化劑生產手性藥物的科學家被授予諾貝爾化學獎。 如今,手性合成已成為21世紀的重要研究領域。[10]
參考資料
參見
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
