富勒烯
碳的同素異形體 来自维基百科,自由的百科全书
富勒烯(英語:Fullerene) 或巴克球、巴基球(英語:Buckyball)是一種完全由碳組成的中空分子,形狀呈球型、橢球型、柱型或管狀。富勒烯在結構上與石墨很相似,石墨是由六元環組成的石墨烯層堆積而成,而富勒烯不僅含有六元環還有五元環,偶爾還有七元環。
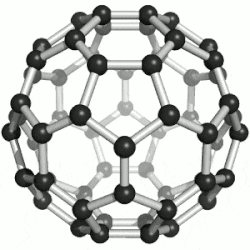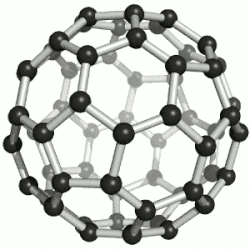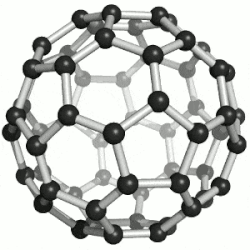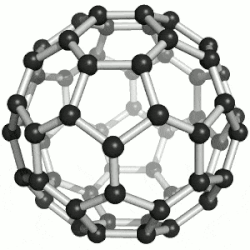

60 的球棒模型
1985年英國化學家哈羅德·沃特爾·克羅托博士和美國科學家理查德·斯莫利在萊斯大學製備出了第一種富勒烯,即「C60分子」或「[60]富勒烯」,因為這個分子與建築學家巴克明斯特·富勒的建築作品很相似,為了表達對他的敬意,將其命名為「巴克明斯特·富勒烯」(巴克球)[1]。飯島澄男早在1980年之前就在透射電子顯微鏡下觀察到這樣洋蔥狀的結構。[2]自然界也是存在富勒烯分子的[3],2010年科學家們通過史匹哲太空望遠鏡發現在外太空中也存在富勒烯。[4] 「也許外太空的富勒烯為地球提供了生命的種子」。[5]
在富勒烯發現之前,碳的同素異形體的只有石墨、鑽石、無定形碳(如炭黑和炭),它的發現極大地拓展了碳的同素異形體的數目。富勒烯和碳納米管獨特的化學和物理性質以及在技術方面潛在的應用,引起了科學家們強烈的興趣,尤其是在材料科學、電子學和納米技術方面。
-
建築學家理查德·巴克明斯特·富勒設計的加拿大1967年世界博覽會球形圓頂薄殼建築
-
巴克明斯特·富勒烯C60的空間填充模型,也稱為巴克球。眾所周知,它是最常見的富勒烯,與足球相似。
-
現代足球與C60有着非常類似結構
命名
很像足球的球型富勒烯也叫做足球烯,或音譯為巴克球,中國大陸通譯為富勒烯,臺灣稱之為球碳,香港譯為布克碳;偶爾也稱其為芙等[6];富勒烯的中文寫法有三種,以C60為例,第一種是標準的寫法,即[60]富勒烯,對應英文的[60]fullerene;第二種為碳60,60也不用下標,這是中文專用的寫法;第三種為C60,與英文一致。

早在1965年,二十面體對稱性的C60H60被認為是一種可能的拓撲結構。[7] 20世紀60年代科學家們對非平面的芳香結構產生了濃厚的興趣,很快就合成了碗狀分子碗烯(Corannulene)[8]。日本科學家大澤映二在與兒子踢足球時想到,也許會有一種分子由sp2雜化的碳原子組成,比如將幾個碗烯拼起來的共軛球狀結構,實現三維芳香性。[9][10][11]他開始研究這種球狀分子,不久他得出這種結構可以由截去一個二十面體的頂角得到,並稱之為截角二十面體,就像足球的拼皮結構那樣;他還預言了CnHn分子的存在。大澤雖然在1970年就預言了C60分子的存在,但遺憾的是,由於語言障礙,他的兩篇用日文發表的文章並沒有引起人們的普遍重視,而大澤本人也沒有繼續對這種分子的研究,因而使得C60的發現已經是15年以後的事了。
1970年漢森(R. W. Henson)設計了一個C60的分子結構,並用紙製作了一個模型。然而這種碳的新形式的證據非常弱,包括他的同事都無法接受。因此這個結果並沒有發表,不過《碳》期刊在1999年確認了這個結果。[12][13]富勒烯的第一個光譜證據是在1984年由美國新澤西州的艾克森實驗室的羅芬(Rohlfing),考克斯(Cox)和科多(Kldor)發現的,當時他們使用由萊斯大學理查德·斯莫利設計的激光汽化團簇束流發生器,用激光汽化蒸發石墨,用飛行時間質譜發現了一系列Cn(n=3,4,5,6)和C2n(n>=10)的峰,而相距較近的C60和C70的峰是最強的[14]。不過很遺憾,他們沒有做進一步的研究,也沒有探究這個強峰的意義。1985年,英國化學家哈羅德·沃特爾·克羅托博士和美國賴斯大學的科學家理查德·斯莫利、海斯(James R. Heath)、歐布萊恩(Sean O'Brien)和科樂(Robert Curl)等人在氦氣流中以激光汽化蒸發石墨實驗中首次製得由60個碳組成的碳原子簇結構分子C60。富勒烯的主要發現者們受建築學家巴克敏斯特·富勒設計的加拿大蒙特利爾世界博覽會球形圓頂薄殼建築的啟發,認為C60可能具有類似球體的結構,因此將其命名為巴克明斯特·富勒烯(buckminster fullerene),簡稱富勒烯(fullerene)。為此,克羅托、科爾和斯莫利獲得了1996年度諾貝爾化學獎。在1990年前,關於富勒烯的研究都集中於理論研究[15],因為沒有足量的富勒烯用於實驗,直到1990後,哈夫曼(Donald Huffman),克拉策門(Wolfgang Krätschmer)和福斯迪羅伯勞斯(Konstantinos Fostiropoulos)等人第一次報道了大量合成C60的方法[16][17],才使得C60的研究得以大量展開。富勒烯的純化對於化學家們是一個挑戰,同時也在很大程度上決定了富勒烯的價格。內嵌富勒烯是指在生成富勒烯的過程中將離子或小分子包到碳籠中。富勒烯的化學反應很特別,例如1993年發現的Bingel反應等。碳納米管在1991被發現。[18]

1971年,大澤映二發表《芳香性》一書,其中描述了C60分子的設想。[19]
1980年,飯島澄男在分析碳膜的透射電子顯微鏡圖時發現同心圓結構,就像切開的洋蔥,這是C60的第一個電子顯微鏡圖。[2] 1983年,克羅托蒸發石墨棒產生的碳灰的紫外可見光譜中發現215nm和265nm的吸收峰,他們稱之為「駝峰」;後來他們推斷這是富勒烯產生的。[14][20]
1984年,富勒烯的第一個光譜證據是在1984年由美國新澤西州的艾克森實驗室的羅芬等人發現的,但是他們不認為這是C60等團簇產生的。[14]
1985年,英國化學家哈羅德·克羅托和美國科學家理查德·斯莫利等人在氦氣流中以激光汽化蒸發石墨實驗中意外合成了C60和C70[21],並由此獲得1996年諾貝爾化學獎。並提出富勒烯可能存在於星際空間。[22]
1990年,克利斯莫(Krätschmer)等人第一次報道了大量合成C60的方法,才使得C60的研究得以大量展開。[23]
1991年,加州大學洛杉磯分校的霍金斯(Joel Hawkins)得到了富勒烯衍生物的第一個晶體結構,標誌着富勒烯結構被準確測定。[24]
起初人們認為這種高度對稱的完美分子只能在實驗室的苛刻條件下或者是星際塵埃中存在,然而1992年美國科學家P. R. Buseck在用高分辨透射電鏡研究俄羅斯數億年前的地下的一種名為Shungites的礦石時,發現了C60和C70的存在,飛行時間質譜也證明了他們的結論,產生原因未知[3]。2010年加拿大西安大略大學科學家在6500光年以外的宇宙星雲中發現了C60存在的證據,他們通過史匹哲太空望遠鏡發現了C60特定的信號。克羅托說:「這個最令人興奮的突破給我們提供了令人信服的證據:正如我們一直期盼的那樣,巴克球在宇宙的亙古前就存在了。」[27]
製備與提純
大量低成本地製備高純度的富勒烯是富勒烯研究的基礎,自從克羅托發現C60以來,人們發展了許多種富勒烯的製備方法。目前較為成熟的富勒烯的製備方法主要有電弧法、熱蒸發法、燃燒法和化學氣相沉積法等。
- 電弧法
一般將電弧室抽成高真空,然後通入惰性氣體如氦氣。電弧室中安置有製備富勒烯的陰極和陽極,電極陰極材料通常為光譜級石墨棒,陽極材料一般為石墨棒,通常在陽極電極中添加銖、鎳、銅或碳化鎢等作為催化劑。當兩根高純石墨電極靠近進行電弧放電時,炭棒氣化形成等離子體,在惰性氣氛下小碳分子經多次碰撞、合併、閉合而形成穩定的C60及高炭富勒烯分子,它們存在於大量顆粒狀煙灰中,沉積在反應器內壁上,收集煙灰提取。電弧法非常耗電、成本高,是實驗室中製備空心富勒烯和金屬富勒烯常用的方法。[28]
- 燃燒法
苯、甲苯在氧氣作用下不完全燃燒的碳黑中有C60和C70,通過調整壓強、氣體比例等可以控制C60與C70的比例,這是工業中生產富勒烯的主要方法。[29]

富勒烯的純化是一個獲得無雜質富勒烯化合物的過程。製造富勒烯的粗產品,即煙灰中通常是以C60為主,C70為輔的混合物,還有一些同系物。決定富勒烯的價格和其實際應用的關鍵就是富勒烯的純化。實驗室常用的富勒烯提純步驟是:從富含C60和C70的煙塵中先用甲苯索氏提取,然後紙漏斗過濾。蒸發溶劑後,剩下的部分(溶於甲苯的物質)用甲苯再溶解,再用氧化鋁和活性碳混合的柱色譜粗提純,第一個流出組分是紫色的C60溶液,第二個是紅褐色的C70,此時粗分得到的C60或C70純度不高,還需要用高效液相色譜來精分。[30]
永田(Nagata)發明了一項富勒烯的公斤級純化技術。[31] 該方法通過添加二氮雜二環到C60、C70等同系物的1、2、3-三甲基苯溶液中。DBU只會和C70以及更高級的同系物反應,並通過過濾分離反應產物,而富勒烯C60與DBU不反應,因此最後得到C60的純淨物;其他的胺化合物,如DABCO,不具備這種選擇性。
C60可以與環糊精以1:2的比例形成配合物,而C70則不行,一種分離富勒烯的方法就是基於這個原理,通過S-S橋固定環糊精到金顆粒膠體,這種水溶性的金/環糊精的複合物[Au/CD]很穩定,與不水溶的煙灰在水中回流幾天可以選擇性地提取C60,而C70組分可以通過簡單的過濾得到。將C60從[Au/CD] 複合物中分離是通過向環糊精水溶液加入對環糊精內腔具有高親和力的金剛烷醇使得C60與[Au/CD] 複合物分離而實現C60的提純,分離後通過向[Au/CD/ADA]的複合物中添加乙醇,再蒸餾,實現試劑的循環利用。50毫克[Au/CD]可以提取5毫克富勒烯C60。[32]後兩種方法都只停留在實驗室階段,並不實用。
種類
自從1985發現富勒烯之後,不斷有新結構的富勒烯被預言或發現,並超越了單個團簇本身。 [33]
- 巴克球團簇:最小的是C
20 (二十烷的不飽和衍生物)和最常見的C
60; - 碳納米管:非常小的中空管,有單壁和多壁之分;在電子工業有潛在的應用;
- 巨碳管(megatubes):比納米管大,管壁可製備成不同厚度,在運送大小不同的分子方面有潛在價值;[34]
- 聚合物:在高溫高壓下形成的「鏈狀、二維或三維聚合物」。
- 納米「洋蔥」:多壁碳層包裹在巴克球外部形成球狀顆粒,可能用於潤滑劑;[35]
- 球棒相連二聚體:兩個巴克球被碳鏈相連;[36]
- 富勒烯環。[37]

|

|

|

|
| C20 (正十二面體) |
C26 | C60 (截角二十面體) |
C70 |
- 巴克球

2007年科學家們預測了一種的新的硼巴克球,它用硼取代了碳形成巴克球,B80的結構是每個原子都形成五或六個鍵,它比C60穩定。[38]另外一種常見的富勒烯是C70[39],72、76、84甚至100個碳組成的巴克球也是很容易得到的。
- 碳納米管
納米管是中空富勒烯管。這些碳管通常只有幾個納米寬,但是他們的長度可以達到1微米甚至1毫米。碳納米管通常是終端封閉的,也有終端開口的,還有一些是終端沒有完全封口的。碳納米管的獨特的分子結構導致它有奇特的宏觀性質,如高抗拉強度、高導電性、高延展性、高導熱性和化學惰性(因為它是圓筒狀或「平面狀」,沒有裸露原子被輕易取代)。一個潛在應用是做紙電池,這是2007年倫斯勒理工學院的一個新發現。[40] 另外一個可能應用是用做太空電梯的高強度碳纜。通過共價鍵將富勒烯吸附在碳納米管外形成的納米「芽」結構稱作納米芽。
- 富勒體


富勒體(Fullerites)是富勒烯及其衍生物的固態形態的稱呼,中文一般不特別稱呼這個形態。超硬富勒體這個詞一般被用來表述使用高壓高溫得到的富勒體,這種條件下普通的富勒烯固體會形成鑽石形式的納米晶體,它有相當高的機械強度和硬度。[41]
- 內嵌富勒烯
內嵌富勒烯是將一些原子嵌入富勒烯碳籠而形成的一類新型內嵌富勒烯,如氫、碳、鈧、氮等,大部分是在電弧法製造富勒烯的過程中形成的,也可以通過化學方法將富勒烯打開孔後裝入一些原子或分子。
結構
在數學上,富勒烯的結構都是以五邊形和六邊形面組成的凸多面體。最小的富勒烯是C20,有正十二面體的構造。沒有22個頂點的富勒烯,之後都存在C2n的富勒烯,n=12、13、14……所有富勒烯結構的五邊形個數為12個,六邊形個數為n-10。


因為C60是富勒烯家庭中相對最容易得到、最容易提純和最廉價的各類,因此C60及其衍生物是被研究和應用最多的富勒烯。
通過質譜分析、X射線分析後證明,C60的分子結構為球形32面體,它是由60個碳原子通過20個六元環和12個五元環連接而成的具有30個碳-碳鍵的足球狀空心對稱分子,所以,富勒烯也被稱為足球烯。C60是高度的Ih對稱,高度的離域大π共軛,但不是超芳香體系,他的核磁共振碳譜只有一條譜線,但是它的雙鍵是有兩種,它有30個六元環與六元環交界的鍵,叫[6,6]鍵,60個五元環與六元環交界的鍵,叫[5,6]鍵。[6,6]鍵相對[5,6]鍵較短,C60的X射線單晶衍射數據表明,[6,6]鍵長是135.5皮米,[5,6]長鍵是146.7皮米,因此[6,6]有更多雙鍵的性質,也更容易被加成,加成產物也更穩定,而且六元環經常被看作是苯環,五元環被看作是環戊二烯或五元軸烯。C60有1812種個異構體。
C60及其相關C70兩者都滿足這種所謂的孤立五角規則(IPR)。而C84的異構體中有24個滿足孤立五角規則的,而其他的51568個異構體則不滿足孤立五角規則,這51568 為非五角孤立異構體,而不滿足孤立五角規則的富勒烯迄今為止只有幾種富勒烯被分離得到,比如分子中兩個五邊形融合在頂尖的一個蛋形籠狀內嵌金屬富勒烯Tb3NaC84。或具有球外化學修飾而穩定的富勒烯如C50Cl10,以及C60H8。
理論計算表明C60的最低未占據軌道(LUMO)軌道是一個三重簡併軌道,因此它可以得到至少六個電子,常規的循環伏安和差示脈衝伏安法檢測只能得到4個還原電勢,而在真空條件下使用乙腈和甲苯的1:5的混合溶劑可以得到六個還原電勢的譜圖[42]。
理論計算表明C70的LUMO軌道是一個二重簡併軌道,不過它的LUMO+1軌道與LUMO軌道的能級差很小,因此它可以得到至少六個電子,常規的循環伏安和差示脈衝伏安法檢測只能得到4個還原電勢,而在真空條件下使用乙腈和甲苯的1:5的混合溶劑可以得到六個還原電勢的譜圖[42]。
低對稱性富勒烯的鍵長是不一樣的,雖然也是離域π鍵,從核磁共振碳譜可以清楚看出來有很多條碳信號。
一些富勒烯是D2對稱性的,因此他們是有固有手性的,如 C76、C78、C80和C84等,科學家一直致力於發展特別的傳感器來識別和分離他們的對映異構體。
性質

| 溶劑 | C60 | C70 |
|---|---|---|
| 1-氯萘 | 51 mg/mL | * |
| 1-甲基萘 | 33 mg/mL | * |
| 1,2-二氯苯 | 24 mg/mL | 36.2 mg/mL |
| 1,2,4-三氯苯 | 18 mg/mL | * |
| 四氫萘 | 16 mg/mL | * |
| 二硫化碳 | 8 mg/mL | 36.2 mg/mL |
| 1,2,3-三溴丙烷 | 8 mg/mL | * |
| 氯苯 | 7 mg/mL | * |
| 二甲苯 | 5 mg/mL | 3.985 mg/mL(間二甲苯) |
| 溴仿 | 5 mg/mL | * |
| 異丙苯 | 4 mg/mL | * |
| 甲苯 | 3 mg/mL | 1.406 mg/mL |
| 苯 | 1.5 mg/mL | 1.3 mg/mL |
| 四氯化碳 | 0.4 mg/mL | 0.121 mg/mL |
| 氯仿 | 0.25 mg/mL | * |
| 正己烷 | 0.046 mg/mL | 0.013 mg/mL |
| 環己烷 | 0.035 mg/mL | 0.080 mg/mL |
| 四氫呋喃 | 0.006 mg/mL | * |
| 乙腈 | 0.004 mg/mL | * |
| 甲醇 | 0.000 04 mg/mL | * |
| 水 | 1.3×10−11 mg/mL | * |
| 戊烷 | 0.004 mg/mL | 0.002 mg/mL |
| 庚烷 | * | 0.047 mg/mL |
| 辛烷 | 0.025 mg/mL | 0.042 mg/mL |
| 異辛烷 | 0.026 mg/mL | * |
| 癸烷 | 0.070 mg/mL | 0.053 mg/mL |
| 十二烷 | 0.091 mg/mL | 0.098 mg/mL |
| 十四烷 | 0.126 mg/mL | * |
| 丙酮 | 0.001 mg/mL | 0.0019 mg/mL |
| 異丙醇 | 0.002 mg/mL | 0.0021 mg/mL |
| 二氧六環 | 0.0041 mg/mL | * |
| 1,3,5-三甲苯 | 0.997 mg/mL | 1.472 mg/mL |
| 二氯甲烷 | 0.254 mg/mL | 0.080 mg/mL |
| * : 沒有測試溶解度 | ||
富勒烯在大部分溶劑中溶解得很差,通常用芳香性溶劑,如甲苯、氯苯,或非芳香性溶劑二硫化碳溶解。純富勒烯的溶液通常是紫色,濃度大則是紫紅色,C70的溶液比C60的稍微紅一些,因為其在500nm處有吸收;其他的富勒烯,如C76、C80等則有不同的紫色。富勒烯是迄今發現的唯一在室溫下溶於常規溶劑的碳的同素異性體。
有些富勒烯是不可溶的,因為他們的基態與激發態的帶寬很窄,如C28[43],C36和C50。C72也是幾乎不溶的,但是C72的內嵌富勒烯,如La2@C72是可溶的,這是因為金屬元素與富勒烯的相互作用。早期的科學科學家對於沒有發現C72很是疑惑,但是卻有C72的內嵌富勒烯。窄帶寬的富勒烯活性很高,經常與其他富勒烯結合。化學修飾後的富勒烯衍生物的溶解性增強很多,如PC61BM室溫下在氯苯中的溶解度是50mg/mL。[44] C60和C70在一些溶劑的溶解度列於左表,這裡的溶解度通常是飽和濃度的估算值。[45][46][47][48][49][50][51][52]

水合富勒烯C60HyFn是一個穩定的,高親水性的超分子化合物。截止2010年以水合富勒烯形式存在的,最大的C60濃度是4mg/mL。[53][54][55][56]
在可以大量生產C60後其很多性質被發現,很快Haddon等人[57] [58]發現鹼金屬摻雜的C60有金屬行為,1991年發現鉀摻雜的C60在18K時有超導行為[59] 這是迄今最高的分子超導溫度,之後大量的金屬摻雜富勒烯的超導性質被發現[60][61]。研究表明超導轉化溫度隨着鹼金屬摻雜富勒烯的晶胞體積而升高。[62][63] 銫可以形成最大的鹼金屬離子,因此銫摻雜的富勒烯材料被廣泛研究,近來報道Cs3C60As在38K時超導性質,[64] 不過是在高壓下。常壓下33K時具有最高超導轉化溫度的是 Cs2RbC60。[65] C60固體超導性的BCS理論認為,超導轉變溫度隨着晶胞體積的增加而升高,因為C60分子間的間隔與費米能級N(εF)的態密度的升高相關,因此科學家們做了大量的工作試圖增加富勒烯分子間的距離,尤其是將中性分子插入A3C60晶格中來增加間距同時保持C60的價態不變。不過,這種氨化技術意外地得到了新奇的富勒烯插入複合物的特別的性質:Mott-Hubbard轉變以及C60分子的取向/軌道有序和磁結構的關係。[66] C60固體是由弱相互作用力組成的,因此是分子固體,並且保留了分子的性質。一個自由的C60分子的分立能級在固體中只是很弱的彌散,導致固體中非重疊的帶間隙很窄,只有0.5eV[58]。未摻雜的 C60固體,5倍 hu帶是其HOMO能級,3倍的t1u帶是其空的LUMO能級,這個系統是帶禁阻的。但是當C60固體被金屬原子摻雜時,金屬原子會給t1u帶電子或是3倍的t1g帶的部分電子占據有時會呈現金屬性質[67]。雖然它的t1u帶是部分占據的,按照BCS理論A4C60 的t1u帶是部分占據的應該有金屬性質,但是它是一個絕緣體[68],這個矛盾可能用Jahn-Teller效應來解釋,高對稱分子的自發變形導致了它的兼併軌道的分裂從而得到了電子能量。這種Jahn-Teller型的電子-聲子作用在C60固體中非常強以致於可以破壞了特定價態的價帶圖案。[66]窄帶隙或強電子相互作用以及簡併的基態對於理解並解釋富勒烯固體的超導性非常重要。電子相互斥力比帶寬大時,簡單的Mott-Hubbard模型會產生絕緣的局域電子基態,這就解釋了常壓時銫摻雜的C60固體是沒有超導性的[64]。電子相互作用驅動的t1u電子的局域超過了臨界點會生成Mott絕緣體,而使用高壓能減小富勒烯相互間的間距,此時銫摻雜的C60固體呈現出金屬性和超導性。
關於C60固體的超導性還沒有完備的理論,但是BCS理論是一個被廣泛接受的理論,因為強電子相互作用和Jahn-Teller電子-聲子偶合能產生電子對,[69]從而得到較高的絕緣體-金屬轉變溫度。[70]
差示掃描量熱法(DSC)表明C60在256K時發生相變,熵為27.3J.K−1.mol−1,歸因於其玻璃形態-晶體轉變,這是典型的導向無序的轉變。相似地,C70在275K、321K和338K也發生無序轉變,總熵為22.7 J.K−1.mol−1。富勒烯的寬的無序轉變與從起始較低的溫度的類跳躍式旋轉向各向同性的旋轉漸變有關。[71]


富勒烯是穩定的,但並不是完全沒有反應性的。石墨中sp2雜化軌道是平面的,而在富勒烯中為了成管或球其是彎曲的,這就形成了較大的鍵角張力。當它的某些雙鍵通過反應飽和後,鍵角張力就釋放了,如富勒烯的[6,6]鍵是親電的,將sp2雜化軌道變為sp3雜化軌道來減小鍵張力,原子軌道上的變化使得該鍵從sp2的近似120°成為sp3的約109.5°,從而降低了C60球的吉布斯自由能而穩定。富勒烯即可以形成單加成產物,也可以形成多加成產物。 富勒烯化學是研究富勒烯的化學性質的科學。[72][73][74] 功能化富勒烯從而調節其性質的需求促使人們在這個領域展開了大量的研究。例如,富勒烯的溶解度很差,而添加合適的官能團可以提高其溶解度。[72] 通過添加一個可以發生聚合的官能團,就可以獲得富勒烯聚合物。富勒烯的功能化以分為兩類:在富勒烯的籠外進行化學修飾;將分子束縛到富勒烯球內,也就是開孔反應。
因為這個分子的球形結構使碳原子高度稜錐體化,這對其反應活性有深遠的影響。據估計,其應變能相當於80%反應熱能。共軛碳原子平行性影響雜化軌道sp²,一個獲得p電子的sp2.27 軌道[75]。p軌道的互相連結擴大在外球面更勝於其內球(碳原子之間以sp2雜化軌道連結,另一個p電子兩兩形成pi鍵,還有pi電子形成近似球的複雜pi-pi共軛體系),這是富勒烯是給電體的一個原因;另一個原因是,空的低能級pi軌道上。
富勒烯中的雙鍵不完全相同,大致可分為兩種:[6,6]鍵,連接兩個六邊形的鍵,[5,6]鍵連接一個六邊形和五邊形。兩者中[6,6]鍵比環狀六邊形聚合物(cyclohexatriene)分子中的[6,6]鍵和軸烯與二環並戊二烯分子中的雙鍵更短。換句話說,雖然富勒烯分子中的碳原子都是超共軛,但富勒烯卻不是一個超大的芳香化合物。C60有60個pi電子,但封閉殼體系結構需要72個電子。富勒烯能夠通過與鉀的反應獲得缺失電子,如首先合成的K6C60 鹽和接着合成的 K12C60鹽;在這種化合物中,分子中鍵長交替的現象消失了。根據IUPAC的規定,亞甲基富勒烯(也稱環丙烷富勒烯,methanofullerene)指閉環(環丙烷)富勒烯衍生物,而fulleroid指開環富勒烯衍生物(亞甲基橋輪烯,methanoannulene)[76][77]富勒烯往往可以發生親電反應,這類反應的關鍵是功能化單加成反應(monoaddition)或多加成反應(multiple addition)。
在親核加成中富勒烯作為一個親電試劑與親核試劑反應,它形成碳負離子被格利雅試劑或有機鋰試劑等親核試劑捕獲。例如,氯化甲基鎂與C60在定量形成甲基位於的環戊二烯中間的五加成產物後,質子化形成(CH3)5HC60[78]。賓格爾反應也是重要的富勒烯環加成反應,形成亞甲基富勒烯。富勒烯在氯苯和三氯化鋁的作用下可以發生富氏烷基化反應,該氫化芳化作用的產物是1,2加成的(Ar-CC-H)。[79]
富勒烯的[6,6]鍵可以與雙烯體或親雙烯體反應,如D-A反應。[2+2]環加成可以形成四元環,如苯炔[80][81]。1,3-偶極環加成反應可以生成五元環,被稱作Prato反應。富勒烯與卡賓反應形成亞甲基富勒烯。
氫化富勒烯產物如C60H18、C60H36。然而,完全氫化的C60H60僅僅是假設產物,因為分子張力過大。高度氫化後的富勒烯不穩定,而富勒烯與氫氣直接在高溫條件下反應會導致籠結構崩潰,而形成多環芳烴。[82]
富勒烯及衍生物在空氣中會被慢慢的氧化,這也是通常情況下富勒烯需要在避光或低溫中保存的原因。富勒烯與三氧化鋨和臭氧等反應;與臭氧的反應很快很劇烈,可以生成羥基多加成的富勒醇混合物,因為加成數和加成位置有很寬的分布。[83][84][85]
富勒烯可以通過羥基化反應得到富勒醇,其水溶性取決於分子中羥基數的多少。一種方法是富勒烯與稀硫酸和硝酸鉀反應可生成C60(OH)15,另一種方法是在稀氫氧化鈉溶液的催化下反應由TBAH增加24到26個羥基。羥基化反應也有過用無溶劑氫氧化鈉與過氧化氫和富勒烯反應的報道。用過氧化氫與富勒烯的反應合成C60(OH)8,羥基的最大數量,可以達到36至40個。
富勒烯也可以發生親電反應,比如在富勒烯球外加成24個溴原子,最多親電加成紀錄保持者是C60F48。
富勒烯的五元環和六元環可以作為金屬配合物的配體,尤其是五元環,可以形成各種茂基配合物。[86][6,6]雙鍵是缺電子的,通常與金屬成鍵為η= 2(配位化學中的哈普托數)。鍵合模式如η= 5或η=6與球狀富勒烯配體有關。陽光直接照射富勒烯和硫羰基鎢W(CO)6的環己烷溶液生成(η²-C60)5 W(CO)6。
開孔反應是指通過化學手段選擇性地切斷富勒烯骨架上的碳碳鍵來製備開孔富勒烯的反應,[87][88][89]開孔後就可能把一些小分子裝到碳球中,如氫分子、氦、鋰等。第一個開孔富勒烯是在1995由伍德等報道的。[90]
將富勒烯和其它一些功能基團有效的通過非共價作用聯結在一起形成具有特定結構的超分子體系,進而通過調控各個基團之間的電子相互作用實現其功能化的研究引起了研究者們的極大興趣。[91]
由於C60分子獨特的剛性球狀結構,發展能夠與其高效結合的特定主體是一件很有意義的工作,二十多年來科學家們樂此不疲地用新奇的化合物和有趣的方式將其包起來得到包含物和嵌合物,在富勒烯的主客體化學方面進行了大量的研究並取得了長足的進展,發展了一系列主體化合物,大致分為富π電子化合物和大環主體兩類;前者有二茂鐵、卟啉、酞菁、四硫富瓦烯、苝、碗烯和帶狀多共軛體系等的衍生物,後者有環糊精、杯芳烴、氮雜杯芳烴,長鏈烷烴和低聚物等的衍生物。[92]迄今與富勒烯分子超分子結合力最強的是相田卓三教授合成的卟啉籠分子,在鄰二氯苯中與C60的結合常數為Log Ka = 8.11。[93]
修飾富勒烯可以獲得更多的作用位點,因此富勒烯衍生物的超分子自組裝的研究一直是個熱點,遠遠多於不修飾的富勒烯的組裝,特別是在基於富勒烯的功能材料、光致電子轉移、人工光合作用體系、光子器件等諸多的研究領域。[94][95][96]
富勒烯功能化後產生的自組裝前體,通過超分子作用形成有序聚集態結構,既是提高對富勒烯本徵認識以及單分子器件構築水平,也是對富勒烯高新技術功能化材料的需要。十多年來,很多研究組已經在獲得穩定的C60納米材料如納米顆粒、納米管、納米線、納米帶和高度有序二維結構等方面進行了大量的研究,發展了經典自組裝法、模板法、氣相沉積法,化學吸附和LB膜技術等方法來構築具有特定形貌的有機納米材料。[97][98]
摩薩(Moussa)等人做了在生物體腹腔內注射大劑量C60後的毒理研究後發現,沒有證據表明白鼠在注射5000mg/kg(體重)的C60劑量後有中毒現象。[99][100] 摩利(Mori)等人也沒有發現給齧齒動物口服 C60和C70混合物2000mg/kg的劑量後有中毒、遺傳毒性或誘變性現象,[101] 其他人的研究同樣證明C60和C70是無毒的,而伽比(Gharbi)等人發現注射C60懸浮液不會導致對齧齒類動物的急性或亞急生毒性,相反一定劑量的C60會保護他們的肝免受自由基傷害。[102]2012年的最新研究表明,口服富勒烯能將小鼠的壽命延長一倍而沒有任何副作用。[103]摩薩(Moussa)教授研究C60的性質長達18年,著有 《持續餵服小鼠C60使其壽命延長》一文,2012年10月他在一次視頻採訪中宣稱,純C60沒有毒性。[104]
科拉森加(Kolosnjaj)於2007年寫了篇複雜且詳盡的關於富勒烯的毒性的綜述,[105][106]回顧了上世紀90年代早期至今的所有富勒烯的毒性研究的工作,認為自富勒烯發現以來都沒有明顯的證據表明C60是有毒性的,而波蘭(Poland)等人將碳納米管注射到小鼠的腹腔中發現了石棉狀的病灶。[107]值得注意的是這項研究不是吸入性研究;雖然在這之前有對納米管的吸入性研究的毒理實驗,因此,憑此項研究還不能確認碳納米管有類似石棉的毒理特性。薩耶等人發現小鼠吸入C60(OH)24或納米C60並沒有毒副作用,而同樣情況下將石英顆粒注入小鼠則引起強烈的炎症。[108]如上所述,納米管在分子量、形狀、尺寸等化學和物理性質(溶解度)方面都與C60迥然不同,因此從毒理學的角度來看,C60和碳納米管的不同毒理學性質的差異性沒有關聯性。在分析毒性數據時,必須區別富勒烯的不同分子:(C60、C70 ……);富勒烯衍生物:C60或其他化學修飾的富勒烯衍生物;富勒烯複合物(比如,表面活性劑輔助的水溶性富勒烯,如C60-聚乙烯基吡咯烷酮;主客體複合物,如與環糊精或卟啉),這種情況下富勒烯是與其他分子是通過超分子作用與其他分子連接的;C60納米顆粒。
應用
富勒烯衍生物與卟啉、二茂鐵等富電子基團共價或非共價形成多元體,用於研究分子內能量、電荷轉移、光致能量和電荷轉移。[110][111]
自1995年俞剛博士將富勒烯的衍生物PCBM([6,6]-phenyl-c61-butyric acid methyl ester,簡稱PC61BM或PCBM)用於本體異質結有機太陽能電池以來,有機太陽能電池得到了長足的發展,其中有三家公司已經將摻雜PCBM的有機太陽能電池商用,迄今大部分有機太陽能電池以富勒烯做為電子受體材料。[112][113][114][115]
流行文化
在流行文化中的富勒烯元素很多,並且在科學家關注它們之前就出現了。在《新科學家》雜誌中,曾經每周有瓊斯(David E. H. Jones)寫的叫做《地達拉斯》(Daedalus)的專欄來描述各種有趣但很難實現的科學和技術。1966年,他建議可能通過摻雜雜原子來扭曲一個平面的六邊形組成的網來得到一個中空的碳球分子。[116]
2010年9月4日,谷歌的首頁上用一個旋轉的C60富勒烯取代了GOOGLE圖案中的第二個"O"來慶祝富勒烯發現25周年。[117][118]
參看
參考文獻
延伸閱讀
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.




