热门问题
时间线
聊天
视角
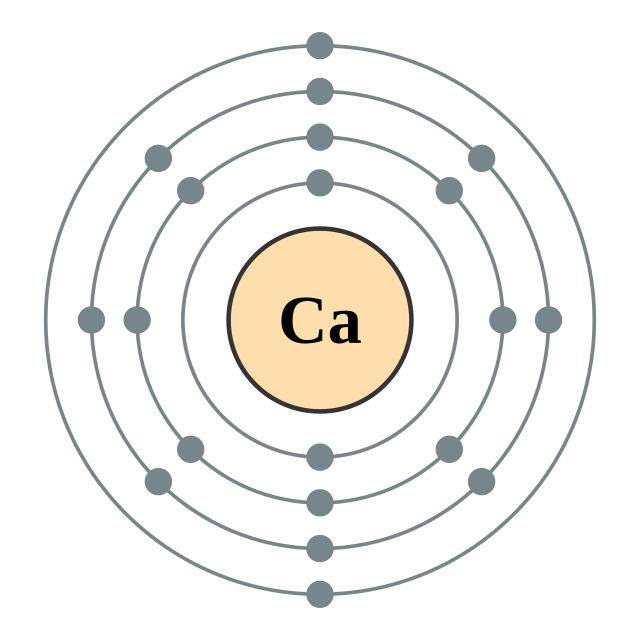
钙
原子序數為20的化學元素 来自维基百科,自由的百科全书
Remove ads
钙(英语:Calcium),是一种化学元素,化学符号为Ca,原子序数为20,原子量为40.078 u。钙是一种银白色碱土金属,化学活动性颇高,暴露于空气下就会形成深色的氧化物和氮化物。它的物理和化学性质与其较重的同族元素锶(Sr)和钡(Ba)相似。它是地壳中第五丰富的元素,占地壳总质量3%[4],也是地壳中第三丰富的金属,仅次于铁和铝。地球上最常见的钙化合物是存在于石灰岩和早期海洋生物的化石残骸的碳酸钙。石膏、硬石膏,萤石和磷灰石也是钙的来源。钙的名称源自拉丁语 calx,意为石灰。
虽然在很久以前就已经发现许多钙的化合物,但是在十七世纪后才开始对这些化合物的性质有更深一层的了解。单质钙直到1808年才由命名这个元素的汉弗里·戴维借由电解其氧化物分离出来。钙化合物有广泛的工业应用:钙补充剂、在造纸工业中作为漂白剂的使用、水泥和绝缘体的原料以及用于制作肥皂。另一方面,纯钙因为反应性高而用处不多。少量的纯钙用于制造合金,钙铅合金也可以做汽车电池。
钙是人体内第五丰富的元素,也是最丰富的金属元素。[5]作为电解质,钙离子在生物体及细胞内的化学反应中扮演重要的角色。钙离子是第二信使系统的一分子,也是神经元释放的神经递质之一。它参与肌肉收缩的过程,也是各种酵素的辅因子。[5]细胞外的钙离子则负责维持细胞膜内外的电位差,合成蛋白质,并在成骨作用中扮演关键角色。[5][6]
Remove ads
性质
钙是有延展性的银色金属(有时描述为浅黄色),性质和较重的碱土金属镁、锶、钡和镭非常相似。一个钙原子有二十个电子,电子排布为 [Ar]4s2。和其它碱土金属一样,钙在最外层的s轨道里有两个价电子,极易在化学反应中失去它们,产生有稳定的稀有气体电子层结构的二价阳离子。[7]
由于CaX2的标准摩尔生成焓远高于CaX,CaX2的晶格能也远大于CaX,因此钙化合物也多以二价离子化合物存在。 [7]
碱土金属中,铍与同族的镁、钙、锶、钡相比差别较大,性质更像铝和锌,且有贫金属的性质,这使得某些地区对“碱土金属”的传统定义会把它排除在外。[8]
钙的熔点是842 °C,沸点是1494 °C,这些值比相邻周期的镁和锶都高。它的晶体结构和锶一样是面心立方晶系,超过450 °C时会转变成和镁一样的六方最密堆积结构。钙的密度为1.55 g/cm3,是所有碱土金属中最小的。[7]
钙比铅硬,但仍然可以用刀切割。虽然按体积计算的话,钙的导电性比铜和铝差,但由于其密度非常低,按质量计算的话钙的导电性就会比铜和铝好。[9]尽管钙因为会和空气中的氧气反应,在大多数作为导体的应用中不可用,但有人已考虑将其用于太空。[9]
钙的化学性质与碱土金属中的锶、钡相似。举个例子,钙和水反应生成氢氧化钙和氢气的速度比镁快,但比锶慢。它也会和空气中的氧气和氮气反应,形成氧化钙和氮化钙的混合物。[10]细碎的钙会在空气中自发燃烧,形成氮化物。大块的钙的反应性较低,会和空气中的水蒸气反应,但在湿度低于30%下可以无限期保存。[11]
- 、
- 钙在空气中的缓慢氧化[12]
除了简单氧化物CaO以外,钙的过氧化物 CaO2可以由金属钙被高压氧气直接氧化而成,而且有证据表明黄色的超氧化物 Ca(O2)2存在。[13][14]
钙单质与其氧化物会直接与水发生反应,得到氢氧化钙 Ca(OH)2,其是一种强碱,碱性弱于锶、钡和碱金属的氢氧化物。[15]
- 钙、锶、钡单质及其氧化物会与水剧烈反应,而铍和镁与水的反应十分缓慢[16]
钙的四种二卤化物都是已知的,[17]无水氯化钙可用作干燥剂,氟化钙是制取HF和F2的原料[18]。 大多数碱土金属的盐类都难溶于水,碳酸钙(CaCO3)和硫酸钙(CaSO4)都是常见的矿物组成。[19]
- 钙的碳酸盐在受热时(1173 K)分解[20]
像锶和钡,以及碱金属和二价的镧系元素铕和镱一样,金属钙可溶于液氨,形成深蓝色溶液。[7]
由于Ca2+离子较大,所以它的配位数也较高,在像是CaZn13的金属间化合物中甚至能达到24。[21]钙会和含氧的螯合剂如EDTA和多聚磷酸盐形成螯合物,这个性质可用于分析化学和在硬水中除去钙离子。在没有空间位阻影响的情况下,越小的碱土金属阳离子形成的配合物越稳定,但当与多齿配体螯合形成大环化合物时,该趋势则相反。[19][22]
虽然同族的镁可以形成很多常用的有机镁化合物,有机钙化合物却因为更难制造且反应性更强而较少被使用。不过,最近有人已将它们作为可能的催化剂研究。[23][24][25][26][27]由于Yb2+(102 pm)和Ca2+(100 pm)的离子半径相似,有机钙化合物的性质更像有机镱化合物。[28]
大部分有机钙化合物都只能在低温下合成,而在这些化合物中使用大位阻基团可以增加稳定性。举个例子,二茂钙 Ca(C5H5)2只能由钙和二茂汞或是环戊二烯反应而成,而将C5H5基团替换成更大的C5(CH3)5增加了化合物的溶解度、挥发性和动力学稳定性。[28]

Remove ads
天然钙有五种稳定同位素(40Ca、42Ca、43Ca、44Ca和46Ca)和半衰期长到可以看作稳定的48Ca(半衰期4.3 × 1019年)的混合物。钙是第一种有六个天然同位素的元素。[10]
在这六种同位素中,40Ca最常见,占了天然钙的96.941%。它是硅燃烧过程中产生的,也是质子数和中子数相等的稳定同位素中最重的。此外,原生同位素40K的衰变也使40Ca的数量不断增加。40Ca捕获一个α粒子会产生不稳定的44Ti,后者迅速发生两次电子捕获,生成稳定的44Ca。它是第二常见的钙同位素,占了2.806%。[29][30]
剩下的四种同位素42Ca、43Ca、46Ca和48Ca较为稀有,它们在天然钙的含量都不足1%。钙较轻的四种同位素是氧燃烧过程和硅燃烧过程的主要产物,而剩下的两种重同位素则需要通过中子捕获产生。46Ca主要在“热”s-过程中,短寿的45Ca捕获一个中子而成的,而48Ca则是Ia超新星的r-过程产生的。[29][30]
在分别多出六个和八个中子的核素中,46Ca和48Ca是其中最轻的“稳定”核素。虽然48Ca的中子很多,但它的质子数20和中子数28都是幻数,所以非常稳定。它β衰变成48Sc的过程因为自旋的严重失配而受到很大阻碍:48Ca的自旋为0,而48Sc的自旋为6+,所以衰变被角动量的转化所禁止。因此,48Ca的衰变方式是双β衰变成48Ti,它也是已知会双β衰变的同位素里最轻的。[31][32]
46Ca理论上也可以双β衰变成46Ti,但这个过程仍未被观察到。最轻也最常见的40Ca的质子数和中子数也都是幻数,理论上可以双电子捕获成40Ar,但这也一样仍未被观察到。40Ca和46Ca的半衰期下限分别为5.9 × 1021年和2.8 × 1015年。[31]
除开几乎稳定的48Ca以外,钙最稳定的放射性同位素是41Ca。它通过电子捕获衰变成41K,半衰期约为十万年。自然界中存在痕量的41Ca,它们是由40Ca中子活化而成的。[30]
其它从35Ca到60Ca的放射性钙同位素也是已知的,它们都比41Ca更短寿。在这之中最稳定的是45Ca(半衰期163天)和47Ca(半衰期4.54天)。比42Ca轻的钙同位素会正β衰变成钾的同位素,而比44Ca的钙同位素会负β衰变成钪的同位素。不过当这些同位素逼近原子核滴线时,质子发射和中子发射会变成它们的主要衰变方式。[31]
Remove ads
历史

虽然在很久以前就已经发现许多钙的化合物,但是在十七世纪后才开始对这些化合物的性质有更深一层的了解。[33]早在公元前7000年,石灰就被用作建材[34]和雕像的熟石膏。[35]第一个石灰窑可以追溯到公元前2500年,于美索不达米亚的哈法耶被发现。[36][37]
石膏(CaSO4·2H2O)是胡夫金字塔的建材,也是图坦卡蒙陵墓中熟石膏的材料。古罗马人则通过使用加热石灰岩(CaCO3)产生的石灰砂浆作为建材。钙的名称“calcium”源自拉丁文“calx”,意为石灰。[33]
维特鲁威注意到煅烧石灰岩产生的石灰会比原本的石灰岩轻,并把这个现象归咎于水的沸腾。1755年,约瑟夫·布拉克证明这是因为煅烧过程会释放二氧化碳气体,而它并没有被古罗马人发现到。[38]
钙和同族的镁、锶和钡都是由汉弗里·戴维在1808年分离的。继约恩斯·贝尔塞柳斯和马格努斯·马丁·阿夫·庞廷电解的工作后,戴维通过将金属氧化物与氧化汞的混合物放在铂板上作为阳极,阴极则是部分浸入汞中的铂丝。之后,他通过电解产生钙汞齐和镁汞齐,然后蒸馏掉汞得到金属钙和镁。[33][39]不过,纯钙不能通过这种方法大量制备,直到一个多世纪后才发现了一种在商业上可行的生产方法。[38]
Remove ads
存在和生产

钙是地球地壳中第五丰富的元素,也是第三丰富的金属,仅次于铝和铁。[33]它也是月陆中第四丰富的元素。[11]碳酸钙沉积岩作为以前的海洋生物的化石残骸,以两种形式遍布地球表面,分别为三方晶系的方解石(更常见)和正交晶系的霞石(在温带海域中形成)。珊瑚、贝壳和珍珠的主要成分都是碳酸钙。除了方解石和霞石,其它重要的钙矿包括石膏(CaSO4·2H2O)、硬石膏(CaSO4)、萤石(CaF2)和磷灰石([Ca5(PO4)3F])。[33]
钙的主要生产者是中国(每年约10000至12000吨)、俄罗斯(每年约6000至8000吨)和美国(每年约2000至4000吨),加拿大和法国也是次要生产国。2005年,全球钙产量约为24000吨,其中大约一半被美国使用。[9]
俄罗斯和中国仍然使用戴维的电解方法来生产钙,但用了熔融氯化钙代替氧化钙。[9]因为钙的反应性低于锶或钡,所以和空气反应产生的氧化物-氮化物层是稳定的,可以车床加工。[40]在美国和加拿大,钙则是由铝在高温下还原石灰而成的。[9]
Remove ads
钙循环提供了地质构造运动、气候和碳循环之间的联系。山脉的隆起会使花岗岩等含钙岩石经受化学风化作用,并将Ca2+离子释放到地表水中。这些离子之后会被运输到海洋,和海水溶解的CO2反应生成石灰石(CaCO
3),沉降到海底并合并到新的岩石中。海水溶解的CO2、碳酸根和碳酸氢根都属于“溶解无机碳”(DIC)。[41]
实际反应要更复杂,涉及CO2和水在海水pH下反应而成的碳酸氢根离子(HCO−
3):
在海水的pH下,大部分溶解的CO2都会立刻变成HCO−
3。该反应导致一分子CO2从海洋或大气净传输到岩石圈。[42]反应的结果是化学风化释放的每个Ca2+离子最终会从地表(大气、海洋、土壤和生物体)中去除一个CO2分子,并将其储存到碳酸盐矿物中停留数亿年。因此,岩石中钙的风化作用会清除海洋和大气中的CO2,对气候产生强烈的长期影响。[41][43]
Remove ads
用途
由于其对氧和硫的化学亲和性很强,金属钙最大的用处是炼钢[44]。它的氧化物和硫化物一旦形成,就会以夹杂物的形式从钢中浮出,处理后这些夹杂物就会分散在整个钢中并变成小球状,从而提高了可铸性、清洁度和机械性能。钙也可以生产无需维护的汽车蓄电池,在这些蓄电池中使用了0.1 % 钙铅合金来代替常用的锑铅合金[45],减少了失水量和自放电量。[46]由于存在膨胀和开裂的风险,有时还会将铝加入这些合金中。钙铅合金也用于铸造。[46]钙还用于强化用于轴承的铝合金,控制铸铁中的石墨碳以及去除铅中的铋杂质。[40]金属钙还存在于一些沟渠清洁剂中,它遇水产生的热和氢氧化钙可以皂化脂肪和液化阻塞下水道的蛋白质(例如头发中的角蛋白)。[47]
除了炼钢,钙的反应性还可以用于从高纯氩气中去除氮气,也是氮气和氧气的吸气剂。它也用于在铬、锆、钍和铀的生产中充当还原剂。钙也可以用来储存氢气,因为它与氢气反应形成氢化钙固体,氢气可以很容易地从其中重新放出。[40]
据报道,钙同位素在形成矿物时观察到类似“分馏”的现象。1997年,Skulan和DePaolo观察到[48]钙矿中的钙同位素略比矿物溶液中的钙同位素轻,这一研究成为了医学和古海洋学中类似应用的基础。因此在骨骼被钙化的动物中,软组织的钙同位素丰度可以反映骨骼矿物质形成和溶解的相对速率。[49]
在人体中,尿液中钙同位素丰度的变化已被证明与骨矿物质平衡的变化有关。当骨头形成的速率比固体被吸收的速率快时,软组织的44Ca/40Ca比例会增加,反之亦然。因为这种关系,测量尿液或血液的钙同位素可能有助于早期检测骨质疏松等代谢性骨病。[49]
类似的系统也存在于海水中。当矿物沉淀去除Ca2+的速率超过新的钙流向海洋的速率时,海水的44Ca/40Ca的比例趋于上升。1997年,Skulan和DePaolo提出了海水44Ca/40Ca随地质时间变化的第一个证据,以及对这些变化的理论解释。最近的论文证实了这一观察结果,表明海水中的Ca2+浓度不是恒定的,并且海洋在钙输入和输出方面从未处于“稳定状态”。这个发现具有重要的气候学意义,因为海洋的钙循环与碳循环密切相关。[50][51]
很多钙化合物用于食品、药品和医药等用处。人们会通过添加乳酸钙、焦磷酸钙和磷酸钙来补充食物中的钙和磷,而磷酸钙也用作牙膏的抛光剂和抗酸药。乳糖酸钙是用作药物的悬浮剂的白色粉末,磷酸二氢钙在烘培中可用作膨松剂,亚硫酸钙在造纸中用作漂白剂和消毒剂,硅酸钙是橡胶的强化剂,而乙酸钙用于制造肥皂和合成树脂。[46]
钙列于世界卫生组织基本药物标准清单当中。[52]
食物来源
富含钙的食物包括如优格和起司的乳制品、沙丁鱼、鲑鱼、大豆制品、羽衣甘蓝和补充了钙的谷物片。[6]
由于担心大量摄入钙导致的长期副作用(如动脉钙化和肾结石),美国国家医学院(IOM)和欧洲食品安全局(EFSA)都对钙设了可耐受最高摄入量(ULs)。美国国家医学院定的值是9–18岁不超过3克/日,19–50岁不超过2.5克/日,51岁以上不超过2克/日。[53]欧洲食品安全局定的值对所有成年人都是2.5克/日,但因为儿童和青少年的信息不足而没有确定他们的可耐受最高摄入量。[54]
对人体的影响

<400
400–500
500–600
600–700
700–800
800–900
900–1000
>1000
钙是人体大量需要的生命元素。[5][6]Ca2+离子起到电解质的作用,对肌肉、循环和消化系统的健康至关重要。此外,钙对于骨骼的构建是必不可少的,而且还参与了血细胞的合成。钙也调节肌肉收缩、神经传导和血液的凝固。Ca2+离子可以和很多有机化合物(尤其是蛋白质)形成稳定的配合物,因此它才能发挥这种作用。钙化合物的溶解度的范围很大,使骨骼得以形成。[5][57]
钙离子和蛋白质的结合方式有三种:第一种方式是和谷氨酸或天冬氨酸的羰基结合,第二种方式是和磷酸化的丝氨酸、酪氨酸或苏氨酸结合,第三种方式则是和γ-羧基化的氨基酸螯合。胰蛋白酶是一种消化酶,它使用第一种结合方式;而骨钙蛋白是一种骨基质蛋白,它使用第三种结合方式。[58]
一些像是骨桥蛋白和骨涎蛋白等骨基质蛋白同时使用第一种和第二种结合方式。和钙结合是酶常见的激活方式,其它一些酶的激活方式则是与结合了钙的酶结合。钙还与细胞膜的磷脂层结合,锚定与细胞表面相关的蛋白质。[58]
钙是复合维生素的常见成分,[5]但在里面的是哪种钙化合物可能会影响其生物利用度。柠檬酸钙、苹果酸钙和乳酸钙的生物利用度都很高,而草酸钙的生物利用度较低。其它可用的钙化合物包括碳酸钙、柠檬酸苹果酸钙和葡萄糖酸钙。[5]摄入的钙有约三分之一会以游离离子的形式被肠道吸收,然后由肾脏调节血浆钙水平。[5]
甲状旁腺激素和维生素D都可以通过允许和增强钙离子沉积来促进骨骼的形成,从而在不影响骨量或矿物质含量的情况下实现快速骨转换。[5]当血浆钙水平下降时,细胞表面受体会被激活并分泌甲状旁腺激素,然后通过从肾、肠和骨细胞中提取钙来刺激钙进入血浆。甲状旁腺激素的骨形成作用会被降钙素拮抗,其分泌随着血浆钙水平的增加而增加。[58]
过量摄入钙会导致高血钙症,不过因为肠道对钙的吸收效率相当低,高血钙症更可能是因为甲状旁腺激素(PTH)分泌过多或维生素D摄入过多引起的,它们都有利于钙的吸收。所有这些情况都会导致过量的钙沉积在心脏、血管或肾脏中。高血钙症的症状包括厌食、恶心、呕吐、记忆力减退、精神错乱、肌肉无力、排尿增多、脱水和代谢性骨病。[58]
长期高血钙症通常会导致软组织的钙化,并造成严重的后果。钙化会导致血管壁丧失弹性和血流中断,进而产生易损斑块和血栓。相反的,钙或维生素D摄入不足会导致低血钙症,常由甲状旁腺激素分泌不足或细胞内的PTH受体有缺陷引起。低血钙症的症状包括神经肌肉兴奋,这可能会导致手足强直和心脏组织传导性的破坏。[58]
由于骨骼的发育需要钙,所以很多骨病都可以追溯到骨骼组织中的有机基质或羟基磷灰石的结构。骨质疏松是每单位体积骨骼中矿物质含量的减少,可以通过补充钙、维生素D和双膦酸盐来治疗。[5][6]钙、维生素D和磷酸盐摄入不足会导致骨质软化。[58]
危险性
金属钙会与水和酸剧烈反应,所以接触人体中的水分后会造成严重的腐蚀。[59]吞下金属钙会严重腐蚀口腔、食道和胃,甚至可能致命。[47]长期接触钙会不会产生明显的不利影响仍不明确。[59]
参考文献
扩展阅读
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




![{\displaystyle {2\,\mathrm {Ca} {}+{}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {CaO} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3245952fb42c632bef3b5a3b94ab02178fe4e80a)
![{\displaystyle {3\,\mathrm {Ca} {}+{}\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {Ca} {\vphantom {A}}_{\smash[{t}]{3}}\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2880c6bc9d2b19cdb37ac71fb6b0a25150efd97d)
![{\displaystyle {\mathrm {Ca} {}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {Ca} (\mathrm {OH} ){\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2f55978f68a3082a24f0ca55b3e50639323cf692)
![{\displaystyle {\mathrm {CaCO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}\mathrm {CaO} {}+{}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/c2cb5872a723d310f8479cf76ac440b32a0e86f3)


