Loading AI tools
belirli bir hastalığa karşı bağışıklık sağlamak için üretilen biyolojik ilaç Vikipedi'den, özgür ansiklopediden
Aşı, belirli bir bulaşıcı veya malign hastalığa karşı aktif kazanılmış bağışıklık sağlayan biyolojik bir preparattır.[1][2] Aşıların güvenliği ve etkinliği geniş çapta incelenmiş ve doğrulanmıştır.[3][4] Bir aşı tipik olarak hastalığa neden olan bir mikroorganizmaya benzeyen bir ajan içerir ve genellikle mikrobun zayıflatılmış veya öldürülmüş formlarından, toksinlerinden veya yüzey proteinlerinden yapılır. Vücudun bağışıklık sistemi ajanı bir tehdit olarak tanır, yok eder ve bu sayede gelecekte karşılaşabileceği bu ajanla ilişkili mikroorganizmaları daha fazla tanır ve yok eder.
| Aşı | |
|---|---|
 Çiçek aşısı ve aşıyı uygulamak için gerekli ekipman | |
| MeSH | D014612 |
Aşılar profilaktik (doğal veya "vahşi" bir patojen tarafından gelecekteki bir enfeksiyonun etkilerini önlemek veya iyileştirmek için) veya terapötik (kanser gibi zaten meydana gelmiş bir hastalıkla savaşmak için) olabilir.[5][6][7][8] Bazı aşılar, enfeksiyonun tamamen önlendiği tam sterilize edici bağışıklık sunar.[9]
Aşıların uygulanmasına aşılama denir. Aşılama, bulaşıcı hastalıkların önlenmesinde en etkili yöntemdir;[10] çiçek hastalığının dünya çapında ortadan kaldırılmasından ve çocuk felci, kızamık ve tetanos gibi hastalıkların dünyanın büyük bir bölümünden sınırlandırılmasından büyük ölçüde aşılama sayesinde oluşturulan yaygın bağışıklık sorumludur. Dünya Sağlık Örgütü (DSÖ) şu anda yirmi beş farklı önlenebilir enfeksiyon için lisanslı aşıların mevcut olduğunu bildirmektedir.[11]
Çiçek hastalığını önlemek için inokülasyonun kayıtlara geçen ilk kullanımı 16. yüzyılda Çin'de gerçekleşmiş olup, Çin'deki uygulamanın ilk ipuçları 10. yüzyılda ortaya çıkmıştır.[12] Bu, aynı zamanda aşısı üretilen ilk hastalıktı.[13][14] Çiçek hastalığına karşı halk arasında uygulanan inokülasyon 1721 yılında Mary Wortley Montagu tarafından Osmanlı İmparatorluğu'ndan İngiltere'ye getirilmiştir.[15] Vaccine (aşı) ve vaccination (aşılama) terimleri, hem aşı kavramını geliştiren hem de ilk aşıyı yaratan Edward Jenner tarafından inek çiçeğini ifade etmek için geliştirilen Variolae vaccinae (inek çiçeği) teriminden türetilmiştir. Jenner bu ifadeyi 1798 yılında inek çiçeğinin çiçek hastalığına karşı koruyucu etkisini anlattığı Variolae vaccinae Known as the Cow Pox adlı kitabının uzun başlığı için kullanmıştır.[16] 1881 yılında Louis Pasteur, Jenner'ı onurlandırmak için bu terimlerin o dönemde geliştirilmekte olan yeni koruyucu aşıları da kapsayacak şekilde genişletilmesini önermiştir.[17] Aşı geliştirme ve üretme bilimi aşı bilimi olarak adlandırılır.

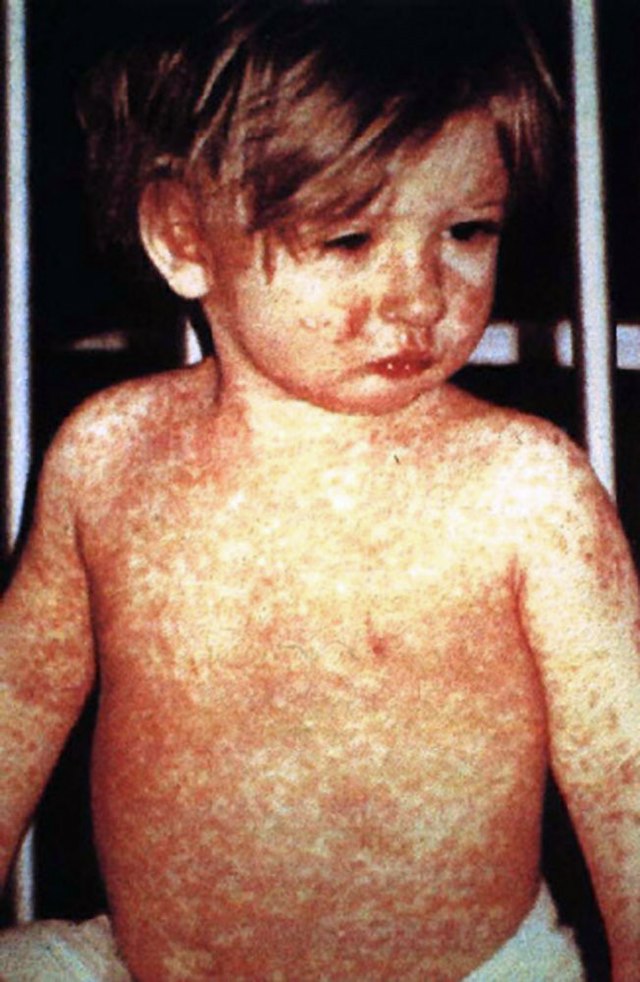
Aşıların bulaşıcı hastalıklarla mücadele etmenin ve bu hastalıkları ortadan kaldırmanın çok güvenli ve etkili bir yolu olduğu konusunda büyük bir bilimsel görüş birliği vardır.[19][20][21][22] Bağışıklık sistemi aşı ajanlarını yabancı olarak tanır, onları yok eder ve "hatırlar". Bir ajanın virülan versiyonuyla karşılaşıldığında, vücut virüsün üzerindeki protein kabuğunu tanır ve böylece ilk olarak hedef ajanı hücrelere girmeden önce nötralize ederek ve ikinci olarak bu ajan çok sayıda çoğalmadan önce enfekte olmuş hücreleri tanıyıp yok ederek yanıt vermeye hazırlanır.[23][24]
Bununla birlikte, aşıların etkinliklerine yönelik sınırlamalar mevcuttur.[25] Bazen, aşı zayıflaması, aşılama rejimleri veya uygulamadaki başarısızlıklar gibi aşı ile ilgili nedenlerden dolayı koruma başarısız olmaktadır.[26]
Başarısızlık, konakçının bağışıklık sisteminin yeterli veya hiç yanıt vermemesi durumunda konakçıya bağlı nedenlerle de ortaya çıkabilir. Konakçıya bağlı yanıt eksikliği, genetik, bağışıklık durumu, yaş, sağlık ve beslenme durumu gibi faktörlere bağlı olarak bireylerin tahmini %2-10'unda görülür.[26] Genetik başarısızlıkla sonuçlanan birincil immün yetmezlik bozukluğunun bir türü, B hücresi gelişimi için gerekli olan bir enzimin yokluğunun, konağın bağışıklık sisteminin bir patojene karşı antikor üretmesini engellediği X'e bağlı agamaglobulinemidir.[27][28]
Konak-patojen etkileşimleri ve enfeksiyona verilen yanıtlar, bağışıklık sistemindeki çoklu yolları içeren dinamik süreçlerdir.[29][30] Bir konakçı anında antikor geliştirmez: vücudun doğuştan gelen bağışıklığı on iki saat gibi kısa bir sürede aktive olabilirken, adaptif bağışıklığın tam olarak gelişmesi 1-2 hafta sürebilir. Bu süre zarfında konakçı hâlâ enfekte olabilir.[31]
Antikorlar üretildikten sonra, ilgili antikor sınıfına bağlı olarak çeşitli yollardan herhangi biriyle bağışıklık desteklenebilir. Bir patojeni temizlemedeki veya etkisiz hale getirmedeki başarı, üretilen antikorların miktarına ve bu antikorların ilgili patojen türüne karşı ne ölçüde etkili olduğuna bağlı olacaktır, çünkü farklı türler belirli bir bağışıklık reaksiyonuna farklı şekilde duyarlı olabilir.[30] Bazı durumlarda aşılar tam veya kalıcı bağışıklık yerine kısmi bağışıklık koruması (bağışıklığın %100'den daha az etkili olduğu ancak yine de enfeksiyon riskini azalttığı) veya geçici bağışıklık koruması (bağışıklığın zaman içinde azaldığı) ile sonuçlanabilir. Yine de aşılar bir bütün olarak popülasyon için yeniden enfeksiyon eşiğini yükseltebilir ve önemli bir etki yaratabilir.[32] Ayrıca aşılar enfeksiyonun şiddetini azaltarak daha düşük ölüm oranı, daha düşük morbidite, hastalıktan daha hızlı iyileşme ve çok çeşitli başka etkilere neden olabilir.[33][34]
Daha yaşlı olanlar genellikle daha genç olanlara göre daha az tepki gösterirler, bu da immünosenesans olarak bilinen bir modeldir.[35] Adjuvanlar, özellikle basit bir aşıya karşı bağışıklık tepkisi zayıflamış olabilecek yaşlı kişilerde bağışıklık tepkisini artırmak için yaygın olarak kullanılır.[36]
Aşının etkinliği veya performansı çeşitli faktörlere bağlıdır:
Aşılanmış bir birey aşılanan hastalığa yakalanırsa (atılım enfeksiyonu) hastalığın aşılanmamış vakalara göre daha az öldürücü olması muhtemeldir.[38]
Etkili bir aşılama programında dikkat edilmesi gereken önemli hususlar şunlardır:[39]
1958 yılında Amerika Birleşik Devletleri'nde 763.094 kızamık vakası görülmüş ve 552 kişi hayatını kaybetmiştir.[40][41] Yeni aşıların kullanılmaya başlanmasından sonra vaka sayısı yılda 150'nin altına düşmüştür (medyan 56).[41] 2008 yılının başlarında 64 şüpheli kızamık vakası görülmüştür. Bu enfeksiyonların elli dördü başka bir ülkeden ithalatla ilişkilendirilmiştir, ancak sadece yüzde on üçü gerçekten Amerika Birleşik Devletleri dışında edinilmiştir; 64 kişiden 63'ü ya hiç kızamık aşısı olmamıştır ya da aşı olup olmadıkları belirsizdir.[41]
Aşılar, insanlardaki en bulaşıcı ve ölümcül hastalıklardan biri olan çiçek hastalığının ortadan kaldırılmasını sağlamıştır.[42] Kızamıkçık, çocuk felci, kızamık, kabakulak, suçiçeği ve tifo gibi diğer hastalıklar, yaygın aşılama programları sayesinde artık yüz yıl önceki kadar yaygın değildir. İnsanların büyük çoğunluğu aşılandığı sürece bir hastalık salgınının ortaya çıkması çok daha zordur. Bu etkiye sürü bağışıklığı denmektedir. Sadece insanlar arasında bulaşan çocuk felci, endemik çocuk felcinin sadece üç ülkenin (Afganistan, Nijerya ve Pakistan) bazı bölümleriyle sınırlandırıldığı kapsamlı bir eradikasyon kampanyasının hedefidir.[43] Ancak, tüm çocuklara ulaşmanın zorluğu, kültürel yanlış anlamalar ve dezenformasyon, öngörülen eradikasyon tarihinin birkaç kez kaçırılmasına neden olmuştur.[44][45][46][47]
Aşılar ayrıca antibiyotik direncinin gelişmesini önlemeye de yardımcı olur. Örneğin, aşı programları Streptococcus pneumoniae'nin neden olduğu zatürre vakalarını büyük ölçüde azaltarak penisilin veya diğer birinci basamak antibiyotiklere dirençli enfeksiyonların yaygınlığını büyük ölçüde azaltmıştır.[48]
Kızamık aşısının her yıl bir milyon ölümü önlediği tahmin edilmektedir.[49]
Çocuklara, ergenlere veya yetişkinlere yapılan aşılar genellikle güvenlidir.[50][51] Yan etkiler - eğer varsa - genellikle hafiftir.[52] Yan etkilerin oranı söz konusu aşıya göre değişir.[52] Bazı yaygın yan etkiler arasında ateş, enjeksiyon bölgesi çevresinde ağrı ve kas ağrıları yer alır.[52] Ayrıca, bazı kişiler aşıdaki bileşenlere karşı alerjik olabilir.[53] KKK aşısı nadiren ateşli nöbetlerle ilişkilendirilir.[51]
Genetik, sağlık durumu (altta yatan hastalık, beslenme, hamilelik, hassasiyetler veya alerjiler), bağışıklık yeterliliği, yaş ve ekonomik etki veya kültürel çevre gibi bir kişiyi enfeksiyona duyarlı hale getiren konakçı ("aşı") ile ilgili belirleyiciler, enfeksiyonun şiddetini ve aşıya yanıtı etkileyen birincil veya ikincil faktörler olabilir.[26] Yaşlı (60 yaş üstü), alerjene aşırı duyarlı ve obez kişiler, aşı etkinliğini önleyen veya engelleyen, muhtemelen bu spesifik popülasyonlar için ayrı aşı teknolojileri veya virüs bulaşmasını sınırlamak için tekrarlayan takviye aşıları gerektiren tehlikeye atılmış immünojenisiteye duyarlıdır.[26]
Ciddi yan etkiler son derece nadirdir.[51] Suçiçeği aşısı bağışıklık sistemi yetersiz bireylerde nadiren komplikasyonlarla ilişkilidir ve rotavirüs aşıları orta derecede intussusepsiyon ile ilişkilidir.[51]
En az 19 ülkede, aşılamanın ciddi olumsuz etkilerine maruz kalanlara tazminat sağlamak için hatasız tazminat programları bulunmaktadır.[54] Amerika Birleşik Devletleri'nin programı Ulusal Çocukluk Çağı Aşı Yaralanmaları Yasası olarak bilinmektedir ve Birleşik Krallık'ta Aşı Hasar Ödemesi uygulanmaktadır.

Aşılar tipik olarak zayıflatılmış, inaktive edilmiş veya ölü organizmalar veya bunlardan elde edilen saflaştırılmış ürünler içerir. Kullanımda olan çeşitli aşı türleri vardır.[55] Bunlar, yararlı bir bağışıklık tepkisi oluşturma yeteneğini korurken hastalık riskini azaltmaya çalışmak için kullanılan farklı stratejileri temsil etmektedir.
Bazı aşılar canlı, zayıflatılmış mikroorganizmalar içerir. Bunların çoğu, virülan özelliklerini devre dışı bırakan koşullar altında yetiştirilen veya geniş bir bağışıklık tepkisi üretmek için yakından ilişkili ancak daha az tehlikeli organizmaları kullanan aktif virüslerdir. Zayıflatılmış aşıların çoğu viral olmasına rağmen, bazıları doğası gereği bakteriyeldir. Örnekler arasında sarıhumma, kızamık, kabakulak ve kızamıkçık gibi viral hastalıklar ve tifo gibi bakteriyel hastalıklar yer almaktadır. Calmette ve Guérin tarafından geliştirilen canlı Mycobacterium tuberculosis aşısı bulaşıcı bir suştan yapılmamıştır, ancak aşıya karşı bir bağışıklık tepkisi ortaya çıkarmak için kullanılan "BCG" adı verilen virülan olarak değiştirilmiş bir suş içerir. Yersinia pestis EV suşu içeren canlı zayıflatılmış aşı veba bağışıklaması için kullanılır. Zayıflatılmış aşıların bazı avantajları ve dezavantajları vardır. Zayıflatılmış aşılar tipik olarak daha dayanıklı immünolojik yanıtlara neden olur. Ancak bağışıklık sistemi baskılanmış bireylerde kullanım için güvenli olmayabilir ve nadir durumlarda virülan bir forma mutasyona uğrayarak hastalığa neden olabilirler.[56]
Bazı aşılar daha önce virülan olan ancak kimyasallar, ısı veya radyasyonla inaktive edilmiş mikroorganizmalar içerir.[57][58] Örnekler arasında IPV (çocuk felci aşısı), hepatit A aşısı, kuduz aşısı ve çoğu grip aşısı bulunmaktadır.[59]

Toksoit aşılar, mikroorganizma yerine hastalığa neden olan inaktive edilmiş toksik bileşiklerden yapılır.[60] Toksoit bazlı aşılara örnek olarak tetanos ve difteri verilebilir.[59] Tüm toksoitler mikroorganizmalar için değildir; örneğin Crotalus atrox toksoidi köpekleri çıngıraklı yılan ısırıklarına karşı aşılamak için kullanılır.[61]
Bir bağışıklık sistemine inaktive edilmiş veya zayıflatılmış bir mikroorganizma sunmak yerine (ki bu bir "bütün-ajan" aşısı teşkil eder), bir alt ünite aşısı bir bağışıklık yanıtı oluşturmak için onun bir parçasını kullanır. Buna bir örnek, virüsün sadece yüzey proteinlerinden oluşan (daha önce kronik olarak enfekte olmuş hastaların kan serumundan elde edilen, ancak şimdi viral genlerin mayada rekombinasyonu ile üretilen) hepatit B'ye karşı alt ünite aşısıdır.[62] Bir başka örnek, viral majör kapsit proteininden oluşan insan papilloma virüsüne (HPV) karşı virüs benzeri parçacık (VLP) aşısı gibi yenilebilir alg aşılarıdır.[63] Bir başka örnek de influenza virüsünün hemagglutinin ve nöraminidaz alt birimleridir.[59] Veba bağışıklaması için bir alt ünite aşısı kullanılmaktadır.[64]
Bazı bakteriler, immünojenik açıdan zayıf olan polisakkarit bir dış kaplamaya sahiptir. Bu dış kaplamalar proteinlere (örn. toksinler) bağlanarak, bağışıklık sisteminin polisakkariti bir protein antijeniymiş gibi tanıması sağlanabilir. Bu yaklaşım Haemophilus influenzae tip B aşısında kullanılmaktadır.[65]
Dış membran vezikülleri (OMV'ler) doğal olarak immünojeniktir ve güçlü aşılar üretmek için manipüle edilebilir. En iyi bilinen OMV aşıları serotip B meningokok hastalığı için geliştirilenlerdir.[66][67]
"Jenner aşıları" olarak da bilinen heterolog aşılar, tedavi edilen organizmada hastalığa neden olmayan ya da hafif hastalığa neden olan diğer hayvanların patojenleri olan aşılardır. Klasik örnek Jenner'ın çiçek hastalığına karşı korunmak için inek çiçeği aşısını kullanmasıdır. Güncel bir örnek ise Mycobacterium bovis'ten yapılan BCG aşısının tüberkülozdan korunmak için kullanılmasıdır.[68]
Genetik aşıların alt grubu viral vektör aşılarını, RNA aşılarını ve DNA aşılarını kapsar.
Viral vektör aşıları, bağışıklık tepkisini uyarmak için yüzey proteinleri gibi spesifik antijenler üretmek üzere vücuda patojen genleri yerleştirmek için güvenli bir virüs kullanır.[69][70]
Bir mRNA aşısı (veya RNA aşısı), lipid nanopartiküller gibi bir vektör içinde paketlenmiş nükleik asit RNA'dan oluşan yeni bir aşı türüdür.[71] COVID-19 aşıları arasında COVID-19 pandemisiyle mücadele etmek için bir dizi RNA aşısı bulunmaktadır ve bazıları onaylanmış veya bazı ülkelerde acil kullanım izni almıştır. Örneğin, Pfizer-BioNTech aşısı ve Moderna mRNA aşısı ABD'de yetişkinlerde kullanım için onaylanmıştır (Pfizer aşısı 16-17 yaş arası gençler için de tamamen onaylanmıştır).[72][73][74]
DNA aşılamasında önerilen mekanizma, viral veya bakteriyel DNA'nın insan veya hayvan hücrelerine yerleştirilmesi ve ifade edilmesi (elektroporasyon kullanımıyla geliştirilmiş) ve bağışıklık sistemi tarafından tanınmasının tetiklenmesidir. İfade edilen proteinleri tanıyan bazı bağışıklık sistemi hücreleri, bu proteinlere ve onları ifade eden hücrelere karşı bir saldırı başlatacaktır. Bu hücreler çok uzun bir süre yaşadıkları için, normalde bu proteinleri ifade eden patojenle daha sonra karşılaşılırsa bağışıklık sistemi tarafından anında saldırıya uğrayacaklardır. DNA aşılarının potansiyel bir avantajı, üretilmelerinin ve saklanmalarının çok kolay olmasıdır.
Ağustos 2021'de Hint yetkililer ZyCoV-D'ye acil onay verdi. Cadila Healthcare tarafından geliştirilen bu aşı, insanlar için onaylanan ilk DNA aşısıdır.

Birçok yenilikçi aşı da geliştirilmekte ve kullanılmaktadır.
Aşıların çoğu mikroorganizmalardan elde edilen inaktive veya zayıflatılmış bileşikler kullanılarak oluşturulurken, sentetik aşılar esas olarak veya tamamen sentetik peptitler, karbonhidratlar veya antijenlerden oluşur.
Aşılar tek değerlikli (univalan veya monovalan olarak da adlandırılır) veya çok değerlikli (polivalan veya multivalan olarak da adlandırılır) olabilir. Tek değerlikli aşı, tek bir antijene veya tek bir mikroorganizmaya karşı bağışıklık kazandırmak için tasarlanmıştır.[80] Multivalent veya polivalent aşı ise aynı mikroorganizmanın iki veya daha fazla suşuna veya iki veya daha fazla mikroorganizmaya karşı bağışıklık sağlamak üzere tasarlanmıştır.[81] Çok değerlikli bir aşının değerliği Yunanca veya Latince bir ön ek ile gösterilebilir (örneğin, bivalan, trivalan veya tetravalan/quadrivalan). Bazı durumlarda, tek değerlikli bir aşı hızlı bir şekilde güçlü bir bağışıklık yanıtı geliştirmek için tercih edilebilir.[82]
İki veya daha fazla aşı aynı formülasyonda karıştırıldığında, iki aşı birbiriyle etkileşime girebilir. Bu durum en sık olarak, aşı bileşenlerinden birinin diğerlerinden daha güçlü olduğu ve diğer bileşenlerin büyümesini ve bağışıklık yanıtını baskıladığı canlı zayıflatılmış aşılarda görülür.[83]
Bu fenomen ilk olarak, aşıdaki serotip 2 virüs miktarının, aşıdaki serotip 1 ve 3 virüslerinin "alımına" müdahale etmesini engellemek için azaltılması gereken üç değerlikli Sabin çocuk felci aşısında görülmüştür.[84] Bu fenomenin, DEN-3 serotipinin baskın olduğu ve DEN-1, -2 ve -4 serotiplerine verilen yanıtı baskıladığı tespit edilen,[85] şu anda araştırılmakta olan dang aşılarında da bir sorun olduğu görülmüştür.[ne zaman?]

Bir aşı dozu, çok azı aktif bileşen olan immünojen olmak üzere birçok bileşen içerir. Tek bir dozda sadece nanogram virüs partikülü veya mikrogram bakteriyel polisakkarit olabilir. Bir aşı enjeksiyonu, oral damla veya burun spreyi çoğunlukla sudur. Bağışıklık yanıtını güçlendirmek, güvenliği sağlamak veya depolamaya yardımcı olmak için diğer bileşenler eklenir ve üretim sürecinden arta kalan çok az miktarda malzeme bulunur. Çok nadiren, bu malzemeler kendilerine karşı çok hassas olan kişilerde alerjik reaksiyona neden olabilir.
Aşılar tipik olarak bağışıklık tepkisini güçlendirmek için kullanılan bir veya daha fazla adjuvan içerir. Örneğin tetanoz toksoidi genellikle şap üzerine adsorbe edilir. Bu, antijeni basit sulu tetanoz toksoidinden daha büyük bir etki yaratacak şekilde sunar. Adsorbe tetanoz toksoidine karşı ters reaksiyon gösteren kişilere, rapel zamanı geldiğinde basit aşı uygulanabilir.[86]
Tüm hücre boğmaca aşısı, 1990 Basra Körfezi harekâtına hazırlık aşamasında şarbon aşısı için bir adjuvan olarak kullanılmıştır. Bu, sadece şarbon aşısı vermekten daha hızlı bir bağışıklık yanıtı üretir ve maruziyetin yakın olması durumunda bir miktar fayda sağlar.[87]
Aşılar ayrıca bakteri veya mantar bulaşmasını önlemek için koruyucu maddeler de içerebilir. Son yıllara kadar, koruyucu tiyomersal (ABD ve Japonya'da Thimerosal olarak da bilinir) canlı virüs içermeyen birçok aşıda kullanılmaktaydı. 2005 yılı itibarıyla, ABD'de eser miktardan daha fazla tiyomersal içeren tek çocukluk aşısı, şu anda yalnızca belirli risk faktörlerine sahip çocuklar için önerilen grip aşısıdır.[88][89] İngiltere'de tedarik edilen tek dozluk grip aşılarının içeriğinde tiyomersal bulunmamaktadır. Koruyucular aşı üretiminin çeşitli aşamalarında kullanılabilir ve en sofistike ölçüm yöntemleri, çevrede ve bir bütün olarak popülasyonda olabileceği gibi, bitmiş üründe de bunların izlerini tespit edebilir.[90]
Birçok aşı, Staphylococcus enfeksiyonu gibi ciddi yan etkileri önlemek için koruyuculara ihtiyaç duyar. 1928'deki bir olayda, koruyucu içermeyen bir difteri aşısı ile aşılanan 21 çocuktan 12'si ölmüştür.[91] Tiyomersal, fenoksietanol ve formaldehit dahil olmak üzere çeşitli koruyucular mevcuttur. Tiyomersal bakterilere karşı daha etkilidir, daha iyi bir raf ömrüne sahiptir ve aşı stabilitesini, gücünü ve güvenliğini artırır; ancak ABD, Avrupa Birliği ve diğer birkaç gelişmiş ülkede, cıva içeriği nedeniyle ihtiyati bir önlem olarak artık çocukluk çağı aşılarında koruyucu olarak kullanılmamaktadır.[92] Tiyomersalin otizme katkıda bulunduğuna dair tartışmalı iddialar ortaya atılmış olsa da bu iddiaları destekleyen ikna edici hiçbir bilimsel kanıt bulunmamaktadır.[93] Ayrıca, 657.461 çocuk üzerinde yapılan 10-11 yıllık bir çalışma, KKK aşısının otizme neden olmadığını ve aslında otizm riskini yüzde yedi oranında azalttığını ortaya koymuştur.[94][95]
Aktif aşının yanı sıra, aşı preparatlarında aşağıdaki yardımcı maddeler ve artık üretim bileşikleri bulunur veya bulunabilir:[96]
Aşı isimleri için oldukça standartlaşmış çeşitli kısaltmalar geliştirilmiştir, ancak standardizasyon hiçbir şekilde merkezi veya küresel değildir. Örneğin, Amerika Birleşik Devletleri'nde kullanılan aşı isimlerinin, başka yerlerde de yaygın olarak bilinen ve kullanılan köklü kısaltmaları vardır. Bunların sıralanabilir bir tablo halinde sunulan ve serbestçe erişilebilen kapsamlı bir listesi ABD Hastalık Kontrol ve Korunma Merkezleri internet sayfasında mevcuttur.[98] Sayfada şu açıklama yer almaktadır: "Bu tablodaki kısaltmalar (Sütun 3) Hastalık Kontrol ve Korunma Merkezleri personeli, ACIP Çalışma Grupları, Haftalık Morbidite ve Mortalite Raporu (MMWR) editörü, Aşı ile Önlenebilir Hastalıkların Epidemiyolojisi ve Önlenmesi (Pembe Kitap) editörü, ACIP üyeleri ve ACIP irtibat kuruluşları tarafından ortaklaşa standartlaştırılmıştır."[98]
Bazı örnekler difteri ve tetanoz toksoidleri ve aselüler boğmaca aşısı için "DBT", difteri ve tetanoz toksoitleri için "DT" ve tetanoz ve difteri toksoidleri için "Td" şeklindedir. CDC, tetanos aşısı ile ilgili sayfasında ayrıca şu açıklamayı yapmaktadır:[99] "Bu kısaltmalardaki büyük harfler, difteri (D) ve tetanos (T) toksoitleri ile boğmaca (B) aşısının tam dozlarını ifade etmektedir. Küçük harfli "d" ve "b", ergen/yetişkin formülasyonlarında kullanılan azaltılmış difteri ve boğmaca dozlarını ifade etmektedir.[99]
Yerleşik aşı kısaltmalarının bir başka listesi de CDC'nin ABD bağışıklama kayıtlarında kullanılan kısaltmaları içeren "Aşı Kısaltmaları" adlı sayfasındadır.[100]
Aşı ruhsatı, geliştirme döngüsünün başarılı bir şekilde sonuçlanmasından ve Aşama I-III'te yer alan klinik çalışmaların ve diğer programların güvenlik, immünoaktivite, belirli bir spesifik dozda immünogenetik güvenlik, hedef popülasyonlar için enfeksiyonu önlemede kanıtlanmış etkinlik ve kalıcı önleyici etkiyi (zaman dayanıklılığı veya yeniden aşılama ihtiyacı tahmin edilmelidir) göstermesinden sonra gerçekleşir.[101] Koruyucu aşılar ağırlıklı olarak sağlıklı nüfus kohortlarında değerlendirildiğinden ve genel nüfusa dağıtıldığından, yüksek bir güvenlik standardı gereklidir.[102] Bir aşının çok uluslu ruhsatlandırılmasının bir parçası olarak, Dünya Sağlık Örgütü Biyolojik Standardizasyon Uzman Komitesi, ulusal düzenleyici kurumların kendi ruhsatlandırma süreçlerine başvurmaları için bir platform olarak tasarlanan bir süreç olan aşıların üretimi ve kalite kontrolü için uluslararası standartlar kılavuzunu geliştirmiştir.[101] Aşı üreticileri, Avrupa İlaç Ajansı (EMA) veya ABD Gıda ve İlaç Dairesi (FDA) gibi çok uluslu veya ulusal bir düzenleyici kuruluş tarafından bilimsel incelemeyi takiben, aşının güvenli ve uzun vadeli etkinliğe sahip olduğunu kanıtlayan eksiksiz bir klinik geliştirme ve deneme döngüsüne kadar ruhsat almazlar.[103][104]
Gelişmekte olan ülkelerin aşı geliştirme ve ruhsatlandırma için DSÖ kılavuzlarını benimsemesinin ardından, her ülkenin ulusal bir ruhsat verme ve aşıyı her ülkede kullanımı boyunca yönetme, dağıtma ve izleme sorumluluğu vardır.[101] Ruhsatlı bir aşının halk arasında güven ve kabul görmesi, aşılama kampanyasının sorunsuz bir şekilde ilerlemesini, hayat kurtarmasını ve ekonomik iyileşmeyi sağlamak için hükûmetlerin ve sağlık personelinin iletişim kurması gereken bir görevdir.[105][106] Bir aşı ruhsatlandırıldığında, değişken üretim, dağıtım ve lojistik faktörler nedeniyle başlangıçta sınırlı tedarikte olacaktır, bu da sınırlı tedarik için bir tahsisat planı ve aşıyı ilk olarak hangi nüfus kesimlerinin almasına öncelik verilmesi gerektiğini gerektirir.[105]
Birleşmiş Milletler Çocuklara Yardım Fonu (UNICEF) aracılığıyla çok uluslu dağıtım için geliştirilen aşılar, çok sayıda ülke tarafından benimsenmesi için uluslararası kalite, güvenlik, immünojenisite ve etkinlik standartlarını sağlamak üzere DSÖ tarafından ön yeterlilik gerektirir.[101]
Süreç, DSÖ ile anlaşmalı laboratuvarlarda İyi Üretim Uygulamalarına (GMP) uygun üretim tutarlılığı gerektirmektedir.[101] BM kuruluşları aşı ruhsatlandırmasına dahil olduğunda, ülkeler 1) aşı, üreticileri ve dağıtım ortakları için pazarlama izni ve ulusal bir lisans vererek ve 2) aşılama programından sonra advers olayların kayıtları da dahil olmak üzere pazarlama sonrası gözetim gerçekleştirerek işbirliği yaparlar. DSÖ, GMP ve düzenleyici gözetime uygunluk açısından üretim tesislerinin ve distribütörlerin denetimlerini izlemek için ulusal kurumlarla birlikte çalışmaktadır.[101]
Bazı ülkeler EMA, FDA veya diğer zengin ülkelerdeki ulusal ajanslar gibi saygın ulusal kuruluşlar tarafından ruhsatlandırılmış aşıları satın almayı tercih etmektedir, ancak bu tür alımlar genellikle daha pahalıdır ve gelişmekte olan ülkelerdeki yerel koşullara uygun dağıtım kaynaklarına sahip olmayabilir.[101]
Avrupa Birliği'nde (AB), mevsimsel grip gibi pandemik patojenlere yönelik aşılar, tüm üye devletlerin uyduğu AB çapında ruhsatlandırılır ("merkezi"), yalnızca bazı üye devletler için ruhsatlandırılır ("merkezi olmayan") veya bireysel ulusal düzeyde ruhsatlandırılır.[103] Genel olarak, tüm AB ülkeleri, Avrupa İlaç Ajansının (EMA) aşı ruhsatından sorumlu bilimsel bir paneli olan Avrupa Beşeri Tıbbi Ürünler Komitesi (CHMP) tarafından tanımlanan düzenleyici rehberliği ve klinik programları takip etmektedir.[103] CHMP, ruhsatlandırma ve dağıtımdan önce ve sonra bir aşının ilerlemesini değerlendiren ve izleyen birkaç uzman grup tarafından desteklenmektedir.[103]
FDA kapsamında, aşıların klinik güvenliği ve etkinliği için kanıt oluşturma süreci, reçeteli ilaçların onay süreciyle aynıdır.[107] Klinik geliştirme aşamalarında başarılı olunması halinde, aşı ruhsatlandırma sürecini, bilimsel bir inceleme ekibi (doktorlar, istatistikçiler, mikrobiyologlar, kimyagerler gibi farklı disiplinlerden) ve aşı adayının gelişimi boyunca etkinlik ve güvenliğe sahip olduğuna dair kapsamlı belgeler sunması gereken bir biyolojik lisans başvurusu takip eder. Ayrıca bu aşamada, önerilen üretim tesisi GMP uyumluluğu açısından uzman gözden geçiriciler tarafından incelenir ve etiketin, sağlık hizmeti sağlayıcılarının aşının olası riskleri de dahil olmak üzere aşıya özgü kullanım tanımını halka iletmek ve ulaştırmak için uyumlu bir açıklamaya sahip olması gerekir.[107] Ruhsat verildikten sonra, GMP uyumluluğu için periyodik denetimler de dahil olmak üzere aşının ve üretiminin izlenmesi, üretici lisansını koruduğu sürece devam eder ve bu, her aşı üretim aşaması için FDA'ya potens, güvenlik ve saflık testleri için ek sunumları içerebilir.[107]
Hindistan İlaç Genel Kontrolörü, Hindistan'da aşılar, kan ve kan ürünleri, IV sıvılar ve serumlar gibi belirli ilaç kategorilerinin ruhsatlarının onaylanmasından sorumlu Hindistan Hükûmeti Merkezi İlaç Standart Kontrol Örgütünün daire başkanıdır.[108]
Bir aşı genel nüfus için kullanılana kadar, aşıdan kaynaklanan tüm potansiyel olumsuz olaylar bilinmeyebilir, bu da üreticilerin aşı halk arasında yaygın olarak kullanılırken pazarlama sonrası gözetim için Faz IV çalışmaları yapmasını gerektirir.[101][107] DSÖ, ruhsatlandırma sonrası gözetimi uygulamak için BM üye devletleriyle birlikte çalışmaktadır.[101] FDA, Amerikan halkında kullanımı boyunca bir aşıyla ilgili güvenlik endişelerini izlemek için bir Aşı Olumsuz Olay Raporlama Sistemine güvenmektedir.[107]

En iyi korumayı sağlamak için, çocukların bağışıklık sistemleri belirli aşılara yanıt verecek kadar gelişir gelişmez aşı olmaları tavsiye edilir ve "tam bağışıklık" elde etmek için genellikle ek "güçlendirici" aşılar gerekir. Bu durum, karmaşık aşılama programlarının geliştirilmesine yol açmıştır. Küresel aşı takvimi önerileri Stratejik Uzmanlar Danışma Grubu tarafından yayınlanır ve hastalık epidemiyolojisi, aşılamanın kabul edilebilirliği, yerel popülasyonlarda eşitlik ve programatik ve finansal kısıtlamalar gibi yerel faktörler göz önünde bulundurularak ülke düzeyinde danışma komitesi tarafından daha da aktarılır.[109] Amerika Birleşik Devletleri'nde, Hastalık Kontrol ve Korunma Merkezleri için program eklemeleri öneren Bağışıklama Uygulamaları Danışma Komitesi, çocukların hepatit A, hepatit B, çocuk felci, kabakulak, kızamık, kızamıkçık, difteri, boğmaca, tetanos, HiB, suçiçeği, rotavirüs, grip, meningokok hastalığı ve zatürreye karşı rutin aşılanmasını önermektedir.[110][111]
Önerilen çok sayıda aşı ve takviye (iki yaşında 24 enjeksiyona kadar) tam uyumun sağlanmasında sorunlara yol açmıştır. Azalan uyum oranlarıyla mücadele etmek için çeşitli bildirim sistemleri oluşturulmuş ve artık birden fazla hastalığa karşı koruma sağlayan birçok karma enjeksiyon (örneğin Pentavalan aşı ve KKKV aşısı) piyasaya sürülmüştür.
Bebek aşıları ve takviyeleri için önerilerin yanı sıra, diğer yaşlar için veya yaşam boyunca tekrarlanan enjeksiyonlar için birçok spesifik aşı önerilir - en yaygın olarak kızamık, tetanoz, grip ve zatürre için. Hamile kadınlar genellikle kızamıkçığa karşı direncin devam edip etmediği konusunda taranmaktadır. İnsan papilloma virüsü aşısı ABD'de (2011 itibarıyla)[112] ve Birleşik Krallık'ta (2009 itibarıyla) önerilmektedir.[113] Yaşlılar için aşı önerileri, bu grup için daha ölümcül olan zatürre ve influenza üzerinde yoğunlaşmaktadır. 2006 yılında, suçiçeği virüsünün neden olduğu bir hastalık olan ve genellikle yaşlıları etkileyen zonaya karşı bir aşı piyasaya sürülmüştür.[114]
Bir aşının zamanlaması ve dozu, bir bireyin bağışıklık yeterlilik düzeyine göre[115] ve örneğin bir pandemi ortamında arzın sınırlı olduğu durumlarda bir aşının nüfus genelinde uygulanmasını optimize etmek için uyarlanabilir.[116]
Aşı geliştirmede karşılaşılan zorluklardan biri de ekonomidir: HIV, sıtma ve tüberküloz dahil olmak üzere aşıya en çok ihtiyaç duyulan hastalıkların birçoğu esas olarak yoksul ülkelerde görülmektedir. İlaç firmaları ve biyoteknoloji şirketlerinin bu hastalıklar için aşı geliştirme konusunda çok az teşviki var çünkü gelir potansiyeli çok az. Daha varlıklı ülkelerde bile, finansal getiriler genellikle asgari düzeydedir ve finansal ve diğer riskler büyüktür.[117]
Bugüne kadarki aşı geliştirme çalışmalarının çoğu hükûmet, üniversiteler ve kâr amacı gütmeyen kuruluşlar tarafından sağlanan "itme" fonlarına dayanmaktadır.[118] Birçok aşı son derece uygun maliyetli ve halk sağlığı için faydalı olmuştur.[119] Gerçekte uygulanan aşıların sayısı son yıllarda önemli ölçüde artmıştır.[120] Bu artış, özellikle de çocuklara okula başlamadan önce uygulanan farklı aşıların sayısındaki artış, ekonomik teşvikten ziyade hükûmet zorunlulukları ve desteğinden kaynaklanıyor olabilir.[121]
Dünya Sağlık Örgütüne göre, az gelişmiş ülkelerde aşı üretiminin önündeki en büyük engel patentler değil, pazara giriş için gereken önemli finansal, altyapı ve işgücü gereksinimleri olmuştur. Aşılar biyolojik bileşiklerin karmaşık karışımlarıdır ve reçeteli ilaçların aksine, gerçek jenerik aşılar yoktur. Yeni bir tesis tarafından üretilen aşı, üretici tarafından güvenlik ve etkinlik açısından eksiksiz klinik testlerden geçirilmelidir. Çoğu aşı için, teknolojideki belirli süreçler patentlidir. Bunlar alternatif üretim yöntemleriyle aşılabilir, ancak bu Ar-Ge altyapısı ve uygun vasıflı işgücü gerektirir. İnsan papilloma virüsü aşısı gibi nispeten yeni birkaç aşı söz konusu olduğunda, patentler ek bir engel oluşturabilir.[122]
2021'deki COVID-19 pandemisi sırasında aşı üretiminin artırılmasına acilen ihtiyaç duyulduğunda, Dünya Ticaret Örgütü ve dünyanın dört bir yanındaki hükûmetler, COVID-19 aşıları üzerindeki fikri mülkiyet hakları ve patentlerden feragat edilip edilmeyeceğini değerlendirdi; bu da "aşılar ve ilaçlar da dahil olmak üzere uygun fiyatlı COVID-19 tıbbi ürünlerinin zamanında sunulmasının önündeki tüm potansiyel engelleri ortadan kaldıracak ve temel tıbbi ürünlerin üretimini ve tedarikini artıracaktı".[123]

Aşı üretimi, normal ilaç üretimi de dahil olmak üzere diğer üretim türlerinden temelde farklıdır, çünkü aşıların büyük çoğunluğu tamamen sağlıklı olan milyonlarca insana uygulanması amaçlanmaktadır.[124] Bu gerçek, diğer ürünler için gerekli olanın çok ötesine geçen katı uyumluluk gereklilikleri ile olağanüstü titiz bir üretim sürecini yönlendirir.[124]
Antijene bağlı olarak, son derece uzmanlaşmış ekipman, temiz odalar ve muhafaza odaları gerektiren bir aşı üretim tesisi kurmak 50 ile 500 milyon ABD dolarına mal olabilir.[125] Aşı üretim hatlarında çalışacak doğru beceri, uzmanlık, bilgi, yetkinlik ve kişilik kombinasyonuna sahip personel konusunda küresel bir kıtlık söz konusudur.[125] Brezilya, Çin ve Hindistan gibi önemli istisnalar dışında, gelişmekte olan ülkelerin çoğunun eğitim sistemleri yeterli sayıda kalifiye aday sağlayamamakta ve bu ülkelerde yerleşik aşı üreticileri, üretimi devam ettirebilmek için yabancı uyruklu personel istihdam etmek zorunda kalmaktadır.[125]
Aşı üretiminin birkaç aşaması vardır. İlk olarak antijenin kendisi üretilir. Virüsler ya tavuk yumurtası gibi birincil hücrelerde (örneğin influenza için) ya da kültürlenmiş insan hücreleri gibi sürekli hücre hatlarında (örneğin hepatit A için) yetiştirilir.[126] Bakteriler biyoreaktörlerde yetiştirilir (örneğin Haemophilus influenzae tip b). Benzer şekilde, virüslerden veya bakterilerden türetilen bir rekombinant protein maya, bakteri veya hücre kültürlerinde üretilebilir.[127][128]
Antijen üretildikten sonra, onu üretmek için kullanılan hücrelerden izole edilir. Bir virüsün inaktive edilmesi gerekebilir, muhtemelen daha fazla saflaştırma gerekmez. Rekombinant proteinler, ultrafiltrasyon ve kolon kromatografisini içeren birçok işleme ihtiyaç duyar. Son olarak, aşı gerektiğinde adjuvan, stabilizatörler ve koruyucular eklenerek formüle edilir. Adjuvan antijene karşı bağışıklık tepkisini artırır, stabilizatörler saklama ömrünü uzatır ve koruyucular çok dozlu flakonların kullanımına izin verir.[127][128] Kombine aşıların geliştirilmesi ve üretilmesi, antijenler ve diğer bileşenler arasındaki potansiyel uyumsuzluklar ve etkileşimler nedeniyle daha zordur.[129]
Aşı üretiminde dağıtımdan önceki son aşama, flakonların aşılarla doldurulması ve dağıtım için paketlenmesi işlemi olan doldur ve bitir aşamasıdır. Bu aşı üretim sürecinin kavramsal olarak basit bir parçası olmasına rağmen, aşıların dağıtımı ve uygulanması sürecinde genellikle bir darboğaz oluşturmaktadır.[130][131][132]
Aşı üretim teknikleri gelişmektedir. Kültürlenmiş memeli hücrelerinin, tavuk yumurtası gibi geleneksel seçeneklere kıyasla, daha fazla üretkenlik ve kontaminasyonla ilgili sorunların düşük insidansı nedeniyle giderek daha önemli hale gelmesi beklenmektedir. Toksoit kullanan bakteriyel aşıların üretimi için genetik olarak detoksifiye edilmiş aşılar üreten rekombinasyon teknolojisinin popülaritesinin artması beklenmektedir. Kombinasyon aşılarının, patojenle ilişkili moleküler kalıpları kullanarak içerdikleri antijen miktarlarını azaltmaları ve böylece istenmeyen etkileşimleri azaltmaları beklenmektedir.[129]
Aşı üretiminde en yüksek pazar payına sahip şirketler Merck, Sanofi, GlaxoSmithKline, Pfizer ve Novartis olup aşı satışlarının %70'i AB veya ABD'de yoğunlaşmıştır (2013).[133]:42 Aşı üretim tesisleri büyük sermaye yatırımları gerektirir (50 milyon dolardan 300 milyon dolara kadar) ve inşa edilmesi 4 ile 6 yıl arası sürebilir; aşı geliştirme sürecinin tamamı ise 10 ile 15 yıl arası sürer. [133]:43 Gelişmekte olan ülkelerdeki üretim, bu ülkelerin tedarikinde giderek artan bir rol oynamaktadır. Özellikle de eski aşılarla ilgili olarak Brezilya, Hindistan ve Çin'de. [133]:47 Hindistan'daki üreticiler gelişmekte olan dünyanın en gelişmiş üreticileridir ve doz sayısı bakımından en büyük aşı üreticilerinden biri olan ve yakın zamanda tavuk yumurtası yerine MRC-5 hücre kültürüne geçerek kızamık aşısı üretim verimliliğini 10 ila 20 kat artıran süreçlerde yenilikçi olan Hindistan Serum Enstitüsünü de içermektedir.[133]:48 Çin'in üretim kabiliyetleri kendi iç ihtiyaçlarını karşılamaya odaklanmıştır ve Sinopharm (CNPGC) tek başına Çin'deki 14 farklı aşı için dozların %85'inden fazlasını sağlamaktadır.[133]:48 Brezilya, gelişmiş dünyadan transfer edilen teknolojiyi kullanarak kendi iç ihtiyaçlarını karşılama noktasına yaklaşmaktadır.[133]:49

Aşıların insan vücuduna verilmesinde kullanılan en yaygın yöntemlerden biri enjeksiyondur.
Yeni uygulama sistemlerinin geliştirilmesi, daha güvenli ve daha etkili aşıların üretilmesi ve uygulanması umudunu artırmaktadır. Araştırma alanları arasında lipozomlar ve ISCOM (bağışıklık uyarıcı kompleks) bulunmaktadır.[134]
Aşı uygulama teknolojilerindeki kayda değer gelişmeler arasında oral aşılar da yer almaktadır. Oral aşıların uygulanmasına yönelik ilk girişimler, etkili bir oral antibakteriyel aşı olasılığının tartışmalı olduğu bir dönem olan 20. yüzyılın başlarından itibaren çeşitli derecelerde umut vadetmiştir.[135] Örneğin 1930'lara gelindiğinde, oral tifo aşısının profilaktik değerine yönelik artan bir ilgi vardı.[136]
Oral çocuk felci aşısının, aşılar resmi eğitim almamış gönüllü personel tarafından uygulandığında da etkili olduğu ortaya çıkmıştır; sonuçlar ayrıca aşıların uygulanmasının daha kolay ve verimli olduğunu göstermiştir. Etkili oral aşıların birçok avantajı vardır; örneğin, kan bulaşma riski yoktur. Oral uygulama için tasarlanan aşıların sıvı olması gerekmez ve katı olduklarından genellikle daha stabildirler ve taşıma ve depolama sırasında donarak hasar görmeye veya bozulmaya daha az eğilimlidirler.[137] Bu tür bir stabilite "soğuk zincir" ihtiyacını azaltır.
Henüz geliştirme aşamasında olan mikroiğne yaklaşımı, "deri yoluyla aşı iletim yolları oluşturabilecek diziler halinde imal edilmiş sivri çıkıntılar" kullanmaktadır.[138]
Deneysel bir iğnesiz[139] aşı uygulama sistemi hayvanlar üzerinde test ediliyor.[140][141] Yapışkan bir bandaja benzeyen pul büyüklüğünde bir yama, cm kare başına yaklaşık 20.000 mikroskobik çıkıntı içermektedir.[142] Bu dermal uygulama, enjeksiyondan daha az aşı gerektirirken aşılamanın etkinliğini potansiyel olarak artırmaktadır.[143]

Hayvanların aşılanması hem onların hastalıklara yakalanmasını önlemek hem de hastalıkların insanlara bulaşmasını engellemek için kullanılır.[144] Hem evcil hayvan olarak tutulan hem de çiftlik hayvanı olarak yetiştirilen hayvanlar rutin olarak aşılanmaktadır. Bazı durumlarda vahşi popülasyonlar da aşılanabilir. Bu bazen hastalık eğilimli bir bölgede yayılan aşılı yiyeceklerle gerçekleştirilir ve rakunlarda kuduzu kontrol etmeye çalışmak için kullanılmıştır.
Kuduz hastalığının görüldüğü yerlerde, köpeklere kuduz aşısı yapılması kanunen zorunlu olabilir. Diğer köpek aşıları arasında köpek gençlik hastalığı, köpek parvovirüsü, bulaşıcı köpek hepatiti, adenovirüs-2, leptospiroz, Bordetella, köpek parainfluenza virüsü ve Lyme hastalığı bulunmaktadır.
İnsanlarda veteriner aşılarının kullanıldığı vakalar, kasıtlı veya kazara olsun, sonuçta ortaya çıkan bazı hastalık vakalarıyla, özellikle bruselloz ile belgelenmiştir.[145] Bununla birlikte, bu tür vakaların raporlanması nadirdir ve bu tür uygulamaların güvenliği ve sonuçları hakkında çok az çalışma yapılmıştır. Veteriner kliniklerinde aerosol aşılamanın ortaya çıkmasıyla birlikte, Bordetella bronchiseptica gibi insanlarda doğal olarak taşınmayan patojenlere insanların maruz kalması son yıllarda muhtemelen artmıştır.[145] Kuduz başta olmak üzere bazı durumlarda, bir patojene karşı paralel veteriner aşısı, insan aşısından çok daha ekonomik olabilir.
SIVA (Segregation of Infected from Vaccinated Animals [Enfekte Hayvanların Aşılanmış Hayvanlardan Ayrılması]) olarak da bilinen DIVA (Differentiation of Infected from Vaccinated Animals [Enfekte Hayvanların Aşılanmış Hayvanlardan Ayırt Edilmesi]) aşıları, enfekte ve aşılanmış hayvanlar arasında ayrım yapılmasını mümkün kılar. DIVA aşıları, eşdeğer yabani mikroorganizmadan en az bir epitop daha az taşır. Bu epitopa karşı antikoru tespit eden eşlik eden bir tanı testi, hayvanın aşılanmış olup olmadığının belirlenmesine yardımcı olur.[kaynak belirtilmeli]
İlk DIVA aşıları (eski adıyla işaretleyici aşılar ve 1999'dan beri DIVA aşıları olarak adlandırılmaktadır) ve refakatçi tanı testleri, Hollanda'nın Lelystad kentindeki Merkez Veteriner Enstitüsü'nde J. T. van Oirschot ve meslektaşları tarafından geliştirilmiştir.[146][147] Sahte kuduza (Aujeszky hastalığı olarak da adlandırılır) karşı mevcut bazı aşıların viral genomlarında (aralarında gE geni de bulunan) delesyonlar olduğunu buldular. Bu delesyona karşı monoklonal antikorlar üretildi ve gE'ye karşı antikorları gösteren bir ELISA geliştirmek için seçildi. Buna ek olarak, genetik olarak tasarlanmış yeni gE-negatif aşılar yapılmıştır.[148] Aynı doğrultuda, sığır herpesvirüs 1 enfeksiyonlarına karşı DIVA aşıları ve eşlik eden tanı testleri geliştirilmiştir.[147][149]
DIVA stratejisi, çeşitli ülkelerde sahte kuduz virüsünü bu ülkelerden başarıyla yok etmek için uygulanmıştır. Domuz popülasyonları yoğun bir şekilde aşılanmış ve refakatçi tanı testi ile izlenmiş ve daha sonra enfekte domuzlar popülasyondan uzaklaştırılmıştır.[kaynak belirtilmeli] Bovine herpesvirus 1 DIVA aşıları da uygulamada yaygın olarak kullanılmaktadır. DIVA prensibini klasik domuz ateşi,[150] kuş gribi,[151] Actinobacillus pleuropneumonia[152] ve domuzlarda Salmonella enfeksiyonları[153] gibi çok çeşitli bulaşıcı hastalıklara uygulamak için önemli çabalar devam etmektedir.
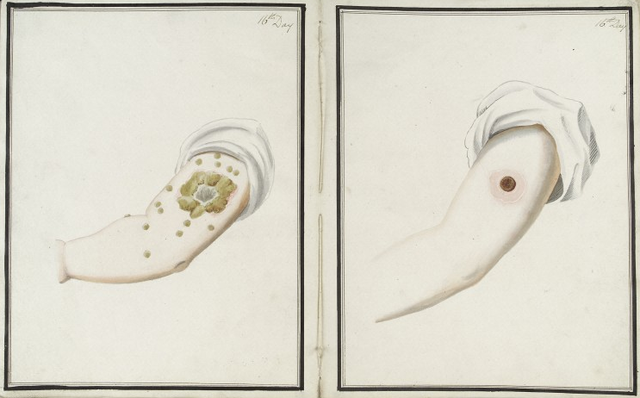
Sığır çiçeği vakalarından elde edilen materyalle aşılamanın (heterotipik bağışıklama) kullanılmaya başlanmasından önce, çiçek hastalığı çiçek virüsü ile kasıtlı variolasyon yoluyla önlenebiliyordu. Çin'de çiçek hastalığı için variolasyon uygulamasına dair en eski ipuçları onuncu yüzyılda ortaya çıkmıştır.[154][daha geniş açıklama gerekli] Çinliler ayrıca on beşinci yüzyıla kadar uzanan, belgelenmiş en eski variolasyon kullanımını da uygulamışlardır. Toz haline getirilmiş çiçek hastalığı materyalinin - genellikle kabukların - burun deliklerine üflenmesiyle uygulanan bir "nazal insüflasyon" yöntemi uygulamışlardır. Çin'de on altıncı ve on yedinci yüzyıllar boyunca çeşitli aşılama teknikleri kaydedilmiştir.[155]:60 1700 yılında Londra'daki Royal Society'ye Çin'deki inokülasyon uygulamasına ilişkin iki rapor ulaşmıştır; bunlardan biri Çin'de görev yapan Doğu Hindistan Şirketi'nin bir çalışanından rapor alan Martin Lister tarafından, diğeri ise Clopton Havers tarafından hazırlanmıştır.[156] Fransa'da Voltaire, Çinlilerin "bu yüzyıldır" variolasyon uyguladıklarını bildirir.[157]

Osmanlı'da variolasyona tanık olan Mary Wortley Montagu, 1721 yılında İngiltere'ye döndüğünde dört yaşındaki kızına Kraliyet Sarayı doktorlarının huzurunda variolasyon uygulatmıştır.[155] Aynı yılın ilerleyen günlerinde Charles Maitland, Londra'daki Newgate Hapishanesi'nde altı mahkûm üzerinde deneysel bir variolasyon gerçekleştirdi.[158] Deney başarılı oldu ve kısa süre sonra variolasyon, prosedürün teşvik edilmesine yardımcı olan kraliyet ailesinin dikkatini çekti. Ancak 1783 yılında, Büyük Britanya Prensi Octavius inolükalasyondan birkaç gün sonra öldü.[159] 1796'da doktor Edward Jenner, sığır çiçeği olan bir sütçünün elinden irin alarak 8 yaşındaki James Phipps adlı bir çocuğun koluna kazıdı ve altı hafta sonra çocuğa çiçek hastalığı variolasyonu yaptı ve daha sonra çocuğun çiçek hastalığına yakalanmadığını gözlemledi.[160][161] Jenner çalışmalarını genişletti ve 1798'de aşısının çocuklarda ve yetişkinlerde güvenli olduğunu ve koldan kola aktarılabildiğini, böylece enfekte ineklerden elde edilen belirsiz kaynaklara olan bağımlılığı azalttığını bildirdi.[159] 1804 yılında İspanya'nın Meksika ve Filipinler'deki kolonilerine çiçek aşısı yapmak üzere yola çıkan İspanyol Balmis ekibi, aşının in vitro ortamda sadece 12 gün hayatta kalabilmesini aşmak için koldan kola nakil yöntemini kullandı. Sığır çiçeği kullandılar.[162] Sığır çiçeği ile aşılama çiçek inokülasyonundan çok daha güvenli olduğu için,[163] İngiltere'de hala yaygın olarak uygulanmasına rağmen, 1840 yılında yasaklandı.[164]

Jenner'in çalışmalarını takiben, ikinci nesil aşılar 1880'lerde Louis Pasteur tarafından tavuk kolerası ve şarbon için geliştirilen aşılarla tanıtıldı[17] ve on dokuzuncu yüzyılın sonlarından itibaren aşılar ulusal bir prestij meselesi olarak kabul edildi. Ulusal aşılama politikaları benimsendi ve zorunlu aşı yasaları çıkarıldı.[160] 1931 yılında Alice Miles Woodruff ve Ernest Goodpasture, kanatlı çiçeği hastalığı virüsünün embriyonlaşmış tavuk yumurtasında yetiştirilebileceğini belgeledi. Kısa süre sonra bilim insanları yumurtalarda başka virüsler de yetiştirmeye başladılar. Yumurtalar, 1935'te sarı humma aşısının ve 1945'te grip aşısının geliştirilmesinde virüs çoğaltımı için kullanıldı. 1959'da besiyeri ve hücre kültürü, aşılar için standart virüs çoğaltma yöntemi olarak yumurtaların yerini aldı.[165]
Aşı bilimi yirminci yüzyılda gelişti ve difteri, kızamık, kabakulak ve kızamıkçığa karşı olanlar da dahil olmak üzere birçok başarılı aşı ortaya çıktı. Başlıca başarılar arasında 1950'lerde çocuk felci aşısının geliştirilmesi ve 1960'lar ve 1970'lerde çiçek hastalığının ortadan kaldırılması yer almaktadır. Maurice Hilleman yirminci yüzyılda aşı geliştirenler arasında en üretken olanıydı. Aşılar daha yaygın hale geldikçe, birçok insan aşıları kanıksamaya başladı. Ancak, herpes simpleks, sıtma, belsoğukluğu ve HIV gibi birçok önemli hastalık için aşı bulmak hâlâ zor.[160][166]

Birinci nesil aşılar, canlı ve zayıflatılmış ya da öldürülmüş formları olan tüm organizma aşılarıdır.[167] Çiçek ve çocuk felci aşıları gibi canlı, zayıflatılmış aşılar, öldürücü T-hücresi (TC veya CTL) yanıtlarını, yardımcı T hücresi (TH) yanıtlarını ve antikor bağışıklığını indükleyebilir. Bununla birlikte, bir patojenin zayıflatılmış formları tehlikeli bir forma dönüşebilir ve bağışıklık sistemi baskılanmış aşı alıcılarında (AIDS'liler gibi) hastalığa neden olabilir. Öldürülmüş aşılar bu riske sahip olmamakla birlikte, spesifik öldürücü T hücre yanıtları oluşturamazlar ve bazı hastalıklar için hiç işe yaramayabilirler.[167]
Canlı aşılardan kaynaklanan riskleri azaltmak için ikinci nesil aşılar geliştirilmiştir. Bunlar spesifik protein antijenlerinden (tetanos veya difteri toksoidi gibi) veya rekombinant protein bileşenlerinden (hepatit B yüzey antijeni gibi) oluşan alt birim aşılardır. TH ve antikor yanıtları oluşturabilirler, ancak öldürücü T hücresi yanıtları oluşturamazlar.[kaynak belirtilmeli]
RNA aşıları ve DNA aşıları üçüncü nesil aşılara örnektir.[167][168][169] 2016 yılında Zika virüsü için bir DNA aşısı Ulusal Sağlık Enstitülerinde test edilmeye başlanmıştır. Ayrı olarak Inovio Pharmaceuticals ve GeneOne Life Science, Miami'de Zika'ya karşı farklı bir DNA aşısının testlerine başladı. Aşıların hacimli üretimi 2016 yılı itibarıyla çözülememiştir.[170] HIV'i önlemeye yönelik DNA aşıları için klinik denemeler devam etmektedir.[171] 2020 yılında Warp Speed Operasyonu'nun yardımıyla BNT162b2 gibi mRNA aşıları geliştirilmiş ve COVID-19 pandemisiyle mücadele etmek için kitlesel olarak konuşlandırılmıştır. 2021 yılında Katalin Karikó ve Drew Weissman, mRNA aşı teknolojisindeki öncü araştırmaları nedeniyle Columbia Üniversitesinin Horwitz Ödülü'nü aldı.[172]
Bu bölümün daha doğru ve güvenilir bilgi sunması için güncellenmesi gerekmektedir. Daha fazla bilgi için tartışma sayfasına bakınız. (Nisan 2023) |
Bilim insanları en azından 2013 yılından bu yana, bir virüsün dış yapısını yeniden yapılandırarak sentetik üçüncü nesil aşılar geliştirmeye çalışmaktadır; bunun aşı direncini önlemeye yardımcı olacağı umulmaktadır.[173]
Bağışıklık tepkisini yöneten ilkeler artık kanserler ve otoimmün bozukluklar gibi bulaşıcı olmayan birçok insan hastalığına karşı kişiye özel aşılarda kullanılabilmektedir.[174] Örneğin, deneysel aşı CYT006-AngQb, yüksek tansiyon için olası bir tedavi olarak araştırılmaktadır.[175] Aşı geliştirme eğilimlerini etkileyen faktörler arasında çevirici tıp alanındaki ilerlemeler, demografi, düzenleyici bilim, siyasi, kültürel ve sosyal tepkiler yer almaktadır.[176]
Transgenik bitkiler yoluyla aşı üretimi fikri 2003 gibi erken bir tarihte tanımlanmıştır. Tütün, patates, domates ve muz gibi bitkilere, insanlar için kullanılabilir aşılar üretmelerine neden olacak genler yerleştirilebilir.[177] 2005 yılında, hepatit B'ye karşı insan aşısı üreten muzlar geliştirilmiştir.[178]
Aşı karşıtlığı, aşı hizmetlerinin mevcut olmasına rağmen aşıların kabulünde gecikme veya aşıların reddedilmesidir. Bu terim, aşılamayı açıkça reddetmeyi, aşıları ertelemeyi, aşıları kabul etmeyi ancak kullanımları konusunda kararsız kalmayı veya bazı aşıları kullanıp diğerlerini kullanmamayı kapsar.[179][180][181][182] Aşıların genel olarak güvenli ve etkili olduğu konusunda büyük bir bilimsel fikir birliği vardır.[183][184][185][186] Aşı karşıtlığı genellikle hastalık salgınlarına ve aşıyla önlenebilir hastalıklardan kaynaklanan ölümlere neden olmaktadır.[187][188][189][190][191][192] Bu nedenle Dünya Sağlık Örgütü aşı karşıtlığını 2019'da en önemli on küresel sağlık tehdidinden biri olarak nitelendirmiştir.[193][194]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.