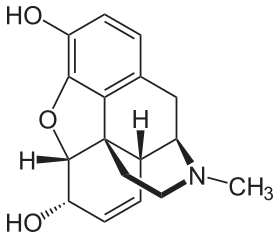
Opioid
psikoaktif kimyasal madde Vikipedi'den, özgür ansiklopediden
Opioidler, haşhaş bitkisinde bulunan doğal maddelerden türetilen veya onları taklit eden bir ilaç sınıfıdır. Opioidler, ağrı kesici de dahil olmak üzere çeşitli etkiler üretmek için beyinde çalışır. Bir madde sınıfı olarak, morfin benzeri etkiler üretmek için opioid reseptörleri üzerinde etki gösterirler.[2][3]
'Opioid' ve 'opiat' terimleri bazen birbirlerinin yerine kullanılmaktadır, ancak bu ilaçların üretim süreçlerine bağlı olarak önemli farklılıklar vardır.[4]
Tıbbi olarak öncelikle anestezi de dahil olmak üzere ağrı kesici olarak kullanılırlar.[5] Diğer tıbbi kullanımlar arasında ishalin baskılanması, opioid kullanım bozukluğu için replasman tedavisi, opioid doz aşımının tersine çevrilmesi ve öksürüğün bastırılması sayılabilir.[5] Karfentanil gibi son derece güçlü opioidler sadece veteriner kullanımı için onaylanmıştır.[6][7][8] Opioidler ayrıca öforik etkileri veya yoksunluk sendromunu önlemek için tıbbi olmayacak şekilde de sıklıkla kullanılır.[9] Opioidler ölüme neden olabilir ve Amerika Birleşik Devletleri'nde infazlar için kullanılmıştır.
Opioidlerin yan etkileri kaşıntı, sedasyon, mide bulantısı, solunum depresyonu, kabızlık ve öfori içerebilir. Uzun süreli kullanım toleransa neden olabilir, yani aynı etkiyi elde etmek için artan dozların gerekli olduğu anlamına gelir ve fiziksel bağımlılık, ilacın aniden kesilmesinin hoş olmayan yoksunluk semptomlarına yol açtığı anlamına gelir.[10] Öfori rekreasyonel kullanımı çeker ve opioidlerin rekreasyonel kullanımının sık sık, artan rekreasyonel kullanımı tipik olarak bağımlılıkla sonuçlanır. Benzodiazepinler gibi diğer depresan ilaçlarla aşırı dozda veya eşzamanlı kullanım genellikle solunum depresyonundan ölümle sonuçlanır.[11]
Opioidler, esas olarak merkezi ve periferik sinir sisteminde ve gastrointestinal sistemde bulunan opioid reseptörlerine bağlanarak etki eder. Bu reseptörler, opioidlerin hem psikoaktif hem de somatik etkilerine aracılık eder. Opioid ilaçlar, ishal önleyici ilaç loperamid gibi kısmi agonistleri ve opioid kaynaklı kabızlık için naloksegol gibi antagonistleri içerir; bunlar kan-beyin bariyerini geçmez, ancak diğer opioidlerin bu reseptörlere bağlanmasını engelleyebilir.
Opioidler bağımlılık yaptığından ve ölümcül doz aşımına neden olabileceğinden, çoğu kontrollü maddelerdir. 2013 yılında, 28 ile 38 milyon insan opioidleri yasa dışı olarak kullandı (15 ile 65 yaş arasındaki küresel nüfusun %0,6 ile %0,8'i).[12] 2011 yılında, Amerika Birleşik Devletleri'nde tahmini 4 milyon insan opioidleri rekreasyonel olarak kullandı veya onlara bağımlıydı.[13] 2015 itibarıyla, artan rekreasyonel kullanım ve bağımlılık oranları, opioid ilaçların aşırı reçetelenmesine ve ucuz yasadışı eroine bağlanmaktadır.[14][15][16] Tersine, aşırı reçeteleme, abartılı yan etkiler ve opioidlerden bağımlılık konusundaki korkular benzer şekilde ağrının yetersiz tedavisi için suçlanmaktadır.[17][18]
Terminoloji
Opioidler, morfinin kendisi de dahil olmak üzere afyondan türetilen bu tür ilaçları ifade eden eski bir terim olan opiatları içerir.[19] Diğer opioidler hidrokodon, oksikodon ve fentanil gibi yarı sentetik ve sentetik ilaçlardır; nalokson gibi antagonist ilaçlar ve endorfinler gibi endojen peptitlerdir.[20] Afyon ve narkotik terimleri bazen opioid ile eş anlamlı olarak karşımıza çıkmaktadır. Afyon, afyon haşhaşının reçinesinde bulunan doğal alkaloidlerle sınırlıdır, ancak bazıları yarı sentetik türevleri içerir.[19][21] Amerikan yasal terimi olarak 'uyuşukluk' veya 'uyku' anlamına gelen kelimelerden türetilen narkotik, kokain ve opioidleri ve bunların kaynak materyallerini ifade eder; ayrıca herhangi bir yasadışı veya kontrollü psikoaktif ilaca gevşek bir şekilde uygulanır.[22][23] Bazı yargı bölgelerinde kontrol edilen tüm uyuşturucular yasal olarak uyuşturucu olarak sınıflandırılmıştır. Terim aşağılayıcı çağrışımlara sahip olabilir ve bu durumda kullanımı genellikle önerilmez.[24][25]
Tıbbi kullanımlar
Özetle
Bakış açısı

Ağrı
Zayıf opioid kodein, düşük dozlarda ve bir veya daha fazla başka ilaçla birlikte, hafif ağrıları tedavi etmek için reçeteli ilaçlarda ve reçetesiz olarak yaygın olarak bulunur.[26][27][28] Diğer opioidler genellikle orta ile şiddetli ağrıların giderilmesi için kullanılır.[27]
Akut ağrı
Opioidler akut ağrının tedavisinde etkilidir (ameliyat sonrası ağrı gibi).[29] Orta ile şiddetli akut ağrının hızlıca giderilmesi için, opioidler hızlı başlangıçları, etkinlikleri ve azalmış bağımlılık riskleri nedeniyle sıklıkla tercih edilen tedavidir. Bununla birlikte, yeni bir rapor, ameliyat veya travma sonrası akut ağrı yönetimi için opioid analjezikler başlatıldığında uzun süreli opioid kullanımı için açık bir risk göstermiştir.[30] Ayrıca, palyatif bakımda, kanser gibi bazı terminal durumlarda ve romatoid artrit gibi dejeneratif durumlarda ortaya çıkabilecek şiddetli, kronik, sakat bırakıcı ağrıya yardımcı olmak için önemli oldukları bulunmuştur. Birçok durumda opioidler, kronik kanser ağrısı olanlar için başarılı bir uzun vadeli bakım stratejisidir.
ABD'deki tüm eyaletlerin yarısından biraz fazlası, akut ağrı için opioidlerin reçete edilmesini veya dağıtılmasını kısıtlayan yasalar çıkarmıştır.[31]
Kronik kanser dışı ağrı
Kılavuzlar, opioid riskinin, baş ağrısı, sırt ağrısı ve fibromiyalji dahil olmak üzere kanser dışı kronik durumların çoğu için kullanıldığında faydalarından daha büyük olduğunu öne sürmüştür.[32] Bu nedenle kronik kanser dışı ağrılarda dikkatli kullanılmalıdırlar.[33] Kullanılırsa fayda ve zararlar en az üç ayda bir yeniden değerlendirilmelidir.[34]
Kronik ağrının tedavisinde, opioidler, parasetamol/asetaminofen, ibuprofen veya naproksen gibi NSAID'ler dahil olmak üzere diğer daha az riskli ağrı kesiciler düşünüldükten sonra denenecek bir seçenektir.[35] Fibromiyalji veya migrenin neden olduğu ağrı da dahil olmak üzere bazı kronik ağrı türleri, tercihen opioidler dışındaki ilaçlarla tedavi edilir.[36][37] Kronik nöropatik ağrıyı azaltmak için opioidlerin kullanılmasının etkinliği belirsizdir.[38]
Opioidler baş ağrısı için birinci basamak tedavi olarak kontrendikedir, çünkü uyanıklığı bozar, bağımlılık riski taşır ve epizodik baş ağrılarının kronikleşme riskini arttırır.[39] Opioidler ayrıca baş ağrısı ağrısına karşı duyarlılığın artmasına neden olabilir.[39] Diğer tedaviler başarısız olduğunda veya kullanılamadığında, hasta kronik baş ağrısının gelişmesini önlemek için izlenebilirse opioidler baş ağrısı tedavisi için uygun olabilir.[39]
Opioidler malign olmayan kronik ağrıların tedavisinde daha sık kullanılmaktadır.[40][41][42] Bu uygulama günümüzde bağımlılık ve opioidlerin kötüye kullanımı ile ilgili yeni ve büyüyen bir soruna yol açmıştır.[33][43] Çeşitli olumsuz etkiler nedeniyle, kronik ağrının uzun süreli yönetimi için opioidlerin kullanımı, diğer daha az riskli ağrı kesicilerin etkisiz bulunmadığı sürece endike değildir. Sinir ağrısı, migren ve fibromiyalji gibi sadece periyodik olarak ortaya çıkan kronik ağrı, sıklıkla opioidler dışındaki ilaçlarla daha iyi tedavi edilir.[36] Parasetamol, ibuprofen ve naproksen dahil olmak üzere steroid olmayan antiinflamatuar ilaçlar daha güvenli alternatifler olarak kabul edilir.[44] Sıklıkla oksikodon (Percocet) ile kombine parasetamol ve hidrokodon (Vicoprofen) ile kombine ibuprofen gibi opioidlerle birlikte kullanılırlar, bu da ağrı kesimini arttırır, ancak aynı zamanda rekreasyonel kullanımı caydırmayı amaçlar.[45][46]
Diğer
Öksürük
Kodein bir zamanlar öksürük bastırıcılarda "altın standart" olarak görülüyordu, ancak bu pozisyonu günümüzde sorgulanmaktadır.[47] Son zamanlarda yapılan bazı plasebo kontrollü çalışmalar, çocuklarda akut öksürük de dahil olmak üzere bazı nedenlerden dolayı plasebodan daha iyi olmayabileceğini bulmuştur.[48][49] Bu nedenle çocuklar için önerilmez.[49] Ek olarak, hidrokodonun çocuklarda yararlı olduğuna dair bir kanıt yoktur.[50] Benzer şekilde 2012 Hollanda kılavuzu, akut öksürüğün tedavisi ile ilgili kullanımını önermemektedir.[51] (Uzun zamandır kodein kadar etkili bir öksürük bastırıcı olduğu iddia edilen opioid analog dekstrometorfan benzer şekilde birkaç yeni çalışmada çok az fayda göstermiştir.)[52][53]
Düşük doz morfin kronik öksürüğe yardımcı olabilir, ancak kullanımı yan etkilerle sınırlıdır.[54]
İshal ve kabızlık
İshal baskın irritabl bağırsak sendromu vakalarında, ishali baskılamak için opioidler kullanılabilir. Loperamid, ishali baskılamak için kullanılan reçetesiz olarak kullanılabilen periferik olarak seçici bir opioiddir.
İshali bastırma yeteneği, opioidler birkaç haftadan fazla kullanıldığında kabızlık da üretir.[55] Periferik olarak seçici bir opioid antagonisti olan Naloksegol, opioid kaynaklı kabızlığı tedavi etmek için artık mevcuttur.[56]
Nefes darlığı
Opioidler, özellikle kanser ve KOAH gibi ileri seviye hastalıklarda nefes darlığına yardımcı olabilir.[57][58] Bununla birlikte, yakın zamanda yapılan iki sistematik literatür incelemesinden elde edilen bulgular, opioidlerin ilerlemiş kanserli hastalarda nefes darlığı tedavisinde mutlaka daha etkili olmadığını ortaya koymuştur.[59][60]
Huzursuz bacak sendromu
Tipik olarak ilk tedavi yöntemi olmamakla birlikte, oksikodon ve metadon gibi opioidler bazen şiddetli ve dirençli huzursuz bacak sendromunun tedavisinde kullanılır.[61]
Hiperaljezi
Opioid kaynaklı hiperaljezi (OIH), kronik opioid maruziyetinden sonraki hastalarda belirgindir.[62][63]
Yan etkiler
Özetle
Bakış açısı
Opioidlerin yan etkileri
Yaygın ve kısa vadeli
Diğer
- Bilişsel etkiler
- Opioid bağımlılığı
- Baş dönmesi
- İştah kaybı
- Gecikmiş mide boşalması
- Azalmış cinsel dürtü
- Cinsel işlev bozukluğu
- Testosteron seviyelerinde azalma
- Depresyon
- Bağışıklık yetmezliği
- Artan ağrı hassasiyeti
- Düzensiz menstrüasyon
- Düşme riskinde artış
- Yavaş nefes alma
- Koma
Her yıl dünya çapında 69.000 kişi aşırı doz opioid kullanımı nedeniyle ölmekte ve 15 milyon kişi opioid bağımlılığına sahiptir.[65]
Yaşlı yetişkinlerde, opioid kullanımı "sedasyon, bulantı, kusma, kabızlık, idrar retansiyonu ve düşmeler" gibi artan yan etkilerle ilişkilidir.[66] Sonuç olarak, opioid alan yaşlı yetişkinlerin yaralanma riski daha fazladır.[67] Opioidler, aspirin ve parasetamol gibi diğer birçok ilacın aksine herhangi bir spesifik organ toksisitesine neden olmaz. Üst gastrointestinal kanama ve böbrek toksisitesi ile ilişkili değildirler.[68]
Akut bel ağrısı ve osteoartrit tedavisi için opioidlerin reçete edilmesi uzun vadeli olumsuz etkilere sahip gibi görünmektedir.[69][70]
USCDC'ye göre, metadon 1999-2010 yılları arasında ABD'de opioid bağlantılı ölümlerin %31'inde ve diğer opioidlerden çok daha yüksek oranda, tek uyuşturucu olarak %40'ında yer almıştır.[71] Uzun süreli opioid çalışmaları, birçoğunun onları durdurduğunu ve küçük yan etkilerin yaygın olduğunu bulmuştur.[72] Bağımlılık yaklaşık %0.3 oranında gerçekleşti.[72] Amerika Birleşik Devletleri'nde 2016 yılında opioid doz aşımı, 10.000 kişiden 1,7'sinin ölümüyle sonuçlandı.[73]
Takviye bozuklukları
Tolerans
Tolerans, ilaç etkilerinin azalmasıyla sonuçlanan nöroadaptasyonlarla karakterize edilen bir süreçtir. Reseptör yukarı regülasyonu sıklıkla önemli bir rol oynayabilirken, diğer mekanizmalar da bilinmektedir.[74] Tolerans, bazı etkiler için diğerlerinden daha belirgindir; Duygudurum, kaşıntı, idrar retansiyonu ve solunum depresyonu üzerindeki etkilere karşı tolerans yavaş gelişir, ancak analjezi ve diğer fiziksel yan etkilere karşı daha çabuk oluşur. Bununla birlikte, kabızlık veya miyoz (gözbebeğinin iki milimetreye eşit veya daha az daralması) için tolerans gelişmez. Bununla birlikte, bazı yazarlar toleransın miyozise dönüştüğünü ileri sürerek bu fikre meydan okunmuştur.[75]
Opioidlere tolerans, aşağıdakiler de dahil olmak üzere bir dizi madde tarafından azaltılır:
- Kalsiyum kanal blokerleri[76][77][78]
- İntratekal magnezyum[79][80] ve çinko[81]
- Dekstrometorfan, ketamin[82] ve memantin[83] gibi NMDA antagonistleri.
- Proglumid gibi kolesistokinin antagonistleri[84][85][86]
- Fosfodiesteraz inhibitörü ibudilast gibi daha yeni ajanlar da bu uygulama için araştırılmıştır.[87]
Tolerans, vücudun sıklıkla mevcut olan bir ilaca uyum sağladığı ve genellikle aynı etkiyi elde etmek için zaman içinde aynı ilacın daha yüksek dozlarını gerektirdiği fizyolojik bir süreçtir. Uzun süreler boyunca yüksek dozda opioid alan kişilerde sık görülen bir durumdur, ancak kötüye kullanım veya bağımlılık ile herhangi bir ilişki öngörmemektedir.
Fiziksel bağımlılık
Fiziksel bağımlılık, vücudun bir maddenin, bu durumda opioid ilacının varlığına fizyolojik adaptasyonudur. Madde kesildiğinde, doz aniden azaltıldığında veya özellikle opioidler söz konusu olduğunda, bir antagonist (örn. nalokson) veya bir agonist-antagonist (örn. pentazosin) uygulandığında yoksunluk semptomlarının gelişmesi ile tanımlanır. Fiziksel bağımlılık, bazı ilaçların normal ve beklenen bir yönüdür ve mutlaka hastanın bağımlı olduğu anlamına gelmez. Opiatlar için yoksunluk belirtileri, şiddetli disfori, başka bir afyon dozu için özlem, sinirlilik, terleme, bulantı, burun akıntısı, titreme, kusma ve kas ağrısını içerebilir. Opioid alımını günler ve haftalar içinde yavaş yavaş azaltmak, yoksunluk semptomlarını azaltabilir veya ortadan kaldırabilir.[88] Çekilme hızı ve şiddeti, opioidin yarı ömrüne bağlıdır; eroin ve morfin yoksunluğu metadon yoksunluğundan daha hızlı gerçekleşir. Akut yoksunluk evresini genellikle aylarca sürebilen uzun süreli bir depresyon ve uykusuzluk evresi takip eder. Opioid yoksunluğu semptomları, klonidin gibi diğer ilaçlarla tedavi edilebilir.[89] Fiziksel bağımlılık, uyuşturucu kötüye kullanımını veya gerçek bağımlılığı öngörmez ve toleransla aynı mekanizma ile yakından ilişkilidir. İbogain ile ilgili anekdotsal fayda iddiaları olsa da madde bağımlılığında kullanımını destekleyen veriler yetersizdir.[90]
Düzenli dozlarda opioid alan kritik hastalar, sık görülen bir sendrom olarak iyatrojenik yoksunluk yaşarlar.[91]
Bağımlılık
Uyuşturucu bağımlılığı, tipik olarak belirli ilaçların yanlış kullanımıyla ilişkili, zamänla ve daha yüksek ilaç dozajlarıyla gelişen karmaşık bir dizi davranıştır. Bağımlılık, etkilenen kişinin tehlikeli veya sağlıksız sonuçlara yol açan eylemlerde ısrar ettiği ölçüde psikolojik zorlamayı içerir. Opioid bağımlılığı, tıbbi nedenlerle reçete edildiği gibi ağızdan opioid almak yerine, insuflasyonu veya enjeksiyonu içerir.[88]
Avusturya, Bulgaristan ve Slovakya gibi Avrupa ülkelerinde, buprenorfin veya metadonun yan etkilerini iyi tolere edemeyen hastalar için opiat ikame tedavisinde (OİT) yavaş salınımlı oral morfin formülasyonları kullanılmaktadır. Buprenorfin, bağımlılığın daha uzun süreli tedavisi için nalokson ile birlikte de kullanılabilir. Birleşik Krallık da dahil olmak üzere diğer Avrupa ülkelerinde bu, değişen bir kabul ölçeğinde olsa da OİT için yasal olarak kullanılmaktadır.
Yavaş salınan ilaç formülasyonları, ağrı hastalarına hala meşru ağrı kesici ve kullanım kolaylığı sağlamaya çalışırken, kötüye kullanımı engellemeyi ve bağımlılık oranlarını düşürmeyi amaçlamaktadır. Bununla birlikte, bu tür müstahzarların etkinliği ve güvenliği hakkında sorular devam etmektedir. Daha fazla kurcalamaya dayanıklı ilaçlar şu anda FDA tarafından pazar onayı için denemeler ile değerlendirilmektedir.[92][93]
Mevcut kanıt miktarı yalnızca zayıf bir sonuca varılmasına izin verir, ancak madde kullanım bozukluğu öyküsü olmayan hastalarda opioid kullanımını uygun şekilde yöneten bir doktorun, bağımlılık geliştirme veya diğer ciddi yan etkiler açısından çok az riskle uzun süreli ağrı kesici sağlayabileceğini düşündürür.[72]
Opioidlerle ilgili sorunlar şunları içerir:
- Bazı insanlar opioidlerin tüm ağrılarını gidermediğini fark edebilirler.[94]
- Bazı insanlar, opioidlerin yan etkilerinin, terapinin yararından daha ağır basan sorunlara yol açtığını düşünebilirler.[72]
- Bazı insanlar zamanla opioidlere tolerans geliştirir. Bu, faydayı sürdürmek için ilaç dozlarını artırmalarını gerektirir ve bu da istenmeyen yan etkileri artırır.[72]
- Uzun süreli opioid kullanımı, hastanın ağrıya duyarlılığının arttığı bir durum olan opioid kaynaklı hiperaljeziye neden olabilir.[95]
Tüm opioidler yan etkilere neden olabilir.[64] Ağrıyı gidermek için opioid alan hastalarda sık görülen yan etkiler bulantı ve kusma, uyuşukluk, kaşıntı, ağız kuruluğu, baş dönmesi ve kabızlığı içerir.[64][88]
Mide bulantısı ve kusma
Bulantıya tolerans, antiemetiklerin (örneğin, gece bir kez düşük doz haloperidol) çok etkili olduğu 7-10 gün içinde ortaya çıkar.[kaynak belirtilmeli] Tardif diskinezi gibi ciddi yan etkiler nedeniyle haloperidol artık nadiren kullanılmaktadır. Benzer risklere sahip olmasına rağmen, ilgili bir ilaç olan proklorperazin daha sık kullanılır. Ondansetron veya tropisetron gibi daha güçlü antiemetikler, daha yüksek maliyetlerine rağmen, bazen bulantı şiddetli veya sürekli ve rahatsız edici olduğunda kullanılır. Daha ucuz bir alternatif, domperidon ve metoklopramid gibi dopamin antagonistleridir. Domperidon kan-beyin bariyerini geçmez ve ters merkezi antidopaminerjik etkiler üretmez, ancak kemoreseptör tetikleme bölgesindeki opioid emetik etkisini bloke eder. Bu illaç ABD'de mevcut değildir.
Antikolinerjik özelliklere sahip bazı antihistaminikler (örneğin orfenadrin veya difenhidramin) de etkili olabilir. Birinci nesil antihistamin hidroksizin, hareket bozukluklarına neden olmaması ve ayrıca analjezik koruyucu özelliklere sahip olması gibi ek avantajlarla birlikte çok yaygın olarak kullanılmaktadır. Δ9-tetrahidrokanabinol bulantı ve kusmayı giderir;[96][97] aynı zamanda daha düşük dozlarda opioid kullanımına izin veren, bulantı ve kusmayı azaltan analjezi üretir.[98][99]
- 5-HT3 antagonistleri (örn. ondansetron)
- Dopamin antagonistleri (örn. domperidon)
- Antikolinerjik antihistaminikler (örn. difenhidramin)
- Δ9-tetrahidrokanabinol (örn. dronabinol)
Kusma, beynin kusma merkezi olan postrema bölgesinin kemoreseptör tetikleyici bölgesi üzerindeki doğrudan etkinin yanı sıra, gastrik stazdan (büyük hacimli kusma, kusmayla geçen kısa süreli mide bulantısı, özofagal reflü, epigastrik dolgunluk, erken doyma) kaynaklanır. Kusma böylece prokinetik ajanlar (örn. domperidon veya metoklopramid) tarafından önlenebilir. Kusma zaten başlamışsa bu ilaçların oral olmayan bir yolla (örn. metoklopramid için subkutan, domperidon için rektal yoldan) uygulanması gerekir.
- Prokinetik ajanlar (örn. domperidon)
- Antikolinerjik ajanlar (örn. orfenadrin)
Kanıtlar, opioid içeren anestezinin postoperatif bulantı ve kusma ile ilişkili olduğunu göstermektedir.[100]
Opioid kullanan kronik ağrısı olan hastalarda ağrıda ve fiziksel işlevde küçük iyileşmeler ve kusma riskinde artış olmuştur.[101]
Somnolans
Somnolans toleransı genellikle 5-7 gün içinde gelişir, ancak zahmetliyse alternatif bir opioide geçmek genellikle yardımcı olur. Fentanil, morfin ve diamorfin (eroin) gibi belirli opioidler özellikle yatıştırıcı olma eğilimindeyken; oksikodon, tilidin ve meperidin (petidin) gibi diğerleri nispeten daha az sedasyon üretme eğilimindedir, ancak bireysel hastaların yanıtları belirgin şekilde değişebilir ve bir dereceye kadar deneme ve belirli bir hasta için en uygun ilacı bulmak için hata gerekebilir. Aksi takdirde, CNS uyarıcıları ile tedavi genellikle etkilidir.[102][103]
- Uyarıcılar (örn. kafein, modafinil, amfetamin, metilfenidat)
Kaşıntı
Ağrıyı gidermek için opioidler kullanıldığında kaşıntı ciddi bir sorun olmama eğilimindedir, ancak antihistaminikler, ortaya çıktığında kaşıntıya karşı koymak için yararlıdır. Feksofenadin gibi yatıştırıcı olmayan antihistaminikler, opioid kaynaklı uyuşukluğun artmasını engelledikleri için sıklıkla tercih edilir. Bununla birlikte, orfenadrin gibi bazı yatıştırıcı antihistaminikler, daha küçük dozlarda opioidlerin kullanılmasına izin veren sinerjik bir ağrı giderici etki üretebilir. Sonuç olarak, Meprozin (meperidin/prometazin) ve Diconal (dipipanon/siklizin) gibi çeşitli opioid/antihistaminik kombinasyon ürünleri pazarlanmıştır ve bunlar aynı zamanda opioid kaynaklı mide bulantısını da azaltabilir.
- Antihistaminikler (örneğin feksofenadin)
Kabızlık
Opioid kaynaklı kabızlık (OKK), uzun süreli opioid alan kişilerin %90 ile 95'inde gelişir.[104] Bu soruna tolerans genellikle gelişmediğinden, uzun süreli opioid kullanan çoğu kişinin müshil veya lavman alması gerekir.[105]
OKK tedavisi ardışıktır ve ciddiyete bağlıdır.[106] İlk tedavi şekli farmakolojik değildir ve diyet lifi, sıvı alımı (günde yaklaşık 15 L) ve fiziksel aktivite gibi yaşam tarzı değişikliklerini içerir.[106] Farmakolojik olmayan önlemler etkisiz ise, dışkı yumuşatıcılar (örn. polietilen glikol), yığın oluşturan laksatifler (örn. lif takviyeleri), uyarıcı laksatifler (örn. bisakodil, senna) ve/veya lavman dahil laksatifler kullanılabilir.[106] OKK için yaygın bir müshil rejimi, docusate ve bisakodil kombinasyonudur.[106][107][108][güncellenmeli] Ozmotik laksatifler, laktuloz, polietilen glikol ve magnezyum sütü (magnezyum hidroksit) ve ayrıca mineral yağ (bir yağlayıcı müshil) de yaygın olarak kullanılır.[107][108]
Laksatifler yeterince etkili değilse (ki bu genellikle böyledir),[109] metilnaltrekson bromür, naloksegol, alvimopan veya nalokson (oksikodon/naloksonda olduğu gibi) gibi periferik olarak seçici bir opioid antagonisti içeren opioid formülasyonları veya rejimleri denenebilir.[106][108][110] Bir 2018 Cochrane incelemesi, kanıtların alvimopan, nalokson veya metilnaltrekson bromür için geçici olduğunu bulmuştur.[111][güncellenmeli] Ağız yoluyla Nalokson güncellemesi en etkili gibi görünmektedir.[112] Günlük 0,2 mg naldemedin dozunun, OKK hastalarında semptomları önemli ölçüde iyileştirdiği gösterilmiştir.[113]
Opioid rotasyonu, uzun süreli kullanıcılarda kabızlığın etkisini en aza indirmek için önerilen bir yöntemdir.[114] Tüm opioidler kabızlığa neden olurken, ilaçlar arasında bazı farklılıklar vardır; çalışmalar, tramadol, tapentadol, metadon ve fentanilin nispeten daha az kabızlığa neden olabileceğini düşündürürken, kodein, morfin, oksikodon veya hidromorfon ile kabızlık nispeten daha şiddetli olabilir.
Solunum depresyonu
Solunum depresyonu, opioid kullanımıyla ilişkili en ciddi advers reaksiyondur, ancak genellikle opioid kullanmamış bir hastada tek bir intravenöz dozun kullanımıyla görülür. Ağrıyı gidermek için düzenli olarak opioid alan hastalarda solunum depresyonuna tolerans hızla oluşur, bu nedenle klinik bir sorun değildir. Solunum depresyonunu kısmen bloke edebilen birkaç ilaç geliştirilmiştir, ancak şu anda bu amaç için onaylanmış tek solunum uyarıcısı, bu uygulamada yalnızca sınırlı etkinliğe sahip olan doksapramdır.[115][116] BIMU8 ve CX-546 gibi daha yeni ilaçlar çok daha etkili olabilir.[117][118][119][birincil olmayan kaynak gerekli]
- Solunum uyarıcıları: karotis kemoreseptör agonistleri (örn. doksapram), 5-HT4 agonistleri (örn. BIMU8), δ-opioid agonistleri (örn. BW373U86) ve AMPAkinler (örn. CX717) analjeziyi etkilemeden opioidlerin neden olduğu solunum depresyonunu azaltabilir, ancak bu ilaçların çoğu sadece orta derecede etkilidir veya insanlarda kullanımını engelleyen yan etkileri vardır. 8-OH-DPAT ve repinotan gibi 5-HT1A agonistleri de opioid kaynaklı solunum depresyonuna karşı koyar, ancak aynı zamanda analjeziyi azaltır, bu da bu uygulama için kullanışlılıklarını sınırlar.
- Opioid antagonistleri (örn. nalokson, nalmefen, diprenorfin)
Opioid uygulamasından sonraki ilk 24 saat, yaşamı tehdit eden solunum depresyonu açısından en kritik olan gibi görünmektedir, ancak opioid kullanımına daha dikkatli bir yaklaşımla önlenebilir olabilir.[120]
Kardiyak, solunum hastalığı ve/veya obstrüktif uyku apnesi olan hastalar solunum depresyonu için yüksek risk altındadır.[121]
Artan ağrı duyarlılığı
Opioid kaynaklı hiperaljezi - ağrıyı gidermek için opioid kullanan kişilerin paradoksal olarak bu ilacın bir sonucu olarak daha fazla ağrı yaşadığı - bazı insanlarda gözlenmiştir. Bu fenomen, nadir olmakla birlikte, palyatif bakım alan bazı kişilerde, çoğunlukla doz hızla artırıldığında görülür.[122][123] Karşılaşılırsa, birkaç farklı opioid ağrı kesici ilaç arasında rotasyon, artan ağrı gelişimini azaltabilir.[124][125] Opioid kaynaklı hiperaljezi daha çok kronik kullanımda veya kısa süreli yüksek dozlarda ortaya çıkar, ancak bazı araştırmalar bunun çok düşük dozlarda da ortaya çıkabileceğini düşündürmektedir.[126][127]
Bazen nöropatik ağrının kötüleşmesine eşlik eden hiperaljezi ve allodini gibi yan etkiler, opioid analjeziklerle uzun süreli tedavinin sonuçları olabilir, özellikle de artan tolerans, zaman içinde etkinlik kaybına ve bunun sonucunda ilerleyen doz artışına neden olduğunda. Bu durum büyük ölçüde opioid ilaçların nosiseptin reseptörü, sigma reseptörü ve Toll benzeri reseptör 4 dahil olmak üzere üç klasik opioid reseptörü dışındaki hedeflerdeki etkilerinin bir sonucu gibi görünmektedir ve hayvan modellerinde sırasıyla J-113,397, BD-1047 veya (+)-nalokson gibi bu hedeflerdeki antagonistlerle önlenebilir.[128] Günümüzde insanlarda opioid kaynaklı hiperaljeziye karşı koymak için özel olarak onaylanmış hiçbir ilaç yoktur ve ciddi vakalarda tek çözüm opioid analjeziklerin kullanımının kesilmesi ve bunların opioid olmayan analjezik ilaçlarla değiştirilmesi olabilir. Bununla birlikte, bu yan etkinin gelişimine karşı bireysel hassasiyet yüksek oranda doza bağlı olduğundan ve hangi opioid analjeziğin kullanıldığına bağlı olarak değişebileceğinden, birçok hasta opioid ilacın dozunu azaltarak (genellikle ek bir opioid olmayan analjezik ilavesiyle birlikte), farklı opioid ilaçlar arasında rotasyon yaparak veya nöropatik ağrıyı da önleyen karma etki tarzına sahip daha hafif bir opioide, özellikle tramadol veya tapentadole geçerek bu yan etkiden kaçınabilir.[129][130][131]
- Ketamin gibi NMDA reseptör antagonistleri
- Milnasipran gibi SNRI'ler
- Gabapentin veya pregabalin gibi antikonvülzanlar
Diğer yan etkiler
Düşük cinsiyet hormonu seviyeleri
Klinik çalışmalar, tıbbi ve eğlence amaçlı opioid kullanımını farklı cinsiyetlerde hipogonadizm (düşük cinsiyet hormonu seviyeleri) ile tutarlı bir şekilde ilişkilendirmiştir. Bu etki doza bağlıdır. Çoğu çalışma, kronik opioid kullanıcılarının çoğunun (belki de %90'ının) hipogonadizm geliştirdiğini göstermektedir. 2015 yılında yapılan bir sistematik inceleme ve meta-analiz, opioid tedavisinin erkeklerde testosteron seviyelerini ortalama 165 ng/dL (5,7 nmol/L) kadar baskıladığını ve bunun da testosteron seviyesinde neredeyse %50'lik bir azalmaya neden olduğunu ortaya koymuştur.[132] Buna karşılık, opioid tedavisi kadınlarda testosteron seviyelerini önemli ölçüde etkilememiştir.[132] Bununla birlikte, opioidler lüteinizan hormon (LH) üretimini sınırlayarak kadınlarda menstrüasyona da müdahale edebilir. Opioid kaynaklı hipogonadizm, muhtemelen östradiol eksikliğine bağlı olarak opioid kullanımının osteoporoz ve kemik kırılması ile güçlü ilişkisine neden olmaktadır. Ayrıca ağrıyı artırabilir ve böylece opioid tedavisinin amaçlanan klinik etkisine müdahale edebilir. Opioid kaynaklı hipogonadizm muhtemelen hipotalamus ve hipofiz bezindeki opioid reseptörlerinin agonizminden kaynaklanmaktadır.[kaynak belirtilmeli] Bir çalışma, eroin bağımlılarının depresif testosteron seviyelerinin yoksunluktan sonraki bir ay içinde normale döndüğünü, bu da etkinin kolayca geri döndürülebilir olduğunu ve kalıcı olmadığını düşündürmektedir.[kaynak belirtilmeli] 2013 yılı itibarıyla, düşük doz veya akut opioid kullanımının endokrin sistem üzerindeki etkisi belirsizdir.[133][134][135][136] Opioidlerin uzun süreli kullanımı diğer hormonal sistemleri de etkileyebilir.[133]
İşin aksaması
Opioid kullanımı işe geri dönememe için bir risk faktörü olabilir.[137][138]
Güvenlik açısından hassas herhangi bir görev yapan kişiler opioid kullanmamalıdır.[139] Sağlık hizmeti sağlayıcıları, vinç veya forklift dahil ağır ekipman kullanan veya kullanan çalışanların kronik veya akut ağrıyı opioidlerle tedavi etmelerini önermemelidir.[139] Güvenlik açısından hassas operasyonlar yürüten işçileri yöneten işyerleri, bu işçiler doktorları tarafından opioidlerle tedavi edildiği sürece işçileri daha az hassas görevlere vermelidir.[139]
Opioidleri uzun süre alan kişilerin işsiz kalma olasılığı artmıştır.[140] Opioid almak hastanın hayatını daha da bozabilir ve opioidlerin olumsuz etkileri hastaların aktif bir yaşam sürmeleri, iş bulmaları ve kariyer sürdürmeleri önünde önemli bir engel haline gelebilir.
Ek olarak, istihdam eksikliği, reçeteli opioidlerin anormal kullanımının bir göstergesi olabilir.[141]
Artan kaza eğilimi
Opioid kullanımı kazaya yatkınlığı artırabilir. Opioidler trafik kazası[142][143] ve kaza sonucu düşme riskini artırabilir.[144]
Azaltılmış dikkat
Opioidlerin, antidepresanlar ve/veya antikonvülzanlarla birlikte kullanıldığında dikkati azalttığı gösterilmiştir.[145]
Nadir yan etkiler
Ağrı kesici olarak opioid kullanan hastalarda seyrek görülen advers reaksiyonlar şunlardır: doza bağlı solunum depresyonu (özellikle daha güçlü opioidlerle), konfüzyon, halüsinasyonlar, deliriyum, ürtiker, hipotermi, bradikardi/taşikardi, ortostatik hipotansiyon, baş dönmesi, baş ağrısı, idrar retansiyonu, üreterik veya biliyer spazm, kas sertliği, miyoklonus (yüksek dozlarda) ve kızarma (histamin salınımına bağlı, fentanil ve remifentanil hariç).[88] Opioidlerin hem terapötik hem de kronik kullanımı bağışıklık sisteminin işlevini tehlikeye atabilir. Opioidler makrofaj progenitör hücrelerin ve lenfositlerin çoğalmasını azaltır ve hücre farklılaşmasını etkiler (Roy & Loh, 1996). Opioidler ayrıca lökosit göçünü de engelleyebilir. Ancak bunun ağrının giderilmesi bağlamındaki önemi bilinmemektedir.
Etkileşimler
Özetle
Bakış açısı
Opioidleri diğer ilaçlarla birlikte kullanan hastaları tedavi eden hekimler, daha ileri tedavinin endike olduğuna dair sürekli dokümantasyon tutarlar ve hastanın durumu daha az riskli tedaviyi hak edecek şekilde değişirse tedaviyi ayarlama fırsatlarının farkında olurlar.[146]
Diğer depresan ilaçlarla birlikte
Opioidlerin benzodiazepinler veya etanol gibi diğer depresan ilaçlarla eşzamanlı kullanımı advers olay ve aşırı doz oranlarını artırmaktadır.[146] Buna rağmen, opioidler ve benzodiazepinler birçok ortamda eşzamanlı olarak dağıtılmaktadır.[147][148] Tek başına opioid doz aşımında olduğu gibi, bir opioid ve başka bir depresanın kombinasyonu solunum depresyonunu hızlandırabilir ve genellikle ölüme yol açabilir.[149] Bu riskler, hasta davranışındaki ve tedaviye uyumdaki değişiklikler için sürekli tarama yapabilecek bir doktor tarafından yakın izleme ile azaltılır.[146]
Opioid antagonisti
Opioid etkileri (olumsuz veya başka türlü) nalokson veya naltrekson gibi bir opioid antagonisti ile tersine çevrilebilir.[150] Bu rekabetçi antagonistler opioid reseptörlerine agonistlerden daha yüksek afinite ile bağlanır ancak reseptörleri aktive etmez. Bu, agonistin yerini alarak agonist etkilerini zayıflatır veya tersine çevirir. Bununla birlikte, naloksonun eliminasyon yarı ömrü opioidin kendisinden daha kısa olabilir, bu nedenle tekrar dozlama veya sürekli infüzyon gerekebilir veya nalmefen gibi daha uzun etkili bir antagonist kullanılabilir. Düzenli olarak opioid alan hastalarda, dayanılmaz bir ağrıyla uyanmak gibi şiddetli ve üzücü bir reaksiyondan kaçınmak için opioidin sadece kısmen tersine çevrilmesi esastır. Bu, tam doz verilmeyip solunum hızı düzelene kadar küçük dozlarda verilerek sağlanır. Daha sonra bir infüzyon başlatılarak tersine çevirme bu seviyede tutulur ve ağrı kesilmeye devam edilir. Opioid antagonistleri, opioid aşırı dozunu takiben solunum depresyonu için standart tedavi olmaya devam etmektedir ve nalokson en yaygın kullanılanıdır, ancak daha uzun etkili antagonist nalmefen, metadon gibi uzun etkili opioidlerin aşırı dozlarını tedavi etmek için kullanılabilir ve diprenorfin, veteriner hekimlikte kullanılan etorfin ve karfentanil gibi son derece güçlü opioidlerin etkilerini tersine çevirmek için kullanılır. Bununla birlikte, opioid antagonistleri opioid analjeziklerin faydalı etkilerini de bloke ettiğinden, genellikle sadece aşırı doz tedavisinde faydalıdırlar; opioid antagonistlerinin yan etkileri azaltmak için opioid analjeziklerle birlikte kullanılması, dikkatli doz titrasyonu gerektirir ve analjezinin sürdürülmesine izin verecek kadar düşük dozlarda genellikle zayıf etkilidir.
Naltreksonun ciddi advers olay riskini artırmadığı görülmüştür, bu da oral naltreksonun güvenilirliğini doğrulamaktadır.[151] Nalokson kullanan hastalarda rebound toksisitesine bağlı ölüm veya ciddi advers olaylar nadir görülmüştür.[152]
Farmakoloji
Özetle
Bakış açısı
| İlaç | Göreceli Potens[153] |
İyonize Olmayan Oran | Bağlayıcı Protein | Lipid Çözünürlüğü[154][155][156] |
|---|---|---|---|---|
| Morfin | 1 | ++ | ++ | ++ |
| Petidin (meperidin) | 0,1 | + | +++ | +++ |
| Hidromorfon | 10 | + | +++ | |
| Alfentanil | 10-25 | ++++ | ++++ | +++ |
| Fentanil | 50-100[157][158][159] | + | +++ | ++++ |
| Remifentanil | 250[kaynak belirtilmeli] | +++ | +++ | ++ |
| Sufentanil | 500-1000 | ++ | ++++ | ++++ |
| Etorfin | 1000-3000 | |||
| Karfentanil | 10.000 |
Opioidler sinir sistemi ve diğer dokulardaki spesifik opioid reseptörlerine bağlanır. Opioid reseptörlerinin üç ana sınıfı vardır: μ, κ, δ (mu, kappa ve delta), ancak on yedi kadar reseptör bildirilmiştir ve ε, ι, λ ve ζ (Epsilon, Iota, Lambda ve Zeta) reseptörlerini içerir. Buna karşılık, σ (Sigma) reseptörleri artık opioid reseptörleri olarak kabul edilmemektedir çünkü aktivasyonları opioid ters-agonisti nalokson tarafından tersine çevrilmez, klasik opioidler için yüksek afiniteli bağlanma göstermezler ve diğer opioid reseptörleri levo-rotatori izomerler için stereo-seçici iken dekstro-rotatori izomerler için stereoselektiftirler. Buna ek olarak, μ-reseptörünün üç alt tipi vardır: μ1 ve μ2 ve yeni keşfedilen μ3. Klinik öneme sahip bir diğer reseptör de ağrı tepkilerinde rol oynayan ve analjezik olarak kullanılan μ-opioid agonistlerine karşı tolerans gelişiminde önemli bir role sahip olan opioid-reseptör benzeri reseptör 1'dir (ORL1). Bunların hepsi GABAerjik nörotransmisyon üzerinde etkili olan G-proteinine bağlı reseptörlerdir.
Bir opioide verilen farmakodinamik yanıt, opioidin bağlandığı reseptöre, bu reseptöre olan afinitesine ve opioidin bir agonist veya antagonist olmasına bağlıdır. Örneğin, opioid agonisti morfinin supraspinal analjezik özelliklerine μ1 reseptörünün aktivasyonu; μ2 reseptörü tarafından solunum depresyonu ve fiziksel bağımlılık; ve κ reseptörü tarafından sedasyon ve spinal analjezi aracılık eder.[kaynak belirtilmeli] Her opioid reseptör grubu, reseptör alt tipleri (örneğin μ1 ve μ2 gibi) daha da [ölçülebilir] spesifik yanıtlar sağlayarak farklı bir dizi nörolojik yanıt ortaya çıkarır. Her opioid için benzersiz olan, çeşitli opioid reseptör sınıflarına farklı bağlanma afinitesidir (örneğin μ, κ ve δ opioid reseptörleri, opioidin spesifik reseptör bağlanma afinitelerine göre farklı büyüklüklerde aktive edilir). Örneğin, opiat alkaloid morfin μ-opioid reseptörüne yüksek afinite ile bağlanırken, ketazosin ĸ reseptörlerine yüksek afinite gösterir. Her biri kendine özgü etki profiline sahip bu kadar geniş bir opioid sınıfının ve moleküler tasarımların var olmasını sağlayan şey bu kombinasyonel mekanizmadır. Opioid metabolizmasından metabolik parçalanma (N-dealkilasyon gibi) sorumlu olduğu için, bireysel moleküler yapıları da farklı etki sürelerinden sorumludur.


Fonksiyonel seçicilik
Yeni bir ilaç geliştirme stratejisi, reseptör sinyal iletimini dikkate almaktadır. Bu strateji, istenmeyen yollar üzerindeki etkiyi azaltırken arzu edilen sinyal yollarının aktivasyonunu artırmaya çalışmaktadır. Bu farklı stratejiye işlevsel seçicilik ve yanlı agonizm gibi çeşitli isimler verilmiştir. Kasıtlı olarak yanlı agonist olarak tasarlanan ve klinik değerlendirmeye alınan ilk opioid oliseridin ilacıdır. Analjezik aktivite gösterir ve yan etkileri azaltır.[161]
Opioid karşılaştırması
Opioidlerin göreceli etki gücünü karşılaştıran eşdeğerlik oranlarını belirlemek için kapsamlı araştırmalar yapılmıştır. Bir opioid dozu verildiğinde, bir diğerinin eşdeğer dozajını bulmak için bir ekanaljezik tablosu kullanılır. Bu tür tablolar opioid rotasyon uygulamalarında ve bir opioidi referans opioid olan morfinle karşılaştırarak tanımlamak için kullanılır. Eşdeğer ağrı kesici tabloları tipik olarak ilaç yarı ömürlerini ve bazen de morfin gibi uygulama yollarına göre aynı ilacın eşdeğer ağrı kesici dozlarını listeler: oral ve intravenöz.
Bağlanma profilleri
| Bileşik | MOR | DOR | KOR | Kay. | |
|---|---|---|---|---|---|
| 3-HO-PCP | 60 | 2300 | 140 | [162] | |
| 7-Hidroksimitraginin | 13,5 | 155 | 123 | [163] | |
| β-Klornaltreksamin | 0,90 | 115 | 0,083 | [164] | |
| β-Endorfin | 1 | 1 | 52 | [164] | |
| β-Funaltreksamin | 0,33 | 48 | 2,8 | [164] | |
| (+)-cis-3-metilfentanil | 0.24 | VY | VY | [165] | |
| Alazosin | 2,7 | 4,1 | 3,2 | [166] | |
| (−)-Alazosin | 3 | 15 | 4,7 | [167] | |
| (+)-Alazosin | 1900 | 19.000 | 1600 | [167] | |
| Alfentanil | 39 | 21.200 | VY | [168] | |
| Binaltorfimin | 1,3 | 5,8 | 0,79 | [168] | |
| BNTX | 18 | 0,66 | 55 | [164] | |
| Bremazosin | 0,75 | 2,3 | 0,089 | [164] | |
| (−)-Bremazosin | 0,62 | 0,78 | 0,075 | [168] | |
| Buprenorfin | 4,18 | 25,8 | 12,9 | [169] | |
| Butorfanol | 1,7 | 13 | 7,4 | [167] | |
| BW-3734 | 26 | 0,013 | 17 | [164] | |
| Karfentanil | 0,024 | 3,3 | 43 | [166] | |
| Cebranopadol | 0,7 | 18 | 2,6 | [170] | |
| Kodein | 79 | >1000 | >1000 | [164] | |
| CTOP | 0,18 | >1000 | >1000 | [164] | |
| Siklazosin | 0,45 | 6,3 | 5,9 | [167] | |
| Siprodim | 9,4 | 356 | 176 | [168] | |
| DADLE | 16 | 0,74 | >1000 | [164] | |
| DAMGO | 2 | >1,000 | >1,000 | [164] | |
| [D-Ala2]Deltorfin II | >1000 | 3,3 | >1000 | [164] | |
| Dermorfin | 0,33 | >1000 | >1000 | [164] | |
| (+)-Desmetramadol (O-DSMT) | 17 | 690 | 1800 | [171][172] | |
| Dekstropropoksifen | 34,5 | 380 | 1220 | [169] | |
| Dezosin | 3,6 | 290 | 460 | [166] | |
| Dihidroetorfin | 0,45 | 1,82 | 0,57 | [173] | |
| Dihidromorfin | 2,5 | 137 | 223 | [174] | |
| Diprenorfin | 0,072 | 0,23 | 0,017 | [164] | |
| DPDPE | >1,000 | 14 | >1000 | [164] | |
| DSLET | 39 | 4,8 | >1,000 | [164] | |
| Dinorfin A | 32 | >1,000 | 0,5 | [164] | |
| Etilketazosin | 3,1 | 101 | 0,4 | [164] | |
| (−)-Etilketazosin | 2.3 | 5.2 | 2.2 | [167] | |
| (+)-Etilketazosin | 2500 | >10.000 | 1600 | [167] | |
| Etorfin | 0,23 | 1,4 | 0,13 | [164] | |
| Fentanil | 0,39 | >1000 | 255 | [164] | |
| Hidrokodon | 11,1 | 962 | 501 | [169] | |
| Hidromorfon | 0,47 | 18,5 | 24,9 | [166] | |
| ICI-204488 | >1000 | >1000 | 0,71 | [164] | |
| Leu-enkefalin | 3,4 | 4 | >1000 | [164] | |
| Levasetilmetadol | 9,86 | 169 | 1020 | [169] | |
| Lofentanil | 0,68 | 5,5 | 5,9 | [164] | |
| Met-enkefalin | 0,65 | 1,7 | >1000 | [164] | |
| Metazosin | 3,8 | 44,3 | 13,3 | [166] | |
| Metadon | 1,7 | 435 | 405 | [169] | |
| Dekstrometadon | 19,7 | 960 | 1370 | [169] | |
| Levometadon | 0,945 | 371 | 1860 | [169] | |
| Metallorfan | VY | VY | VY | VY | |
| Dekstralorfan | 1140 | 2660 | 34,6 | [169] | |
| Levallorfan | 0,213 | 2,18 | 1100 | [169] | |
| Metorfan | VY | VY | VY | VY | |
| Dekstrometorfan | 1280 | 11.500 | 7000 | [169] | |
| Levometorfan | 11,2 | 249 | 225 | [169] | |
| Mitraginin | 7,24 | 60,3 | 1,100 | [163] | |
| Mitraginin psödoindoksil | 0,087 | 3,02 | 79,4 | [163] | |
| Morfanol | VY | VY | VY | VY | |
| Dekstrorfan | 420 | 34.700 | 5.950 | [169] | |
| Levorfanol | 0,42 | 3,61 | 4,2 | [169] | |
| Morfiseptin | 56 | >1000 | >1000 | [164] | |
| Morfin | 1,8 | 90 | 317 | [168] | |
| Morfin, (−)- | 1.24 | 145 | 23.4 | [169] | |
| Morfin, (+)- | >10.000 | >100.000 | >300.000 | [169] | |
| MR-2266 | 1 | 3 | 0,16 | [166] | |
| Nalbufin | 11 | >1000 | 3,9 | [164] | |
| Nalmefen | 0,24 | 16 | 0,083 | [175] | |
| Nalorfin | 0,97 | 148 | 1,1 | [164] | |
| Naloksonazin | 0,054 | 8,6 | 11 | [164] | |
| Nalokson | 1,1 | 16 | 12 | [167] | |
| (−)-Nalokson | 0.93 | 17 | 2,3 | [164] | |
| (+)-Nalokson | >1000 | >1000 | >1000 | [164] | |
| Naltrekson | 1 | 149 | 3,9 | [164] | |
| Naltriben | 12 | 0,013 | 13 | [164] | |
| Naltrindol | 64 | 0,02 | 66 | [164] | |
| Norbinaltorfimin | 2,2 | 65 | 0,027 | [164] | |
| Normorfin | 4 | 310 | 149 | [168] | |
| Ohmefentanil | 0,0079 | 10 | 32 | [168] | |
| Oksikodon | 8,69 | 901 | 1350 | [169] | |
| Oksimorfindol | 111 | 0,7 | 228 | [166] | |
| Oksimorfon | 0,78 | 50 | 137 | [168] | |
| Pentazosin | 5,7 | 31 | 7,2 | [164] | |
| Petidin (meperidin) | 385 | 4,350 | 5140 | [168] | |
| Fenazosin | 0,2 | 5 | 2 | [176] | |
| PLO17 | 30 | >1,000 | >1,000 | [164] | |
| Kuadazosin | 0,99 | 2,6 | 0,5 | [177] | |
| Salvinorin A | >10.000 | >10.000 | 16 | [178] | |
| Samidorfan | 0,052 | 2,6 | 0,23 | [179] | |
| SIOM | 33 | 1,7 | >1000 | [164] | |
| Spiradolin | 21 | >1000 | 0,036 | [164] | |
| Sufentanil | 0,15 | 50 | 75 | [164] | |
| Tianeptin | 383 | >10.000 | >10.000 | [180] | |
| Tifluadom | 32 | 189 | 2.1 | [167] | |
| Tramadol | 2,120 | 57,700 | 42,700 | [169] | |
| (+)-Tramadol | 1.330 | 62.400 | 54.000 | [169] | |
| (−)-Tramadol | 24,800 | 213.000 | 53.500 | [169] | |
| U-47700 | 11,1 | 1220 | 287 | [181] | |
| U-50488 | >1000 | >1000 | 0,12 | [164] | |
| U-69593 | >1,000 | >1,000 | 0,59 | [164] | |
| U-77891 | 2 | 105 | 2300 | [182] | |
| Ksorfanol | 0,25 | 1 | 0,4 | [177] | |
| Aksi belirtilmedikçe değerler Ki (nM)'dir. Değer ne kadar küçükse ilaç bölgeye o kadar güçlü bağlanır. Deneyler çoğunlukla klonlanmış veya kültüre edilmiş kemirgen reseptörleri ile yapılmıştır. | |||||
Kullanım
Özetle
Bakış açısı
ABD'de opioid reçeteleri 1991 yılında 76 milyon iken 2013 yılında 207 milyona yükselmiştir.[183]
1990'larda opioid reçetelendirilmesi önemli ölçüde artmıştır. Bir zamanlar neredeyse sadece akut ağrıların veya kansere bağlı ağrıların tedavisinde kullanılan opioidler artık kronik ağrı çeken kişiler için de serbestçe reçete edilmektedir. Bu durum, kazara bağımlılık ve ölümle sonuçlanan kazara aşırı doz oranlarının artmasını da beraberinde getirmiştir. Uluslararası Narkotik Kontrol Kuruluna göre, reçeteli opioidlerin kişi başına tüketiminde Amerika Birleşik Devletleri ve Kanada başı çekmektedir.[184] Amerika Birleşik Devletleri ve Kanada'da kişi başına düşen opioid reçetesi sayısı, Avrupa Birliği, Avustralya ve Yeni Zelanda'daki tüketimin iki katıdır.[185]
Opioid bağımlılığı krizinden, Birinci Dünya toplumları[186] ve düşük gelirli nüfuslar da dahil olmak üzere belirli nüfuslar diğerlerinden daha fazla etkilenmiştir.[187] Halk sağlığı uzmanları bu durumun, kronik ağrının giderilmesine yönelik alternatif yöntemlerin mevcut olmaması ya da yüksek maliyetli olmasından kaynaklanabileceğini belirtmektedir.[188] Opioidler kronik ağrı için maliyet-etkin bir tedavi olarak tanımlanmaktadır, ancak opioid salgınının etkisi ve opioid aşırı dozlarının neden olduğu ölümler maliyet-etkinliklerinin değerlendirilmesinde dikkate alınmalıdır.[189] 2017 verileri, ABD'de nüfusun yaklaşık yüzde 3,4'üne günlük ağrı yönetimi için opioid reçete edildiğini göstermektedir.[190] Opioid reçetelerinin azaltılmasına yönelik çağrılar, kronik ağrısı olan hastalar için güvenlik veya faydayı destekleyen çok az bilimsel kanıtla birlikte geniş ölçekli opioid azaltma uygulamalarına yol açmıştır.
Tarihçe
Özetle
Bakış açısı
Doğal olarak oluşan opioidler

Opioidler dünyanın bilinen en eski ilaçları arasındadır.[191] Papaver somniferum'un bir insan arkeolojik alanındaki bilinen en eski kanıtı, MÖ 5700-5500 civarında Neolitik döneme tarihlenmektedir. Tohumları İber Yarımadası'ndaki Cueva de los Murciélagos ve İtalya Yarımadası'ndaki La Marmotta'da bulunmuştur.[192][193][194]
Afyon haşhaşının tıbbi, eğlence ve dini amaçlarla kullanımı, Sümer kil tabletlerindeki ideogramlarda "neşe bitkisi" olan "Hul Gil"in kullanımından bahsedildiği MÖ dördüncü yüzyıla kadar uzanmaktadır.[195][196][197] Afyon, Mısırlılar tarafından biliniyordu ve Ebers Papirüsü'nde çocukların yatıştırılması[197][198] ve göğüs apselerinin[199] tedavisi için bir karışımın bileşeni olarak bahsedilmektedir. Afyon Yunanlar tarafından da biliniyordu.[198] Hipokrat (MÖ 460 - 370) ve öğrencileri tarafından uyku getirici özellikleri nedeniyle değer görmüş ve ağrı tedavisinde kullanılmıştır.[200] Latince deyiş "Sedare dolorem opus divinum est", çev. "Acıyı dindirmek ilahi olanın işidir", Hipokrat'a ve Bergamalı Galen'e çeşitli şekillerde atfedilmiştir.[201] Afyonun tıbbi kullanımı daha sonra Roma ordusunda görev yapan Yunan bir hekim olan Pedanius Dioscorides (MS 40-90) tarafından De materia medica adlı beş ciltlik eserinde ele alınmıştır.[202]
İslam'ın Altın Çağı'nda afyon kullanımı İbn-i Sina (MS 980 civarı - Haziran 1037) tarafından El-Kanun fi't-Tıb'da ayrıntılı olarak ele alınmıştır. Kitabın beş cildi afyonun hazırlanışı, bir dizi fiziksel etkisi, çeşitli hastalıkları tedavi etmek için kullanımı, kullanımının kontrendikasyonları, bir zehir olarak potansiyel tehlikesi ve bağımlılık potansiyeli hakkında bilgiler içerir. İbn-i Sina afyonun son çare dışında kullanılmasını önermemiş, analjeziklerle ağrıyı en aza indirmeye çalışmak yerine ağrının nedenlerini ele almayı tercih etmiştir. İbn-i Sina'nın gözlemlerinin çoğu modern tıbbi araştırmalarla desteklenmiştir.[198][203] Dünyanın Hindistan ve Çin'deki afyondan tam olarak ne zaman haberdar olduğu kesin değildir, ancak Çin tıp eseri K'ai-pao-pen-tsdo'da (MS 973) afyondan bahsedilmiştir.[197] MS 1590'da afyon haşhaşları Agra bölgesinin Subahlarında temel bir bahar mahsulüydü.[204]
Hekim Paracelsus (yaklaşık 1493-1541) genellikle Alman Rönesansı sırasında Batı Avrupa'da afyonu tıbbi kullanıma yeniden sokmasıyla tanınır. Afyonun tıbbi kullanım için faydalarını övmüştür. Ayrıca, laudanum adını verdiği ve özellikle ölümün kandırılması gerektiğinde diğerlerinden daha üstün olan bir "arcanum" hapına sahip olduğunu iddia etmiştir. ("Ich hab' ein Arcanum - heiss' ich Laudanum, ist über das Alles, wo es zum Tode reichen will.")[205] Daha sonraki yazarlar Paracelsus'un afyon tarifinin afyon içerdiğini iddia etmişlerdir, ancak bileşimi bilinmemektedir.[205]
Laudanum
Laudanum terimi 17. yüzyıla kadar genel olarak yararlı ilaçlar için kullanılmıştır. Thomas Sydenham ilk sıvı afyon tentürünü tanıttıktan sonra "afyon" hem afyon hem de alkol karışımı anlamına gelmeye başladı.[205] Sydenham'ın 1669 tarihli afyon tarifi afyonu şarap, safran, karanfil ve tarçınla karıştırıyordu.[206] Sydenham'ın afyonu 20. yüzyıla kadar hem Avrupa'da hem de Amerika'da yaygın olarak kullanıldı.[198][206] Afyon temelli diğer popüler ilaçlar arasında çocuklar için çok daha hafif bir sıvı preparat olan Paregoric, daha güçlü bir preparat olan Black-drop ve Dover's powder yer alıyordu.[206]
Afyon ticareti
Afyon, diğerlerinin yanı sıra Hindistan, Portekiz, Hollanda, İngiltere ve Çin'i içeren ticaret ağları üzerinden yasal ve yasa dışı olarak hareket eden önemli bir sömürge ürünü haline geldi.[207] İngiliz Doğu Hindistan Şirketi, MS 1683 yılında afyon ticaretini bir yatırım fırsatı olarak gördü.[204] 1773 yılında Bengal Valisi, Doğu Hindistan Şirketi adına Bengal afyonu üretimi üzerinde bir tekel kurdu.[204][208] Hint afyonunun ekimi ve üretimi 1797 ve 1949 yılları arasında bir dizi kanunla daha da merkezileştirildi ve kontrol altına alındı. İngilizler, Çin çayının ithalatından kaynaklanan ekonomik açığı, Çin hükümetinin yasaklarına rağmen Çin'e kaçırılan Hint afyonunu satarak dengeledi. Bu durum Çin ve İngiltere arasında Birinci (1839-1842) ve İkinci Afyon Savaşlarına (1856-1860) yol açmıştır.[207][208][209][210]
Morfin
19. yüzyılda, geniş kapsamlı etkileri olan iki büyük bilimsel ilerleme kaydedildi. 1804 yılı civarında Alman eczacı Friedrich Sertürner afyondan morfini izole etti. Kristalizasyonunu, yapısını ve farmakolojik özelliklerini 1817'de iyi karşılanan bir makalede tanımladı.[206][209][211][212] Morfin, herhangi bir tıbbi bitkiden izole edilen ilk alkaloiddi ve modern bilimsel ilaç keşfinin başlangıcıydı.[209][213]
Yaklaşık elli yıl sonra gerçekleşen ikinci gelişme ise Alexander Wood ve diğerlerinin hipodermik iğneyi geliştirmesi oldu. Deri altı iğneli bir cam şırınganın geliştirilmesi, birincil aktif bileşiğin kontrollü ölçülebilir dozlarının kolayca uygulanmasını mümkün kılmıştır.[197][206][214][215][216]
Morfin başlangıçta ağrıyı hafifletme kabiliyeti nedeniyle harika bir ilaç olarak karşılandı.[217] İnsanların uyumasına yardımcı olabiliyordu[209] ve öksürük ve ishalin kontrolü de dahil olmak üzere başka yararlı yan etkileri de vardı.[218] Doktorlar tarafından yaygın olarak reçete ediliyor ve eczacılar tarafından kısıtlama olmaksızın dağıtılıyordu. Amerikan İç Savaşı sırasında, afyon ve laudanum askerleri tedavi etmek için yaygın olarak kullanıldı.[217][219] Ayrıca kadınlar için adet sancısı ve "sinirsel karakterli" hastalıklar için de sıklıkla reçete ediliyordu.[220]:85 İlk başta bu yeni uygulama yönteminin bağımlılık yapmayacağı varsayılmıştır (yanlış olarak).[209][220]
Kodein
Kodein, 1832 yılında Pierre Jean Robiquet tarafından keşfedilmiştir. Robiquet, İskoç kimyager William Gregory (1803-1858) tarafından tanımlanan morfin ekstraksiyon yöntemini inceliyordu. Gregory'nin prosedüründen kalan kalıntıyı işleyen Robiquet, afyonun diğer aktif bileşenlerinden kristal bir madde izole etti. Keşfi hakkında şunları yazmıştır: "İşte afyonda bulunan yeni bir madde... Şimdiye kadar afyonun tek aktif prensibi olduğu düşünülen morfinin tüm etkileri açıklamadığını biliyoruz ve fizyologlar uzun süredir doldurulması gereken bir boşluk olduğunu iddia ediyorlar."[221] Alkaloidi keşfi, kodeine dayalı bir nesil antitüsif ve antidiyareik ilaçların geliştirilmesini sağladı.[222]
Yarı sentetik ve sentetik opioidler
Sentetik opioidler 20. yüzyılda icat edilmiş ve etkileri için biyolojik mekanizmalar keşfedilmiştir.[197] Bilim insanları opioidlerin bağımlılık yapmayan formlarını aramış, ancak bunun yerine daha güçlü olanlarını yaratmışlardır. İngiltere'de Charles Romley Alder Wright, bağımlılık yapmayan bir afyon türevi arayışında yüzlerce opiat bileşiği geliştirdi. 1874 yılında, asetilasyon adı verilen ve morfinin asetik anhidrit ile birkaç saat kaynatılmasını içeren bir işlem kullanarak diamorfini (eroin) sentezleyen ilk kişi oldu.[209]
Eroin, Bayer Laboratuvarlarında Heinrich Dreser (1860-1924) için çalışan Felix Hoffmann (1868-1946) tarafından bağımsız olarak sentezlenene kadar çok az ilgi gördü.[223] Dreser yeni ilacı 1898 yılında tüberküloz, bronşit ve astım için bir analjezik ve öksürük tedavisi olarak piyasaya sürdü. Bayer, eroinin bağımlılık yapma potansiyelinin fark edilmesinin ardından 1913 yılında üretimi durdurdu.[209][224][225]
1910'larda Almanya'da birkaç yarı sentetik opioid geliştirilmiştir. İlki olan oksimorfon, 1914 yılında afyon haşhaşında bulunan bir opioid alkaloid olan tebainden sentezlendi.[226] Ardından Martin Freund ve Edmund Speyer, 1916'da Frankfurt Üniversitesinde yine tebainden oksikodonu geliştirdi.[227] 1920'de hidrokodon Carl Mannich ve Helene Löwenheim tarafından kodeinden türetilerek hazırlandı. 1924 yılında morfine hidrojen eklenerek hidromorfon sentezlendi. Etorfin 1960 yılında haşhaş samanındaki oripavinden sentezlenmiştir. Buprenorfin 1972 yılında keşfedilmiştir.[226]
İlk tam sentetik opioid, 1932 yılında IG Farben'de Alman kimyager Otto Eisleb (veya Eislib) tarafından tesadüfen bulunan meperidindir (daha sonra demerol).[226] Meperidin, morfinle ilgisi olmayan bir yapıya sahip olan, ancak opiat benzeri özelliklere sahip ilk opiattı.[197] Analjezik etkileri 1939 yılında Otto Schaumann tarafından keşfedilmiştir.[226] Yine IG Farben'de çalışan Gustav Ehrhart ve Max Bockmühl, çalışmalarını Eisleb ve Schaumann'ın çalışmaları üzerine inşa ettiler. Yaklaşık 1937'de "Hoechst 10820"yi (daha sonra metadon) geliştirdiler.[228] 1959 yılında Belçikalı doktor Paul Janssen, eroinden 30 ila 50 kat daha güçlü sentetik bir ilaç olan fentanili geliştirdi.[209][229] Şu anda yaklaşık 150 sentetik opioid bilinmektedir.[226]
Kriminalizasyon ve tıbbi kullanım
Afyonun klinik dışı kullanımı Amerika Birleşik Devletleri'nde 1914 tarihli Harrison Narkotik Vergi Yasası ve diğer birçok yasa ile suç sayılmıştır.[230][231] Opioid kullanımı damgalanmış ve sadece ölmek üzere olan hastalar için son çare olarak reçete edilmesi gereken tehlikeli bir madde olarak görülmüştür.[209] 1970'teki Kontrollü Maddeler Yasası Harrison Yasası'nın sertliğini gevşetmiştir.[kaynak belirtilmeli]
Birleşik Krallık'ta, Kraliyet Doktorlar Koleji Başkanı başkanlığında Morfin ve Eroin Bağımlılığı Departman Komitesinin 1926 tarihli raporu tıbbi kontrolü yeniden ortaya koymuş ve 1960'lara kadar süren "İngiliz kontrol sistemini" kurmuştur.[232]
1980'lerde Dünya Sağlık Örgütü, farklı ağrı seviyeleri için opioidler de dahil olmak üzere ilaçların reçetelenmesine yönelik kılavuzlar yayınladı. ABD'de Kathleen Foley ve Russell Portenoy, opioidlerin "kötü huylu olmayan inatçı ağrı" vakalarında ağrı kesici olarak serbestçe kullanılmasının önde gelen savunucuları oldular.[233][234] İddialarını destekleyecek çok az bilimsel kanıta sahip olan ya da hiç olmayan endüstri bilimcileri ve savunucuları, kronik ağrısı olan kişilerin bağımlılığa karşı dirençli olacağını öne sürdüler.[209][233][235]
OksiKontin'in 1996'da piyasaya sürülmesine, ağrı kesici olarak opioid kullanımını teşvik eden agresif bir pazarlama kampanyası eşlik etti. Opioid reçetelerinin artması eroin için büyüyen bir karaborsayı körükledi. 2000 ve 2014 yılları arasında "ülke genelinde eroin kullanımında endişe verici bir artış ve aşırı dozda uyuşturucu ölümlerinde bir salgın" yaşandı.[209][235][236]
Sonuç olarak, Sorumlu Opioid Reçetelemesi için Hekimler gibi sağlık kuruluşları ve halk sağlığı grupları opioid reçetelerinin azaltılması çağrısında bulunmuştur.[235] Hastalık Kontrol ve Korunma Merkezleri (CDC) 2016 yılında "aktif kanser tedavisi, palyatif bakım ve yaşam sonu bakımı dışındaki kronik ağrılar için" opioid reçetelenmesi ve opioid azaltımının artırılması için yeni bir dizi kılavuz yayınlamıştır.[237]
"Riski Ortadan Kaldırın"
Nisan 2019'da ABD Gıda ve İlaç Dairesi, Amerikalıların kullanılmayan reçeteli opioidleri evlerinden çıkarma ve uygun şekilde imha etme konusunda oynadıkları önemli rolü anlamalarına yardımcı olmak için yeni bir eğitim kampanyası başlattığını duyurdu. Bu yeni girişim, FDA'nın ülke çapındaki opioid krizini (aşağıya bakınız) ele almaya yönelik devam eden çabalarının bir parçasıdır ve opioidlere gereksiz maruz kalmayı azaltmaya ve yeni bağımlılıkları önlemeye yardımcı olmayı amaçlamaktadır. "Riski Ortadan Kaldırın" kampanyası, evdeki sağlık kararlarını denetleme olasılığı en yüksek olan ve genellikle opioidler ve diğer reçeteli ilaçların evdeki bekçileri olarak hizmet veren 35-64 yaş arası kadınları hedeflemektedir.[238]
Toplum ve kültür
Özetle
Bakış açısı
Tanım
"Opioid" terimi 1950'lerde ortaya çıkmıştır.[239] "Opium" (afyon) + "opiat-benzeri" ("opiat"lar morfin ve afyondan türetilen benzer uyuşturuculardır) anlamına gelen "-oid" kelimelerinin birleşiminden oluşmuştur. Bu terimin kullanıldığı ilk bilimsel yayın olan 1963 yılında, "Bu makalede 'opioid' terimi, George H. Acheson (kişisel iletişim) tarafından morfin benzeri aktivitelere sahip herhangi bir kimyasal bileşiği ifade etmek için önerilen anlamda kullanılmıştır" şeklinde bir dipnot yer almıştır.[240] 1960'ların sonlarında, araştırmalar opiat etkilerinin sinir sisteminde "opioid reseptörleri" olarak adlandırılan belirli moleküler reseptörlerin aktivasyonu yoluyla gerçekleştiğini ortaya koymuştur.[241] "Opioid" tanımı daha sonra opioid reseptörlerinin aktivasyonu ile aracılık edilen morfin benzeri aktivitelere sahip maddelere atıfta bulunacak şekilde geliştirilmiştir. Bir modern farmakoloji ders kitabında şöyle denmektedir: "opioid terimi morfin benzeri aktiviteye sahip tüm agonist ve antagonistlerin yanı sıra doğal olarak oluşan ve sentetik opioid peptitler için de geçerlidir".[242] Başka bir farmakoloji referansı morfin benzeri gerekliliğini ortadan kaldırmaktadır: "Daha modern bir terim olan opioid, opioid reseptörlerine bağlanan (antagonistler dahil) hem doğal hem de sentetik tüm maddeleri belirtmek için kullanılır".[2] Bazı kaynaklar opioid terimini opiyatları hariç tutacak şekilde tanımlarken diğerleri opioid yerine opiyatı kapsamlı olarak kullanmaktadır, ancak kapsayıcı olarak kullanılan opioid modern olarak kabul edilmekte, tercih edilmekte ve yaygın olarak kullanılmaktadır.[19]
ABD'de keyfî kullanımı azaltma çabaları
2011 yılında Obama yönetimi, opioid kriziyle başa çıkmak için yönetimin planını açıklayan bir beyaz kitap yayınladı. Yönetimin bağımlılık ve kazara doz aşımı konusundaki endişeleri, dünya çapında çok sayıda başka tıbbî ve hükûmet danışma grubu tarafından da yankılandı.[188][243][244][245]
2015 yılı itibarıyla, Missouri hariç her eyalette reçeteli ilaç izleme programları mevcuttur.[246] Bu programlar eczacıların ve reçete yazanların şüpheli kullanımları tespit etmek amacıyla hastaların reçete geçmişlerine erişmelerine olanak sağlamaktadır. Ancak 2015 yılında ABD'li doktorlar arasında yapılan bir anket, doktorların sadece %53'ünün bu programları kullandığını, %22'sinin ise bu programlardan haberdar olmadığını ortaya koymuştur.[247] Hastalık Kontrol ve Korunma Merkezleri (CDC) yeni bir kılavuz oluşturmak ve yayınlamakla görevlendirildi ve yoğun bir lobi faaliyeti yürütüldü.[248] 2016 yılında Amerika Birleşik Devletleri Hastalık Kontrol ve Korunma Merkezleri, Kronik Ağrı için Opioid Reçeteleme Kılavuzu'nu yayınlayarak opioidlerin yalnızca ağrı ve fonksiyon için faydalarının risklerden daha ağır basması beklendiğinde kullanılmasını ve daha sonra mümkün olan en düşük etkili dozda kullanılmasını ve mümkün olduğunca eşzamanlı opioid ve benzodiazepin kullanımından kaçınılmasını tavsiye etti.[34] Araştırmalar, kronik opioid tedavisine (KOT) bağlı olarak yüksek dozda opioid reçete edilmesinin, devletin yasal yönergeleri ve sağlık planlarının yüksek dozları azaltmak için kaynak ayırması ve ortak beklentiler oluşturması yoluyla zaman zaman önlenebileceğini göstermektedir.[249]
10 Ağustos 2017 tarihinde Donald Trump opioid krizini (FEMA dışı) ulusal halk sağlığı acil durumu ilan etti.[250]
Küresel kıtlık
Morfin ve diğer haşhaş bazlı ilaçlar Dünya Sağlık Örgütü tarafından şiddetli ağrıların tedavisinde temel olarak tanımlanmıştır. 2002 yılı itibarıyla yedi ülke (ABD, İngiltere, İtalya, Avustralya, Fransa, İspanya ve Japonya) dünyadaki morfin kaynaklarının %77'sini kullanmakta ve gelişmekte olan birçok ülkeyi ağrı kesici ilaçlardan yoksun bırakmaktadır.[251] Haşhaş bazlı ilaçların yapımında kullanılan ham haşhaş malzemelerinin mevcut tedarik sistemi, 1961 tarihli Uyuşturucu Maddeler Tek Sözleşmesi hükümleri uyarınca Uluslararası Narkotik Kontrol Kurulu (INCB) tarafından düzenlenmektedir. Bu hükümlere göre her ülkenin yıllık olarak talep edebileceği ham haşhaş maddesi miktarı, ülkenin önceki iki yıl içindeki ulusal tüketiminden elde edilen ihtiyaç tahminine karşılık gelmelidir. Birçok ülkede, yüksek fiyatlar ve haşhaş bazlı ilaçların reçetelenmesi konusunda eğitim eksikliği nedeniyle morfinin eksik reçetelenmesi yaygındır. Dünya Sağlık Örgütü şu anda sağlık çalışanlarını eğitmek ve haşhaş bazlı ilaçların daha fazla reçetelenmesini kolaylaştırmak için ilaç reçetelemeye ilişkin ulusal düzenlemeler geliştirmek üzere çeşitli ülkelerin yönetimleriyle birlikte çalışmaktadır.[252]
Morfinin bulunabilirliğini arttırmaya yönelik bir başka fikir de Senlis Konseyi tarafından ortaya atılmış olup, Afgan morfini önerileri ile Afganistan'ın gelişmekte olan ülkelere ikinci kademe bir tedarik sisteminin bir parçası olarak ucuz ağrı kesici çözümler sunabileceğini ve bu sistemin kurduğu dengeyi ve kapalı sistemi koruyarak mevcut INCB tarafından düzenlenen sistemi tamamlayacağını ve aynı zamanda şiddetli ağrı çeken ve mevcut sistem altında haşhaş bazlı ilaçlara erişemeyenlere bitmiş ürün morfin sağlayabileceğini öne sürmektedirler.
Keyfî kullanım
Opioidler güçlü öfori duyguları üretebilir[253] ve sıklıkla eğlence amaçlı kullanılır. Geleneksel olarak eroin gibi yasadışı opioidlerle ilişkilendirilen reçeteli opioidler, eğlence amaçlı olarak kötüye kullanılmaktadır.
Yanlış ilaç kullanımı ve tıbbi olmayan kullanım, ilaçların reçete edilmeyen nedenlerle veya dozlarda kullanılmasını içerir. Opioidlerin kötüye kullanımı, reçete edilmeyen kişilere ilaç verilmesini de içerebilir. Bu tür saptırmalar birçok ülkede hapisle cezalandırılabilen suçlar olarak değerlendirilebilir.[254][255] 2014 yılında yaklaşık 2 milyon Amerikalı reçeteli opioidleri kötüye kullanmış veya bunlara bağımlı olmuşlardır.[256][257]
Sınıflandırma
Özetle
Bakış açısı
Bir dizi geniş opioid sınıfı vardır:[258]
- Doğal opiatlar: afyon haşhaşının reçinesinde bulunan alkaloidler, öncelikle morfin, kodein ve tebain, ancak farklı bir etki mekanizmasına sahip olan papaverin ve noskapin değil
- Morfin opiatlarının esterleri: biraz kimyasal olarak değiştirilmiş ancak yarı sentetiklerden daha doğaldır, çünkü çoğu morfin ön ilaçlarıdır, diasetilmorfin (morfin diasetat; eroin), nikomorfin (morfin dinikotinat), dipropanoilmorfin (morfin dipropiyonat), dezomorfin, asetilpropiyonilmorfin, dibenzoilmorfin, diasetildihidromorfin[259][260]
- Yarı sentetik opioidler: hidromorfon, hidrokodon, oksikodon, oksimorfon, etilmorfin ve buprenorfin gibi doğal opiatlardan veya morfin esterlerinden oluşturulur
- Tamamen sentetik opioidler: fentanil, petidin, levorfanol, metadon, tramadol, tapentadol ve dekstropropoksifen gibi
- Endorfinler, enkefalinler, dinorfinler ve endomorfinler gibi vücutta doğal olarak üretilen endojen opioid peptitler.
- Endojen opioidler, peptid olmayan: Morfin ve vücutta az miktarda üretilen diğer bazı opioidler bu kategoriye dahildir.
- Doğal opioidler, hayvansal olmayan, opiat olmayan: Mitragyna speciosa (kratom) yaprakları, Mu- ve Delta reseptörleri aracılığıyla aktif olan, doğal olarak oluşan birkaç opioid içerir. Salvia divinorum bitkisinde doğal olarak bulunan Salvinorin A, bir kappa-opioid reseptör agonistidir.[261]
Monoamin alım inhibitörleri olarak görev yapan tramadol ve tapentadol aynı zamanda μ-opioid reseptörünün hafif ve güçlü agonistleri (sırasıyla) olarak da görev yapmaktadır.[262] Her iki ilaç da bir opioid antagonisti olan nalokson uygulandığında bile analjezi üretir.[263]
Kratom, Corydalis ve Salvia divinorum bitkilerinde ve Papaver somniferum dışındaki bazı haşhaş türlerinde bulunan moleküller de dahil olmak üzere bazı küçük afyon alkaloidleri ve opioid etkisi olan çeşitli maddeler başka yerlerde de bulunur. Birçok yarı sentetik ve sentetik opioid yapımında önemli bir hammadde olan thebaine'i bol miktarda üreten türler de vardır. 120'den fazla haşhaş türünden sadece ikisi morfin üretmektedir.
Analjezikler arasında, merkezi sinir sistemi üzerinde etkili olan ancak opioid reseptör sistemi üzerinde etkili olmayan ve bu nedenle opioidlerin diğer (narkotik) niteliklerinden hiçbirine sahip olmayan, ancak ağrıyı hafifleterek öfori üretebilen az sayıda ajan vardır - üretilme şekli nedeniyle alışkanlık, fiziksel bağımlılık veya bağımlılığın temelini oluşturmayan bir öforidir. Bunların başında nefopam, orfenadrin ve belki de feniltoloksamin veya diğer bazı antihistaminikler gelmektedir. Trisiklik antidepresanlar da ağrı kesici etkiye sahiptir, ancak bunu dolaylı olarak endojen opioid sistemini aktive ederek yaptıkları düşünülmektedir. Parasetamol ağırlıklı olarak merkezi etkili bir analjeziktir (narkotik değildir) ve etkisini azalan serotoninerjik (5-hidroksi triptaminerjik) yolaklar üzerindeki etkisiyle, 5-HT salınımını artırarak (ağrı aracılarının salınımını engeller) gösterir. Ayrıca siklo-oksijenaz aktivitesini de azaltır. Yakın zamanda, parasetamolün terapötik etkinliğinin çoğunun veya tamamının, serotonin salınımını artıran ve anandamid alımını inhibe eden bir metabolit olan AM404'e bağlı olduğu keşfedilmiştir.[kaynak belirtilmeli]
Diğer analjezikler periferik olarak çalışır (yani beyin veya omurilik üzerinde değil). Araştırmalar, morfin ve ilgili ilaçların, morfin jelinin yanıklar üzerinde etkili olması gibi, gerçekten de periferik etkileri olabileceğini göstermeye başlamıştır. Son araştırmalar periferik duyusal nöronlar üzerinde opioid reseptörleri keşfetmiştir.[264] Opioid analjezisinin önemli bir kısmına (%60'a kadar), özellikle artrit, travmatik veya cerrahi ağrı gibi enflamatuar durumlarda, bu tür periferik opioid reseptörleri aracılık edebilir.[265] İnflamatuar ağrı, periferik opioid reseptörlerini aktive eden endojen opioid peptidler tarafından da köreltilir.[266]
İnsanların ve bazı hayvanların endojen opioid peptidlere ek olarak doğal olarak çok az miktarda morfin, kodein ve muhtemelen eroin ve dihidromorfin gibi daha basit türevlerini ürettikleri 1953 yılında keşfedilmiştir.[kaynak belirtilmeli] Bazı bakteriler, sırasıyla morfin veya kodein içeren bir çözelti içinde yaşarken hidromorfon ve hidrokodon gibi bazı yarı sentetik opioidler üretebilmektedir.
Afyon haşhaşının alkaloidlerinin ve diğer türevlerinin çoğu opioid veya narkotik değildir, buna en iyi örnek düz kas gevşetici papaverindir. Noskapin, MSS etkileri olduğu için marjinal bir durumdur, ancak morfine benzer olması gerekmez ve muhtemelen kendi başına bir kategoridedir.
Dekstrometorfan (yarı sentetik bir opioid agonisti olan levometorfanın stereoizomeri) ve metaboliti dekstrorfan, diğer opioidlere yapısal benzerliklerine rağmen hiçbir opioid analjezik etkiye sahip değildir; bunun yerine güçlü NMDA antagonistleri ve sigma 1 ve 2 reseptör agonistleridir ve reçetesiz satılan birçok öksürük kesici ilaçta kullanılırlar.
Salvinorin A benzersiz, seçici, güçlü bir ĸ-opioid reseptör agonistidir. Yine de uygun bir opioid olarak kabul edilmez, çünkü:
- kimyasal olarak bir alkaloid değildir ve
- tipik opioid özellikleri yoktur: kesinlikle anksiyolitik veya öksürük kesici etkileri yoktur. Bunun yerine güçlü bir halüsinojendir.
| Opioid peptitler | İskelet moleküler görüntüleri |
|---|---|
| Adrenorfin |  |
| Amidorfin |  |
| Kasomorfin | |
| DADLE | |
| DAMGO |  |
| Dermorfin | |
| Endomorfin |  |
| Morfiseptin |  |
| Nosiseptin |  |
| Oktreotid |  |
| Opiorfin |  |
| TRIMU 5 |  |
Endojen opioidler
Vücutta üretilen opioid-peptitler şunları içerir:
- Endorfin
- Enkefalinler
- Dinorfinler
- Endomorfinler
β-endorfin, arkuat çekirdekteki proopiomelanokortin (POMC) hücrelerinde, beyinsapında ve bağışıklık hücrelerinde ifade edilir ve μ-opioid reseptörleri aracılığıyla etki eder. β-endorfinin cinsel davranış ve iştah dahil olmak üzere birçok etkisi vardır. β-endorfin ayrıca hipofiz kortikotroplarından ve melanotroplardan dolaşıma salgılanır. α-Neoendorfin ayrıca kavisli çekirdekteki POMC hücrelerinde de ifade edilir.
met-enkefalin MSS'de ve bağışıklık hücrelerinde yaygın olarak bulunur; [met]-enkefalin, proenkefalin geninin bir ürünüdür ve μ ve δ-opioid reseptörleri aracılığıyla etki gösterir. leu-enkefalin de proenkefalin geninin bir ürünüdür ve δ-opioid reseptörleri aracılığıyla etki gösterir.
Dinorfin κ-opioid reseptörleri aracılığıyla etki eder ve omurilik ve hipotalamus dahil olmak üzere MSS'de, özellikle arkuat çekirdek ve supraoptik çekirdekteki hem oksitosin hem de vazopressin nöronlarında yaygın olarak dağılır.
Endomorfin, μ-opioid reseptörleri aracılığıyla etki eder ve bu reseptörlerdeki diğer endojen opioidlerden daha güçlüdür.
Afyon alkaloidleri ve türevleri
Afyon alkaloidleri
Doğal olarak (afyonda) bulunan fenantrenler:
Papaveretum da dahil olmak üzere karışık afyon alkaloidleri preparatları hala ara sıra kullanılmaktadır.
Morfin esterleri
- Diasetilmorfin (morfin diasetat; eroin)
- Nikomorfin (morfin dinikotinat)
- Dipropanoilmorfin (morfin dipropiyonat)
- Diasetildihidromorfin
- Asetilpropiyonilmorfin
- Desomorfin
- Metildesorfin
- Dibenzoilmorfin
Morfin eterleri
- Dihidrokodein
- Etilmorfin
- Heterokodein
Yarı sentetik alkaloid türevleri
- Buprenorfin
- Etorfin
- Hidrokodon
- Hidromorfon
- Oksikodon (OxyContin olarak satılır)
- Oksimorfon
Sentetik opioidler
Anilidopiperidinler
- Fentanil (ayrıca bkz fentanil analogları listesi)
- Alfametilfentanil
- Alfentanil
- Sufentanil
- Remifentanil
- Karfentanil
- Ohmefentanil
Benzimidazoller
Benzimidazol opioidleri nitazenler olarak da bilinir.
- Metodesnitazen (Metazen)
- Etodesnitazen (Etazen)
- Metonitazen
- Etonitazen
- Etonitazepyne
- Etonitazepipne
- İzotonitazen
- Klonitazen
Fenilpiperidinler
- Pethidin (meperidin)
- Ketobemidon
- MPPP
- Alilprodin
- Prodin
- PEPAP
- Promedol
Difenilpropilamin türevleri
- Propoksifen
- Dekstropropoksifen
- Dekstromoramid
- Bezitramid
- Piritramid
- Metadon
- Dipipanon
- Levometadil asetat (LAAM)
- Difenoksin
- Difenoksilat
- Loperamid (kan-beyin bariyerini geçer ancak P-Glikoprotein tarafından hızla merkezi olmayan sinir sistemine pompalanır. Hayvan modellerinde hafif opiat yoksunluğu, rhesus maymunları, fareler ve sıçanlar dahil olmak üzere sürekli ve uzun süreli kullanımdan sonra bu etkiyi gösterir).
Benzomorfan türevleri
- Dezosin-agonist/antagonist
- Pentazosin-agonist/antagonist
- Fenazosin
Oripavin türevleri
- Buprenorfin-kısmi agonist
- Dihidroetorfin
- Etorfin
Morfinan türevleri
- Butorfanol-agonist/antagonist
- Nalbufin-agonist/antagonist
- Levorfanol
- Levometorfan
- Rasemethorfan
Diğer
- Lefetamin
- Meptazinol
- Mitraginin
- Tilidin
- Tramadol
- Tapentadol
- Eluksadolin
- AP-237
- 7-Hidroksimitraginin
Allosterik modülatörler
Düz allosterik modülatörler opioidlere ait değildir, bunun yerine opioiderjik olarak sınıflandırılırlar.
Opioid antagonistleri
- Nalmefen
- Nalokson
- Naltrekson
- Metilnaltrekson (Metilnaltrekson, merkezi olarak aktif olmak için kan-beyin bariyerini yeterli miktarda geçmediğinden sadece periferik olarak aktiftir. Bu nedenle, loperamidin antitezi olarak kabul edilebilir).
- Naloksegol (Naloksegol, merkezi olarak aktif olmak için kan-beyin bariyerini yeterli miktarda geçmediğinden sadece periferik olarak aktiftir. Bu nedenle, loperamidin antitezi olarak kabul edilebilir).
Kaynakça
Wikiwand - on
Seamless Wikipedia browsing. On steroids.