Vann
kjemisk forbindelse av to hydrogenatomer og ett oksygenatom From Wikipedia, the free encyclopedia
Remove ads
Vann, eller vatn[1] (fra norrønt vatn), er en kjemisk forbindelse og et polart molekyl. Det er flytende under STP-forhold. Dens kjemiske formel er H2O, som betyr at et molekyl vann består av to hydrogenatomer og ett oksygenatom.
For «et vann», se innsjø.

Vann finnes nesten overalt på Jorden og er livsnødvendig for alt kjent liv. Omtrent 70 % av Jordens overflate er dekket av åpent vann (hav, innsjøer og elver).
En vannmasse eller vassmasse er et uttrykk for et osean, hav, innsjø, elv, bekk, kanal, dam eller lignende.
Remove ads
Etymologi
Ordet «vann» kommer via norrønt vatn, videre fra indoeuropeisk, som igjen er utviklet fra urindoeuropeisk fra roten *wes. Det skandinaviske ordet «vinter», de engelske ordene «water» og «wash», med flere, det tyske ordet «Wasser» og de russiske ordene «вода, voda» og «водка, vodka» har samme opphav. Avledet fra urindoeuropeisk *ud-ro kommer også greske hydro («vann») og hydra, mens det latinske aqua kommer fra urindoeuropeisk *agwjo.
Remove ads
Vannets egenskaper
Aggregattilstander og temperatur
Vann i fast form er kjent som is og i gassform som damp. Temperaturskalaen celsius er definert ut fra vannets smelte- og fordampningspunkt, der vannet fryser ved 0 °C og koker ved 100 °C, og én grad stigning tilsvarer 1/100 av forskjellen mellom disse punktene. Temperaturskalen Kelvin har samme stigningstall. Mellom smeltepunktet og kokepunktet, inkludert i STP-forhold, er vannet i flytende tilstand (ved normalt trykk).
Temperaturenhetene (tidligere celsius og nå kelvin) er definert ut i fra trippelpunktet til vann, 273,16 K (0,01 C) og 611,2 Pa. Under dette trykket og denne temperaturen kan fast, flytende og gassformen av vann eksistere samtidig i likevekt. Vann viser ganske merkelig atferd, som å kunne eksistere som glassaktig is, en ikke-krystallisk fast form av vann.
Under temperaturer større enn 647 K og trykk større enn 22,064 Mpa, vil en samling av vannmolekyler anta en superkritisk tilstand, der væskelignende grupper flyter inni en gasslignende fase.

Dipolaritet
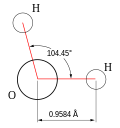
En viktig egenskap ved vann er dets polare egenskap. Vannmolekylet H2O er vinklet, med oksygen i spissen og hydrogenatomer ytterst. Siden oksygen har høyere elektronegativitet enn hydrogen, har oksygenatomets side delvis negativ ladning i forhold til hydrogensiden. Et molekyl med en slik ladningsforskjell kalles en dipol. Spenningsforskjellene gjør at vannmolekylene tiltrekkes av hverandre (den negative siden trekkes til et annets molekyl positive side) og til andre polare molekyler. Dette kalles hydrogenbinding. Denne kraften er relativt svak, men det høye antallet hydrogenbindinger fører til at vann har en rekke spesielle fysiske egenskaper.
Kokepunkt og varmekapasitet
Vann har, på grunn av hydrogenbindingene, et veldig høyt kokepunkt, siden det trengs mye energi for å bryte disse bindingene mellom molekylene. Grunnstoffet svovel som ligger under oksygen i periodesystemet, og dets tilsvarende kjemiske forbindelse hydrogensulfid (H2S), har ikke disse hydrogenbindingene og er en gass ved romtemperatur selv om det har dobbelt så høy molekylvekt som vann. Hydrogenbindinger gir også vann høy varmekapasitet, det vil si at det trengs mye energi for å varme opp vann.
Tetthet
Hydrogenbindinger gir samtidig vann spesielle egenskaper når det fryser. Som de fleste andre materialer blir vannets tetthet større ved lavere temperatur. Men når vann blir kjølt ned til nær frysepunktet fører hydrogenbindingene til – mens vannmolekylene flytter på seg for å minimalisere sin energi – at det dannes en struktur som faktisk har lavere tetthet. Dermed vil vann utvide seg når det fryser og is vil flyte i vann, mens de fleste andre materialer krymper og synker når de går over til fast form.
Flytende vann har sin høyeste tetthet ved 3,98 °C. Dette har en interessant konsekvens for livet i vannet om vinteren. Vann som blir avkjølt ved overflaten blir tyngre og synker, og danner konveksjonsstrømmer som avkjøler hele vannet. Når overflaten kjøles under 4 °C blir den imidlertid lettere, konveksjonsstrømmene opphører, og overflaten fryser til is som danner en isolerende hinne som kan hindre videre nedkjøling og bunnfrysing. Dermed kan fisk og andre organismer leve videre i vannet som holder ca. 4 °C på bunnen. (Grunt vann vil likevel bunnfryse ved sterk kulde.)
Løsemiddel

Vann er også et godt løsemiddel på grunn av sin polaritet. Egenskapene som løsemiddel er livsviktige i biologi, fordi mange biokjemiske reaksjoner forekommer kun i vannholdige løsninger, for eksempel reaksjoner i celleslimet og blodet. I tillegg brukes vann til å transportere biologiske molekyler.
Når en ionisk eller polar forbindelse kommer i kontakt med vann blir den omringet av vannmolekyler. Siden vannmolekylene er relativt små kan de omringe helt et molekyl av det oppløste. De delvis negative dipolene til vann blir tiltrukket av de positivt ladde delene av det oppløste, og motsatt for de positive dipolene.
Et eksempel på en ionisk løsning er bordsalt; natriumklorid, NaCl, vil dele seg opp i Na+–kationer og Cl––anioner. Hvert ion vil bli omringet av vannmolekyler. Ionene blir da lett fraktet ut av sitt krystallgitter og inn i løsningen. Et eksempel på en ikke-ionisk løsning er sukker. Dipolene til vann vil hydrogenbinde seg til de dipolare områdene på sukkermolekylet og frakter det ut i løsningen.
Generelt løser ioniske og polare substanser som syrer, alkoholer og salter seg lett med vann, mens ikke-polare substanser som fett gjør ikke det. Ikke-polare molekyler holder seg sammen i vann fordi det er energisk mer gunstig for vannmolekylene å hydrogenbinde seg med hverandre enn å anta van der Waals forbindelser med ikke-polare molekyler.
Medisinsk
Selv om vann er essensielt for menneskekroppen, kan sterkt overdrevet vanninntak kan føre til en potensielt livstruende tilstand kjent som vannforgiftning. Årsaken er at vannet fører til en lavere konsentrasjon av blant annet elektrolytter i blodet.
Kohesjon og overflatespenning

De sterke hydrogenbindingene gir høy kohesjon, og dermed overflatespenning. Dette ses tydelig hvis man har vann på en overflate som ikke er løselig i vann. Vannet holder seg samlet i dråper. Denne evnen er viktig når plantene frakter vann gjennom stengelen; de sterke intramolekylære kreftene holder vannet sammen og motvirker hårrørskreftene. Andre væsker vil ha langt større tendens til å danne luftlommer, vakuum og dermed stoppe væsketilførselen.
Konduktivitet
Rent vann er en isolator, men likevel er det vanlig å se på vann som et elektrisk ledende, eller konduktivt, stoff. Hvis et salt løses i vann, vil denne saltløsningen (elektrolytten) kunne lede elektrisk strøm. Denne ledeevnen skyldes redoksreaksjonen som oppstår i løsningen. Det er altså ikke selve vannet som leder strømmen. Se Elektrolyse nedenfor.
Elektrolyse
Vann kan deles opp i sine bestanddeler, hydrogen og oksygen, ved å la en strøm gå gjennom det. Denne prosessen kalles elektrolyse. Vannmolekyler skiller seg naturlig til H+- og OH--ioner som trekkes henholdsvis mot anoden og katoden. Ved katoden vil to H+-ioner ta opp elektroner og danne H2-gass. Ved anoden går fire OH–-ioner sammen og danner O2-gass og avgir fire elektroner. Gassene som blir dannet bobler opp til overflaten og kan bli samlet opp.
Reaktivitet og pH
Vann kan oppføre seg som både syre og base; det kan både avgi og motta protoner (H+), en reaksjon som kalles protolyse. Vann protolyserer med seg selv etter følgende likevektsreaksjon:
H2O + H2O ↔ H3O+ + OH-
Vann reagerer med syrer og baser og lager sure og basiske løsninger, etter hvor sterke syrene/basene er. Hvor sur eller basisk en løsning er, måles med pH (eller pOH). pH er et mål på konsentrasjonen av oksoniumioner (H3O+) i en løsning, mens pOH er et mål på konsentrasjonen av hydroksidioner (OH–). Jo lavere pH, jo høyere er konsentrasjonen av H3O+. I vann ved romtemperatur er produktet av konsentrasjonene av H3O+ og OH– alltid 10−14 (mol/l)2; summen av pH og pOH er 14. Ved pH 7 er konsentrasjonen av H3O+ og OH– lik, og løsningen er nøytral. Hvis denne likevekten forstyrres, blir løsningen sur (lavere pH; mer H3O+) eller basisk (høyere pH; mer OH–).
Det systematiske syrenavnet for vann er hydroksisyre, mens det systematiske basenavnet er hydrogenhydroksid. Det bør imidlertid nevnes at vann alene er verken syre eller base, men kan altså opptre som en svak syre eller en svak base i nærvær av hhv. en sterk base eller en sterk syre.
I teorien har rent vann pH 7, men i praksis er rent vann svært vanskelig å fremstille. Vann som er i kontakt med luft over en viss tid opptar raskt karbondioksid og danner en løsning av karbonsyre (kullsyre) med en likevekt-pH på ca. 5,7.[2]
Farge
Rent vann er farget i en veldig lys blåfarge[3], men oppfattes som oftest som fargeløst, og viser som regel fargen på stoffene bak eller rundt, eller reflekterer lyset som treffer vannoverflaten. Havet er faktisk blått i seg selv og ikke bare fordi det reflekterer himmelen. Under visse lysforhold kan regn eller lignende vannfall vise en regnbue.
Lukt og smak
Rent vann har ingen lukt eller smak, men siden vann er et meget godt løsemiddel vil det ofte være salter og andre forurensinger til stede. Når man refererer til «smaken» på vann fra ulike kilder, er det tilstedeværelsen av disse forurensningene man egentlig sikter til.
Dihydrogenmonoksid

Kjemisk formel: H2O, dihydrogenmonoksid.
Kjemikere omtaler tidvis vann spøkefullt som dihydrogenmonoksid eller DHMO, molekylets systematisk kovalente navn, særlig i parodier på kjemisk forskning som krever forbud mot dette «farlige kjemikaliet».[4] I byen Aliso Viejo i California ble isoporkopper nesten bannlyst da det ble kjent at DHMO var brukt i produksjonen.[5]
Remove ads
Vann på jorden


- Se også: hydrologi, vannets kretsløp
Vann eksisterer i mange former omtrent overalt på jorden, til og med dypt under de store ørkenene. Mesteparten av vannet befinner seg i verdenshavene og som polaris, men en del finnes også som skyer og vanndamp, regnvann, elver, vassdrag og is. Vannet forandrer stadig aggregattilstand, drevet av sollyset, og sirkulerer dermed rundt, og har på den måten en kontinuerelig bevegelse, vannets kretsløp. Gjennom fordampning, nedbør og avrenning, avgjør vannet temperaturen og klimaet over hele jorden.
Den totale vannmengden på jordkloden anslås til å være ca. 1 384 120 000 km³. Mesteparten av dette finnes i havet, ca. 97,2 %. Resten, ca. 2,8 % er ferskvann. 2,15 % av dette finnes i frossen tilstand som breer og innlandsis, 0,63 % befinner seg under bakkenivå som grunnvann. Bare 0,02 % befinner seg i vassdrag, elver og innsjøer, og ikke mer enn 0,001 % som vanndamp i atmosfæren.
Vannet har høyest densitet ved 4 °C, hvilket gjør at det kalde vannet, og det av vannet som har frosset til is, legger seg som et isolerende lag over det varmere vannet. Dette gjør at større vannansamlinger veldig sjeldent bunnfryser, hvilket gir godt grunnlag for liv i innsjøer, elver og i havet.
Vann som ressurs
Se også: Vannressurser
Vann som har fordampet og kondensert, faller – dersom ansamlingen er tung nok – ned til jorden som nedbør. Dette er avgjørende for jordbruk og for mennesker generelt. Mennesker har derfor en mengde ord for å beskrive de ulike formene nedbør, for eksempel regn, hagl, snø, tåke og dugg.
På samme måte har hvordan vannet renner stor betydning for menneskenes tilholdssteder. Elver og oppsamling av vann er viktige forutsetninger for vårt jordbruk, og havene gir muligheter for fiske, samt for reise, handel og transport. Gjennom erosjon former vannet kontinentene og landskapet. De fleste mennesker lever i daler og ved elvedeltaer.
Vannet trenger inn i jorden og blir jordvann. Dette grunnvannet tar seg opp til jordens overflate igjen, gjennom naturlige vannkilder og menneskenes brønner, eller som varme kilder og geysirer.
Økt etterspørsel etter vann påvirker også investeringsnivået. FN venter at det globalt vil investeres for nærmere 800 milliarder dollar i året frem mot 2020.[6]
 |
 |
Tidevann
Utdypende artikkel: tidevann
Tidevann er en periodisk variasjon i vannstanden i havet, hvor havet stiger og synker, fordi månen og solen med sin tyngdekraft trekker vannet i havet mot seg. Forandringer kommer av at månen og solen forandrer posisjon i forhold til jorden, kombinert med jordens rotasjon og lokalt batymetri. Dette forårsaker forandringer mht. hvor høyt vannet står, spesielt ved kysten, og skaper også varierende strømmer, kjent som tidevannsstrøm. Økologisk er landstripen som vises ved lavvann er en viktig sone.
Remove ads
Vann i universet
Mye av universets vann er et biprodukt av stjernedannelse. En stjernes fødsel involverer sterke ytre vinder som inneholder gass og støv. Når denne utstrømningen av materialer til slutt påvirker det omkringliggende gassen vil sjokkbølgene som oppstår komprimere og varme opp gassene. I denne oppvarmede, tette gassen produseres vann[7]
Den 22. juli 2011 ble det publisert en rapport om oppdagelsen av en gigantisk sky av vanndamp, som inneholder «140 billioner ganger mer vann enn alle verdens hav til sammen» rundt en kvasar 12 milliarder lysår fra Jorden. Ifølge forskerne viser funnet at «vann har vært utbredt i universet nesten siden universets begynnelse».[8][9]
Vann er påvist i interstellare skyer i vår egen galakse, Melkeveien. Sannsynligvis finnes vann i overflod i andre galakser siden vannets komponenter, hydrogen og oksygen, er blant de vanligste elementene i universet. Over tid vil de interstellare skyene kondensere til solskyer og solsystemer som vårt eget.
Vanndamp er til stede i
- Merkurs atmosfære: 3,4 %, og vann i store mengder i Merkurs eksosfære[10]
- Venus' atmosfære: 0,002 %
- Jordatmosfæren: ~ 0,40 % over hele atmosfæren, Typisk 1-4 % på overflaten
- Mars' atmosfære: 0,03 %
- Jupiters atmosfære: 0,0004 %
- Saturns atmosfære – kun i volatiler
- Enceladus (en av Saturns måner): 91 %
- Eksoplaneter som HD 189733 b[11] og HD 209458 b[12]
Flytende vann er til stede på
- Jorden: 71 % av overflaten
- Europa: 100 km dypt undergrunnshav
Mye tyder på at flytende vann er til stede like under overflaten av Saturns måne Enceladus.
Is er til stede på
- Jorden – Hovedsakelig innlandsisen på polene
- Polene på Mars
- Månen
- Titan
- Europa
- Saturns ringer[13]
- Enceladus
- Pluto og Charon[13]
- Kometer og kometpopulasjoner (Kuiperbeltet og Oorts sky).
Vann i form av is kan være til stede på Ceres og Tethys. Vann og andre volatiler utgjør sannsynligvis mye av de indre strukturene i Uranus og Neptun og vannet i de dypere lagene kan være i form av ionisk vann som molekylene bryter ned til en suppe av hydrogen- og oksygenioner, og dypere nede superionisk vann der oksygen krystalliseres mens hydrogenionene flyter fritt rundt inne i oksygenkrystallene.[14]
Remove ads
Religion og mytologi

Vann blir ansett som rensende i de fleste religioner. Rituell vask inngår i flere større religioner, blant annet innen kristendom, hinduisme, rastafaribevegelsen, islam, shintoisme, taoisme og jødedom. Nedsenking av en person i vann er et sentralt sakrament i kristendommen (hvor det er kalt dåp); det er også en del av praksisen i andre religioner, som jødedom (mikvah) og sikhisme (Amrit Sanskar). I tillegg blir døde badet i rent vann i mange religioner, inkludert jødedom og islam. Innen islam kan de fem daglige bønnene som regel gjennomføres etter å ha vasket visse deler av kroppen med rent vann (wudu). I shintoisme blir vann brukt i nesten alle ritualer for å vaske en person eller et område, for eksempel i misogi-ritualet.
Noen trossamfunn bruker vann spesielt forberedt for religiøs bruk (hellig vann innen kristendommen, amrita i sikisme og hinduisme). Mange religioner anser også visse vannkilder eller vannansamlinger som hellige eller i det minste gunstige, for eksempel Lourdes i Den romersk-katolske kirke, Jordan (i det minste symbolsk) i noen kristne samfunn, Zamzam i islam og elva Ganges (blant mange andre) i hinduismen.
Vann er ofte ansett å ha spirituell makt. Innen keltisk mytologi er Sulis den lokale gudinnen for varme kilder, og i hinduismen er Ganges også personifisert som gudinne, mens Saraswati har blitt referert til som gudinne i Vedaene. Vann er også en av hinduismens elementer, sammen ild, jord, rom og luft. Guder kan også være beskyttere for visse kilder, elver eller sjøer: For eksempel var den greske og romerske guden Peneus en elvegud, en av tre tusen okeanider. I islam gir ikke vann bare liv, men livet selv har kommet fra vannet.
Den greske filosofen Empedokles anså vann som en av de fire klassiske elementene, sammen ild, jord og luft. Det ble også ansett som ylem, en basisk substans av universet. Vann ble ansett som kaldt og vått. I teorien om de fire kroppsvæsker forbindes vannet med slim. Vann var også en av de fem elementene innen tradisjonell kinesisk filosofi, sammen med jord, ild, tre og metall.
Remove ads
Vannrettigheter og utvikling
UNESCOs internasjonale vannforskningsprogram og deres World Water Development Report (2003) anslår at verden i løpet av de neste 20 årene står foran en mangel på drikkevann uten sidestykke i historien. Mengden av alment tilgjengelig, brukbart vann antas å minske med 30 prosent i denne perioden. Årsakene er forurensning, global oppvarming og politiske stridigheter.
40 prosent av verdens befolkning har for lite vann til et minimum av hygieniske formål. Mer enn 2,2 millioner mennesker døde av sykdommer knyttet til inntak av forurenset vann i år 2000.
Rapporten oppgir store globale forskjeller i volumet av tilgjengelig vann pr. person, fra 10 000 liter årlig i Kuwait til mer enn 810 000 000 liter årlig i Fransk Guyana. Imidlertid kan rike land som Kuwait lettere enn fattige land håndtere et relativt vannunderskudd.
Verdens vanndag er en internasjonal FN-merkedag den 22. mars hvert år for å sette fokus på mangel på rent drikkevann.
Vannforbruk
Vannforbruket pr. individ er høyt, men varierer med levestandard. FN har beregnet at et menneske trenger 20–50 liter vann om dagen for å dekke grunnleggende behov for drikke, personlig hygiene og renhold.[15] En gjennomsnittlig nordmann forbruker likevel 200 liter vann om dagen.[16] Rundt 10 liter går til drikke og matlaging, mens det øvrige går til andre formål, som renhold, hygiene, klesvask, toalettspyling m.m. Vann- forsyningen dekker også behovene til andre enn husholdningene, som næringsliv, brannvesen, skoler, barnehager og helseinstitusjoner.
Remove ads
Se også
- Avsalting
- Amfotær
- Dehydrering
- Dihydrogenmonoksid
- Drikkevann
- Elektrolyse
- Ferskvann
- Flom
- Flatt vann
- Hydrografi
- Hydrologi
- Is
- Kunstig vanning
- Meteorologi
- Mineralvann
- Mpemba-effekt – kan varmt vann fryse raskere enn kaldt?
- Nedbør
- Regn
- Saltvann
- Spillvann
- Tungtvann
- Tørke
- Vannanlegg
- Vannbehandlingsanlegg
- Vanndirektivet
- Vievann
- Stanley Meyers vannbrenselcelle
Referanser
Litteratur
Eksterne lenker
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads