Vírus
biokémiai fertőző mikroorganizmus From Wikipedia, the free encyclopedia
A vírus szubmikroszkopikus biológiai organizmus, amely nem sejtes szerveződésű és csak parazitaként az élőlények sejtjeiben képes szaporodni. Minden életformának, növényeknek, állatoknak, gombáknak, egysejtű eukariótáknak és baktériumoknak megvannak a vírusos fertőzéseik.[1]
| Vírusok | ||
|---|---|---|
 | ||
| Vírusbesorolás | ||
| ||
| Csoport | ||
|
I: kettős szálú DNS-vírusok | ||
| Hivatkozások | ||
A Wikimédia Commons tartalmaz Vírusok témájú médiaállományokat és Vírusok témájú kategóriát. | ||
A vírusokat Dmitrij Ivanovszkij fedezte fel 1892-ben, amikor a dohány mozaikos megbetegedését vizsgálta. Az elnevezést – amely a latin virus, méreg szóból származik – Martinus Beijerincktől kapta 1898-ban.[2] Máig mintegy 5000 fajukat írták le, de valószínűsíthető számukat több millióra teszik.[3] A vírusok minden ökoszisztémában megtalálhatóak, létszámukat tekintve a leggyakoribb földi organizmusok közé tartoznak.[4][5] A vírusokat a mikrobiológia egyik ága, a virológia tanulmányozza.
A sejteken kívül életjelenségeket nem mutató vírusrészecskeként, csak genetikai információt hordozó virion formában léteznek, amelyek a genomból (a vírusok többsége RNS-vírus), egy fehérjeburokból (kapszid) és egyes fajok esetén egy külső lipidburokból (peplon) állnak. Formájuk változatos, lehetnek rúd, fonál, ikozaéder vagy egyéb alakúak. Méretük 20-1500 nanométer között változik, döntő többségüket fénymikroszkóppal nem, csak elektronmikroszkóppal lehet megfigyelni.
Eredetük bizonytalan. Több elmélet is létezik származásuk magyarázására, van, amelyik szerint leegyszerűsödött parazitabaktériumok, vagy a sejtek citoplazmájában található plazmidok voltak őseik; van olyan vélemény is, hogy együtt alakultak ki a sejtes élettel. Az evolúcióban fontos szerepet játszanak, általuk lehetővé válik a fajok közötti génátadás.[6] Élőlény mivoltuk vita tárgya; bár vannak génjeik és alkalmazkodnak környezetükhöz, önálló anyagcserét nem folytatnak.[7]
Változatos módon terjednek; van, amelyiket rovarok viszik át egyik állatról vagy növényről a másikra, vannak, amelyek cseppfertőzéssel (tüsszentéssel, köhögéssel), a levegőbe kerülő aeroszollal, testnedvekkel, esetleg ürülékkel szennyezett tárgyakkal kerülnek új gazdaszervezetükbe. A legtöbb vírus csak egy vagy néhány fajt tud megfertőzni.[8]
A vírusok ellen az élőlények immunrendszere védekezik, amelyet oltással fel lehet készíteni a fertőzés elleni még hatékonyabb válaszra. Vannak olyan vírusok is, amelyek képesek kikerülni az immunrendszert. Az antibiotikumok nem hatékonyak a vírusok ellen.
Felfedezésük

A baktériumokat felfedező Louis Pasteur képtelen volt megtalálni a veszettség kórokozóját és feltételezte, hogy annyira apró, hogy nem látszik a mikroszkópban.[10] 1884-ben Charles Chamberland francia mikrobiológus kifejlesztett egy porcelánszűrőt (ma Chamberland-szűrő néven ismert), amelynek pórusai kisebbek voltak a baktériumoknál, így az oldatokat teljesen bacilusmentessé tudta tenni.[11] 1892-ben Dmitrij Ivanovszkij orosz biológus a dohány mozaikbetegségét tanulmányozta és úgy találta, hogy a levelek kivonata porcelánfilteren átszűrve is képes maradt az infekció átvitelére. Ivanovszkij feltételezte, hogy a betegséget a baktériumok által kiválasztott toxinok okozhatják, de további kutatásokat nem folytatott.[12]

A korabeli, általánosan elfogadott vélekedés az volt, hogy minden fertőző ágens fennakad a szűrőkön és megfelelő táptalajon tenyészteni is lehet őket (ez volt a betegségek csíraelmélete).[2] 1898-ban a holland Martinus Beijerinck megismételte Ivanovszkij kísérleteit, de ő arra a következtetésre jutott, hogy a dohány levélmozaikjáért valamilyen, addig ismeretlen fajta kórokozó a felelős.[13] Megfigyelte, hogy a kórokozó csak osztódó sejtek jelenlétében szaporodik, de mivel sem mikroszkóppal nem tudta megfigyelni, sem kiszűrni nem volt képes, úgy gondolta, hogy az ágens egyfajta élő folyadék, (contagium vivum fluidum) lehet és a latin méreg szó alapján elnevezte vírusnak.[12] Beijerinck egész életében fenntartotta, hogy a vírusok folyékonyak, elméletét Wendell M. Stanley cáfolta meg véglegesen, amikor bebizonyította részecsketermészetüket.[12] Szintén 1898-ban mutatta ki a német Friedrich Loeffler és Paul Frosch a száj- és körömfájás kórokozójának szűrhetőségét.[14]
A 20. század elején Frederick Twort angol bakteriológus baktériumokat fertőző vírusokat fedezett fel, amelyeket bakteriofágoknak (vagy röviden fágoknak) nevezett el.[15] Tőle függetlenül a francia-kanadai Félix d'Herelle is leírt vírusokat, amelyek elpusztítják az agaron tenyésző mikroorganizmusokat. Kidolgozott egy módszert is, amellyel meg tudta mérni a fertőző részecskék mennyiségét: a vírustartalmú oldatot addig hígította, míg már nem pusztította el valamennyi baktériumot, hanem a Petri-csészében növő baciluspázsitban kör alakú foltokat hagyott. Feltételezve, hogy a foltok egy-egy szaporodóképes kórokozótól származnak, a hígítás ismeretében kiszámolta az eredeti koncentrációjukat (úgynevezett vírustitrálás).[16] A fágokat sokáig felhasználhatónak tartották a bakteriális fertőzések (mint például tífusz vagy kolera) leküzdésében, de aztán a penicillin felfedezése miatt felhagytak az ez irányú kutatásokkal.
A vírusokról sokáig úgy tudták, hogy csak élő szervezetben képesek szaporodni. Miután Ross Granville Harrisonnak 1906-ban először sikerült idegszövetet nyirokban mesterségesen fenntartania, néhány évvel később E. Steinhardt, C. Israeli és R. A. Lambert a módszerét alkalmazva tengerimalac szaruhártyáján sikeresen tenyésztette a vakciniavírust.[17] 1928-ban H. B. Maitlandnak sikerült in vitro csirkevesében szaporítania a vakciniavírust, de a szövettenyésztéses módszerek igazán csak az 1950-es évek után, a poliovírusra kifejlesztett módszerek elterjedésével váltak általánossá.[18]
1931-ben az amerikai Ernest William Goodpasture újabb áttörést ért el, amikor sikerült az influenzavírust megtermékenyített tyúktojásban szaporítania.[19] 1949-ben John Franklin Enders, Thomas Weller és Frederick Robbins kidolgozta a poliovírus szaporításának módszerét tenyésztett emberi sejteken és ezzel akkora vírusmennyiséget lehetett előállítani, ami jelentősen meggyorsította a hatékony gyermekbénulás-vakcina előállításán fáradozó Jonas Salk munkáját.[20]
Képek készítése a vírusokról azután vált lehetségessé, miután a német Ernst Ruska és Max Knoll elkészítette az első elektronmikroszkópot.[21] 1935-ben az amerikai Wendell M. Stanley elemezte a dohánymozaikvírust és úgy találta, hogy döntően fehérjéből épül fel,[22] majd röviddel később felfedezte, hogy RNS-t is tartalmaz.[23] A dohánymozaikvírus volt az első, amelyet kristályosítani tudtak és miután 1941-ben röntgendiffrakciós képet készítettek róla, Rosalind Franklin meg tudta határozni a szerkezetét.[24] 1955-ben Heinz-Fraenkel-Conrat és Robley Williams kimutatta, hogy a dohánymozaikvírus tisztított fehérjéje és RNS-e összekeverve magától fertőzőképes vírusrészecskékké áll össze.[25]
A 20. század második fele a vírusvadászok aranykora volt, ezekben az években több mint kétezer új fajt fedeztek fel.[26] Többek között 1957-ben leírták a lovak arteritiszét okozó vírust és a marhák hasmenéses betegségét okozó pestivírust. Baruch Blumberg 1963-ban felfedezte a hepatitisz B vírust,[27] 1965-ben Howard Temin közölte az első retrovírus felfedezését; az életciklusok alapját képező, RNS-t DNS-sé átíró reverz transzkriptázt 1970-ben írta le egymástól függetlenül Temin és David Baltimore.[28] 1983-ban a Pasteur Intézetben Luc Montagnier csapata elsőként izolálta az AIDS kórokozóját, a HIV-et.[29]
Eredetük

A vírusok mindenütt megtalálhatóak a sejtes élőlények közelében és feltehetően azóta léteznek, amióta azok létrejöttek.[30] Mivel fosszíliákat nem képeznek, rokonsági viszonyaikat és fejlődésüket elsősorban molekuláris biológiai módszerekkel vizsgálják.[31] Egyes vírusok képesek beintegrálódni a gazdaszervezet genomjába, amit az aztán továbbad az utódainak, akár sok-sok generáción keresztül. Ez a tulajdonságuk is hasznos a paleovirológusok számára, akik így több millió évvel ezelőtti vírusformákat is képesek tanulmányozni. A vírusok eredetét illetően ma három jelentősebb elmélet létezik:[32][33]
- Regresszív elmélet
- a vírusok valamikor kis, sejtes paraziták voltak, amelyek nagyobb sejteket fertőztek meg. Idővel a fölösleges, szabadban való életmódhoz szükséges génjeik elvesztek. Ma ilyen szervezetek a Rickettsia és Chlamydia baktériumok, amelyek csak a gazdasejtekben képesek szaporodni. Létezésük alátámasztja a hipotézist (amelyet degenerációs elméletnek is neveznek).[34][35]
- A sejtes eredet elmélete
- szerint a vírusok elszabadult sejtalkotórészek, nagyobb szervezetek önállóvá vált DNS-e vagy RNS-e. Eredetileg talán plazmidok (a citoplazmában található különálló, cirkuláris DNS-szakaszok, amelyek képesek egyik sejtből a másikba átmenni) voltak, esetleg transzpozonok (a sejt genomjába beépült és azon belül magát másolni képes DNS).[36] Az ugráló géneknek is nevezett mobilis genetikai elem transzpozonok, amelyeket Barbara McClintock fedezett fel 1950-ben, egyes vírusok ősei lehettek.[37]
- Koevolúciós elmélet
- szerint a vírusok az élet hajnalán egy időben alakultak ki a sejtes életformákkal és több milliárd éve együtt élnek. A fehérjeburok nélküli, vírusoknál is egyszerűbb, életciklusukhoz az ő segítségüket igénylő parazita szervezetek szolgáltatnak példát a korai formákra. Az ilyen szubvirális organizmusokra[38] példák a növénypatogén viroidok,[39] a hepatitisz delta vírus, amely a hepatitisz B vírusától kölcsönzi a proteinköpenyt és nélküle szaporodásképtelen,[40] vagy a mimivírusokon élősködő szputnyik virofág.[41]
Mindegyik elméletnek megvan a maga problémája: a regresszív elmélet nem magyarázza, hogy miért különböznek alapvetően a vírusok a baktériumoktól. A kiszabadulós hipotézis nem tud számot adni a komplex kapszidokról, amelyekhez hasonlóra nincs példa a baktériumokban. A koevolúciós elmélet hibája ott van, hogy nem magyarázza, hogyan szaporodtak a vírusok a sejtes élet létrejötte előtt.[14] A mai értelmezés szerint a vírusok nagyon ősiek és létrejöttük megelőzi az élet három ágra (archeák, prokarióták, eukarióták) való szétválását.[42] Ez a felfedezés a három hipotézis újraértékelésére ösztönzi a virológusokat.[42]
Az élet kezdetén létező RNS-világra utaló bizonyítékok[43] és a virális és gazda-nukleinsavak számítógépes összehasonlítása szintén új fénybe helyezhetik a víruscsaládok rokonsági viszonyait és eredetét; bár ezek az adatok egyelőre nem erősítették meg egyik eredetelméletet sem.[43] Mindenesetre valószínűtlennek látszik, hogy valamennyi vírusnak közös őse lett volna, feltehetően többször is létrejöttek, akár különböző mechanizmusok révén is.[44]
Felmerült, hogy a vírusok olyan önreplikáló molekuláktól is származhattak, mint a prionok.[45] A prionok fehérjemolekulák, nukleinsavat egyáltalán nem tartalmaznak.[46] Olyan betegségeket képesek okozni, mint a birkák surlókórja, a kergemarhakór; emberekben pedig kurut, Creutzfeldt–Jakob-szindrómát és Gerstmann–Sträussler–Scheinker-szindrómát.[47]
Biológiájuk
Élőlények-e a vírusok?
A vélemények eltérnek abban a kérdésben, hogy a vírusok az élet egy formájának, vagy csak élettelen szerves struktúráknak tekintendők-e. Sokszor az élet határán mozgó szerveződésekként írják le őket,[7] mert vannak génjeik, van evolúciójuk természetes kiválasztódás által,[48] és sokszorozni képesek magukat; viszont nincsenek sejtjeik, amit sokan az élet alapegységének tekintenek. Nincs saját anyagcseréjük és minden tekintetben a gazdasejttől függenek, képtelenek azon kívül „szaporodni”.[49] Azonban vannak olyan baktériumok – a Rickettsiák és Chlamydiák – amelyekre a fentiek szintén igazak, mégsem merül fel kétség élőlény mivoltuk iránt.[50][51] A vírusok egyértelműen különböznek a növekvő és bizonyos szempontból reprodukáló kristályoktól abban, hogy genetikai mutációik vannak és alkalmazkodnak a környezetükhöz. A külső hatásoktól független, önálló vírusösszeszerelődés fontos kutatási terület az élet keletkezését tanulmányozó tudósok számára; példája alátámaszthatja az élet létrejöttének azt a modelljét, amely szerves molekulák spontán összekapcsolódásából indul ki.[1]
Szerkezetük


A vírusok mérete és formája széles határokon belül változik. Legtöbbjük jóval kisebb a baktériumoknál, 20 és 300 nanométer között van. Egyes filovírusok elérik az 1400 nm-es hosszúságot, de vastagságuk csak 80 nm.[52] A 2015-ben ismert legnagyobb vírus a kisebb baktériumok méretét meghaladó Pithovirus. Többségük túl kicsi ahhoz, hogy fénymikroszkóppal meg lehessen figyelni őket, és tanulmányozásukhoz elektronmikroszkópra van szükség.[53] A vírusrészecske és a háttér kontrasztjának megnövelésére elektrodenz „festékeket”, többnyire nehézfémek (például volfrám) sóit használják.[54]
A sejten kívüli vírusrészecskét virionnak nevezik. A virion a valamilyen nukleinsavból (DNS vagy RNS) álló genomból és az azt körülvevő proteinköpenyből, a kapszidból áll. A kapszidot egyforma alegységek, úgynevezett kapszomerek építik fel.[55] A kapszid szinte minden esetben a vírus génjei által kódolt fehérjékből áll, és alakja fontos támpontot jelent a víruscsaládok morfológiai elkülönítésében.[56][57] Egyes vírusok a kapszidon kívül egy külső lipidburokkal is rendelkeznek, amelynek fehérjéi a gazdasejt sejtmembránjából származnak, és segíti a vírus kötődését a gazdasejthez. A kapszid és külső burok szerepet játszik a gazdasejthez való kapcsolódásban, a sejt belsejébe történő belépésben, a genom felszabadításában a sejten belül, az újonnan kialakult vírusrészecskék „összeszerelésében”, és a genetikai anyag egyik sejtből a másikba történő átvitelében is. Struktúrájuk meghatározza, hogy egy vírus mennyire stabil, például a kémiai vagy fizikai behatásokkal szemben mennyire ellenálló. Általában, a külső burokkal nem rendelkező vírusok stabilabbak és túlélő képességük hosszabb a gazdasejteken kívüli környezetben.[58]
Az alegységek spontán, külső vezérlés nélkül állnak össze kapsziddá, de az összeszerelődéshez többnyire a vírusgenom jelenléte is szükséges. A bonyolultabb vírusok olyan fehérjéket is kódolnak, amelyek segítik a kapszid-összeszerelést; ezek közé tartoznak a genomhoz kapcsolódó nukleoproteinek. A vírusok általában öt nagyobb morfológiai csoportba sorolhatók:

- Helikális
- Ezekben a vírusokban egyfajta kapszomer egy központi tengely körül alkot szorosan csavart csigavonalszerű struktúrát, a középső üregben helyezkedik el a vírus-nukleinsav. A végső forma lehet viszonylag rövid és merev rúdforma, vagy hosszú, hajlékony filamentum. Genomjuk többnyire egyszálú RNS-ből, ritkábban egyszálú DNS-ből áll, és a negatív töltésű nukleinsavat a fehérjecső belső pozitív töltései kötik meg. A kapszidhélix hossza a nukleinsav méretével arányos, vastagsága pedig a kapszomerek nagyságának függvénye. Egyik legismertebb képviselőjük az egyik legrégebben tanulmányozott faj, a dohánymozaikvírus.[60]
- Ikozaéderes
- A legtöbb, állatokat fertőző vírus ikozaéder alakú vagy ilyen szimmetriájú, de gömbközeli formájú. Az ikozaéder az optimális forma, ha azonos alegységekből akarunk kihasználatlan sarok nélküli dobozt készíteni. A kapszomerek minimális száma tizenkettő, és öt egyforma alegységből állnak. Sok vírus (például a rotavírus) kapszidja tizenkettőnél több kapszomerből épül fel, és gömb alakúnak látszik, de alapvető szimmetriája az ikozaédert követi. A csúcsokon lévő kapszomereket öt másik veszi körbe, ezért nevük penton. A síkokat alkotó kapszomereknek hat szomszédja van, elnevezésük hexon.[61] A hexonok laposak, míg a 12 csúcsot formáló pentonok kidomborodóak. A kétféle kapszomer felépülhet ugyanabból a fehérjéből, de lehet különböző is az összetételük.
- Nyújtott
- Ez az előző forma egyik alesete, amikor az ikozaéder egyik tengelye mentén megnyújtott; elsősorban bakteriofágok feje esetében találkozhatunk vele. A központi hengert mindkét végén egy szögletes forma zárja le.[62]

- Lipidburok
- Egyes vírusok a fehérjekapszidjukat lipidmembránnal veszik körbe, amely többnyire a gazdasejt sejtmembránjából, esetleg az endoplazmatikus retikulumból, vagy a sejtmag hártyájából származik. A lipidrétegben megtalálhatók a sejt eredeti fehérjéi és szénhidrátjai, valamint a vírus saját proteinjei is. Utóbbiak alapvetőek a fertőzőképességhez, azért ha alkohollal szétbontjuk a lipidburkot, a vírus inaktívvá válik. Az influenzavírus, a HIV, a koronavírus is ebbe a csoportba tartozik.[63]
- Összetett
- Vannak nehezen besorolható morfológiájú vírusok, amelyek nem egyszerűen helikálisak vagy ikozaéder alakúak, hanem különböző extra struktúrákkal rendelkeznek. Egyes bakteriofágok, pl. a T4 fág ikozaéderes fejjel és hozzá kapcsolódó helikális farokkal rendelkezik, amelynek hatszögletű alapjához további farokszálak kötődnek. A farokstruktúra egyfajta molekuláris injekcióként működik, a vége a gazdasejthez rögzül és rajta keresztül hatol be a vírus nukleinsavja a fejből a sejt belsejébe.[64]
Sajátos struktúrája van a poxvírusoknak. A központi, súlyzó formájú proteinburkot és mellette a két ismeretlen funkciójú laterális testet kétszeres lipidburok veszi körbe, amitől lekerekített sarkú tégla vagy ovoid formája lesz.[65] A legnagyobb vírusok közé tartozó, 400 nm átmérőjű mimivírus az elektronmikroszkópos felvételek tanúsága szerint ikozaéder formájú, és felszínét sűrűn borítják a 100 nm hosszú filamentumok.[66] A 2015-ig legnagyobb ismert vírus, a fénymikroszkópban is látható, 1500 nm-es hosszával kisebb baktériumok méretét meghaladó Pithovirus, melyet egy harmincezer éves fagyott szibériai talajmintából izoláltak. Formája megnyúlt ovális, melyben a fehérjetegumentumot lipidburok fedi be, és egyik keskeny végén méhsejtszerű struktúra található.[67]
A sajátos formák különösen elterjedtek az archeákat fertőző vírusok körében: vannak közöttük orsó, könnycsepp, sőt palack formájúak is. Mások a bakteriofágokra emlékeztetnek, de több farokstruktúrával is rendelkeznek.[68]
Genom
| Tulajdonság | Forma |
|---|---|
| nukleinsav |
|
| alak |
|
| szálak száma |
|
| szenzitás (használható-e transzlációra) |
|
A virális genom szerveződését illetően elképesztő változatosság tűnik elő, diverzitásuk nagyobb, mint a növényeknél, az állatoknál és a baktériumoknál együttvéve.
A genetikai anyaga lehet DNS vagy RNS, ennek megfelelően lehet beszélni DNS- és RNS-vírusokról. A vírusok többsége RNS-vírus. A növények kórokozói inkább egyszálú RNS-t használnak, míg a bakteriofágok alapvetően kettős szálú DNS-genommal bírnak.[69]
A genom lehet kör alakú, mint a poliómavírusok esetében vagy lineáris, mint az adenovírusoknál. Egyik alak sem függ attól, hogy DNS-ről vagy RNS-ről van-e szó. Sok RNS-vírus (és néhány DNS-vírus is) genomja szegmentált, több rövid szakaszból áll (hasonlóan az eukarióták kromoszómáihoz). Az RNS-vírusok esetében a szegmensek többnyire csak egy fehérjét kódolnak, de nem minden esetben van szükség valamennyi szegmensre ahhoz, hogy a vírus fertőzőképes legyen, ilyen például a rozsnokmozaikvírus.[52]
A genom (függetlenül a nukleinsav fajtájától) lehet egyszálú vagy kétszálú. A kétszálú genom a jól ismert kettős hélix szerkezet, azzal a különbséggel, hogy nem csak DNS, hanem RNS is alkothatja. Az egyszálú genom ennek csak az egyik felét tartalmazza. Egyes vírusok – például a Hepadnaviridae család tagjai – genomjában egy- és kétszálú szakaszokat is találhatunk.[69]
Az egyszálú genomok (akár az RNS vagy a DNS) variációt mutatnak a szenzitás szempontjából is, vagyis hogy közvetlenül, a fehérjeszintézisben (transzlációban) azonnal használható módon vagy komplementer formában tartalmazzák-e a genetikai információt. A közvetlenül átírható (a sejt mRNS-ének megfelelő) kódot pozitív-szenznek (+) nevezik. A negatív-szenz (-) formát előbb egy RNS-függő RNS-polimerázzal át kell írni (+) alakba, mielőtt fehérjék készülhetnének róla. Az egyszálú DNS-ek esetében a genom (-) orientációjú (templátszál) és a róla készülő RNS-kópia (+) (kódoló szál).[69] Több példa is van arra, hogy egy vírusgenom ambiszenz, azaz miután lemásolták, mindkét szála egyformán használható fehérjetranszlációra. Ilyenek a növényeket fertőző geminivírusok vagy az állatokat megbetegítő arénavírusok.[70]
A genom mérete is igen tág határok között változhat. A legkisebbek a cirkovírusok, mindössze két proteint kódolnak és hosszuk alig kétezer bázis;[71] míg az óriás pandoravírusok genomja 2500 gént tartalmaz és mérete eléri a kétmillió bázist.[72]
Általánosságban az RNS-vírusok genomja rövidebb, mert az RNS-másolás hibarátája nagyobb és a biztonságosan másolható RNS-molekula mérete korlátozott.[31] Efölött már túl sok mutáció keletkezik és a vírus életképessége lecsökken. Ezt kompenzálandó, sok RNS-vírusnak szegmentált genomja van, vagyis több darabból áll, és egyetlen rossz mutáció nem tudja tönkretenni az egész vírusrészecskét. A DNS másolásának hűsége jóval magasabb, ezért a genomok is nagyobbak lehetnek.[73] A szabály alól az egyszálú DNS-vírusok a kivételek, ahol a mutációs ráta megközelíti az RNS-vírusokét.[74]
Mutációk

A vírusok genetikai anyaga több mechanizmus segítségével változhat. A hagyományos pontmutáció többnyire másolási hiba következménye; ezek nagy része úgynevezett semleges mutáció, vagyis a kódolt fehérje aminosavsorrendjében nem jelentkezik. Más esetekben viszont igen és összességük létrehoz egy olyan genetikai variabilitást, amely az antivirális szerek elleni rezisztencia kialakulását teszi lehetővé.[75][76] Az RNS-vírusok mutációs rátája magasabb, mert az őket másoló enzimek gyakrabban ejtenek hibát. A HIV esetében a másolási hiba gyakorisága körülbelül 3×10−5, vagyis minden harmadik vírusban létrejön egy új mutáció.[77] Emiatt az RNS-vírusokat sokszor nem igazi fajnak, hanem „kvázifajnak” tartják, mert az egyes törzsek genetikai különbsége egészen nagy lehet.[78] A szegmentált genomú influenzavírus esetében a mutációk lassú felhalmozódását és ezáltal az immunrendszer kikerülését driftnek (sodródás) hívják, szemben a shifttel („csuszamlás”), amikor két vírus között a szegmensek átrendeződése és új vírustörzsek gyors létrejötte zajlik.[79]
A nem szegmentált genomú vírusok (akár RNS, akár DNS) is rekombinálódhatnak ha két vírus egyszerre fertőz meg egy sejtet. Az ilyen esetek jelentősen meggyorsíthatják az evolúciót, A szekvenciavizsgálatok alapján a rekombináció nem ritka jelenség.[80][81][82]
Életciklus

A vírusok nem osztódással szaporodnak (mivel sejtjeik nincsenek), hanem a gazdasejttel elkészíttetik alkatrészeiket, amelyek aztán spontán összeállnak érett virionná.
Az egyes fajok életciklusa nagyban különbözhet, de hat stádium gyakorlatilag valamennyinél megfigyelhető:[83]
Kapcsolódás: amikor a virion külső proteinjei csatlakoznak a gazdasejt felszínén található receptorhoz. Ezek a receptorok határozzák meg, hogy a vírus milyen fajt, azon belül milyen szövetet, sejttípust képes megfertőzni. Például a HIV a humán fehérvérsejtek egy csoportját fertőzi, ugyanis felszíni fehérjéje, a gp120 a leukocitákon lévő CD4 receptorhoz képes kapcsolódni és így ezeket a sejteket tudja elpusztítani. A kapcsolódás után a felszíni vírusprotein konformációváltozáson megy át, ami a következő fázishoz, a behatoláshoz vezet.
Behatolás: a kapcsolódás után a vírus vagy endocitózis, vagy (ha lipidburokkal rendelkezik) a lipidmembránok összeolvadása révén jut a sejt belsejébe. A növényeket és a gombákat fertőző vírusok annyiban nehezebb helyzetben vannak, hogy azokat a sejteket vastag, cellulózból vagy kitinből (a gombák esetében) álló sejtfal veszi körbe és csak sérülés esetén képesek az infekcióra.[84] Ha azonban már bent vannak, a sejteket összekötő vékony plazmaszálakon, a plazmodezmákon keresztül könnyen átjuthatnak a szomszédos sejtekbe.[85] A baktériumoknak is van faluk, ami azonban (legalábbis a Gram-negatív fajok esetében) jóval vékonyabb a növényekénél és a bakteriofágok kifejlesztettek egy módszert, amivel direktben áttörik a falat és beinjekciózzák genetikai anyagukat a sejt belsejébe, míg a fehérjekapszid odakint marad.[86]

Kicsomagolás: ennek során a víruskapszid szétesik. Ez vagy virális enzimek hatására történik vagy egyszerűen alkotóelemei szétválnak - ennek elindítója lehet az alacsony pH is, amikor az endocitózis után az endoszóma belső környezete savassá válik. A végeredmény, hogy a genom bekerül a sejt citoplazmájába.
Replikáció: ha már házon belül van, a vírus szaporodása (a (+) RNS-vírusok kivételével) azzal kezdődik, hogy a „korai” génjeiről mRNS-t ír át, ezek termékei segítik a genom lemásolását. A fertőzés későbbi szakaszában a vírusnukleinsav nagy mennyiségben történő másolása és a kapszidot felépítő struktúrproteinek gyártása zajlik.
Összeszerelés: a vírusrészecskék alkotóelemekből való összeállása után sok esetben még utólagos módosításokra, „érésre” van szükség. A HIV esetében ez már csak azután történik, amikor a vírus elhagyta a sejtet.[87]
Kijutás: a legtöbb vírus a sejt elpusztulása, lízise után jut ki a külvilágba, miután a sejtmembrán (és esetleg a sejtfal) szétesett. Egyes fajok DNS-e az úgynevezett lizogén stádiumban beilleszkedik a sejt kromoszómájába, és sokáig inaktív maradhat; ilyenkor provírusnak vagy (fág esetében) profágnak hívjuk.[88] Ha sejt osztódik, ugyanúgy lemásolja a vírusgenomot is. Egy idő múlva a provírus aktiválódik, elindítja késői génjeit és befejezi szaporodási ciklusát, amely végén a gazdasejt jellemzően elpusztul.[89] A lipidburokkal rendelkező vírusok (mint pl. a HIV) a sejtmembránon áthaladva „bimbózással” szabadulnak ki, aminek során magukkal viszik a membrán egy darabját. Ez a fajta kiszabadulás nem feltétlenül végzetes a gazdasejtre nézve.[90]
A genom másolása a különböző fajokban eltérő módon megy végbe.
- DNS-vírusok
- a legtöbb DNS-vírus a sejtmagban másolja le genetikai anyagát, aminek oka az, hogy itt találhatóak a sejt saját másolóenzimjei és transzkripciós mechanizmusa. Ehhez a genomnak megfelelő szignállal kell rendelkeznie, hogy a magpórusokon keresztül bejuthasson a magba. A baktériumoknak nincs magja, így ott ez a fázis elmarad.[91] A nagyobb, sok gént kódoló vírusok azonban saját DNS-másoló enzimekkel is rendelkezhetnek, ilyenek például a poxvírusok. Ezek a sejt citoplazmájában replikálódnak.
- RNS-vírusok
- valamennyi RNS-vírus a saját RNS-replikázát használja a másoláshoz, ugyanis a bakteriális és eukarióta sejteknek nincs hosszabb szakaszokat átírni képes RNS-függő RNS-polimeráza.[92] A konkrét replikáció a genom típusától függ (egy- vagy kétszálú, (+) vagy (-) polaritású).
- Reverz transzkripciós vírusok
- ezek vagy egyszálú RNS-t (retrovírusok, Metaviridae, Pseudoviridae) vagy kétszálú DNS-t (Caulimoviridae és Hepadnaviridae) tartalmaznak. Az első csoport először DNS-sé írja át a génjeit, amelyről aztán nagy mennyiségből új RNS-kópiák készülnek; a második csoport egy RNS-intermedieren keresztül másolja genomját. Mindkét típus a reverz transzkriptáz enzimet használja, amely RNS-templátról készít DNS-másolatot. A retrovírusok az DNS-sé átírt genetikai anyagukat provírus formában beillesztik a gazdasejt kromoszómáiba; a pararetrovírusoknál ez a fázis elmarad, bár a kísérletesen kromoszómába integrált pararetrovírusról is készül fertőzőképes virion.[93] Ezek a kórokozók érzékenyek a reverz transzkriptázt gátló gyógyszerekre, pl. a zidovudinra vagy lamivudinra. Az első csoport ismert képviselője a HIV, míg a második csoporté a hepatitisz B vírusa.[94]
Hatásuk a gazdasejtre
A legtöbb vírus közvetlenül vagy közvetve káros, citopátiás hatást gyakorol a gazdasejtjére, amely sokszor annak pusztulásával jár. A pusztulás oka a sejt lízise, sejtmembránjának megváltozása vagy apoptózis lehet;[95] sok esetben viszont az, hogy a vírusfehérjék meggátolják a normál működést.[96]
Az esetek egy részében a vírus látens marad, a fertőzésnek nincs látható hatása és a sejt normális működésre képes akár hónapokon vagy éveken keresztül.[97] Valójában az emberi genom 1%-át olyan endogén retrovírusok teszik ki, amelyeknek nincs semmilyen látható káros hatásuk és nagy részük a mutációk miatt már képtelen lenne az aktiválódásra.[98]
Egyes vírusok, mint az Epstein–Barr-vírus osztódásra késztetik a gazdasejtet, anélkül hogy az tumorrá fajulna,[99] míg mások (pl. egyes papillómavírus-törzsek) bizonyítottan rákot képesek okozni.[100]
Gazdaszervezetek
Létszámukat tekintve a vírusok messze a leggyakoribb szervezetek a Földön, többen vannak mint a többiek együttvéve.[101] Bármilyen sejtes életformát képesek megfertőzni, állatokat, növényeket, gombákat és baktériumokat is. Az egyes fajok azonban csak limitált számú gazdaszervezet sejtjeibe képesek behatolni, többnyire pedig fajspecifikusak. Ilyen például a feketehimlő vírusa, amely csak egy fajt – az embert – fertőz sikeresen, míg a széles spektrumú fajok képviselője a veszettségvírus.[102] A növénypatogén vírusok teljesen ártalmatlanok az állatokra és az állatok kórokozói az esetek döntő többségében nem tudnak kárt tenni az emberben.[103] Egyes bakteriofágok csak a gazdabaktérium adott törzseiben szaporodóképesek és detektálásukkal nyomon lehet követni a baktériumok által okozott járványokat (fágtipizálás).[104]
Osztályozás
Az első rendszert a vírusok osztályozására 1962-ben dolgozta ki André Lwoff, Robert Horne és Paul Tournier[105] A fajokat saját (és nem gazdaszervezeteik) tulajdonságai alapján a klasszikus Linné-féle taxonómia szerint törzsekbe, osztályokba, rendekbe, családokba stb. sorolták.[106] Az osztályozási rendszer kidolgozását később a Nemzetközi Vírustaxonómiai Bizottság (International Committee on Taxonomy of Viruses, ICTV) vette át. Ők nem alkalmazzák a törzs és osztály kategóriákat, mert a vírusgenomok kis mérete és magas mutációs rátája miatt nem lehetséges megbízhatóan megállapítani a rokonsági fokot a rendek szintje fölött. Ezzel párhuzamosan a Baltimore-féle osztályozás is használatban van.
Az ICTV osztályozás
A jelenleg alkalmazott taxonómiai rendszert az ICTV fejlesztette ki és folyamatosan figyelemmel kíséri, hogy az egyes csoportok egységesek maradjanak. A legkisebb egység a faj, az alfajok, törzsek, izolátumok között nem tesz különbséget. A jelenleg leírt fajok csak kis töredékét teszik ki a ténylegesen létező vírusoknak, még az emberből származó minták esetében is a vírusszekvenciák 20%-a ismeretlen, míg a környezetből (például tengervízből, óceáni üledékből) izolált virális szekvenciák döntő többsége új a tudomány számára.[107]
A taxonómiai rendszer hierarchiája és az elnevezések végződése a következő:
- Rend (-virales)
- Család (-viridae)
- Alcsalád (-virinae)
- Nem (-virus)
- Faj (-virus)
- Nem (-virus)
- Alcsalád (-virinae)
- Család (-viridae)
A 2013-as ICTV taxonómia 7 rendet ismer: a Caudovirales, Herpesvirales, Ligamenvirales, Mononegavirales, Nidovirales, Picornavirales és Tymovirales rendeket. A családok száma 104 (és ebből 78 nincs besorolva rendbe), az alcsaládoké 22, a nemeké 455. 2827 vírusfaj van leírva és több mint 4000 besorolatlan faj vár osztályozásra.[108][109][110]
A Baltimore-rendszer
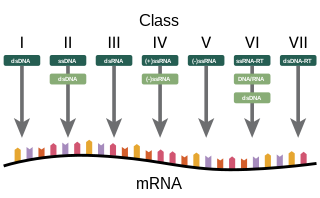
A Nobel-díjas David Baltimore 1971-ben kezdte el a róla elnevezett Baltimore-rendszer kidolgozását,[28][111] amelyet ma az ICTV-taxonómiával párhuzamosan alkalmaznak.[112][113][114]
A rendszer alapja az mRNS szintézisének módja és közvetetten a vírusgenom fajtája. A fajokat hét nagy csoportba sorolja, amelyek a következők:
- I: kettős szálú DNS-vírusok (pl. adenovírusok, herpeszvírusok, poxvírusok)
- II: egyszálú DNS-vírusok ((+)szenzitással, pl. parvovírusok)
- III: kettős szálú RNS-vírusok (pl. reovírusok)
- IV: (+) egyszálú RNS-vírusok (pl. picornavírusok, togavírusok)
- V: (−) egyszálú RNS-vírusok (pl. orthomyxovírusok, rhabdovírusok)
- VI: egyszálú RNS-reverz transzkripciós vírusok (pl. retrovírusok)
- VII: kettős szálú DNS-reverz transzkripciós vírusok (pl. hepadnavírusok)
Például a bárányhimlő kórokozója, a varicella zoster vírus a Herpesvirales rendbe, a Herpesviridae családba, Alphaherpesvirinae alcsaládba, Varicellovirus nembe tartozik; a Baltimore-féle rendszerben pedig a I. csoportba, azon kettős szálú DNS-vírusok közé, amelyek nem használnak reverz transzkripciót.
A vírusfajok elnevezése
A vírusfajok elnevezésére nem érvényesek a kettős nevezéktan szabályai. A vírusok tudományos nevei angol nyelvűek, 2-5 tagúak. Az elnevezések általában tükrözik egyrészt a vírus rendszertani besorolását, az általuk okozott tünetek jellegét, vagy a gazdaszervezeteket.[115] A rendkívül hosszú tudományos nevek használatából adódó nehézségek miatt általánosan elterjedt a vírusnevek rövidítéseinek használata.[116]
Humán kórokozói szerepük

A vírusfertőzés számos emberi megbetegedéshez vezethet, vannak közöttük enyhébbek (nátha, influenza, bárányhimlő, herpesz) és súlyos, akár halálos kimenetelűek is (Ebola, AIDS, madárinfluenza, MERS, SARS, COVID–19). Vannak olyan esetek, ahol a vírus kóroki szerepe még nem tisztázott, mint például a humán herpeszvírus 6 (HHV-6) és sclerosis multiplex vagy a mialgiás encephalomyelitis közötti kapcsolat.[118] Másik példa a lovakat is megfertőző bornavírus (Orthobornavirus), ami feltehetően humán pszichiátriai betegségeket (szkizofrénia) is okozhat.[119]
A kórt okozó mechanizmus eltérő az egyes fajok között, de többnyire összefügg azzal, hogy a vírusszaporodás a gazdasejt pusztulásával jár és ha elég sok sejt elhal, a szervezet megérzi a következményeit. A fertőzés nem jár minden esetben betegséggel. A szájherpeszt okozó herpes simplex vírus éveken keresztül tartózkodhat látens formában a szervezetben, minden tünet nélkül;[120] bár ez általában jellemző a herpeszvírusokra, mint a mononukleózist okozó Epstein-Barr-vírusra vagy a bárányhimlő kórokozójára, a varicella zoster vírusra is. A legtöbb ember átesik valamilyen herpeszvírus-fertőzésen.[121] Azt is megfigyelték, hogy a látens herpeszvírus-fertőzés védelmet nyújt a baktérium okozta megbetegedések, például a pestis ellen.[122]
Egyes vírusok élethosszig tartó, krónikus fertőzést okoznak és kikerülve az immunrendszert folyamatosan szaporodnak.[123] Ilyenek a hepatitisz B és C vírusok; tünetmentes hordozóik is folyamatosan fertőzőképesek.[124]
Epidemiológia
A vírusok a gazdaszervezetből továbbadódhatnak vertikálisan, vagyis anyáról gyermekre (pl. hepatitisz B vírus, HIV[125] vagy a varicella zoster vírus, amely felnőttekre nem jelent komoly veszélyt, de a magzat vagy újszülött halálát is okozhatja)[126] vagy horizontálisan, azaz egyik személyről a másikra. Utóbbi figyelhető meg a vírusfertőzések döntő többsége esetén. A fertőző ágens átadása történhet szexuális aktus során (pl. HIV), vagy vérrel (hepatitisz C), nyállal (Epstein-Barr vírus), elfogyasztott szennyezett étellel vagy vízzel (norovírus); aeroszollal (influenzavírus) vagy vérszívó rovarok közvetítésével (denguevírus). Az átvitel sebessége a népsűrűségtől, fogékony (nem immunis) személyek arányától,[127] az egészségügyi ellátás minőségétől és transzmisszió módját befolyásoló tényezőktől, például az időjárástól függ.[128]

A kórokozó továbbadási módjának ismerete alapvető a fertőzés továbbterjedésének meggátolásában. Optimális esetben a fertőzöttek környezetében élők beoltásával megtörhető a transzmissziós láncolat. Ha vakcina nem áll rendelkezésre, a higiéniás és fertőtlenítési módszerek is hatékonyak lehetnek. A betegeket sok esetben elkülönítik, karanténbe helyezik.[129] Állatokat érintő járványok esetében tömeges vágásokra lehet szükség; 2001-ben az Angliát sújtó száj- és körömfájásjárvány alatt több ezer szarvasmarhát pusztítottak el.[130] A fertőzés szinte minden esetben egy lappangási időszakkal kezdődik, amikor tünetek még nem jelentkeznek; ennek hossza néhány naptól néhány hétig terjed.[131] A lappangási időszakot – sokszor a végével átfedve – az úgynevezett kommunikabilitási szakasz követi, amikor a páciens fertőző és átadja másoknak a betegséget. A járvány leküzdése szempontjából fontos ennek az időtartamának ismerete is.[132] Ha a megbetegedések száma eléri a populáció bizonyos hányadát, járványról lehet beszélni; ha pedig a járvány világméreteket ölt akkor pandémiáról.[133]
Járványok
Az amerikai őslakosok, akik azelőtt soha nem találkoztak ezekkel a kórokozókkal, rendkívül fogékonynak bizonyultak az európai gyarmatosítók által behozott fertőző betegségekkel (mint a feketehimlő) szemben. A járványok áldozatainak számát csak becsülni lehet, de a feltételezések szerint az eredeti lakosság körülbelül 70%-a halt meg. A járványok jelentősen megkönnyítették az európaiaknak, hogy gyarmatosítsák és betelepítsék a földrészt.[134]
Az 1918-ban kezdődő spanyolnátha-járvány a modern kor legsúlyosabb pandémiája volt, melyet az influenza A vírus egy különösen virulens törzse okozott. A betegség áldozatai többnyire egészséges fiatal felnőttek voltak, ellentétben a legtöbb influenzajárvánnyal, amely elsősorban a gyerekeket, időseket és meggyengült szervezetűeket támadja.[135] Régebbi becslések szerint a járvány áldozatainak száma 40-50 millió volt,[136] újabban úgy gondolják, hogy akár 100 millió embert, a világ akkori népességének 5%-át is elpusztíthatta.[137]
A napjainkban is dúló világméretű AIDS-járvány a szubszaharai Afrikából indult a 20. század közepén.[138] A fertőzöttek száma ma meghaladja a 38 milliót[139] és a WHO becslése szerint a járvány 1981-es kirobbanása óta áldozatainak száma már több mint 25 millió.[140] 2007-ben 2,7 millió új fertőzés történt és 2 millióan haltak meg a betegség következtében.[141]
A Filoviridae család egyes tagjai különösen letális betegséget, a vírusos vérzéses lázat okozzák. Közéjük tartozik a Marburg-vírus és az ebolát okozó vírus. Az elsőt 1967-ben fedezték fel és 2005-ben okozott helyi járványt Angolában,[142] míg az 1976-ban leírt ebolavírus több alkalommal is feltűnt, utoljára 2013-ban Nyugat-Afrikában.[143]
Onkogén vírusok
Egyes vírusok képesek rákot okozni a gazdaszervezetben. Ezek a fajok többféle osztályból származnak, lehetnek DNS- vagy RNS-vírusok, nincs különálló rákkeltő víruscsoport. A tumor kialakulását több tényező is befolyásolja, a virális géneken kívül az immunrendszer és gazdasejt mutációi is.[144][145] A bizonyítottan onkogén vírusok közé tartozik a humán papillomavírus, a hepatitisz B vírus, a hepatitisz C vírus, az Epstein–Barr vírus, a humán herpeszvírus 8 és a humán T-limfotróp vírus. A hepatitiszvírusok esetében a májtumor kialakulásának oka a folyamatos sejtpusztulás és a sejtek állandó osztódása, amely meggyorsítja a mutációk fellépését.[146][147] A humán T-limfotróp vírus T-sejtes leukémiát,[148] a papillómavírusok pedig a méhnyak, végbélnyílás és a pénisz nyálkahártyájának tumoros elfajulását idézhetik elő.[149] A humán herpeszvírus 8 a Kaposi-szarkómáért felelős (másik neve Kaposi-szarkómát kísérő herpeszvírus), az Epstein-Barr vírus pedig a Burkitt-limfómáért és Hodgkin-limfómáért, és garatrákot is okoz.[150]
Viszonylag új felfedezés a 2008-ban leírt Merkel-sejt poliómavírus, ami egy ritka bőrtumor okozója.[151] Ennek rokonságába tartozik az SV40 majomvírus és az egér poliómavírus, amelyek 50 éve szolgálnak a virális tumorképződés modelljeiül.[152]
Az immunrendszer és a vírusok

A szervezet első védekezési vonala a patogénekkel szemben a veleszületett immunrendszer, ez azonban csak általában ismeri fel a kórokozókat, nem specifikus és nem biztosít hosszútávú immunitást.[154]
A sejten belüli vírusvédelmi mechanizmusok egy érdekes példája az RNS-interferencia.[155] Ez a rendszer a kettős szálú RNS-eket ismeri fel (mivel a sejt maga nem használ ilyeneket, csak bizonyos vírusok), kisebb darabokra vágja, majd a darabokat felhasználja, hogy a későbbiekben felismerje és lebontsa a hasonló szekvenciákat. A rotavírusoknak azonban már sikerült kikerülniük ezt a védelmet; a sejten belül RNS-ük a csak félig széteső kapszidban marad.[156][157] A megfertőzött sejtek beindíthatják a programozott sejthalál, az apoptózis folyamatát is.[158]
A fejlettebb állatok adaptív immunrendszerrel rendelkeznek, amely a vírussal való találkozás után speciális ellenanyagokat termel, amelyek a virionhoz tapadva meggátolják a fertőzést. Ez az úgynevezett humorális immunitás. Az ellenanyagok egyik típusát, az immunoglobulin M-et (IgM) a szervezet csak a fertőzés kezdetén, néhány hétig termeli. Egy másik fajta, az immunoglobulin G (IgG) termelődése csak később indul be, de évekig, akár élethosszig megmarad és véd a későbbi fertőzésektől. Az IgM jelenléte a vérben akut fertőzésre utal, míg az IgG-é azt jelenti, hogy valamikor régen a szervezet már találkozott az adott kórokozóval.[159]
Ha az ellenanyagokat kötött vírusnak sikerül bejutnia a sejtbe, akkor a belső védekezőrendszer aktiválódik. A citoplazmában található a TRIM21 fehérje, amely a víruskötött ellenanyagokhoz kapcsolódik és beindítja a sejt fehérjebontó mechanizmusát, a proteoszómát.[160]

A humorális immunválaszon kívül létezik a fehérvérsejtek (T-sejtek) által működtetett celluláris immunitás is. A szervezet sejtjei fehérjéik kis darabjait, antigénjeit, folyamatosan prezentálják a felszínükön, és ha a T-sejtek vírusgyanús proteint találnak rajtuk, a killer T-sejtek elpusztítják őket.[161] A fertőzött sejtek interferont kezdenek termelni, ami aktiválja az immunrendszert és stimulálja a környező sejtek antivirális rendszereit, közöttük az antigénprezentációt.[162]
A vírusok is kifejlesztették az immunrendszert megkerülő vagy hatástalanító módszereiket. Hírhedt példája ennek a HIV, amely magas mutációs rátájával folyamatosan változtatja külső fehérjéit. A túlélési stratégiák közé tartozik a latencia (hosszabb ideig tartó inaktivitás), a genetikai rekombináció vagy genomszegmens cserélése; vagy blokkolhatják az antigénprezentációt, a citokinek hatásmechanizmusát, a killer limfociták hatását és az apoptózist.[163] Egyes vírusok az idegrendszer sejtjeibe bújnak el, ahol az immunrendszer nem képes elérni őket.
Megelőzés és kezelés
A vírusok a gazdaszervezet saját rendszereit használják a szaporodásukhoz, azért az ellenük használt gyógyszerek komoly toxikus hatásokat okoznának. Általában vagy vakcinákat alkalmaznak a fertőzések megelőzésére, vagy a vírusok saját proteinjei ellen tervezett szelektív antivirális szereket használnak a kezelés során.
Vakcinák
Az oltás olcsó és hatékony módja lehet a fertőzés megelőzésének. Már azelőtt alkalmazták őket, hogy magukat a kórokozókat felismerték volna. A lakosság beoltása drámai módon lecsökkentette a gyermekbénulás, kanyaró, mumpsz vagy rózsahimlő előfordulását,[164] a feketehimlőt pedig teljesen kiirtotta.[165] A vakcinák legyengített kórokozót vagy annak tisztított proteinjeit, antigénjeit tartalmazzák, amelyek beindítják az ellenanyag-termelést és a tényleges fertőzést az immunrendszer már csírájában képes elfojtani.[166] Teljes vírust tartalmazó oltóanyagok beadása veszélyes lehet gyenge immunrendszerű páciensek esetén, mert esetleg kialakulhat az eredeti betegség.[167] Újabban biotechnológiai és molekuláris klónozási módszerekkel csak a vírusproteint állítják elő. Az így készült vakcina (például a hepatitisz B ellen) ebből a szempontból teljesen biztonságos.[168][169]
Antivirális gyógyszerek
A gyorsan szaporodó, nukleinsavaikat állandóan szintetizáló vírusok ellen gyakran nukleozidanalógokat (módosított DNS-alegységeket) adnak gyógyszerként, amelyek beépülnek a másolódó genomba, de utána az enzimek nem tudják folytatni a DNS-láncot és a replikáció leáll.[170] Ilyen a herpes simplex vírus ellen alkalmazott aciklovir vagy a HIV és hepatitisz B elleni lamivudin. Az aciklovir az egyik legrégebbi és leggyakrabban felírt antivirális gyógyszer.[171] A gyógyszerek a vírus életciklusához szükséges fontos enzimeket is blokkolhatják, ilyenek például a HIV ellen adott proteáz-inhibitorok.
A krónikus hepatitisz C ellen hatékony a nukleozidanalóg ribavirin és interferon kombinációja,[172] a hepatitisz B kezelésre pedig lamivudint alkalmaznak.[173]
Egyéb gazdaszervezetek
Állatok
A vírusok a haszonállatok számos megbetegedését okozhatják; ilyen a száj- és körömfájás, az afrikai sertéspestis,[174] az enterovírus okozta fertőző sertésbénulás vagy a hólyagos betegség. Az encefalomiokarditisz alapvetően egy kardiovírus miatt kialakuló rágcsálókór, ám az ürülékük révén háziállatok (főleg a sertés), az ember, sőt akár elefántok is megkaphatják a betegséget. A szúnyogok által terjesztett afrikai lópestist időnként Európába is behurcolják (akár fertőzött zebrák révén). A baromfiak betegsége a birnavírus okozta fertőző bursitis, a reovírus okozta, ízületproblémákkal járó fertőző tenoszinovitisz vagy a kacsa vírusos májgyulladása.[175]
Megemlítendő a közel-keleti légúti koronavírus, amely tevékben enyhe vagy közepesen súlyos légúti tüneteket okoz, az emberekben viszont akár halálos kimenetelű fertőzéssel jár.[176]
A házikedvencként tartott kutyáknak, macskáknak is megvannak a vírusos megbetegedéseik, régóta ismert a kanyaróvírussal rokon morbillivírus okozta szopornyica, vagy az emberre is veszélyes veszettség. A kutya parvovírus-infekció a kölyökkutyák elhullásáért lehet felelős.[177] Az infekciók nem csak a gerincesekre, hanem a rovarokra is végzetesek lehetnek, a házi méh számos betegségét vírusok okozzák,[178] például tömlős költésrothadás[179] és deformált szárny vírus.[180]
Növények

A haszonnövények legtöbb vírusos betegsége nem végzetes a növényre nézve és csak terméscsökkenéssel jár. Mivel a növényi sejteket sejtfal védi a behatolás ellen, a vírusokat többnyire valamilyen sérülést okozó vektor: rovar, fonálféreg, gomba, egysejtű terjeszti. Az infekció elleni védekezés is elsősorban a vektorok irtására és az alternatív gazdaszervezetként használt gyomok elpusztítására korlátozódik.[181] A növényi vírusok állatokat vagy az embert nem képesek megbetegíteni,[182] de léteznek növényvírusok, melyek rovarokban is képesek szaporodni (pl. rhabdovirus fajok).[183]
Becslések szerint a gabonafélék esetében 1-2%-os terméscsökkenést okoznak a vírusos betegségek. Más haszonnövényeknél a kár jóval nagyobb lehet, pl. a trópusi manióka termésének akár 30-40%-át is elviheti a maniókamozaik, a citrusfélék tristeza betegsége pedig tízmilliószámra pusztította el a fákat Dél- és Közép-Amerikában, sőt Európában is. A burgonyát legalább 37 vírusfaj (az Y, M és S-burgonyavírus, burgonya levélsodró vírus, stb.) képes megbetegíteni, akár felére csökkentve a termést. Kelet-Európában főleg az M és S burgonyavírusok károsítanak. A paradicsom molytetvek által terjesztett sárga levélsodródását egy geminivírus okozza és szintén komoly (20-100%) gazdasági veszteségekkel járhat. A csonthéjas gyümölcsök termésének minőségromlásának és lehullásának kórokozója a Magyarországon is elterjedt szilvahimlő-vírus.[184]
A növények is védekeznek a fertőzések ellen. Vírusinfekció esetén aktiválódnak az ún. rezisztenciagénjeik (R-gének) amelyek elpusztítják a környező sejteket és az infekció nem képes továbbterjedni. Ezeket a régiókat barna foltként szabad szemmel is lehet látni.[185] Az állatokhoz hasonlóan ők is használják az RNS-interferenciát.[186] A növények antivirális anyagokat is termelnek, mint szalicilsavat, nitrogén-monoxidot és reaktív oxigénszármazékokat.[187]
Baktériumok
A bakteriofágok a vírusok nagy és változatos csoportja, melynek képviselői nagy mennyiségben fordulnak elő a környezetben. A tengervízben tízszer annyi található belőlük, mint baktériumból,[188] számuk elérheti a milliliterenkénti 250 milliót.[189] A fágok specifikusan az adott fajta mikroorganizmust támadják meg; a fertőzés többnyire a sejt pusztulásával jár, akár már húsz perc elteltével is.[190]
A baktériumok úgy védekeznek, hogy lebontják a citoplazmájukba jutott idegen DNS-t. A saját nukleinsavaikat metilációval megjelölik, azt a DNS-t pedig, amelyen ezt nem találják, a restrikciós enzimek szétvágják.[191] Adaptív immunválaszra is képesek: az úgynevezett CRISPR DNS-szekvenciák segítségével megőrzik az idegen DNS-darabokat és a későbbi infekció során ezeket használják a kórokozó korai felismerésére és semlegesítésére.[192][193]
Ősbaktériumok
Az archeákban szaporodó kettős szálú DNS-vírusok különleges, a többiektől eltérő morfológiájukkal tűnnek ki.[4][68] Leginkább a termofil Sulfolobales és Thermoproteales rendekbe tartozó baktériumok parazitáit kutatták.[194] Az archeák ismert védekezési módjai az RNS-interferencia és a vírusgénekhez hasonló, repetitív DNS-szakaszok alkalmazása.[195][196]
Evolúciós szerepük
A vírusok – elsősorban azok a fajok, amelyek beépülnek a gazda genomjába és kiszakadva belőle időnként magukkal visznek belőle egy darabot – fontos szerepet játszanak az evolúcióban azzal, hogy lehetővé teszik a fajok közötti géncserét, az úgynevezett horizontális géntranszfert.[6] Egyes elméletek szerint fontos szerepet játszottak az élet korai szakaszában, mielőtt a baktériumok, archeák és eukarióták elváltak volna egymástól.[197]
Felhasználásuk
Kutatás és orvostudomány

A vírusok a molekuláris és sejtbiológiai kutatások fontos eszközei.[198] Mint a legegyszerűbb önálló biológiai rendszereken rajtuk tanulmányozták a gének működését és a fehérjeszintézist, segítségükkel értették meg a DNS-replikáció, transzkripció, transzláció, sejten belüli fehérjetranszport és sok más folyamat működését.
A molekuláris biológiában és génsebészetben gyakran vírusokat használnak vektorként, vagyis olyan eszközként, amellyel idegen DNS-t lehet bejuttatni egy sejtbe. Ezáltal új géneket lehet bejuttatni a genomba és transzgénikus élőlények állíthatók elő. Az orvostudományban genetikailag módosított vírusok általi viroterápiával is próbálkoznak a rák gyógyításában vagy a genetikai betegségek esetében a génterápia eszközeként. Melanóma ellen jó eredményeket értek el egy olyan módosított herpeszvírussal, amely képtelen egészséges sejtekben szaporodni, a tumorsejtekkel szemben pedig immunválaszt indukál és sejtpusztulást idéz elő.[199]
Régebben, az antibiotikumok elterjedése előtt fágterápiával is próbálkoztak a bakteriális fertőzések leküzdésében és ha az antibiotikumrezisztenciák tovább terjednek, elképzelhető, hogy vissza kell nyúlnunk a régi módszerekhez.[200] A biotechnológiai ipar is használ vírusvektorokat, hogy a transzgénikus baktériumokkal vakcina-antigéneket, ellenanyagokat, fehérjealapú gyógyszereket termeljenek.[201]
Biológiai fegyverek
A vírusok pusztító járványokat képesek okozni, ezt a tulajdonságukat már régóta kihasználják a háborúkban és konfliktusokban. Az amerikai telepesekről feljegyezték, hogy szándékosan adták oda az indiánoknak a fekete himlőben elhunyt betegek takaróit.[202] Miután az 1970-es években sikeresen kiirtották a fekete himlőt, csak két vírusmintát hagytak meg, egyet az akkori Szovjetunióban, a másikat pedig az Egyesült Államokban. A Szovjetunió felbomlása után aggodalmak merültek fel, hogy az orosz minták terroristák kezébe kerülhetnek és a himlő ellen már nem oltott népességben halálos járvány szabadulhat el.[203]
Jegyzetek
Források
Fordítás
További információk
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
