ברזל
יסוד כימי בעל המספר האטומי 26 מוויקיפדיה, האנציקלופדיה החופשית
ברזל (בלטינית: Ferrum) הוא יסוד כימי מתכתי שסמלו הכימי Fe ומספרו האטומי 26.
| קובלט - ברזל - מנגן | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| נתונים בסיסיים | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| מספר אטומי | 26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| סמל כימי | Fe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| סדרה כימית | מתכות מעבר | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מראה | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מתכת מבריקה בגווני אפרפר וכסף | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| תכונות אטומיות | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| משקל אטומי | 55.845 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| סידור אלקטרונים ברמות אנרגיה | 2, 8, 14, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| קונפיגורציה אלקטרונית | [Ar] 3d⁶ 4s² | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| דרגות חמצון | 2, 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| תכונות פיזיקליות | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| צפיפות | 7,874 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מצב צבירה בטמפ' החדר | מוצק | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| נקודת רתיחה | 3,134.15K (2,861°C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| נקודת התכה | 1,811.15K (1,538°C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| לחץ אדים | 7.05Pa ב-1,808K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מהירות הקול | 4,910 מטר לשנייה ב-293.15K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מגנטיות | פרומגנטיות | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| שונות | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| אלקטרושליליות | 1.83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| קיבול חום סגולי | 440 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מוליכות חשמלית | 9.93 106/m·Ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מוליכות חום | 80.2 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| אנרגיית יינון ראשונה | 762.5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| היסטוריה | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| תאריך גילוי | האלף ה־5 לפנה״ס? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ברזל הוא היסוד העיקרי בהרכב כדור הארץ מבחינת מסה, והרביעי בהרכב קרום כדור הארץ. יש לו שימושים רבים בתרבות האנושית עוד מתקופות פרהיסטוריות. שיטות להפקת ברזל ועיבודו התפתחו בעיקר החל מהמאה ה-19 והביאו לפיתוח התעשייה הכבדה, בה הברזל הוא היסוד המופק בכמות הרבה ביותר. בתרבות המודרנית ברזל הוא מרכיב עיקרי בבנייה ובייצור מכונות, כלים ומוצרי צריכה רבים.
הברזל הוא החומר הפרומגנטי הראשון שזוהה, ותכונה זו קרויה על שמו. תכונה זו גורמת לברזל להימשך אל קוטבי מגנט ומאפשרת יצירת מגנטים מברזל.
בבעלי חיים, הברזל הוא מינרל קורט החיוני לבניית התרכובת האורגנית הם, אשר מאפשרת נשיאת חמצן על ידי תאי דם אדומים. כמו כן הברזל משמש בשמירת החמצן בתוך רקמת תא בתוך מיוגלובין.
מחסור בברזל בתזונה יכול לגרום לאנמיה ועייפות,[1] לפגיעה בחוש הטעם, וכן לפגיעה בבריאות המנטלית.[2]
בטבע
סכם
פרספקטיבה
הברזל מיוצר כחלק מתהליך נוקליאוסינתזה כוכבית – היתוך גרעיני בכוכבים בעלי מסה גבוהה, והוא היסוד היציב הכבד ביותר והאחרון המיוצר בתהליך זה. בליבה של כוכבים אלה נוצרות כמויות גדולות של ברזל, יחד עם ניקל ויסודות קלים יותר. כוכבים שעברו פיצוץ סופרנובה פיזרו את הברזל שבליבתם ברחבי היקום, וזה מקורו של כל הברזל הקיים מחוץ לשמשות (בכוכבי לכת, אסטרואידים וגופים קטנים יותר). ברזל הוא היסוד השישי הנפוץ ביותר ביקום.[3]
ברזל הוא היסוד המתכתי הנפוץ ביותר בכדור הארץ (כ-5% ממסת קרום כדור הארץ, כ-32% ממסת כדור הארץ הכוללת). בקרום כדור הארץ הוא נמצא כמעט תמיד בצורת תרכובות כמו המטיט (Fe2O3), מגנטיט (Fe3O4) וטקוניט. ברזל במצב מתכתי נמצא על פני כדור הארץ בכמויות קטנות שמקורן במטאוריטים (בסגסוגת עם ניקל). ההנחה המקובלת בגאופיזיקה היא כי ליבת כדור הארץ וכוכבי הלכת הדומים לו מורכבת מסגסוגת דומה.
ברזל מופיע בטבע בארבעה איזוטופים:
- 54Fe (5.845%, אולי רדיואקטיבי עם מחצית חיים מעל 3.1×1022 שנים)
- 56Fe (91.754%, יציב)
- 57Fe (2.119%, יציב)
- 58Fe (0.282%, יציב)
כמו כן ידועים 24 איזוטופים רדיואקטיביים, רובם בעלי זמן מחצית חיים קצר (חלקיקי שנייה עד שנים בודדות) ולכן אינם מצויים בטבע. רק לאיזוטופ 60Fe זמן מחצית חיים ארוך יחסית, כ-2.6 מיליון שנה. איזוטופ זה נוצר בתהליך המתרחש רק במהלך סופרנובה, ומתפרק ל-60Ni, איזוטופ יציב של ניקל. קיומו של 60Ni בשיעור גדול מהצפוי באסטרואידים מצביע על כך שההרכב הראשוני של מערכת השמש כלל שיעור ניכר של 60Fe, ומכך ניתן להסיק כי נוצרה מכוכבים קדומים יותר.
בתעשייה
סכם
פרספקטיבה

הפקה
ברזל ממוצה מעפרותיו (בעיקר המטיט ומגנטיט) כשהוא מחומם עם פחמן בכבשן לטמפרטורה של 2,000 מעלות צלזיוס. לכבשן מוכנס אוויר חם ברציפות ומתרחשת התגובה:
הפחמן החד-חמצני מגיב עם המטיט (או מקור ברזל אחר) כך:
בשנת 2000 הופקו כ-1,100 מיליון טון עפרות ברזל בשווי 25 מיליארד דולר. חמש המפיקות הגדולות ביותר של עפרות ברזל הן סין, ברזיל, אוסטרליה, רוסיה והודו.
מוצרי תעשיית הברזל
- ברזל גולמי (Pig Iron) מכיל בין 5%-4% פחמן וכמויות משתנות של זיהומים כגון גופרית, צורן וזרחן. לברזל זה תכונות ביניים של מחצב ברזל, ברזל יציקה ופלדה.
- ברזל יציקה (יצקת) (Cast Iron) מכיל 3.5%-2% פחמן וכמויות קטנות של מנגן. זיהומים כמו בברזל גולמי מסולקים ממנו על מנת למנוע פגיעה בתכונותיו. טמפרטורת ההיתוך שלו נעה בין 1,147–1,197 מעלות צלזיוס.
- פלדה (Carbon Steel) שמכילה בין 0.5% ל-1.5% פחמן, עם כמויות קטנות של מנגן, גופרית, זרחן וצורן.
- ברזל חשיל (Wrought Iron) מכיל פחות מ-0.5% פחמן. סגסוגת זו רכה, ניתנת לריקוע ויוצרה במיוחד עבור נפחים.
סגסוגות ברזל מכילות לעיתים חומרים כמו כרום, ניקל, מוליבדן, ונדיום טונגסטן ועוד לקבלת תכונות רצויות.
שימושים
ברזל הוא המתכת השימושית ביותר לאדם (95% מכלל המתכת שמופקת בעולם). המחיר הנמוך ורמת הקשיחות הגבוהה הופכים אותו לחומר מקובל מאוד בבניית מכוניות, אוניות, בניינים וכדומה. שימושים נוספים של ברזל:
- מוטות ורשתות ברזל (פלדה) משולבים בתוך יציקות בטון ליצירת בטון מזוין, שלו עמידות גבוהה בפני מאמצים. בטון מזוין הוא חומר עיקרי בבניה של מבנים גדולים בכל העולם, ובישראל הוא משמש גם לבניית בתי מגורים. מחיר הברזל הוא מרכיב עיקרי בעלות הבניה של מבנים אלה.
- ברזל הוא מרכיב עיקרי בהתקנים חשמליים המשתמשים בשדות מגנטיים, כגון מנועים, שנאים, גנרטורים ואלקטרומגנטים.
- צבענים מבוססי תחמוצות ברזל נפוצים מאוד בצבעים תעשייתיים, צבעי אמנות ואיפור מינרלי, ממקור סינתטי או טבעי. הצבענים אינם רעילים ונוחים לשימוש, ועל כן נפוצים מאוד. לדוגמה אומברה שרופה, או שחור מאדים.
תכונות
סכם
פרספקטיבה
לברזל מבנה גבישי קובייתי ממורכז גוף או קובייתי ממורכז פאה. ברזל טהור שאינו מעורב בפחמן הוא חומר רך וקל לריקוע, אולם אפילו כמות קטנה של פחמן (אשר מעורב בברזל בתהליך הפקתו) גורמת עליה ניכרת בחוזק ובקשיות. סגסוגת של ברזל ופחמן ביחסים שונים (הקרויות פלדה) מאפשרות קבלת שילובים שונים של חוזק, גמישות וקשיות.
ברזל בטמפרטורות נמוכות מ-770 מעלות צלזיוס הוא חומר פרומגנטי – הוא נמשך לקטבים של מגנט ויכול להתמגנט בעצמו. בנוכחות שדה מגנטי חיצוני, נוצר בתוך ברזל שדה מגנטי פנימי חזק יותר. תכונה זו שימושית לבניית אלקטרומגנטים ושנאים, בהם השדה המגנטי מוכל ברובו בתוך ליבת ברזל המעוצבת בצורה הרצויה.
ברזל מגיב עם חמצן, בעיקר בנוכחות מים, בתהליך שיתוך (קורוזיה) היוצר תערובת של תרכובות ברזל המוכרת בשם חלודה. בניגוד למתכות אחרות שהתחמוצות שלהן יוצרות שכבת מגן (פסיבציה) העוצרת את תהליך השיתוך, חלודה היא רכה יותר ובעלת צפיפות נמוכה יותר מהברזל ממנו היא נוצרת. כתוצאה מכך החלודה נוטה לפרק את הברזל ולהתקלף ממנו, תוך חשיפת שכבה חדשה של ברזל לחמצן ולמים, כך שתהליך החלודה יכול להמשיך ואף להתגבר, עד להפיכת כל הברזל לתחמוצת. ניתן לעכב את התפשטות החלודה על ידי צביעה בצבע אטום למים, או ציפוי במתכת אחרת כגון אבץ (תהליך הקרוי גלוון מאפשר יצירת שכבה אחידה של ציפוי). בסגסוגת של פלדה עם כרום (פלדת אל-חלד המוכרת גם בשם המסחרי נירוסטה) מתאפשרת פסיבציה המונעת החלדה של הברזל.
יוני ברזל
סכם
פרספקטיבה
קיימות ארבע צורות (מצבי חמצון) של יוני ברזל:
- Fe+2: מכונה כיום ברזל (II); באנגלית כונה בעבר Ferrous, ובעברית: קט-ברזל.
- Fe+3: מכונה כיום ברזל (III); באנגלית כונה בעבר Ferric, ובעברית: רב-ברזל.
- Fe+4: מכונה כיום ברזל (IV); באנגלית כונה בעבר Ferryl. צורה זו פחות שכיחה מהקודמות.
- Fe+6: מכונה כיום ברזל (VI); באנגלית כונה בעבר Ferrate. צורה זו נדירה מאוד.
על מנת להבין מדוע הצורות ברזל (II) ו-ברזל (III) הן הצורות היציבות יותר יש צורך להסתכל על קונפגורציית האלקטרונים באורביטלות היון. הברזל במצבו הנייטרלי הוא בעל 26 אלקטרונים הפרוסים על פני האורביטלות בקונפיגורציה של: . כאשר מייננים אטום, האלקטרונים נלקחים מהרמה הגבוהה ביותר.[4] במקרה זה מארוביטלת 4s. לכן קונפיגורציה בה אין בכלל רמה 4 היא יציבה יחסית. במצב של ברזל II בדיוק שני אלקטרונים נלקחים ומתירים את רמה 4 ריקה. במקרה של ברזל III האורביטלים לא רק שרמה 4 מבוטלת אלא גם יש בדיוק מילוי של חצי מאורביטלת d. דבר המקנה גם הוא יציבות יחסית.
הברזל נוטה ליצור קשרים יוניים עם אל-מתכות וקשרים מתכתיים עם מתכות ויכול ליצור קשר קוולנטי בצורת יון מורכב.
הברזל ביצורים חיים
סכם
פרספקטיבה
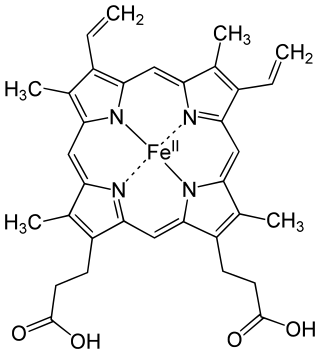
לברזל חשיבות עליונה בביולוגיה; הוא חומר חיוני לרוב היצורים החיים. הברזל נמצא בעיקר באתר הפעיל של כמה אנזימים וחלבונים חשובים כמרכיב בתרכובת האורגנית הם.
בבעלי חיים נמצא הברזל בהמוגלובין, החלבון נושא החמצן בכדוריות הדם האדומות אשר בדם ובמיוגלובין הנושא חמצן מהדם לשרירים. החמצן הנקלט בריאות נקשר באופן ישיר אל אטום הברזל, ומועבר באמצעות הדם אל כל תאי הגוף. חוסר ברזל בגוף (עקב תזונה לקויה או מחלה) עלול לגרום לאנמיה. בכל היצורים האווירניים מצוי הברזל במרכזו של החלבון ציטוכרום, חלבון מרכזי בתהליך הנשימה התאית. לברזל חשיבות גם למחזור התא, להפיכה של ריבונוקלאוטידים (המרכיב את ה-RNA) לדאוקסיריבונוקלאוטיד (המרכיב את ה-DNA).[5]
בגוף האדם הבוגר יש בין ארבעה לחמישה גרם של ברזל. כ-65 אחוזים בהמוגלובין, 4–5 אחוזים במיוגלובין, כאחוז אחד במרכיבים שונים של חמצון תוך-תאי, כעשירית האחוז מחובר לחלבון טרנספרין וכ־15–30 אחוזים מאוכסנים בתאי כבד ובמערכת הרטיקולואנדותלית. ברזל מאוחסן בתאים בפריטין או בהמוסידרין (Hemosiderin).
תזונה
ברזל הוא מרכיב תזונה חשוב לגוף, כמות נמוכה מדי של ברזל גורמת לאנמיה – ירידה בכמות ההמוגלובין בתאי הדם האדומים, כמו גם לירידה במספר תאי הדם האדומים. דבר זה מוביל לירידת כמות החמצן שמגיע לרקמות בגוף ולתפקוד פחות טוב של רקמות אלה. גם כמות גדולה מדי של ברזל עלולה להיות מסוכנת לבריאות.
בממוצע, הכמות היומית המומלצת לגבר בוגר היא 8.7 מיליגרם ולאישה בגיל הפוריות 14.8 מיליגרם. נשים בתקופת הפוריות צריכות כמות גדולה יותר של ברזל מגברים, משום שהן מאבדות דם בווסת.
הברזל מצוי במזונות צמחיים ובמזונות שמקורם בבעלי חיים.
במזונות מן הצומח מצוי הברזל בקטניות, כמו שעועית, אפונה, פול, חמצה, עדשים; מוצרי סויה (כמו טופו, חלב סויה ועוד), אגוזים, טחינה, ברוקולי, אבוקדו, פירות יבשים; קינואה, דבשה, בורגול ושמרי בירה; ומזון מדגנים מלאים כמו לחם מלא.
במזונות מן החי מצוי הברזל בבשר אדום, בדגים, ובבשר עוף. כבד הוא מקור עשיר לברזל.
קפה ותה מכילים תרכובות פוליפנול שעלולות להקשות על ספיגת הברזל בגוף, לכן מומלץ למי שחושש ממחסור בברזל להימנע משתייתם בזמן הארוחה או עד חצי שעה לאחריה. ויטמין C מסייע לגוף לספוג ברזל, ולכן אכילת ירקות כמו כרוב ניצנים, פטרוזיליה, ברוקולי, פלפל או כרוב הקלח בזמן הארוחה או אכילת פירות כמו תפוז, תות שדה או פפאיה לקינוח עשויות לסייע לספיגת הברזל בגוף.
מחסור בברזל
 ערך מורחב – אנמיה מחוסר ברזל
ערך מורחב – אנמיה מחוסר ברזל
מחסור בברזל יכול לגרום לתופעות כגון נשירת שיער, שבירת ציפורניים, עייפות, דיכאון, חרדה ועוד.
מעת לעת במסגרת מעקב רפואי יישלח מטופל לביצוע בדיקות דם, ובנוסף לרמות ההמוגלובין, ייבדקו גם רמות ה-iron (ברזל זמין), פריטין וטראנספרין (Transferrin, מאגרי הברזל ויכולת ניודו).
תורמי דם נמצאים בסיכון מיוחד של רמות ברזל נמוכות בדם. לכן מתבצעת בדיקת המוגלובין למבקשים לתרום דם. רמת ההמוגלובין צריכה להיות לפחות 12 גרם לדציליטר לאישה, ו-13 גרם לדציליטר לגבר. אם הרמה נמוכה יותר, לא לוקחים תרומת דם מאותו אדם.
עודף ברזל
קליטת ברזל בגוף מווסתת בדרך כלל בזמן העיכול. לגוף אין תהליך לפליטת ברזל ולכן הדרך לוויסות כמות הברזל בגוף היא בקרה על קליטתו.
עודף ברזל בגוף יכול לגרום למחלות כמו המוכרומטוזיס שבה כמות רבה של ברזל נאגרת באיברים. תופעה זו עלולה להתרחש אצל אנשים שבקרת קליטת הברזל שלהם אינה תקינה, בדרך כלל כתוצאה מפגם גנטי תורשתי. מעריכים ששכיחות התופעה היא כ-0.3% עד 0.5% מהאוכלוסייה אצל אנשים לבנים. לכן עדיף להימנע מנטילת תוספי מזון המכילים ברזל ללא המלצת רופא.
היסטוריה
פרק זה לוקה בחסר. אנא תרמו לוויקיפדיה והשלימו אותו. ייתכן שתמצאו פירוט בדף השיחה. גילוי הברזל (מטאוריטים), אזכורים בתנ"ך.
תקופת הברזל החלה לפני כשלושת אלפים שנה, כשהאדם גילה את הברזל ותכונותיו. הוא השתמש בברזל לייצור כלים שונים (כמו חוד של חנית) ומאוחר יותר למד להפיק פלדה, שהיא סגסוגת של ברזל ופחמן (אחוז הפחמן 0.02%–2.06%) ולפעמים עם מתכות שונות נוספות, כגון כרום או ניקל.

בהודו השתמשו בברזל כבר בשנת 2500 לפנה"ס. סדרת הפסלים המפורסמת "אשוקה פילאר" ליד דלהי עשויה מברזל נקי למדי (98%) שלא החליד או נשחק עד היום. בין השנים 3000–2000 לפנה"ס, גדלו מספר החפצים העשויים ברזל (המקור ככל הנראה בברזל ממטאור) במסופוטמיה, השימושים היו טקסיים וברזל היה מתכת יקרה מאוד, אפילו יותר מזהב. באיליאדה, מתואר שכלי נשק היו עשויים מארד, אבל השתמשו במטילי ברזל בסחר. מספר מקורות מציעים שברזל היה מופק באותו זמן כתוצר נלווה לזיקוק נחושת.
בין השנים 1600–1200 לפנה"ס, גבר השימוש בברזל במזרח התיכון אבל הוא לא החליף את הארד. בין המאה ה-12 לפנה"ס למאה ה-10 לפנה"ס הייתה מגמה להחליף כלי ארד לכלי ברזל במזרח התיכון. באותו זמן התגלתה טכניקת הפחמון (או קרבוניזציה, שבה מעלים את אחוז הפחמן במתכת) שבעזרתה אנשי המזרח התיכון ייצרו ברזל חזק בהרבה ופחות שביר.
בתרבות
הברזל משמש סמל לכוח עקב שימושו הרב ככלי נשק ובתעשייה הכבדה.
טריאתלון איש הברזל הוא תחרות ספורט הדורשת כושר גופני גבוה מאוד ונחשבת לתובענית במיוחד.
איירון מן ("איש הברזל" באנגלית) הוא דמות של גיבור-על שהוא ממציא, מהנדס ותעשיין עשיר החמוש בחליפת שריון טכנולוגית מתקדמת.
בישראל ידועה מערכת ההגנה האווירית כיפת ברזל. מספר עוצבות שריון מכילות "ברזל" או "פלדה" בשמן, הידועה שבהן היא עוצבת עקבות הברזל (חטיבה 401) שהייתה הראשונה להצטייד בטנק מרכבה סימן 4.
ראו גם
קישורים חיצוניים
- ברזל, באתר אנציקלופדיה בריטניקה (באנגלית)
- אמיר רובין, על חשיבות הברזל בפעילות גופנית, באתר איירון סיינס, 27 ביוני 2020
- ברזל ב-Webelements (באנגלית)
- ברזל בספרייה הווירטואלית של מט"ח (בעברית)
- שי שמש, ברזל מכוכב אחר, באתר מדע גדול, בקטנה, 18 בדצמבר 2017
 ברזל, דף שער בספרייה הלאומית
ברזל, דף שער בספרייה הלאומית
הערות שוליים
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



![{\displaystyle [1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}]4s^{2}3d^{6}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/89d6c00b9edc34342fc7176d41d8184b30a134f6)