Receptor de tipo Toll
clase de proteínas From Wikipedia, the free encyclopedia
Os receptores de tipo Toll, similares a Toll ou Toll-like receptors (TLRs) son unha clase de proteínas que xogan un papel fundamental no funcionamento do sistema inmunitario innato e do aparato dixestivo. Son receptores simples non catalíticos, situados na membrana celular abranguendo todo o grosor da mesma, e que recoñecen moléculas estruturalmente conservadas pertencentes a microbios. Unha vez que estes microbios conseguen penetrar as barreiras físicas como a pel e a mucosa do tracto intestinal, son recoñecidas polos TLRs, que activan as respostas das células inmunitarias.

Reciben o seu nome da súa semellanza coa proteína codificada polo xene Toll identificado en Drosophila en 1985 por Christiane Nüsslein-Volhard.[1] Cando ese xene está mutado as moscas Drosophila teñen un aspecto estraño. A palabra Toll procede do idioma alemán e significa 'fantástico'.[2]
Diversidade
Os receptores de tipo Toll son un tipo de receptor de recoñecemento de padrón (PRR) que recoñece moléculas que son moi comúns en gran número de patóxenos (pero que se distinguen ben das moléculas do hóspede), denominadas en conxunto padróns moleculares asociados a patóxenos (PAMPs). Os TLRs xunto cos receptores da interleucina-1 forman unha superfamilia de receptores, coñecida como "superfamilia receptor da interleucina-1/receptor de tipo Toll"; na cal todos os seus membros teñen en común un dominio TIR (Toll-IL-1 receptor).
Existen tres grupos de dominios TIR. As proteínas con dominios TIR do subgrupo 1 son receptores das interleucinas que son producidos polos macrófagos, monocitos, e células dendríticas e todos teñen dominios de inmunoglobulina (Ig) extracelulares. As proteínas con dominios TIR do subgrupo 2 son os TLRs clásicos, e únense directa ou indirectamente a moléculas de orixe microbiana. Un terceiro subgrupo de proteínas que conteñen dominios TIR son as proteínas adaptadoras, que son exclusivamente citosólicas, e median a sinalización realizada polas proteínas dos subgrupos 1 e 2.
Os TLRs están presentes en vertebrados e invertebrados. Os compoñentes cos que están feitos os TLRs están representados nas bacterias e plantas, e sábese que os receptores de recoñecemento de padrón de plantas se requiren para a defensa do hóspede contra as infeccións. Os TLRs parecen ser un dos compoñentes máis antigos e conservados do sistema inmunitario.
Nos últimos anos identificáronse TLRs tamén no sistema nervioso de mamíferos. Os membros da familia TLR detectáronse na glía, nas neuronas e nas células proxenitoras neurais, nas cales regulan o destino celular.[3]
Descubrimento
Cando se descubriu que os microbios eran a causa das doenzas infecciosas, fíxose evidente que os organismos pluricelulares tiñan que poder recoñecelos cando eran infectados e, por tanto, tiñan que poder recoñecer as moléculas microbianas. Unha gran cantidade de literatura, publicada durante todo o século XX, trata sobre as investigacións das moléculas destes ligandos e os seus receptores. Hai máis de 100 anos, Richard Pfeiffer, un estudante de Robert Koch, acuñou o termo "endotoxina" para describir unha substancia producida por bacterias gramnegativas que podían causar febre e choque en animais experimentais. Nas décadas seguintes, a endotoxina foi caracterizada quimicamente e identificada como un lipopolisacárido (LPS) producido pola maioría das bacterias gramnegativas. Outras moléculas (lipopéptidos bacterianos, flaxelina, e o ADN non metilado) viuse que provocaban respostas no hóspede, que normalmente eran protectoras. Porén, estas respostas poden ser prexudiciais se son excesivamente prolongadas ou intensas. Por lóxica, debía de haber receptores para esas moléculas, coa capacidade de alertar ao hóspede da presenza da infección, pero non se puideron descubrir durante moitos anos.
Os receptores de tipo Toll cóntanse hoxe entre as moléculas chave que alertan ao sistema inmunitario da presenza de infeccións microbianas. Denomináronse Toll pola súa similitude co receptor codificado no xene Toll identificado en Drosophila melanogaster, e que se coñecía inicialmente pola súa función no desenvolvemento dese organismo. En 1996, Jules A. Hoffmann e os seus colegas atoparon que Toll tiña un papel esencial na inmunidade da mosca da froita ás infeccións fúnxicas,[4] papel que desempeñaba ao activar a síntese de péptidos antimicrobianos. Pamela Ronald atopou homólogos en plantas en 1995 (arroz XA21)[5] e Thomas Boller en 2000 (Arabidopsis FLS2).[6]
O primeiro receptor de tipo Toll humano describiuno Nomura e os seus colegas en 1994,[7] e foi mapeado nun cromosoma por Taguchi e colegas en 1996.[8] Como a función inmune de Toll en Drosophila non se coñecía entón, asumiuse que o TIL, como lle chamaban daquela (hoxe coñecido como TLR1), podería participar no desenvolvemento dos mamíferos. Porén, en 1991 (antes do descubrimento do TIL) observouse que unha molécula cunha clara función inmunitaria nos mamíferos, o receptor da interleucina-1 (IL-1), tamén tiña homoloxía co Toll de drosófila, xa que as porcións citoplasmáticas de ambas as moléculas eran similares.[9]
En 1997, Charles Janeway e Ruslan Medzhitov mostraron que un receptor de tipo Toll agora coñecido como TLR4, podía, se era ligado artificialmente a anticorpos, inducir a activación de certos xenes necesarios para iniciar unha resposta inmunitaria adaptativa.[10] TLR 4 funciona como un receptor sensible ao LPS e foi descuberto por Bruce A. Beutler e os seus colegas.[11] Estes investigadores utilizaron a clonación posicional para probar que os ratos que non podían responder ao LPS tiñan mutacións que anulaban a función do TLR4. Isto identificou o TLR4 como un dos compoñentes chave do receptor do LPS.
Á súa vez, elimináronse os outros xenes TLR nos ratos, principalmente no laboratorio de Shizuo Akira e os seus colegas. Agora crese que cada TLR detecta un determinado conxunto de moléculas de orixe microbiana, e indica a presenza dunha infección.
En 2011, os doutores Beutler e Hoffmann foron galardoados co Premio Nobel de Medicina e Fisioloxía polo seu traballo neste eido.[12]. Os doutores Hoffmann e Akira recibiron o Canada Gairdner International Award en 2011.[13]
Familia ampliada
Estímase que a maioría das especies de mamíferos teñen entre dez e quince tipos de receptores de tipo Toll. Identificáronse trece TLRs (nomeados desde o TLR1 ao TLR13) nos humanos e ratos, e formas equivalentes de moitos deles atopáronse noutras especies de mamíferos.[14][15][16] Porén, non en todos os mamíferos se encontran equivalentes de certos TLR atopados en humanos. Por exemplo, un xene que codifica un análogo proteico do TLR10 en humanos está presente nos ratos, pero parece que foi danado nalgún momento do pasado evolutivo por un retrovirus. Por outra parte, os ratos expresan os TLRs 11, 12, e 13, ningún dos cales está presente na especie humana. Outros mamíferos poden expresar TLRs que non aparecen nos humanos. Outras especies non mamíferas poden ter TLRs diferentes aos dos mamíferos, como o TLR14, atopado nos peixes tetraodóntidos do xénero Takifugu.[17] Isto pode complicar o uso de animais experimentais como modelos da inmunidade innata humana.
Ligandos
A causa da especificidade dos receptores de tipo Toll (e doutros receptores da inmunidade innata) estes non poden sufrir cambios facilmente no decurso da evolución, xa que estes receptores recoñecen moléculas que están constantemente asociadas con diversos perigos para o organismo (como patóxenos ou estrés celular) e son moi específicos contra esas ameazas (por exemplo, non poden confundirse con moléculas propias). As moléculas asociadas aos patóxenos que cumpren estes requirimentos son xeralmente fundamentais para o funcionamento dos patóxenos e non poden eliminarse ou cambiar por mutación, polo que se di que están evolutivamente conservadas. Características ben conservadas nos patóxenos son: os lipopolisacáridos (LPS) da superficie bacteriana, lipoproteínas, lipopéptidos, e lipoarabinomananos; proteínas como a flaxelina dos flaxelos bacterianos; ARN de dobre cadea de virus; ou as illas non metiladas CpG do ADN de bacterias e virus; e outros ARN e ADN. Para a maioría dos TLRs, a especificidade no recoñecemento do ligando xa foi ben establecida pola técnica do knockout de xenes: unha técnica pola cal un determinado xene pode ser suprimido selectivamente nos ratos (rato knockout).[18][19] Véxase a táboa de máis abaixo para un resumo dos ligandos de TLR coñecidos.
Ligandos endóxenos
A resposta inflamatoria típica provocada pola activación dos receptores de tipo Toll motivou a especulación de que os activadores endóxenos de tipo Toll poderían participar en respostas autoinmunes. Sospeitouse que os TLRs se unían a moléculas do hóspede como o fibrinóxeno (implicado na coagulación do sangue) e proteínas de choque térmico (HSPs) e ao ADN do hóspede.
Sinalización
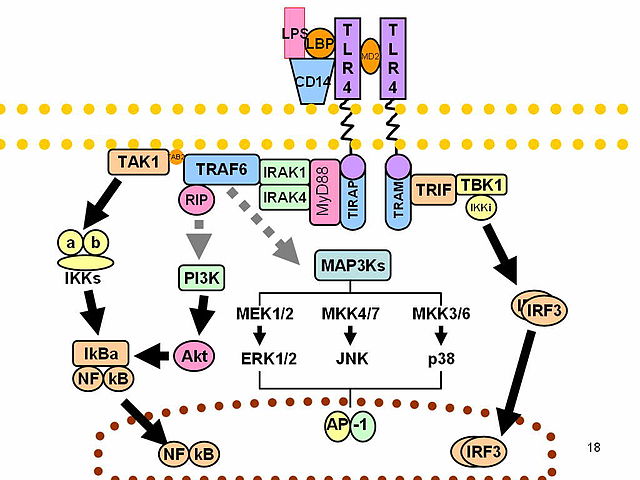
Crese que os TLRs funcionan como dímeros. Aínda que a maioría dos TLRs parecen funcionar como heterodímeros, o TLR2 forma heterodímeros con TLR1 ou TLR6, e cada dímero ten unha especificidade de ligando diferente. Os TLRs poden tamén depender doutros correceptores para teren unha sensibilidade completa ao ligando, como no caso do recoñecemento polo TLR4 do LPS, o cal require MD-2. O CD14 e a proteína de unión ao LPS (LBP) sábese que facilitan a a presentación do LPS ao MD-2.
As proteínas adaptadoras e as quinases que median a sinalización dos TLR tamén foron estudadas. Ademais, utilizouse a mutaxénese aleatoria da liña xerminal con ENU para descifrar as vías de sinalización dos TLR. Cando son activados, os TLRs recrutan moléculas adaptadoras no citoplasma das células para propagar o sinal. Coñécense catro moléculas adaptadoras que están implicadas na sinalización. Estas proteínas coñécense como MyD88, Tirap (tamén chamada Mal), Trif, e Tram.[20][21][22]
A sinalización que realizan os TLR comprende dúas vías distintas de sinalización, a vía dependente de MyD88 e a vía dependente de TRIF. A resposta dependente de MyD88 prodúcese na dimerización do receptor TLR, e utilízase por todos os TLR agás o TLR3. O seu efecto principal é a activación do NF-κB. A unión do ligando e o cambio conformacional que ocorre no receptor recruta a proteína adaptadora MyD88, que é membro da familia TIR. A MyD88 despois recruta a IRAK 4, IRAK1 e IRAK2. As quinases IRAK despois fosforilan e activan á proteína TRAF6, que á súa vez poliubiquitina a proteína TAK1 e a si mesma para facilitar a unión de IKKβ. Ao unirse, a TAK1 fosforila o IKKβ, que despois fosforila a IκB causando a súa degradación e permitindo que NF-κB difunda ao núcleo da célula e active a transcrición.[23]
Tanto o TRL3 coma o TRL4 utilizan a vía dependente de TRIF, que é desencadeada polo ARN bicatenario e o LPS, respectivamente. Para o TRL3, o ARN bicatenario causa a activación do receptor, recrutando o adaptador TRIF. O TRIF activa as quinases TBK1 e RIP1, as cales forman unha ramificación na vía de sinalización. O complexo de sinalización TRIF/TBK1 fosforila o IRF3, o que permite a súa translocación ao núcleo e a produción de interferóns de tipo I. Mentres, a activación do RIP1 causa a poliubiquitinación e activación do TAK1 e a transcrición de NF-κB da mesma maneira ca a vía dependente de MyD88.[23]
A sinalización dos TLRs orixina finalmente a indución ou supresión de xenes que orquestran a resposta inflamatoria. En total, a sinalización dos TLRs activa miles de xenes, e en conxunto os TLRs constitúen unha das vías máis pleiotrópicas, aínda que estritamente reguladas, da modulación xénica.
Sumario dos TLRs de mamífero coñecidos
Os receptores de tipo Toll únense e son activados por diferentes ligandos, os cales. á súa vez, están localizados en diferentes organismos ou estruturas. Teñen tamén diferentes adaptadores para responder á activación e están localizados algunhas veces na superficie celular e outras nos compartimentos celulares internos. Ademais, tamén os expresan diversos tipos de leucocitos ou outros tipos celulares.
| Receptor | Ligando(s)[24] | Localización do ligando[24] | Adaptadores | Localización | Tipos de células [24] |
|---|---|---|---|---|---|
| TLR 1 | múltiples triacil lipopéptidos | Bacterias | MyD88/MAL | superficie celular |
|
| TLR 2 | múltiples glicolípidos | Bacterias | MyD88/MAL | superficie celular | |
| múltiples lipopéptidos | Bacterias | ||||
| múltiples lipoproteínas | Bacterias | ||||
| ácido lipoteicoico | Bacterias grampositivas | ||||
| HSP70 | células hóspedes | ||||
| cimosano (zymosan), un beta-glucano | Fungos | ||||
| Moitos outros | |||||
| TLR 3 | ARN bicatenario, poli I:C | virus | TRIF | compartimento celular |
|
| TLR 4 | lipopolisacáridos | bacterias gramnegativas | MyD88/MAL/TRIF/TRAM | superficie celular | |
| varias proteínas de choque térmico | Bacterias e células hóspede | ||||
| fibrinóxeno | células hóspede | ||||
| fragmentos de heparán sulfato | células hóspede | ||||
| fragmentos de ácido hialurónico | células hóspede | ||||
| níquel | |||||
| Varias drogas opioides | |||||
| TLR 5 | flaxelina | Bacterias | MyD88 | superficie celular |
|
| TLR 6 | múltiples diacil lipopéptidos | Micoplasma | MyD88/MAL | superficie celular |
|
| TLR 7 | imidazoquinolina | pequenos compostos sintéticos | MyD88 | compartimento celular |
|
| loxoribina (un análogo da guanosina) | |||||
| bropirimina | |||||
| ARN monocatenario | |||||
| TLR 8 | pequenos compostos sintéticos; ARN monocatenario | MyD88 | compartimento celular |
| |
| TLR 9 | oligodesoxinucleótido CpG non metilado (ADN sintético monocatenario) | Bacterias | MyD88 | compartimento celular |
|
| TLR 10 | descoñecido | descoñecido | ? | ||
| TLR 11 | profilina | Toxoplasma gondii | MyD88 | compartimento celular[27] |
|
| TLR 12 | descoñecido | descoñecido | ? |
| |
| TLR 13 [29] | descoñecido | Virus | MyD88, TAK-1 | compartimento celular |
Activación e efectos
Despois da activación por un ligando de orixe microbiana, son posibles varias reaccións. As células inmunitarias poden producir factores de sinalización chamados citocinas, que desencadean a inflamación. No caso dun factor bacteriano, o patóxeno pode ser fagocitado e dixerido, e os seus antíxenos presentados aos células T colaboradoradoras (CD4+). No caso dun factor viral, a célula infectada pode parar a súa síntese de proteínas e pode sufrir unha morte celular programada (apoptose). As células inmunitarias que detectaron o virus poden tamén liberar factores antivirais como os interferóns.
O descubrimento dos receptores de tipo Toll supuxo identificar finalmente os receptores inmunitarios innatos que eran responsables de moitas das funcións inmunitarias innatas que foran estudados durante moitos anos. É interesante salientar que os TLRs parecen estar implicados só na produción de citocinas e na activación celular en resposta aos microbios, e non xogan un papel significativo na adhesión e a fagocitose de microorganismos.
Schmidt et al. demostraron que o TLR4 está implicado no desenvolvemento da alerxia de contacto ao níquel en humanos.[30] Ao unirse a dúas histidinas non conservadas, a H456 e a H458, o Ni2+ crea enlaces entre os dous monómeros receptores, TLR4 e MD2, desencadeando a formación dun dímero que lembra estruturalmente o inducido polo lipopolisacárido. Ese dímero, á súa vez, activa as cascadas de transdución do sinal proinflamatorio intracelular.
Said et al. atoparon que os ligandos de TLR causan a inhibición da expansión e funcionamento das células T CD4+ dependentes de IL-10 ao sobrerregularen os niveis de PD-1 nos monocitos, o que orixina a produción de IL-10 polos monocitos despois da unión do PD-1 e PD-L.[31]
Os receptores de tipo Toll son unha importante conexión entre a inmunidade innata e a adaptativa debido á súa presenza en células dendríticas. Os TLRs 3 e 4 están presentes na superficie de monocitos derivados de células dendríticas e utilizan a vía dependente de Myd88 para producir as interleucinas 12 e 18, as cales fan que as células T virxes maduren en células T colaboladoras de tipo 1. Estes TLRs tamén utilizan a vía do TIRF para sobrerregular proteínas coestimuladoras, as cales axudan á diferenciación das células T. Os TLRs 7 e 9 están presentes nos endosomas das células dendríticas plasmocitoides. Estas proteínas só utilizan a vía dependente de Myd88 para producir interleucinas para a maduración de células T virxes en células T colaboradoras de tipo 1.
Evelyn A. Kurt-Jones et al. tamén demostraron o papel dos TLR4s na resposta inmune innata ao virus respiratorio sincicial. A produción de citocinas acrecéntase ao expoñer monocitos humanos a dito virus. Despois de aplicar a técnica do knockout a CD14 (coactivador de TLR4), esta resposta diminuía significativamente, como tamén as respostas dos ratos C3H/HeJ, unha cepa de ratos con respostas inmunitarias reducidas, e dos ratos deficientes en TLR4.
Interaccións con drogas
Os fármacos Imiquimod (usado en dermatoloxía), e o seu sucesor resiquimod, son ligandos do TLR7 e TLR8.[32]
O eritoran, análogo do lípido A, actúa como antagonista do TLR4, e está desenvolvéndose como fármaco contra a sepse grave.[33]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.