NF-κB
complexo proteico que controla a transcrición do ADN From Wikipedia, the free encyclopedia
O NF-κB ou factor nuclear potenciador das cadeas lixeiras kappa das células B activadas (κ aquí é a letra grega kappa) é un complexo proteico que controla a transcrición do ADN. O NF-κB encóntrase na maioría de tipos de células animais e está implicado na resposta celular ante estímulos como o estrés, as citocinas, radiación ultravioleta, LDL oxidadas e antíxenos bacterianos ou virais.[1][2][3][4][5] O NF-κB xoga un papel chave na regulación da resposta inmune debida á infección (as cadeas lixeiras kappa son compoñentes cruciais das inmunoglobulinas). A regulación defectuosa do NF-κB está relacionada co cancro, enfermidades inflamatorias e autoinmunes, choque séptico, infeccións virais ou un desenvolvemento inmune inadecuado. Tamén está implicado en procesos de plasticidade sináptica e de memoria.[6][7][8][9][10]


Descubrimento
O NF-κB descubriuse no laboratorio polo gañador do premio Nobel David Baltimore por medio da súa interacción cunha secuencia de 11 pares de bases do amplificador (enhancer) do xene da cadea lixeira da inmunoglobulina nas células B.[11]
Estrutura
Todas as proteínas da familia dos NF-κB comparten un dominio de homoloxía Rel no seu extremo N-terminal. Unha subfamilia de proteínas NF-κB, entre as que están a RelA, RelB e c-Rel, teñen un dominio de transactivación no seu extremo C-terminal. Polo contrario, as proteínas NF-κB1 e NF-κB2 son sintetizadas como precursores, p105 e p100, que tras madurar dan lugar ás subunidades do NF-κB, p50 e p52 respectivamente. A maduración de p105 e p100 está mediada pola vía ubiquitina/proteasoma e implica a degradación selectiva do extremo C-terminal da rexión que contén repeticións de anquirina. Mentres que a formación de p52 a partir de p100 é un proceso altamente regulado, a p50 fórmase polo procesamento constitutivo da p105.[12][13]
Membros da familia proteica
Os membros da familia do NF-κB comparten estrutura homóloga coa oncoproteína retroviral v-Rel, o que fai que se clasifiquen como proteínas NF-κB/Rel.[1]
En mamíferos existen 5 membros da familia NF-κB:[14]
| Clase | Proteína | Alias | Xene |
|---|---|---|---|
| I | NF-κB1 | p105 → p50 | NFKB1 |
| NF-κB2 | p100 → p52 | NFKB2 | |
| II | RelA | p65 | RELA |
| RelB | RELB | ||
| c-Rel | REL |
Distribución nas especies e evolución
Ademais de en mamíferos, o NF-κB encóntrase tamén en animais máis sinxelos.[15] Entre eles os cnidarios (como as anemones de mar, o coral ou a hidra), poríferos (esponxas), o parasito unicelular eucariota Capsaspora owczarzaki e insectos (como couzas, mosquitos e moscas da froita). A secuenciación dos xenomas dos mosquitos Aedes aegypti e Aedes gambiae, e a mosca da froita Drosophila melanogaster permitiu realizar estudos comparativos xenéticos e evolutivos sobre o NF-κB. Nestas especies de insectos, a activación do NF-κB está provocada pola vía Toll (que evolucionou de forma independente en insectos e mamíferos) e pola vía Imd (inmunodeficiencia).[16]
Sinalización
Activación

O NF-κB é relevante na regulación da resposta celular, xa que pertence á categoría dos factores de transcrición primarios de “acción rápida”, que son os factores de transcrición que están presentes nas células nun estado de inactivación e que non requiren unha nova síntese de proteínas para seren activados (outros membros desta familia inclúen factores de transcrición como c-Jun, STATs, e receptores nucleares hormonais). Isto permite ao NF-κB ser a primeira resposta a estímulos celulares nocivos. Os indutores da actividade do NF-κB son moi diversos, e poden ser especies reactivas do osíxeno (ROS), o factor de necrose tumoral alfa (TNF-α), a interleucina 1-beta (IL-1β), os lipopolisacáridos bacterianos (LPS), o isoproterenol, a cocaína e mesmo radiacións ionizantes.[18]
O receptor activador do factor nuclear kappa B (RANK), que é un tipo de TNFR, é un activador central do NF-κB. A osteoprotexerina (OPG), que é un receptor chamariz homólogo para o ligando RANK, inhibe RANK uníndose a RANKL, e así, a osteoprotexerina está estreitamente relacionada coa regulación da activación de NF-κB.[19]
Moitos produtos bacterianos e a estimulación dunha gran variedade de receptores da superficie celular inducen a activación de NF-κB, e tamén cambios rápidos na expresión xénica.[1] A identificación de receptores de tipo Toll (TLRs) como patróns específicos de recoñecemento molecular, e o descubrimento de que a estimulación de TLRs leva á activación do NF-κB, mellorou a comprensión de como os diferentes patóxenos poden chegar a activar NF-κB. Por exemplo, diversos estudos identificaron o TLR4 como un receptor para o compoñente LPS das bacterias gramnegativas.[20] Os TLRs son reguladores esenciais tanto das respostas inmunes innatas coma das adaptativas.[21]
A diferenza de RelA, RelB, e c-Rel, as subunidades p50 e p52 do NF-κB non conteñen dominios de transactivación nas súas metades C-terminais. Porén, a p50 e p52 do NF-κB xogan un papel importante modulando a especificidade da función de NF-κB. Aínda que os homodímeros de p50 e p52 son, en xeral, represores da transcrición do sitio κB, ambos os dous (p50 e p52) participan na transactivación de xenes diana formando heterodímeros con RelA, RelB, ou c-Rel.[22] Ademais, os homodímeros p50 e p52 tamén se unen á proteína nuclear Bcl-3, e ditos complexos poden funcionar como activadores transcripcionais.[23][24][25]
Inhibición
En células non estimuladas, os dímeros de NF-κB son secuestrados no citoplasma por unha familia de inhibidores, chamados IκBs (inhibidores de κB), os cales son proteínas que conteñen múltiples copias dunha determinada secuencia, chamadas “repeticións de anquirina”. Con estes dominios, as proteínas IκB enmascaran a secuencia de localización nuclear (NLS) das proteínas NF-κB e mantéñenas secuestradas nun estado de inactivación no citoplasma.[26]
As IκBs forman unha familia de proteínas relacionadas, que teñen un dominio N-terminal regulador, seguido por seis ou máis repeticións de anquirina e un dominio PEST preto do seu extremo C-terminal. Aínda que a familia das IκB consta de IκBα, IκBβ, IκBε, e Bcl-3, a IκB principal e máis estudada é a IκBα. Debido á presenza de repeticións de anquirina nas súas metades C-terminais, p105 e p100 tamén funcionan como proteínas IκB. A metade C-terminal de p100, que a miúdo se denomina IκBδ, tamén funciona como inhibidor.[27][28] A degradación de IκBδ en resposta a estímulos de desenvolvemento, como aqueles transducidos a través de LTβR, potencia a activación do dímero NF-κB a través dunha vía non canónica dependente de NIK.[27][29]
A activación do NF-κB comeza pola degradación inducida por sinal de proteínas IκB. Isto ocorre principalmente mediante a activación dunha quinase chamada IκB quinase (IKK). A IKK está formada por un heterodímero das subunidades catalíticas de IKK alfa e IKK beta e por unha proteína reguladora “mestra” chamada NEMO (modulador esencial do NF-κB) ou IKK gamma. Cando se activa por sinais, normalmente procedentes de fóra da célula, a IκB quinase fosforila dous residuos de serina localizados nun dominio IκB regulador. Unha vez fosforiladas estas serinas (por exemplo, as serinas 32 e 36 na IκBα humana), as moléculas do inhibidor IκB son modificadas por un proceso chamado ubiquitinación, que despois as leva a ser degradadas por unha estrutura celular chamada proteasoma.
Coa degradación de IκB, o complexo NF-κB é libre para entrar no núcleo onde pode activar a expresión dos xenes específicos que teñen preto sitios de unión ao ADN para NFκB. A activación destes xenes por NF-κB entón induce unha resposta fisiolóxica, como por exemplo, unha resposta inflamatoria ou inmune, unha resposta de supervivencia celular, ou unha proliferación celular. NFκB activa a expresión do seu propio represor, IκBα, e este represor IκBα novamente sintetizado reinhibe NFκB e, por tanto, forma un bucle de autorretroalimentación, que provoca niveis oscilatorios de actividade do NFκB.[30] Ademais, varios virus, como o VIH causante da SIDA, posúen sitios de unión para NFκB que controlan a expresión de xenes virais, que á súa vez contribúen á replicación viral ou á patoxenicidade viral. No caso do VIH-1, a activación do NFκB pode verse implicada, polo menos en parte, na activación do virus desde un estado latente e inactivo.[31] O YopP é un factor secretado pola bacteria Yersinia pestis, o axente causante da peste, que impide a ubiquitinazión de IκB. Isto provoca que este axente patóxeno inhiba eficazmente a vía NF- κB e así bloquea a resposta inmune dunha persoa infectada con Yersinia.[32]
Inhibidores da actividade NF-κB
En canto ás proteínas inhibidoras da actividade NF-κB, unha delas, IFRD1, reprime a actividade da p65 de NF-κB por medio da potenciación da desacetilación mediada por HDAC da subunidade p65 na lisina 310, favorecendo o secuestro da HDAC3 en p65. De feito, IFRD1 forma complexos trimoleculares con p65 e HDAC3.[33][34]
Vía non canónica
Un selecto grupo de estímulos de diferenciación celular ou desenvolvemento celular, tales como a linfotoxina-α, BAFF ou RANKL, activan a vía non canónica do NF-κB para inducir a formación do dímero NF-κB/RelB:p52 no núcleo. Nesta vía, a activación da quinase indutora do NF-κB (NIK) por ligación ao receptor induce a fosforilación e o posterior procesamento proteasomal da proteína p100 precursora de NF-κB2 para formar a subunidade p52 madura a través dunha vía dependente de IKK1/IKKa. Despois, a p52 dimeriza con RelB para aparecer como RelB:p52 nuclear con actividade de unión ao ADN e regular unha clase distinta de xenes.[35] A diferenza da sinalización canónica, que depende da degradación de IκBα IκB-β e IκB-ε mediada por NEMO-IKK2, a sinalización non canónica depende do procesamento de p100 para formar p52 mediado por NIK. Tendo en conta as súas diferentes regulacións, pensábase que estas dúas vías eran independentes unha doutra. Porén, recentes análises revelaron que a síntese dos constituíntes da vía non canónica, é dicir RelB e p52, é controlada pola sinalización canónica de IKK2-IκB-RelA:p50.[36] Por outra parte, a xeración dos dímeros tanto canónicos coma non canónicos, é dicir, RelA:p50 e RelB:p52, no medio celular, tamén están relacionadas entre si de maneira mecánica.[36] Estas análises suxiren que un sistema NF-κB integrado leva á activación dos dímeros RelA e RelB e que un mal funcionamento da vía canónica pode dar lugar a unha resposta celular aberrante tamén a través da vía non canónica.
Inmunidade
O NF-κB é un factor de transcrición principal na inmunidade, xa que que regula xenes responsables tanto da resposta innata coma da resposta adaptativa. Por medio da activación dos receptores dos linfocitos T ou B, o factor NF-κB actívase a través de distintos compoñentes de sinalización. Por ligación ao receptor da célula T, a proteína quinase Lck, é recrutada e fosforila os motivos ITAM da cola citoplásmica de CD3. A continuación a molécula ZAP é recrutada nos ITAM fosforilados, o que axuda a recrutar a LAT e PLC gamma, o que causa a activación de PKC. Por medio dunha cascada de eventos de fosforilación, o complexo quinase actívase e o NF-κB pode entrar no núcleo para estimular a expresión de xenes implicados no desenvolvemento, maduración e proliferación das células T.[37]
En neuronas
Ademais das funcións na supervivencia celular, o NF-κB ten diversas funcións no sistema nervioso, como a plasticidade, a aprendizaxe e a memoria neuronal. Ademais dos estímulos que activan o NF-κB noutros tecidos, no sistema nervioso o NF-κB pode ser activado por factores de crecemento (BDNF, NGF) utilizando o glutamato como neurotransmisor.[7] Estes activadores de NF-κB no sistema nervioso converxen no complexo de IKK e na vía canónica.
Recentemente, estase prestando moito interese á función exercida polo NF-κB no sistema nervioso. Os estudos actuais suxiren que o NF-κB é importante para a aprendizaxe e a memoria en múltiples organismos como cangrexos,[9][10] moscas da froita,[38] e ratos.[7][8] O factor NF-κB pode regular a aprendizaxe e a memoria, en parte, pola modulación da plasticidade,[6][39] función sináptica,[38][40][41] así como o crecemento das dendritas[42] e das espiñas dendríticas.[41]
Demostrouse que os xenes que dispoñen de sitios de unión para o NF-κB incrementan a súa expresión despois da aprendizaxe, o que suxire que as dianas transcricionais do NF-κB no sistema nervioso son importantes para a plasticidade. Moitos destes xenes diana de NF-κB importantes para a plasticidade e aprendizaxe son os receptores de glutamato (AMPA e NMDA-R-R),[43][44][45][46] os factores de crecemento (BDNF, NGF),[47] citocinas (TNF-alfa, TNFR),[48] quinases (PKAc),[39] e as proteínas sinápticas (PSD-95).[41]
Importancia clínica
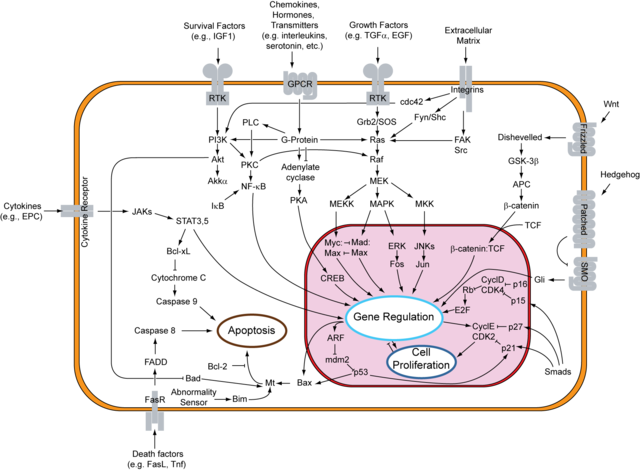
O NF-κB é moi utilizado polas células eucariotas como regulador dos xenes que controlan a proliferación celular e a supervivencia celular. Debido a isto, moitos tipos diferentes de tumores humanos teñen mal regulado o NF-κB (é dicir, activado constitutivamente). Cando o NF-κB está activado, induce a expresión dos xenes que promoven a proliferación celular e protexen á célula, que noutras condicións, debería morrer por apoptose.
Os defectos no NF-κB producen unha maior susceptibilidade á apoptose que leva a que haxa un aumento na morte celular. Isto débese a que o NF-κB regula xenes anti-apoptóticos (sobre todo o TRAF1 TRAF2) e, por tanto, controla a actividade encimática das caspases, que son fundamentais para a maioría dos procesos apoptóticos.[49]
Nas células tumorais o NF-κB actívase debido a mutacións en xenes que codifican os factores de transcrición de NF-κB ou nos xenes que controlan a actividade de NF-κB (por exemplo, xenes IkB) e, ademais, algunhas células tumorais segregan factores que son activadores do NF-κB. O bloqueo do NF-κB pode causar que as células tumorais deixen de proliferar, morran, ou sexan máis sensibles á acción dos axentes anti-tumorais. Polo tanto, o NF-κB está sendo moi investigado polas empresas farmacéuticas para buscar unha terapia contra o cancro.[50]
Debido a que o NF-κB controla varios xenes implicados na inflamación, non é de estrañar que o NF-κB estea activado cronicamente en enfermidades inflamatorias, como a enfermidade inflamatoria intestinal, a artrite, sepse, gastrite, asma e arteriosclerose entre outras.[51] É importante sinalar que os reguladores chave do NF-κB asócianse cunha elevada mortalidade, especialmente en enfermidades cardiovasculares,[52][53] e un incremento da expresión do NF-κB asociouse coa esquizofrenia.[54]
Demostrouse que moitos produtos naturais, incluídos os antioxidantes que teñen actividade anticanceríxena e antiinflamatoria, tamén poden inhibir NF-κB. Hai unha polémica patente no EEUU [55] aplicada ao descubrimento de axentes que poden bloquear o NF-κB con fins terapéuticas. Esta patente está implicada en varios xuízos. Un traballo recente de Karin,[56] Ben-Neriah[57] e outros salientaron a importancia da conexión entre o NF-κB, a inflamación e o cáncer, dando unha maior importancia ás terapias inhibitorias do NF-κB.[58]
Extractos procedentes dun gran número de plantas tamén son inhibidores da activación do NF-κB in vitro.[59]
Terapéutica
Observouse que en moitos cánceres hai unha sobreactivación do factor NF-κB. Por outra parte, a supresión do NF-κB limita a proliferación de células cancerosas. Ademais, NF-κB xoga un papel chave na resposta inflamatoria. Polo tanto, os métodos de inhibición de sinalización de NF-κB teñen grande interese terapéutico en cánceres e enfermidades inflamatorias.[60][61]
A activación da translocación nuclear de NF-κB é independente do aumento de estrés oxidativo,[62] polo que, grazas a isto, pode levarse a cabo un mellor estudo de posibles estratexias para a inhibición do NF-κB.
Un novo medicamento chamado denosumab actúa aumentando a densidade mineral ósea e, por tanto, reducindo as fracturas óseas en moitos pacientes. Inhibe a RANKL, que actúa a través do seu receptor RANK, que á súa vez promove o NF-κB ;[63] o RANKL normalmente funciona permitindo a diferenciación dos osteoclastos a partir de monocitos.
Outros medicamentos son o disulfiram, olmesartán e ditiocarbamatos, que inhiben a cascada de sinalización do factor nuclear κB (NF-κB).[64]
O fármaco Anatabine ten efectos antiinflamatorios, debido á modulación da actividade do factor NF-κB.[65]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
