From Wikipedia, the free encyclopedia
Yersinia pestis (antes chamada Pasteurella pestis) é unha especie de bacterias gramnegativas con forma de bacilo ou cocobacilo, anaerobia facultativa, que pode infectar a humanos e outros animais, e é a causante das pragas de peste dos últimos 1300 anos.[1]
| Yersinia pestis | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
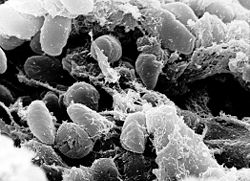 Micrografía electrónica de varrido dunha masa de bacterias Yersinia pestis no intestino anteiror dunha pulga infectada. | |||||||||||||||||
| Clasificación científica | |||||||||||||||||
| |||||||||||||||||
| Nome binomial | |||||||||||||||||
| Yersinia pestis (Lehmann & Neumann, 1896) van Loghem 1944 | |||||||||||||||||
| subespecies | |||||||||||||||||
| |||||||||||||||||
A infección por Y. pestis en humanos pode presentarse de tres formas principais: peste pneumónica, peste septicémica, e peste bubónica.[1] Todas as formas foron responsables de epidemias de grande mortalidade na historia humana, como a Peste de Xustiniano no século VI e a Peste negra que matou a 1/3 da poboación europea no século XIV.[2][3] Pénsase que esas pragas se orixinaron en poboacións de roedores da China.[4][5]
Y. pestis foi descuberta en 1894 por Alexandre Yersin,un médico e bacteriólogo francosuízo do Instituto Pasteur, durante unha peste epidémica en Hong Kong.[6] Yersin era membro da escola de pensamento de Pasteur. Por outra parte, Kitasato Shibasaburō, un bacteriólogo xaponés formado en Alemaña na metodoloxía de Robert Koch, tamén se ocupou naquela época da procura do axente causante da peste.[7] Porén, foi Yersin quen realmente asociou a peste con Yersinia pestis. Orixinalmente a bacteria recibiu o nome de Pasteurella pestis, pero o organismo foi renomeado en 1967 co seu nome actual.
A Organización Mundial da Saúde informa todos os anos de miles de casos de peste, aínda que hoxe cun adecuado e rápido tratamento, o prognóstico das vítimas mellorou moito. Durante a guerra do Vietnam os casos en Asia multiplicáronse por 5 ou por 6, posiblemente debido á destrución dos ecosistemas e a unha maior proximidade entre os homes e os animais. A peste tamén afecta moi prexudicialmente a outros mamíferos (furóns, cans das praderías etc.)
Y. pestis é un bacilo anaerobio facultativo cunha tinguidura bipolar (que lle dá ao aspecto dun imperdible).[8] Similar a outros membros do xénero Yersinia dá negativo na proba de urease, e nas da fermentación da lactosa, e do indol.[9] A especie máis próxima é o patóxeno gastrointestinal Yersinia pseudotuberculosis, e máis afastada está Yersinia enterocolitica.
A secuencia xenómica completa de Y. pestis está dispoñible para dúas das tres subespecies de Y. pestis: cepa KIM (do biovar Medievalis),[10] e cepa CO92 (do biovar Orientalis, obtido dun illado clínico nos Estados Unidos).[11] En 2006, acabouse de completar a secuencia xenómica da cepa do biovar Antiqua.[12] Igual que outras capas patóxenas, hai signos de mutacións de perda de funcións. O cromosoma da capa KIM ten 4.600.755 pares de bases; o cromosoma da cepa CO92 ten 4.653.728 pares de bases. Igual que os seus parentes próximos Y. pseudotuberculosis e Y. enterocolitica, Y. pestis contén o plásmido pCD1. Ademais, contén outros dous plásmidos, o pPCP1 (tamén chamado pPla ou pPst) e o pMT1 (tamén chamado pFra), que non están presentes noutras especies de Yersinia. O plásmido pFra codifica a fosfolipase D que é importante pola capacidade de Y. pestis de ser transmitida por pulgas.[13] O pPla codifica unha protease, Pla, que activa o plasminóxeno nos hóspedes humanos e é un factor de virulencia moi importante na peste pneumónica.[14] Xunto con estes plásmidos e unha illa de patoxenicidade chamada HPI, o xenoma codifica tamén varias proteínas que causan a patoxénese, que son moi características de Y. pestis. Entre outras cousas, estes factores de virulencia son necesarios para a adhesión da bacteria e a inxección de proteínas na célula hóspede, a invasión da bacteria na célula hóspede (por medio do sistema de secreción de tipo III), e para a captación e ligazón do ferro que procede dos glóbulos vermellos (por medio de sideróforos).
Y. pestis pénsase que descende de Y. pseudotuberculosis, da que difire só na presenza de plásmidos de virulencia específicos.
En 2006 fíxose unha análise proteómica exhaustiva e comparativa da cepa KIM de Y. pestis.[15] A análise centrouse no momento da transición ao crecemento similar ao crecemento nas células hóspedes.

Nos ciclos urbanos e forestais (selváicos) de Y. pestis, a maioría das transmisións ocorren entre os roedores e as pulgas. No ciclo selvático, son roedores salvaxes, pero, no ciclo urbano, os roedores son domésticos (viven nas casas). Ademais de polas pulgas, os animais infectados poden transmitir a infección aos humanos a través de contactos co tecido epitelial. Os humanos tamén poden transmitirse entre eles a bacteia por medio de espirros, toses, ou contacto directo co tecido infectado.
Os reservorios de Y. pestis son varias especies de roedores. Nas estepas, as especies reservorio crese que son principalmente as marmotas. En Norteamérica crese que varias especies de roedores son reservorios de Y. pestis. Porén, a dinámica da enfermidade esperada non se observou en ningunha especie de roedor, e sábese que esas poboacións de roedores teñen unha resistencia variable á bacteria, que fai que algúns individuos sexan susceptibles e outros sexan portadores asintomáticos.[16] Hai probas de que as pulgas doutros mamíferos tamén teñen un papel nas epidemias de peste humanas.[17]
Esta falta de coñecementos sobre a dinámica da praga nas especies de mamíferos dáse tamén entre os roedores susceptibles como os cans das praderías de rabo negro (Cynomys ludovicianus), nos cales a praga pode causar o colapso de toda a colonia, causando un efecto masivo na rede trófica da que forman parte.[18] Porén, a dinámica de transmisión nos cans das praderías parece non depender de pulgas co tubo dixestivo obstruído, senón talvez dos cadáveres, pulgas non obstruídas ou outros vectores.[19]
Noutras rexións do mundo, o reservorio da infección non está claramente identificado, o cal complica a prevención e os programas de alerta temperá. Un exemplo é a epidemia de 2003 en Alxeria.[20]
A transmisión de Y. pestis polas pulgas está ben caracterizada.[21] A transmisión inicial de Y. pestis polo vector ocorre durante a súa alimentación. Varias proteínas contribúen ao mantemento da bacteria no tracto dixestivo da pulga, entre elas o sistema de almacenamento de hemina (Hms) e a toxina murina de Yersinia (Ymt).
Aínda que a toxina murina de Yersinia é moi tóxica para os roedores e antes se pensaba que se producía para asegurar a reinfección dos novos hóspedes, o que está demostrado é que a Ymt é importante para a supervivencia de Y. pestis nas pulgas.[13]
O sistema Hms xoga un importante papel na transmisión de Y. pestis ao hóspede mamífero.[22] Mentres que no vector insecto, as proteínas codficadas polos loci xenéticos do Hms inducen a formación de biofilmes no proventriculo, unha válvula que conecta o intestino medio co esófago do insecto.[23] A agregación no biofilme impide a alimentación, xa que se forma unha masa de sangue coagulado inxerido e de bacterias (denominado "bloque de Bacot".[24]) A transmisión de Y. pestis ten lugar durante os inútiles intentos da pulga por alimentarse dun sangue que non poderá tragar. O sangue inxerido é bombeado ao esófago, onde remove algunhas das bacterias que forman o tapón do proventrículo, e o sangue coas bacterias é regurxitado na ferida da picadura do hóspede, e as bacterias pasan ao seu sistema circulatorio. Como as pulgas non se poden alimentar, teñen fame e pican máis frecuentemente.
A patoxénese debida á infección por Y. pestis dos hóspedes mamíferos é producida por varios factores como a capacidade da bacteria de suprimir e evitar as respostas normais do sistema inmunitario, como a fagocitose e a produción de anticorpos. A picada das pulgas permite que a bacteria sobrepase a barreira da pel. Y. pestis expresa o produto do xene yadBC, que é similar ás adhesinas doutras especies de Yersinia, o que facilita a adherencia e invasión das células epiteliais.[25] Y. pestis expresa un activador do plasminóxeno que é un importante factor de virulencia para a peste pneumónica e que podería degradar os coágulos e sangue para facilitar a invasión sistémica.[14] Moitos dos factores de virulencia da bacteria son antifagocíticos. Dous impotantes antíxenos antifagocíticos, chamados F1 (Fracción 1) e V ou LcrV, son importantes para a virulencia.[8] Estes antíxenos prodúceos a bacteria á temperatura corporal humana normal. Ademais, Y. pestis sobrevive e produce os antíxenos F1 e V mentres está no interior de células brancas do sangue como os monocitos, pero non en neutrófilos. A inmunidade natural ou inducida conséguese pola produción de anticorpos opsonizantes específicos contra os antíxenos F1 e V; os anticorpos contra F1 e V inducen a fagocitose por parte dos neutrófilos.[26]
Ademais, o sistema de secreción de tipo III (T3SS) permite que Y. pestis inxecte proteínas nos macrófagos e outras células inmunes. Estas proteínas inxectadas polo T3SS denomínanse Yops (Yersinia Outer Proteins, Proteína Externas de Yersinia) e entre elas está Yop B/D, que forma poros na membrana plasmática do hóspede e foi asociada coa citólise. Inxéctanse no citoplasma da célula hóspede por medio do T3SS as YopO, YopH, YopM, YopT, YopJ, e YopE por poros creados en parte por YopB e YopD.[27] As proteínas Yop inxectadas limitan a fagocitose e as vías de sinalización celular importantes para o sistema inmunitario innato. Ademais, algunhas cepas de Y. pestis son capaces de interferir coa sinalización inmune (por exemplo, ao impediren a liberación dalgunhas citocinas).
Yersinia pestis prolifera no interior dos ganglios linfáticos, onde pode evitar a súa destrución por células inmunitarias como os macrófagos. A capacidade de Y. pestis de inhibir a fagocitose permítelle crecer nos ganglios linfáticos e causar linfadenopatías. YopH é unha proteína tirosina fosfatase que contribúe a esa capacidade de Y. pestis de evadirse da acción das células inmunitarias.[28] Nos macrófagos, YopH desfosforila a p130Cas, Fyb (proteína de unión a Fyn) SKAP-HOM e Pyk, unha tirosina quinase homóloga de FAK. YopH tamén se une á subunidade p85 da fosfoinosítido 3-quinase, a Gab1, ás proteínas adaptadoras Gab2, e ao factor de intercambio do nucleótido guanina Vav.
YopE funciona como proteína activadora da GTPase para membros da familia Rho de GTPases como RAC1. YopT é unha cisteína protease que inhibe RhoA ao eliminar o grupo isoprenilo, que é importante para a localización da proteína na membrana plasmática. Propúxose que YopE e YopT poderían funcionar limitando a citólise inducida por YopB/D.[29] Isto podería limitar o función de YopB/D de crear os poros usados para a inserción de Yop nas células hóspedes e impedir a rotura inducida por YopB/D das células hóspede e que se libere o contido celular, o cal atraería e estimularía as respostas inmunitarias.
YopJ é unha acetiltransferase que se une a unha hélice alfa conservada das quinases MAPK.[30] YopJ acetila as quinases MAPK en residuos de serinas e treoninas que normalmente se fosforilan durante a activación da cascada das quinases MAP.[31][32] YopJ actívase nas células eucariotas pola interacción co ácido fítico (IP6) da célula diana.[33] Esta distorsión da actividade das proteína quinases da célula hóspede causa a apoptose dos macrófagos, e propúxose que é importante para o establecemento da infección e para a evasión da acción do sistema inmunitario. YopO é unha proteína quinase tamén coñecida como proteína quinase A de Yersinia (YpkA). YopO é un potente indutor da apoptose dos macrófagos humanos.[34]
Non hai vacinas efectivas contra a doenza. Téñense utilizado algunhas vacinas de escasa efectividade e que podían causar graves inflamacións, como a vacina inactivada con formol, que xa non se usa. Estanse facendo experimentos con técnicas de enxeñaria xenética de vacinas baseadas nos antíxenos F1 e V e parecen prometedores. Porén, as bacterias que carecen do antíxeno F1 seguen sendo virulentas, e os antíxenos V son suficientemente variables como para que unha vacina composta deles non sexa totalmente protectora.[35][36][37]
A peste pneumónica pode producirse por inhalación de aerosois coa bacteria (primaria) ou esta pode chegar aos pulmóns desde o sangue (secundaria). Como a bacteria se transporta polo sangue, poden verse afectados varios órganos, como o bazo e o cerebro. A infección difusa pode causar unha cascada inmunolóxica que dea lugar a unha coagulación intravascular diseminada, que á súa vez produce hemorraxias e necrose na pel e tecidos. Unha infección diseminada dese tipo incrementa a mortalidade ao 22%. A pneumonía progresa en de 2 a 4 días e se non se iniciou un tratamento temperán os pacientes poden morrer en só 36 horas.
Coa excepción dos bubóns, os síntomas iniciais da peste son moi similares ao de moitas outras enfermidades, o que fai difícil o diagnóstico.[39]
Códigos ICD-9 da OMS para as enfermidades causadas por Y. pestis:
A tinguidura de Gram pode confirmar a presenza de bacilos gramnegativos, e nalgúns casos a identificación de formas de dobre curvatura. Unha proba serolóxica anti-F1 pode diferenciar as diferentes especies de Yersinia, e a reacción en cadea da polimerase (PCR) pode utilizarse para identificar a Y. pestis.
A proteína H da fibra da cola do bacteriófago fago de Yersinia L-413C permite a diferenciación entre Y. pestis e Y. pseudotuberculosis.[40]
O tratamento tradicional de primeira liña contra Y. pestis son os antibióticos estreptomicina,[41][42] cloranfenicol, tetraciclina,[43] e as fluoroquinolonas. Hai tamén boas evidencias que apoian o uso de doxiciclina ou xentamicina.[44] Illáronse cepas resistentes, polo que o tratamento debe guiarse polas sensibilidades aos antibióticos sempre que sexa posible. O tratamento antibiótico só é insuficiente para algúns pacientes, que poden tamén requirir apoio circulatorio, respiratorio ou renal.[45]
A mediados do século VI produciuse unha pandemia coñecida como Peste de Xustiniano, que matou a unha terceira parte dos habitantes do Imperio Bizantino, que se cre foi debida á peste bubónica. Houbo epidemias recorrentes e non desapareceu de todo ata o ano 750.[46] Un estudo xenético suxire que esta praga se orixinou de cepas hoxe extintas de Y. pestis, xeneticamente distintas das cepas que orixinaron a Peste negra no século XIV, ou talvez de patóxenos non relacionados coa peste bubónica.[47][48] En 2012 investigadores alemáns recolleron mostras de Y. pestis de tumbas da época de Xustiniano para reconstruíren o ADN da bacteria.[49]
En 2000, Didier Raoult e outros informaron do descubrimento de ADN de Y. pestis en tecido de polpa dental de mostras dun cemiterio do século XIV de Montpellier.[50] Outro estudo de 2010, que estudou restos de vítimas da peste enterradas en Inglaterra, Francia e Países Baixos, confirmou que Y. pestis foi a causa da Peste negra e as sucesivas epidemias de peste posteriores.[51] Neste estudo atoparon dúas cepas previamente descoñecidas, que eran cepas antigas de Y. pestis.[52]
Inicialmente pensouse que os tres biovares de Y. pestis correspondían a cada unha das pandemias históricas da peste bubónica.[53] O biovar Antiqua pénsase que corresponde á Peste de Xustiniano; non se sabe se este biovar tamén corresponde ás epidemias temperás ou menores de peste bubónica, ou se estas eran verdadeiramente peste bubónica e non outra doenza.[54] Antes pensábase que o biovar Mediaevalis correspondía á pandemia da Peste negra,e o biovar Orientalis correspondía á Terceira pandemia e á maioría dos estalidos modernos da praga. Porén, os cálculos da idade evolutiva de Y pestis, obtidos usando o número de substitucións sinónimas de polimorfismos dun só nucleótido (SNP) en conxunción coas taxas dos reloxos moleculares, datan a emerxencia destes biovares nun momento anterior ao de calquera das epidemias históricas debido á cantidade de tempo que cómpre para acumular esas mutacións.[55] Evidencias adicionais en contra desa hipótese son o feito de que Mediaevalis é probablemente demasiado nova para ter producido a Peste negra debido á súa recente diverxencia de Orientalis.[56]
A utilización con fins bélicos de Y. pestis é un dos primeiros exemplos de guerra biolóxica na historia. En 1347 os mongois catapultaron a vítimas da peste sobre as murallas da cidade de Caffa, que hoxe se chama Feodosiya, en Ucraína. É posible que os habitantes desta cidade, algúns infectados, fuxisen a Italia, e así espallasen a Peste negra por Europa, aínda que esta é só unha das varias rutas polas que puido ter chegado a peste desde o leste.[57]
Y. pestis foi utilizada como arma biolóxica na segunda guerra mundial. Os xaponeses o 4 de outubro de 1940 lanzaron desde un avión que sobrevoaba a cidade chinesa de Chushien (na provincia de Chekiang), arroz e trigo con pulgas de rata que estaban infectadas de Y. pestis. Un segundo avión fixo o mesmo 3 semanas máis tarde. Estas accións orixinaron unha praga local que matou a 121 persoas.[58][58]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.