Mucoviscidose
maladie génétique De Wikipédia, l'encyclopédie libre
Maladie rare et souvent mortelle qui touche les voies digestives et respiratoires, la mucoviscidose (pour « maladie des mucus visqueux » en français)[5] ou fibrose kystique (en anglais : cystic fibrosis, sous-entendu « du pancréas »)[6] est une maladie génétique, affectant les épithéliums glandulaires de nombreux organes. C'est la maladie génétique létale à transmission autosomique récessive la plus fréquente dans les populations de type europoïde, alors qu'elle est très rare dans les populations africaines et asiatiques. Elle est liée à des mutations du gène CFTR sur le chromosome 7, entraînant une altération de la protéine CFTR (sigle pour cystic fibrosis transmembrane conductance regulator). Cette protéine est un canal ionique perméable aux ions chlorure et thiocyanate[7], jouant un rôle essentiel dans la régulation du transport des ions chlorure à travers les membranes cellulaires. Son dysfonctionnement provoque une augmentation de la viscosité du mucus et son accumulation dans les voies respiratoires et digestives. La maladie touche de nombreux organes mais les atteintes respiratoires sont prédominantes et représentent l'essentiel de la morbidité. La forme clinique la plus fréquente associe troubles respiratoires, troubles digestifs et troubles de la croissance staturopondérale. D'évolution chronique et progressive, la maladie s'exprime souvent tôt dès la petite enfance même s'il existe des formes frustes de diagnostic tardif.
| Mucoviscidose | |
| Référence MIM | 219700 |
|---|---|
| Transmission | Autosomique récessive |
| Chromosome | Chromosome 7 7q31.2 |
| Gène | CFTR |
| Empreinte parentale | Non |
| Mutation | Ponctuelle |
| Nombre d'allèles pathologiques | Plus de 1 500, la plus fréquente est ΔF508 (delta-F508)[1] |
| Porteur sain | Environ 1/25 soit 4 % de la population générale occidentale[2] |
| Incidence | 1 sur 3 500 naissances[3] |
| Prévalence | 5 000 à 6 000 cas en France et 70 000 cas dans le monde |
| Pénétrance | 100 % |
| Maladie génétiquement liée | Aplasie congénitale bilatérale des canaux déférents chez 98 % des garçons atteints[4] |
| Diagnostic prénatal | Possible mais rare |
| Liste des maladies génétiques à gène identifié | |
| modifier | |
Mucoviscidose
| Symptômes | Occlusion intestinale, ostéoporose, ulcère gastro-duodénal, cholestase, hépatite, calcul biliaire (en), cirrhose, bronchite, pneumonie, atélectasie, bronchectasie, fibrose pulmonaire, faiblesse musculaire (en), dyspnée, cyanose et insuffisance cardiaque |
|---|
| Médicament | Phénylbutyrate de sodium (en), dornase alfa (en), amiloride, acétylcystéine, ivacaftor, tobramycine, aztréonam, tobramycine et elexacaftor/ivacaftor/tezacaftor |
|---|---|
| Spécialité | Génétique médicale, pédiatrie et pneumologie |
| CISP-2 | T99 |
|---|---|
| CIM-10 | E84 |
| CIM-9 | 277.0 |
| OMIM | 219700 |
| DiseasesDB | 3347 |
| MedlinePlus | 000107 |
| eMedicine | 1001602 |
| MeSH | D003550 |
| Patient UK | Cystic-fibrosis-pro |
Le diagnostic biologique repose sur le test de la sueur confirmé par une identification des mutations génétiques. Le dépistage néonatal, généralisé en France depuis 2002 permet un diagnostic et une prise en charge précoce alors que le conseil génétique permet à un couple hétérozygote connu de ne pas avoir un autre enfant malade.
Une trithérapie est disponible depuis 2021. Les progrès de la prise en charge ont permis d'améliorer la qualité et l'espérance de vie des patients ; ainsi en France, l'espérance de vie à la naissance[8] est passée de sept ans en 1965 à 47 ans en 2005[9], et dépasse 50 ans depuis 2014[10].
Connue depuis le Moyen Âge, la maladie est décrite scientifiquement par le pédiatre suisse Guido Fanconi en 1936[11]. Elle est identifiée deux ans plus tard par Dorothy Hansine Andersen comme une entité pathologique atteignant le pancréas d'où son nom historique de fibrose kystique du pancréas. Elle conserve ce nom en anglais : cystic fibrosis.
Historique
Résumé
Contexte
Grandes dates

Histoire de la description de la maladie

La mucoviscidose, décrite scientifiquement comme maladie en 1936, était en fait déjà connue depuis longtemps. Au Moyen Âge on connaissait le sort funeste du nouveau-né dont la mère remarquait le « baiser salé », c'est-à-dire le goût salé laissé par un baiser sur le front de l'enfant[12],[13],[14]. Welsh cite un vieil adage du folklore de l'Europe du Nord[13] : « Malheur à l'enfant chez qui un baiser sur le front a un goût salé. Il est ensorcelé et doit bientôt mourir. » En 1606, le médecin espagnol Alonso y de los Ruyzes de Fonteca rapporte que les doigts passés sur le front des enfants ensorcelés ont un goût salé[15]. Rochholz dans son almanach de 1857 écrit « L'enfant mourra bientôt dont le front embrassé est salé. »[12] Selon Busch[14] une des premières descriptions médicales des lésions pancréatiques rencontrées dans la mucoviscidose pourrait être un rapport d'autopsie fait par le professeur Pieter Pauw, à Leyde aux Pays-Bas en 1595, dans lequel il décrit une patiente chétive de 11 ans supposée ensorcelée et présentant un pancréas élargi, dur et blanc.
Au XIXe siècle le médecin viennois Karel Rokitansky signale chez un fœtus un cas fatal de péritonite méconiale[16], qui sera plus tard identifié comme une complication de l'iléus méconial, obstruction intestinale néonatale présente chez certains enfants mucoviscidosiques décrite en 1905 par Landsteiner[17].
Au début du XXe siècle apparaissent les premières observations associant maladie pulmonaire, diarrhée et anomalie pancréatique avec plusieurs cas dans la même famille. En 1912, Garrod[18] décrit des familles dont les enfants présentent une diarrhée graisseuse et meurent d'infection pulmonaire. Ces descriptions se focalisent le plus souvent sur les problèmes digestifs, stéatorrhée et troubles pancréatiques, et leurs auteurs en font une forme de maladie cœliaque même si les problèmes bronchopulmonaires sont également notés[19],[20],[11],[21].
C'est en 1936, dans une thèse écrite en allemand et présidée par le pédiatre suisse Guido Fanconi, que la maladie est décrite pour la première fois chez des enfants supposés atteints de maladie cœliaque, sous le nom de « fibrose kystique du pancréas et bronchectasie[11] ». La mucoviscidose ne fut considérée comme une entité pathologique distincte qu'en 1938 par la pédiatre américaine Dorothy Hansine Andersen, médecin au Babies' Hospital de New York, qui publia un article intitulé « Fibrose kystique du pancréas et ses relations avec la maladie cœliaque »[19]. C'est en pratiquant des autopsies sur des nourrissons qu'elle décrivit les caractéristiques cliniques et histologiques de la maladie, notamment l'obstruction intestinale néonatale, les complications respiratoires et digestives et les lésions histologiques spécifiques du pancréas. Elle relia cette maladie à un déficit en vitamine A[22] et persista à soutenir cette théorie[23],[24] pendant de nombreuses années bien qu'elle ne fût jamais confirmée.
Le terme de mucoviscidosis, créé à partir des termes « mucus » et « visqueux », fut utilisé pour la première fois en 1943 par le docteur Sydney Farber[25], médecin-chef au Children's Hospital de Boston, afin de corriger la dénomination employée par Dorothy Andersen, centrée sur le pancréas. Farber était persuadé que la maladie était due à une diffusion généralisée de mucus visqueux. Le terme de mucoviscidosis reste très employé dans le monde, et notamment en France, et est parfois préféré au terme anglais cystic fibrosis[26].
Le caractère héréditaire et le mode de transmission récessif furent suggérés en 1945 par Dorothy Andersen et Hodges[27].
C'est à la suite d'une vague de chaleur entraînant un état de prostration chez de jeunes patients de l'hôpital Columbia de New York en 1948[28] que le docteur Paul di Sant' Agnese découvre et décrit en 1953 les anomalies électrolytiques[29],[30] dans la sueur des malades (augmentation importante du chlore, du sodium et moins marquée du potassium), permettant d'envisager un diagnostic spécifique à la maladie : le test de la sueur. Jusqu'alors, le diagnostic ne pouvait être fait que devant la combinaison de signes cliniques et de symptômes évocateurs d'insuffisance pancréatique et de malabsorption intestinale. Pendant des décennies la stimulation thermique a été utilisée, au cours de laquelle les enfants étaient entièrement enveloppés dans des pansements afin de stimuler la transpiration. Le recueil de la sueur était effectué grâce à des buvards. De réalisation difficile, la technique fut par la suite simplifiée par la méthode de l'iontophorèse à la pilocarpine décrite en 1959 par Gibson et Cooke[31], puis améliorée par Shwachman[32] et standardisée chez l'enfant par Legrys[33]. Le test de la sueur devint et reste jusqu'à ce jour[Quand ?] le test le plus fiable pour établir le diagnostic, en dehors de l'analyse génétique qui ne fut disponible que bien plus tard.
C'est au début des années 1980 que le lien physiopathologique fut fait entre d'une part l'anomalie de la sécrétion de mucus, entraînant des obstructions glandulaires avec anomalies histologiques et d'autre part l'anomalie de la sueur, entraînant des sécrétions salées sans anomalie histologique. En 1981, Knowles et al.[34] découvrirent que le potentiel électrique au niveau de la muqueuse nasale des patients mucoviscidosiques étaient plus électronégatifs que chez les sujets sains, ce qu'ils expliquèrent par une réabsorption massive du sodium entraînant une déshydratation à la surface de l'épithélium. Cette découverte faisait le lien physiologique entre les poumons, le pancréas et les glandes sudoripares. Le lien commun expliquant l'atteinte des différents organes n'était pas le mucus lui-même, mais les anomalies électrolytiques. En 1983 Quinton, lui-même atteint de la mucoviscidose, montra que l'imperméabilité au chlore qu'il avait trouvée dans les glandes sudoripares[35] était la cause de l'augmentation des électrolytes dans la sueur[36]. Ceci fut considéré comme une étape majeure dans la compréhension de la maladie.
Restait à localiser et à identifier le gène dont la mutation provoque la mucoviscidose, une tâche rendue difficile car seules la sémiologie clinique, le mode de transmission autosomique récessif et l'anomalie de transport du chlore étaient alors connus. En l'absence de toute connaissance sur la protéine défectueuse, et donc de marqueur chimique identifié, la récente technique du clonage positionnel - ou génétique inverse, qui permet d'identifier un gène sans connaître la protéine qu'il code, fut utilisée. Cette méthode consiste grâce à des analyses statistiques de liaison génétique à déterminer la région du chromosome où le gène a une forte probabilité de se trouver, afin de la séquencer et d'étudier les gènes exprimés. Le gène de la mucoviscidose est le premier gène à avoir été cloné uniquement par analyse de liaisons[37].
En 1985, Eiberg et al.[38] trouvent un lien entre l'enzyme paraoxinase (PON) et le gène CF en étudiant des familles où il y avait plus d'un enfant atteint. La même année, Tsui et al.[39], à la suite d'études sur des souris hybrides, localisent le gène sur le bras long du chromosome 7 grâce à un marqueur RLFP lié à la fois à la paraoxinase et à la mucoviscidose.
En 1989, le gène impliqué dans la mucoviscidose est isolé par les équipes de Lap-Chi Tsui, Collins et Riordan[40],[41],[42]. L'anomalie génétique à l'origine de la maladie est enfin découverte, il s'agit d'une mutation d'un gène localisé en 7q31 et contenant 27 exons, nommé cystic fibrosis (CF) codant une protéine transmembranaire appelée cystic fibrosis transmenbrane conductance regulator (CFTR) composée de 1480 acides aminés. Ce n'est qu'un peu plus tard qu'on apporta les preuves que CFTR était bien un canal du chlore[43],[44]. La découverte de l'anomalie génétique permit par la suite d'ajouter le génotypage au protocole diagnostique, et d'envisager la thérapie génique.
Histoire de la prise en charge de la maladie
Dans les années 1940, la maladie était considérée comme étant avant tout un problème nutritionnel avec une déficience en vitamine A. La prise en charge se résumait essentiellement à un régime riche en protéines, des injections intramusculaires de vitamine A à hautes doses, des extraits pancréatiques et des inhalations de pénicilline[45]. En 1945, Dorothy Andersen conseille « un régime pauvre en graisse, riche en protéines, avec une proportion libre de légumes, fruits et sucres et une restriction modérée en féculents. Une supplémentation en vitamine A est essentielle et des complexes pancréatiques et de la vitamine B sont ajoutés[46] ». Elle précise que la diète doit être débutée précocement pour être efficace[24]. À cette époque la durée de survie reste courte, 64 % des 28 patients d'une série de la Mayo Clinic n'atteignant pas l'âge de 7 ans[47]. La première drogue antibactérienne, un sulfamidé commercialisé sous le nom de Prontosil, fut disponible en 1934 et la pénicilline sous forme injectable en 1944. D'autres antibiotiques suivirent et eurent un rôle essentiel dans le traitement des patients. À cette date, le principal germe pathogène était Staphylococcus aureus et de nombreuses souches étaient encore sensibles à la pénicilline[45]. En 1946 Di Sant Agnese et D. Andersen écrivent que l'amélioration du pronostic lors de cette décennie est due à « un régime approprié débuté rapidement et poursuivi de façon continue, l'utilisation de sulphadiazine pendant la période de toux chronique et de nébulisation de pénicilline »[48]
Dans les années 1950, le sort des enfants atteints est toujours considéré comme sans espoir mais quelques centres spécialisés dans la prise en charge de la mucoviscidose voient le jour aux États-Unis et au Royaume-Uni. Le drainage postural est alors un des traitements traditionnels au stade de bronchectasie et en 1950 Young propose de le débuter dès le diagnostic posé[45]. L'effet des bronchodilateurs est décrit en 1959[49]. En 1955 Shwachman décrit de façon détaillée une méthode de prise en charge qui pose les fondements du traitement moderne : diagnostic précoce, traitement actif et précoce de l'infection pulmonaire, et surveillance et maintien de l'état nutritionnel[45]. Lors de cette décennie, d'autres antibiotiques apparaissent. Dès 1951, alors que Staphylococcus aureus est la bactérie habituellement retrouvée, on note l'augmentation de la fréquence de Pseudomonas aeruginosa, attribuée aux traitements antibiotiques prolongés[50], néanmoins le bénéfice de traitements antibiotiques agressifs devient progressivement évident[51]. En 1952 Shwachman rapporte l'apparition de résistance de S. aureus à la terramycine et écrit que les aérosols de pénicilline et de streptomycine sont utiles[52]. En 1958 Shwachman et Kulczycki publient le premier article de synthèse provenant d'un grand centre spécialisé dans lequel ils décrivent leur système de classification clinique et notent une amélioration du pronostic des enfants atteints et une augmentation de la fréquence de survie jusqu'à l'âge adulte[53]. La mortalité des enfants malades avec un ileus méconial est alors toujours supérieure à 50 % mais se trouve grandement améliorée par une méthode chirurgicale d'iléostomie décrite en 1957 par Bishop et Koop[54]. C'est en 1955 que la preuve objective de l'efficacité d'un traitement par enzymes pancréatiques est apportée par l'équipe londonienne de Norman[55].
Dans les années 1960, la création d'organisations nationales consacrée à la maladie permet une approche collaborative entre la communauté médicale et les parents et patients. Ainsi la US National CF Research Foundation (qui deviendra plus tard la CF Foundation) est créée en 1955, la Canadian CF Foundation en 1959, la UK CF Research Foundation Trust en 1964 et l’International Cystic Fibrosis Association en 1965 à Paris. La survie des malades reste très précaire, la plupart décédant durant la jeune enfance, l'enfance ou l'adolescence, après de pénibles années de maladie chronique[45]. La « Mist tent therapy » fut une forme de traitement populaire aux États-Unis à cette période qui consistait à faire dormir les enfants sous une fine brume afin de diminuer la viscosité des sécrétions et d'améliorer leur état respiratoire[56],[57]. Mais son efficacité ne fut pas reconnue et le traitement fut discrédité au début des années 1970[58],[59],[60]. Des résultats encourageants proviennent néanmoins de Londres, en 1969 David Lawson est le premier à suggérer qu'une antibioprophylaxie anti-staphylococcique continue pourrait améliorer la survie[61] et en 1972 il écrit qu'« un diagnostic plus rapide par un dépistage néonatal amélioré est essentiel car actuellement le diagnostic est posé au stade alors que des lésions pulmonaires sont déjà présentes[62]. » Margaret Means en 1972 également rapporte une réduction de moitié de la mortalité chez les enfants de moins de 5 ans, passant de 14 % à 6,5 %, grâce à des antibiotiques anti-staphylococciques disponibles depuis 1957. Elle écrit qu'« un traitement vigoureux et un contrôle de l'infection dès la petite enfance, peut prévenir la plupart de ces patients de devenir insuffisants respiratoires à l'enfance[63]. »
Dans les années 1970, de nombreux progrès sont réalisés, notamment au niveau des soins chirurgicaux et médicaux néonataux ; la ventilation des nouveau-nés devient possible et s'améliore progressivement. Cette décennie est marquée par l'intérêt croissant vis-à-vis des problèmes nutritionnels chroniques qui apparaissent avec l'extension de la survie des patients[45]. L'attitude générale était alors restrictive et rigide, on recommandait alors des apports de 30 à 40 g de graisses maximum par jour, 200 Kcal/kg/jour et de 4 à 5 g de protéine/kg/jour[64] ». L'« Allan Diet » destinée à améliorer l'absorption intestinale et l'état nutritionnel des patients[65] fit preuve de son efficacité mais s'avéra trop astreignante et trop coûteuse pour être utilisée en routine. Des enzymes pancréatiques gastro-résistantes apparurent et il y eut des avancées majeures permettant un apport normal en graisse, et donc des apports énergétiques accrus chez la plupart des patients[45]. En 1978, un article supportant l'hypothèse qu'un bon état nutritionnel est associé à un meilleur pronostic paraît[66]. C'est au cours de cette décennie qu'on décrit un traitement non chirurgical de l'iléus méconial par lavement à la Gastrografine[67], qu'on décrit le rôle pathogène de Burkholderia cepacia dont la dangerosité et la contagiosité entraîne des changements radicaux dans la pratique clinique et les habitudes sociales des patients[68] et qu'on se rend compte que sévérité de l'infection par P. aeruginosa et pronostic vital sont liés[69], observation à l'origine du protocole danois des antibiothérapies intraveineuses de 3 mois[70],[71],[72]. Les progrès sont si importants que la vision des médecins concernant la maladie change progressivement. En 1974, Crozier publie un article intitulé « La fibrose cystique - une maladie pas si fatale[73] ». En 1981 Norman annonce qu'une nouvelle ère commence et qu'il est « temps d'arrêter d'utiliser le terme de maladie génétique la plus létale[74]. »
Dans les années 1980, de considérables avancées scientifiques ont lieu sur la compréhension de la maladie, mais sans grande répercussion sur la prise en charge des patients. En 1983, le diagnostic anténatal devient disponible pour les familles ayant déjà un enfant affecté. En 1984, un article de l'australien Peter Phelan met en évidence que les soins en centre spécialisé sont un des principaux facteurs de la meilleure survie observée chez les patients de Nouvelle-Galles du Sud par rapport à ceux d'Angleterre et du Pays de Galles, soignés dans des services de pédiatrie générale[75]. Cette observation fut suivie par la création de nombreux centres spécialisés dans la prise en charge de la mucoviscidose, notamment au Royaume-Uni. L'amélioration spectaculaire constatée après un traitement basique constitué de 2 semaines d'antibiothérapie intraveineuse, de physiothérapie, de support nutritionnel et de doses adéquates d'enzymes pancréatiques poussa de nombreux parents vers ces centres.
Les antibiotiques intraveineux devinrent la pièce maitresse du traitement de l'infection chronique par P. aeruginosa qui touche virtuellement tous les patients[76],[77]. Devant la dégradation qui suit inévitablement l'arrêt de l'antibiothérapie, le centre spécialisé danois de Copenhague introduit des protocoles de cures trimestrielles systématiques de 2 semaines d'antibiothérapie intraveineuse, entraînant une amélioration impressionnante de la survie de leurs patients[71]. Afin d'améliorer la qualité de vie et de diminuer les coûts, les traitements antibiotiques IV à domicile se développent peu à peu. Après un article de 1981 de Margaret Hodson dans lequel elle décrit que des nébulisations biquotidiennes de gentamicine et de carbenicilline permettent de stabiliser les patients ayant des infections à P. aeruginosa récidivantes[78], les nébulisations d'antibiotiques connaissent un regain d'intérêt important. En 1985, Littlewood note que des nébulisations de colomycine peuvent éradiquer une infection à P. aeruginosa[79] et empêcher sa chronicisation, jusque-là considérée comme inévitable.
Une avancée majeure pour les patients au stade terminal de la maladie est la première transplantation cœur-poumon réalisée en 1984 à Harefield au Royaume-Uni et à Chapel Hill aux États-Unis[80]. Par la suite, la translantation bipulmonaire devint plus populaire[81]. Des donneurs vivants ont été utilisés particulièrement aux États-Unis, en raison d'une pénurie de donneurs d'organes[82].
Cette décennie connaît aussi d'importants progrès en matière de nutrition. Il devient évident que les patients avec un apport normal en graisse ont un meilleur apport énergétique, un meilleur état nutritionnel et une meilleure croissance[83]. Une autre avancée majeure est l'apparition de nouvelles préparations d'enzymes acido-résistantes, mélanges d'enzymes pancréatiques de substitution ayant une activité amylolytique, lipolytique et proteolytique. La forme galénique d'enrobage gastro-résistant préserve l'activité enzymatique jusqu'à son arrivée dans le jéjunum. Ces préparations ont été commercialisées sous les noms de spécialité de Pancrease puis de Creon. Seule cette dernière spécialité est disponible en France (Solvay-Pharma propriétaire de la marque jusqu'en 2018). Il devient progressivement évident pour de nombreux praticiens que la restriction en graisse est maintenant rarement indiquée si des doses adéquates d'extraits pancréatiques sont apportées[84]. Dans les cas de dénutrition, si la nutrition intraveineuse parentérale s'avère être une solution à court terme, sa mise en œuvre n'est pas aisée et la nutrition entérale, par sonde nasogastrique ou gastrostomie, prend progressivement de l'ampleur[45].
Au début des années 1990, une vague d'enthousiasme suit l'identification du gène CFTR, certains patients pensant qu'un traitement curatif a été découvert. Des modèles animaux sont créés avec des souris mutantes permettant des recherches in vivo sur le fonctionnement du gène. Des études sur le remplacement génétique sont entreprises et même si les progrès sont lents, Davies envisage en 2001 que la thérapie génique sera une réalité dans les 5 à 10 ans[85]. Des traitements pharmacologiques alternatifs ou complémentaires destinés à améliorer la fonction CFTR sont également en cours d'étude[86]. Des centres spécialisés dans la prise en charge des adultes mucoviscidosiques apparaissent. Avec l'avènement de la médecine fondée sur les faits, tous les traitements, traditionnels ou récents, sont passés au crible : antibiothérapie intraveineuse, bronchodilatateur et stéroïdes inhalés semblent utiles, le mucolytique Pulmozyme est efficace pour améliorer la fonction respiratoire, P. aeruginosa peut être éradiqué par un traitement précoce et l'infection chronique bénéficie d'une antibiothérapie inhalée au long cours et de cures trimestrielles d'antibiotiques intraveineux. Les stéroïdes oraux s'avèrent trop toxiques sur des durées prolongées[45]. Les différentes techniques de physiothérapie sont également réévaluées, ce qui donne lieu en 2002 à une recommandation du CF Trust[87]. On met en évidence les risques de transmission d'agents infectieux tels que Burkholderia cepacia et Pseudomonas aeruginosa entre patients, ce qui entraîne une disparition des réunions et groupes de patients, modifiant profondément leur vie sociale[45].
Épidémiologie
Résumé
Contexte
La mucoviscidose est la maladie génétique la plus fréquente parmi les enfants de type caucasien[88], c'est-à-dire des maladies génétiques potentiellement graves dès l’enfance[89].
Après avoir été longtemps évaluée à 1⁄2500 en Europe et en Amérique du Nord[90], elle touche environ un enfant sur 3 500 naissances[3] et la fréquence des hétérozygotes, porteurs sains de la maladie, y est d’environ 1⁄25[2], soit 4 % de la population générale occidentale.
La mucoviscidose est présente dans toutes les populations du globe, mais à des prévalences variables. Il existe ainsi très peu de cas chez les populations Noires et encore moins chez les Asiatiques[91]. Respectivement l'incidence à la naissance — nombre de nouveaux cas observés dans une période et une population donnée — et la fréquence des hétérozygotes est au Moyen-Orient d'environ 1⁄4400 et de 1⁄33, dans la population hispanique de 1⁄8500 et 1⁄46, chez les Noirs américains et Africains de 1⁄20000 et 1⁄70 et chez les Asiatiques de 1⁄32400 et 1⁄90[92].
La prévalence — nombre de cas présents à un moment donné dans une population donnée — de la mucoviscidose, comme celle de toute maladie rare, est difficile à évaluer avec précision[93],[94]. La prévalence en Europe est estimée entre 8 et 12 cas pour 100 000 habitants[88],[93]. La Cystic Fibrosis Foundation estime le nombre de malades aux États-Unis d'Amérique à environ 30 000 enfants et adultes et à 70 000 le nombre total de malades dans le monde[95].
En France, il existe depuis 2002 un dépistage néonatal systématique de la mucoviscidose ce qui a permis de réévaluer l’incidence de la maladie dans ce pays. Elle serait près de deux fois moins élevée que les estimations antérieures, d'environ un nouveau-né sur 4 600 naissances, soit une fréquence d'hétérozygotes de l’ordre de 1 sur 35[96]. L'incidence varie selon les régions de 1⁄2500 dans le nord-ouest à 1⁄10000 dans le sud-est[2]. Il y aurait environ 5 000 à 6 000 personnes atteintes de la mucoviscidose[97] et 2 millions de porteurs hétérozygotes sains.
Au Canada, un nouveau-né sur 3 600 est atteint de cette maladie. 50 % des cas sont diagnostiqués avant l'âge de 6 mois. Dans ce même pays, une personne atteinte de cette maladie décède chaque semaine[98].
Le sex-ratio est proche de 1 ce qui signifie que les hommes et les femmes sont atteints avec la même fréquence par la maladie. Par contre l'atteinte est souvent plus grave chez les femmes[99],[100],[101].
Origine des mutations et de la prévalence élevée
La mucoviscidose concerne principalement la population d'origine européenne. Si la maladie, monogénique car causée par un unique gène, récessif, touche 1 nouveau-né sur 2 000 à 3 000, on estime que 4 % de cette population est porteur sain[102]. Un couple de porteurs sains a alors une chance sur 4 d'avoir un enfant malade. Dans cette population, la mutation p.Phe508del (ΔF508, F508del), qui bloque la maturation du protéine CFTR, représente 66 % des cas. On a donc un tableau caractérisé par :
- une fréquence anormalement élevée pour une maladie génétique potentiellement létale ;
- la forte prédominance d'une mutation particulière.
Ce tableau évoque le cas d'une maladie héréditaire récessive sélectionnée positivement[102] comme la drépanocytose, dans laquelle les porteurs sains — beaucoup plus nombreux que les malades — ont bénéficié d'un avantage sélectif et ont donc été favorisés par rapport aux non-porteurs (dans le cas de la drépanocytose, l'avantage sélectif est la résistance au paludisme)[103].
La toxine du choléra ayant besoin de la protéine CFTR pour fonctionner correctement, des auteurs ont proposé l'hypothèse que les porteurs hétérozygotes du gène CF bénéficient d'une résistance accrue vis-à-vis du choléra ou d'autres formes de diarrhée infectieuse[104]. Cette hypothèse n'a pas été, dans un premier temps, confirmée[105],[106] avant d'être reprise en 2010 par une étude de l'Université du Pays Basque qui a confirmé l'hypothèse selon laquelle la mutation p.Phe508del (perte du 508e acide aminé de la protéine) protègeait bien des diarrhées sécrétoires (notamment du choléra)[107].
En 2018, Emmanuelle Génin de l'Université de Brest et Philip Farrell de l'Université du Wisconsin ont repris l'étude de la datation de cette mutation. Ils ont montré que[108],[109] :
- la mutation est apparue il y a environ 4 700 ans dans le nord-ouest de l’Europe (néolithique tardif) ;
- elle a été ensuite diffusée progressivement dans le reste de l'Europe par les peuples[110] qui ont diffusé la culture campaniforme ; on trouve en effet une concordance entre l'avancée de cette culture vers le sud-est de l'Europe et l'apparition de la mutation dans ces régions.
Les peuples de culture campaniforme étaient des éleveurs et se nourrissaient de produits laitiers. C'est vraisemblablement à cause de problèmes d'hygiène liés à la conservation du lait que les porteurs sains de la mutation ont été avantagés. Sans cet avantage, la mutation aurait dû disparaître[108],[111].
Autres hypothèses
Des résistances à différentes maladies infectieuses ont été proposées comme étant la cause de l'avantage hétérozygote lié au gène CF :
- l'entrée de Salmonella enterica typhi, agent responsable de la fièvre typhoïde, dans les cellules nécessite la présence de protéines CFTR normales[112], ce qui pourrait faire penser que les porteurs d'un gène mutant puissent être protégés contre cette maladie. Aucune étude in vivo n'a encore confirmé cette hypothèse. Celle-ci a pourtant connu un regain d'intérêt dans les années 2010 en raison d'une corrélation entre la dispersion de la maladie et celle des éleveurs de la culture campaniforme, pour lesquels une résistance accrue aux diarrhées provoquées par la consommation de produits laitiers mal conservés aurait pu constituer un avantage sélectif[113] ;
- d'autres auteurs, sur la base de modèles génétiques, démographiques et épidémiologiques, ont fait remarquer que les épidémies de choléra ou de fièvre typhoïde n'avaient pas pu exercer assez de pression sélective pour donner les chiffres actuels de prévalence de la mutation. Et font remarquer que la tuberculose a pu exercer une telle pression : les individus qui ont seulement un des deux chromosomes porteurs de la mutation ΔF508 ont un poumon suffisamment visqueux pour être plus résistant à la tuberculose mais pas assez, comme c'est le cas lorsque les deux allèles portent la mutation, pour développer la mucoviscidose[114].
Étiologie et physiopathologie
Résumé
Contexte
Le gène responsable de la mucoviscidose

Le gène CFTR, Cystic fibrosis transmembrane conductance regulator, code la synthèse d'une protéine appelée CFTR dont la fonction est essentielle à l'organisme. Les mutations dans ce gène sont responsables de la mucoviscidose et de l'aplasie congénitale du canal déférent. C'est un grand gène constitué d'environ 250 000 paires de bases réparties en 27 exons et codant un ARNm de 6,5 kb. Il est localisé sur le locus 7q31.2, dans la région q31.2 du bras long du chromosome 7[115],[116],[117].
Mutations du gène CFTR
On dénombre en 2011 plus de 1 900 mutations du gène CFTR[118].
La majorité des mutations du gène CFTR sont des mutations ponctuelles. Les plus fréquentes sont des mutations faux-sens (42 %), puis viennent des microinsertions et des microdélétions (24 %), des mutations non-sens (16 %), des mutations d'épissage (16 %) et enfin des délétions d'un acide aminé (2 %). On rapporte également quelques grandes délétions[119].
Les mutations du gène CFTR sont regroupées en 6 classes en fonction des conséquences fonctionnelles qu'elles occasionnent. Certaines mutations entraînent des anomalies quantitatives ou qualitatives sur la protéine CFTR[119] :
- Classe 1 : mutations altérant la production de la protéine CFTR.
- Classe 2 : mutations perturbant le processus de maturation cellulaire de la protéine CFTR.
- Classe 3 : mutations perturbant la régulation du canal chlorure.
- Classe 4 : mutations altérant la conduction du canal chlorure.
- Classe 5 : mutations altérant la stabilité de l'ARNm CFTR.
- Classe 6 : mutations altérant la stabilité de la protéine mature.
La mutation la plus fréquente est la mutation « Delta F508 » (ΔF508) qui consiste en une délétion de trois nucléotides au niveau du dixième exon du gène, aboutissant à l'élimination d'un acide aminé, la phénylalanine, en position 508. Cette mutation est retrouvée dans près de deux tiers des cas avec des variations importantes selon les populations étudiées, ainsi on retrouve un gradient de répartition suivant une direction nord-ouest/sud-est en Europe, avec par exemple 88 % de DF508 au Danemark, 81 % en Bretagne et 50 % en Italie[119]. Seules quatre autres mutations, hors ΔF508, représentent plus de 1 % des cas, il s'agit de G542X, G551D, N1303K et W1282X[1]. Toutes les autres mutations sont rares, voire exceptionnelles, uniquement décelées au sein d'une seule famille.
Les mutations les plus fréquentes dans les populations caucasiennes sont[1] :
| Nom de la mutation | Fréquence | Nom de la mutation | Fréquence | |
|---|---|---|---|---|
| ΔF508 | 66,0 % | R553X | 0,7 % | |
| G542X | 2,4 % | 621+1G | 0,7 % | |
| G551D | 1,6 % | 1717-1G | 0,6 % | |
| N1303K | 1,3 % | R117H | 0,3 % | |
| W1282X | 1,2 % | R1162X | 0,33 % | |
Les génotypes trouvés sont[119] :
| Paire de mutations | Fréquence |
|---|---|
| ΔF508 - ΔF508 (homozygote) | 50 % |
| ΔF508 - autre mutation (hétérozygote composite) | 40 % |
| autre mutation | 10 % |
Corrélation génotype et phénotype
Il existe un certain rapport entre la mutation (le génotype) et les manifestations cliniques de la maladie (le phénotype). La très grande variabilité des manifestations et de la gravité de cette maladie est en rapport avec les multiples mutations du gène CFTR.
La pénétrance est habituellement de 100 % chez les homozygotes avec mutations sévères mais la sévérité de la maladie reste variable avec des formes atténuées sans insuffisance pancréatique ou avec atteinte respiratoire modérée.
L'état homozygote ΔF508/ΔF508 est associée à la forme classique de la maladie avec une augmentation des électrolytes dans la sueur, une insuffisance pancréatique et une atteinte pulmonaire souvent sévère. Certaines mutations entraînent plus de troubles fonctionnels que d'autres ainsi les études épidémiologiques montrent une mortalité différente dans des populations ayant des mutations différentes. Ainsi les mutations ΔF508/R117H, ΔF508/ΔI507, ΔF508/3849+10kbC-→T et ΔF508/2789+5G-→A ont un taux de mortalité plus bas que les homozygotes ΔF508. Et les mutations ΔF508/R117H, ΔF508/ΔI507, ΔF508/ 3849+10 kbC-→T, ΔF508/2789+5G-→A et ΔF508/A455E ont des manifestations phénotypiques atténuées[120].
C'est pour la fonction pancréatique que la corrélation génotype/phénotype est la plus évidente, le pancréas peut présenter des lésions de gravité très variable selon les mutations, alors que la sévérité de l'atteinte pulmonaire peut être très différente chez des sujets ayant un même génotype CFTR, même au sein d'une même famille. Cette variabilité phénotypique de l'atteinte respiratoire pourrait être due à des facteurs génétiques distincts du gène CFTR ou à des facteurs environnementaux[121]. Ainsi les hétérozygotes ΔF508/A455E ont une meilleure fonction pulmonaire que les homozygotes ΔF508 ; cette mutation étant associée à une fonction pancréatique conservée, la moindre sévérité de l'atteinte pulmonaire pourrait être la conséquence d'un meilleur état nutritionnel[122].
La protéine CFTR
La protéine CFTR (cystic fibrosis transmembrane conductance regulator), codée par le gène CFTR, est une protéine transmembranaire de 1 480 acides aminés et dont le poids moléculaire est de 168 kD[115],[116].
La molécule CFTR est composée de 5 domaines, deux domaines hydrophobes transmembranaires (membrane-spanning domains, MSD) comportant chacun six segments transmembranaires en hélice alpha, deux domaines hydrophiles d'interaction avec les nucléotides (nucleotide-binding domains, NBD), et un domaine cytoplasmique de régulation (regulatory domain, R) codé par l'exon 13 et contenant de nombreux résidus chargés et la majorité des sites potentiels de phosphorylation[123].
La molécule se situe au pôle apical des cellules épithéliales et se comporte comme un canal ionique laissant passer l'ion chlorure, thiocyanate[7],[124],[125] selon un gradient électrochimique (transport actif secondaire, tirant son énergie du gradient électrochimique favorable à l'entrée de l'ion sodium dans la cellule entretenu par l'activité de la pompe sodium-potassium). L'activation du canal dépend de multiples phénomènes de phosphorylation du domaine de régulation (R) et de l'hydrolyse d'une molécule d'Adénosine triphosphate (ATP) sur les domaines d'interaction avec les nucléotides. L'hydrolyse du NBD en situation N-terminal permet l'ouverture du canal transmembranaire sélectif aux ions chlorure. L'hydrolyse de l'ATP sur le domaine NBD C-terminal, conduit à sa fermeture[126].
Outre sa fonction canal chlore, la protéine CFTR régule également d'autres canaux comme le canal chlore à rectification sortante, le canal sodium épithélial, et des canaux potassium à rectification entrante. D'autres fonctions sans rapport avec la régulation des canaux ont aussi été décrites comme le transport d'ATP, la modulation des phénomènes d'exocytose et endocytose, la régulation du pH des organites intracellulaires. Ce qui fait de la protéine CFTR une protéine multifonctionnelle[119].

Physiopathologie des manifestations
La mutation du gène de la mucoviscidose entraîne un défaut dans la synthèse de la protéine cystic fibrosis transmenbrane conductance regulator ou CFTR (famille ATP Binding Cassette), qui est une protéine membranaire entrant dans la formation d'un canal ionique sélectif aux anions et principalement chlorures.
Le défaut de synthèse de la protéine entraîne un déficit en chlore extracellulaire, en thiocyanate[127] et donc un défaut d'hydratation du mucus, une hyperviscosité des sécrétions épithéliales liée à une réabsorption exagérée de l'eau secondaire à la rétention cellulaire de l'ion chlore et au non passage des composés nécessaires à la défense immunitaire du poumon[128],[129],[130]. Ainsi, le composé hypothiocyanite[131] ne peut être produit du fait du déficit en thiocyanate n'étant pas transféré par le CFTR[7], les protéines duox étant quant à elles, inhibées par les Pseudomonas aeruginosa[132],[133],[134], approche validée par les deux agences médicales Européenne[135] et Américaine[136]
L'insuffisance de fonctionnement des glandes exocrines se remarque surtout au niveau du poumon, du pancréas et du foie. Les atteintes digestives sont les plus précoces et les premières historiquement décrites.
Au niveau du pancréas
Les enzymes du pancréas, comme la lipase et la trypsine, qui servent à la digestion sont mal excrétées dans la lumière intestinale parce que les canaux pancréatiques se bouchent du fait d'une sécrétion trop épaisse et d'une fibrose importante. Les enzymes agressent alors directement le tissu pancréatique, contribuant à la fibrose. Des kystes peuvent éventuellement se former. Lorsque les fonctions pancréatiques sont significativement altérées, on parle d'insuffisance pancréatique[137].
Le pancréas est atteint dans sa fonction exocrine et endocrine de deux manières :
- atteinte de la fonction exocrine : la réduction ou l'absence d'arrivée d'enzymes de digestion dans la lumière intestinale conduit à un syndrome de malabsorption pouvant avoir un retentissement sur le développement staturopondéral et pubertaire des enfants.
- atteinte de la fonction endocrine : la destruction des cellules bêta des îlots de Langerhans conduit à un défaut de sécrétion d'insuline et un diabète insulinoprive — mais bien distinct du diabète de type 1 auto-immun — apparaît. Si l'insuffisance pancréatique exocrine apparaît précocement, les îlots de Langerhans sont longtemps épargnés. Il semble que la destruction des îlots ne soit pas causée uniquement par le développement progressif d'une fibrose pancréatique mais aussi par d'autres phénomènes tels qu'une ischémie. La capacité à sécréter de l’insuline reste longtemps normale et plusieurs années s'écoulent entre la période d'intolérance au glucose et l'apparition du diabète. Outre les anomalies de sécrétion de l'insuline, d'autres facteurs pourraient contribuer au développement du diabète tels qu'une insulino-résistance transitoire[138].
Au niveau hépatobiliaire
La viscosité de la bile est augmentée par les dysfonctionnements de la protéine CFTR des cellules épithéliales biliaires. Les canaux qui transportent la bile vont se boucher à cause de ce liquide trop épais. La répétition de ces obstructions conduit à des phénomènes de cirrhose localisée et d'hépatomégalie.
Les conséquences habituelles de la cirrhose biliaire sont les mêmes chez le patient mucoviscidosique que dans le reste de la population. L'hypertension dans la veine porte, les hémorragies digestives et l'insuffisance hépatocellulaire peuvent conduire à la greffe hépatique.
Au niveau du poumon
Le liquide de surface tapissant l'arbre bronchique se compose d'eau et de mucus. Les canaux CFTR servent à la sécrétion active de chlore vers ce liquide, ils interagissent avec les canaux d'absorption du sodium pour limiter leur travail. Ce mouvement de chlore entraîne un mouvement de sodium et d'eau. Cette sécrétion d'eau permet d'hydrater le liquide de surface bronchique et de lui maintenir des propriétés rhéologiques adéquates pour une clairance mucociliaire efficace. La clairance mucociliaire est le débit de liquide de surface transporté par les cellules ciliées de l'arbre bronchique. L'évacuation de ce liquide permet l'élimination des poussières et des agents infectieux vers le système digestif.
L'altération fonctionnelle des canaux CFTR entraîne une déshydratation du liquide de surface bronchique. Les modifications des propriétés du mucus, et notamment l'augmentation de sa viscosité rendant plus difficile son évacuation par les cils, conduit à une obstruction chronique des bronches ainsi qu'à la non évacuation des poussières et bactéries. De plus les propriétés antibactériennes du mucus sont diminuées. Tous ces éléments favorisent l'apparition d'une infection précoce devenant rapidement chronique associée à une réaction inflammatoire marquée[139].
Au fil du temps, différentes bactéries colonisent les voies respiratoires d'un même malade. Une large étude[140] publiée en 2000 faite sur 1 000 enfants de moins de 2 ans retrouvait sur des prélèvements bronchoscopiques 19 % d'Haemophilus influenzae, 42 % de Staphylococcus aureus, 29 % de Pseudomonas aeruginosa, 7 % de Stenotrophomonas maltophilia et moins de 1 % de Burkholderia cepacia. D’autres agents infectieux, bactériens, viraux ou fongiques, peuvent parfois être retrouvés. Initialement ce sont des bactéries banales telles que Haemophilus influenzae et Staphylococcus aureus qui colonisent et infectent les poumons, puis survient la colonisation à Pseudomonas aeruginosa, qui constitue un tournant dans l’évolution de la maladie respiratoire[139]. L'utilisation répétée d'antibiotiques mais aussi d'autres facteurs encore indéterminés et liés à la maladie elle-même, favorisent la colonisation du tractus bronchique par Pseudomonas aeruginosa généralement résistante aux antibiotiques d'utilisation courante. Cette bactérie est exceptionnelle chez les personnes indemnes de mucoviscidose[140].
Il existe une inflammation de l'épithélium bronchique dont les mécanismes sont incomplètement élucidés. Il n'est pas encore tranché que cette inflammation soit directement consécutive à la colonisation bactérienne du mucus. Les études physiopathologiques se concentrent sur les autres fonctions de la protéine CFTR, qui aurait un rôle dans la régulation de l'inflammation, voire un rôle dans la destruction de Pseudomonas aeruginosa.
À terme, l'inflammation et l'infection chronique entretiennent un cercle vicieux et entraînent une dégradation pulmonaire par des lésions du tissu pulmonaire conduisant à un tableau de bronchopneumopathie chronique obstructive.
Description clinique
Résumé
Contexte
La mucoviscidose est une maladie du tissu épithélial des glandes exocrines de l'organisme. Ce tissu se retrouve dans de nombreux organes comme les voies respiratoires (bronches, cavités nasales…), le pancréas, le foie et l'arbre biliaire, l'intestin grêle, les canaux déférents des organes génitaux masculins, les glandes sudoripares de la peau.
La sévérité du tableau clinique varie selon les mutations du gène CFTR, mais aussi selon d'autres facteurs génétiques et environnementaux. L'histoire naturelle de la maladie est donc très variable et va du décès précoce dans la petite enfance par aggravation progressive de l'obstruction pulmonaire avec bronchectasie, à une insuffisance pancréatique avec atteinte obstructive pulmonaire progressive durant l'adolescence et une augmentation de la fréquence des hospitalisations consécutive à l'atteinte respiratoire au début de l'âge adulte[122].
La forme clinique la plus fréquente associe troubles respiratoires (bronchite chronique), troubles digestifs (stéatorrhée, constipation) et troubles de la croissance staturopondérale[88].
Manifestations pulmonaires
Les manifestations pulmonaires restent la cause majeure de la morbidité et de la mortalité. Il existe une inflammation chronique des bronches avec surinfection bactérienne qui entretiennent un cercle vicieux et sont la cause de la dégradation de l'état pulmonaire. Les premiers germes colonisant les voies aériennes sont Haemophilus influenzae et Staphylococcus aureus, puis Pseudomonas aeruginosa (bacille pyocyanique) à un stade plus avancé[122],[139].
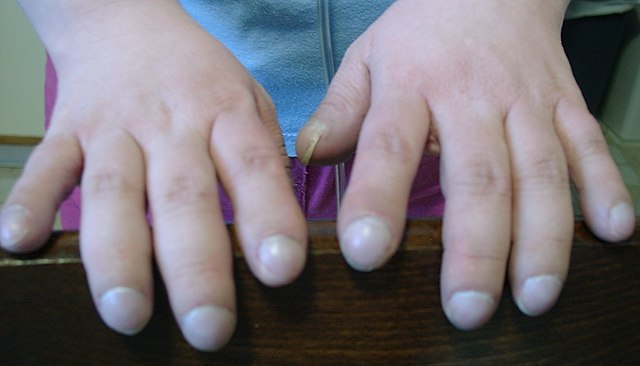
L'histoire naturelle de la maladie pulmonaire est une dégradation progressive de l'état respiratoire, évoluant par poussées, débutant par des symptômes tels qu'une toux et des crachats et aboutissant à une insuffisance respiratoire grave voire à un cœur pulmonaire chronique[122],[139],[141],[142].
Les premières manifestations respiratoires sont une toux chronique ou récurrente — initialement sèche — parfois paroxystique et pouvant entraîner des vomissements, puis grasse et éventuellement purulente, des crachats et des difficultés expiratoires qui surviennent lorsque la fonction respiratoire se détériore. Des épisodes de bronchites chroniques surviennent chez l'enfant et entraînent progressivement des lésions de l'arbre bronchique menant à des bronchectasies.
Une fois l'atteinte respiratoire bien installée, les malades peuvent présenter des douleurs thoraciques, des pneumopathies récurrentes, des formes atypiques d'asthme et un wheezing récurrent. Des épisodes de pneumothorax ou d'hémoptysies peuvent engager le pronostic vital. Toutes ces manifestations sont des complications pulmonaires et peuvent parfois être les manifestations initiales révélatrices de la maladie.
Les lésions des poumons s'aggravent progressivement, avec formation d'abcès et de kystes et fibrose du parenchyme pulmonaire proches des voies aériennes, aboutissant à une insuffisance respiratoire majeure.
À l'examen clinique du patient, on peut retrouver un hippocratisme digital ou une dystrophie thoracique d'apparition précoce et témoignant de la bronchopathie chronique obstructive[142]. L'auscultation est variable selon l'atteinte pulmonaire, elle peut être normale ou retrouver des sibilants ou des râles bronchiques.
À la radiographie pulmonaire on retrouve des images bronchiques et alvéolaires non spécifiques comme un épaississement péribronchique, une distension pulmonaire avec emphysème, une atélectasie, un foyer alvéolaire, des signes de bronchectasies[142].
Manifestations digestives
Manifestations intestinales
Les manifestations surviennent dès la période néonatale sous forme d'un iléus méconial qui survient chez 10 à 20 % des enfants porteurs de la maladie et peut être diagnostiqué lors de l'échographie morphologique montrant l'existence d'une hyperéchogénicité intestinale[143]. Cet iléus méconial correspond à une occlusion intestinale aiguë néonatale basse qui se traduit chez le nouveau-né par l'absence d'émission de méconium associé à des vomissements et à des ballonnements. Le lavement permet l'évacuation d'un méconium obstructif visqueux[142].
Le syndrome de l'occlusion intestinale distale (SOID), qui touche plus volontiers l'enfant, est une occlusion de l'intestin grêle qui mime la crise appendiculaire.
Le reflux gastro-œsophagien est fréquent chez le nourrisson, parfois majoré par les manœuvres de kinésithérapie respiratoire et la toux chronique. Ce reflux ne s'amende pas avec l'âge de l'enfant à l'inverse de la majorité des reflux gastro-œsophagiens.
Le prolapsus rectal est également plus fréquent chez les nourrissons mucoviscidosiques et justifie la réalisation d'un test de la sueur. Il est favorisé par un volume de selles plus important, la malnutrition et l'augmentation de pression intra abdominale lors des efforts de toux et de défécation[144].
Une sténose colique peut se voir lors d'un surdosage du traitement par enzymes pancréatiques. Une hémorragie digestive complique les manifestations hépato-biliaires.
Manifestations hépato biliaires

L'atteinte hépato-biliaire de la mucoviscidose est fréquente mais n'évolue vers la cirrhose biliaire que dans 10 à 15 % des cas[142]. Elle se traduit par une élévation de la viscosité de la bile puis par une obstruction à l'évacuation de cette dernière dans les canaux hépatiques vers la vésicule biliaire. La conséquence est l'apparition d'un ictère rétentionnel néonatal (coloration jaune de la peau et des muqueuses) qui est le reflet de l'élévation de la bilirubine conjuguée dans le sang. Biologiquement on note l'élévation concomitante des transaminases et des γGT.
La cirrhose biliaire multifocale se complique de la même manière qu'une cirrhose commune avec l'apparition d'une hypertension portale et d'hémorragies digestives, d'une insuffisance hépatocellulaire et d'épisodes de décompensation œdémato-ascitique.
La vésicule biliaire est souvent atrophique et on peut parfois retrouver également une lithiase vésiculaire, le plus souvent asymptomatique mais pouvant aggraver une pathologie pancréatique sous-jacente.
Manifestations pancréatiques
L'insuffisance pancréatique exocrine est présente chez la grande majorité des patients, dans environ 90 % des cas[142]. Elle est responsable d'un défaut d'absorption des graisses (acides gras essentiels), des protéines et des vitamines liposolubles (A, D, E, K, et parfois hydrosoluble comme B12). La malabsorption des graisses entraîne une diarrhée chronique graisseuse (caractérisant la stéatorrhée) avec ballonnement abdominal et appétit conservé qui contraste avec l'hypotrophie pondérale puis staturale. Le trouble de l'absorption de la vitamine D entraîne une mauvaise minéralisation des os et un risque de rachitisme et de fracture. Parmi les autres manifestations de la malabsorption, on retrouve une insuffisance de croissance, un retard pubertaire, une anémie, des troubles carentiels (en vitamines, oligo-éléments et minéraux).
On peut voir parfois l'apparition de pancréatite aiguë ou chronique, plus fréquemment chez les patients avec une fonction pancréatique conservée[122].
Un diabète insulinoprive, traduit une atteinte de la fonction endocrine du pancréas, secondaire à la destruction des îlots de Langerhans par la fibrose et à des anomalies fonctionnelles de la sécrétion d’insuline. Ce diabète est différent du diabète de type 1 auto-immun. Il touche entre 13 et 16 % des malades, sa prévalence augmentant avec l’âge et le sexe féminin. L'âge médian de découverte est de 20 ans. Il ne se développe pas chez les patients sans insuffisance pancréatique[138].
Manifestations génitales
Les manifestations génitales de la mucoviscidose posent un problème de plus en plus important avec l'amélioration de la survie et le désir d'enfant des patients[142].
Chez la femme on retrouve une hypofertilité due à des modifications de la glaire cervicale, néanmoins les grossesses de femmes mucoviscidosiques ne sont plus rares.
Chez l'homme on retrouve une stérilité par atrésie bilatérale des canaux déférents. La découverte de cette anomalie lors de l'investigation d'une infertilité d'un couple doit d'ailleurs faire rechercher systématiquement cette pathologie. L'atrophie ou hypoplasie des voies excrétrices des spermatozoïdes (canal déférent et vésicules séminales) entraîne une azoospermie ou oligospermie sévère (moins de 5 millions de spermatozoïdes par ml). La composition du sperme est aussi modifiée[145] :
| Normal | Mucoviscidose | |
|---|---|---|
| pH | >8 | <7 |
| Acide citrique | 400-1 500 mg/100 ml | > 2 000 mg/100 ml |
| Phosphatase acide | 140-290 µg/ml | 760-1 140 µg/ml |
| Fructose | 250-720 mg/100 ml | 30–80 mg/100 ml |
Autres manifestations
Les affections rhinosinusiennes sont fréquentes. La qualité du mucus dans les sinus est la même que celle des bronches. Une inflammation et une infection chronique entraîne une sinusite chronique et secondairement une polypose nasale[146],[147].
Les désordres hydroélectrolytiques avec déshydratation par perte de sel peuvent apparaitre lors d'efforts ou de forte chaleur. Le diagnostic de mucoviscidose devant un tableau de déshydratation avec hyponatrémie, hypochlorémie et alcalose métabolique n'est pas rare notamment l'été[148].
Une Cardiomyopathie probablement d'origine carentielle peut être décrite[149] ainsi qu'une hypertension artérielle pulmonaire consécutive à un cœur pulmonaire chronique.
Diagnostic et dépistage
Résumé
Contexte
Diagnostic
La suspicion de mucoviscidose se base sur les signes cliniques suivants mais cette liste n'est pas limitée :
- Des maladies pulmonaires ou bronchiques chroniques, récidivantes (toux chronique, encombrement et syndrome obstructif chronique, colonisation par certains germes, anomalies radiologiques, sinusites chroniques, hippocratisme digital)
- Des troubles digestifs (iléus méconial, prolapsus rectal, insuffisance pancréatique et syndrome de malabsorption, maladies hépatobiliaires chroniques)
- Une azoospermie,
- Un syndrome de perte de sel…
Le diagnostic est établi chez une personne présentant un ou plus des signes cliniques précédents associés à au moins un des signes de mauvais fonctionnement du gène CFTR suivants :
- Présence de mutation anormale du gène CFTR sur chacun des chromosomes 7, ou
- Deux tests de la sueur positifs (>60 mEq/L), ou
- Une recherche de différence de potentiel de l'épithélium nasal positive.
En l'absence de signe clinique, le diagnostic peut être fait :
- si un enfant est porteur de la même mutation du gène CFTR sur chacun des chromosomes 7 qu'un de ses frères et sœurs malades de la mucoviscidose,
- au cours d'un dépistage néo natal systématique (en 2002, 12,8 % des mucoviscidoses sont diagnostiquées de cette façon aux États-Unis),
- au cours d'un dépistage in utero (en 2002, 4 % des mucoviscidoses sont diagnostiquées pendant la période prénatale aux États-Unis).
Test de la sueur
Le test de la sueur est le dosage du chlore contenu dans la sueur du patient et représente un des principaux tests diagnostiques de la mucoviscidose. Il comprend trois temps : l'obtention de la sueur, le recueil de la sueur et la détermination de la concentration en chlorure[151].
La méthode de référence pour obtenir de la sueur est la stimulation des glandes sudoripares, au niveau de la face interne du bras, au-dessus du pli du coude, par iontophorèse à la pilocarpine[152] : le passage d’un faible courant à travers la peau entre deux électrodes permet de faire passer la pilocarpine — molécule possédant des propriétés cholinergiques — à travers la peau, stimulant ainsi la sécrétion de sueur par les glandes sudoripares.
La méthode de référence pour le recueil de la sueur, délicat, est le recueil sur papier filtre[152], décrite par Gibson et Cooke[31]. Il faut recueillir un échantillon d'au moins 100 mg de sueur. L'âge minimum requis est de 5 semaines avec un poids corporel d'environ 4 kg[152]. Cet examen indolore dure 15 à 30 minutes.
Les méthodes utilisées pour déterminer la concentration en chlorures de la sueur sont de trois catégories : les méthodes quantitatives qui mesurent avec précision le poids de la sueur recueillie, les méthodes semi-quantitatives qui déterminent la concentration en électrolytes avec une approximation du volume recueilli et les méthodes qualitatives basées sur des réactions chimiques de précipitation permettent une estimation qualitative de la concentration en chlorures[152].
Chez les malades, les glandes sudoripares ont une teneur augmentée en ions Na+, K+ et Cl-. On ne teste cependant que la teneur en chlorure, plus discriminative que la teneur en sodium pour poser le diagnostic[153].
Un test de la sueur retrouvant une concentration de chlore supérieure à 60 mmol·l-1 (millimoles par litre) est dit positif et est en faveur du diagnostic de mucoviscidose, il doit être positif à deux reprises pour affirmer le diagnostic. Un test retrouvant une concentration de chlore intermédiaire comprise entre 40 mmol·l-1 et 60 mmol·l-1 est douteux et suggère le diagnostic sans pour autant le poser avec certitude, des examens complémentaires sont nécessaires. Une concentration inférieure à 40 mmol·l-1 est normale et le risque de mucoviscidose est faible.
Ce test est sensible, positif chez plus de 90 % des cas de mucoviscidose[122]. Il n'y a pas de corrélation entre la valeur retrouvée lors du test et la gravité de l'atteinte[154]. Le test ne permet pas d'identifier les sujets hétérozygotes qui transmettent la maladie même si ceux-ci ont statistiquement des concentrations intermédiaires.
Les résultats supérieurs à 160 mmol l−1 ne sont pas physiologiquement possibles et sont à rapporter avec un problème technique[122].
Les faux positifs — le test est positif mais la personne n'est pas malade — exceptionnels, peuvent se retrouver dans le syndrome de Hurler, la fucosidose, la glycogénose de type 1, l'insuffisance surrénalienne aiguë, un déficit en alpha-1-antitrypsine, une hypothyroïdie, une dysplasie ectodermique, un diabète insipide, une néphronophtise[155], une anorexie, une dysfonction du système nerveux autonome, une maladie cœliaque, une cholestase familiale, une hypogammaglobulinémie, une hypoparathyroïdie, un syndrome de Klinefelter, une malnutrition, une mucopolysaccharidose de type 1, un pseudohypoaldosternonisme[150].
À l'inverse il existe de rares cas de mucoviscidose avec un test de la sueur douteux ou négatif. Quelques mutations sont associées à des résultats limites telles que R117H, 3849 + 10kb C-T, R334W ou P67L[156],[157],[158]. Très rarement, le test peut même être normal chez un patient présentant un génotype mucoviscidosique avéré[159],[160],[161],[162]. De plus environ 1 à 2 % des malades ont une concentration de chlore inférieure à 60 mmol·l-1[163]. Dans cette situation, seule l'identification de deux mutations sur le gène CFTR permet un diagnostic de certitude.
Différence de potentiel de l'épithélium nasal
Cet examen proposé par Knowles[164] puis standardisé[165],[166] consiste à mesurer la différence de potentiel (DDP) de l'épithélium nasal et permet l'exploration in vivo des transports ioniques transépithéliaux. Il peut être utilisé à partir de 6 ans et il est réalisé dans de nombreux centres dans le monde dans le cadre de la démarche diagnostique. La mesure de la DDP nasal est accompagnée par des tests pharmacologiques associés destinées à mieux différencier la population malade de la non malade.
La DDP nasal n'est pas corrélée avec le test de la sueur ou avec la sévérité de la maladie ; et cette méthode ne détecte pas les sujets hétérozygotes[167]. La valeur basale de la DDP nasal est modifiée par des pathologies telles l'inflammation, l'infection ou la polypose nasale[167],[168].
Les individus atteints de mucoviscidose comparés à des individus indemnes ont[122] :
- Une différence de potentiel élevée (plus négative) reflétant une absorption accrue du sodium,
- Une variation plus importante de la différence de potentiel durant l'administration au niveau de la muqueuse nasale d'amiloride, un inhibiteur de l'absorption sodique,
- Des variations minimes de la différence de potentiel sous perfusion d’amiloride, de solution sans chlore et d'un agoniste ß2.
La mesure de la DDP nasal avec stimulations pharmacologiques dans le bilan de la mucoviscidose n'a pas d'intérêt dans les formes typiques de la maladie mais elle est intéressante dans les formes cliniques atypiques associées à des tests de la sueur « limites[169] ».
Génotypage
Le génotypage par analyse génétique à partir d'un échantillon de sang vise à rechercher la présence d'une mutation anormale sur le gène CFTR. Il est essentiellement utilisé lors de la démarche diagnostique lorsque le test à la sueur n'est pas réalisable ou non informatif. Il peut être utilisé en première intention dans les cas suivants[122]:
- Dépistage prénatal chez un fœtus à haut risque,
- Dépistage prénatal chez un fœtus à faible risque mais avec une hyperéchogénicité digestive fœtale,
- Dépistage néonatal,
- Enfants symptomatiques (avec un iléus méconial) trop jeunes (moins de 5 semaines) pour pouvoir réaliser un test de la sueur (impossibilité de collecter une quantité suffisante de sueur),
- Dépistage de la fratrie d'un patient atteint chez qui on a identifié les deux mutations du gène CFTR.
L’analyse génétique par la méthode de détection ciblée recherche les mutations parmi les plus fréquentes. En 2004, l'American College of Medical Genetics (ACMG) recommandait des kits analysant la présence de 23 mutations parmi les plus fréquentes, permettant d'atteindre un taux de détection allant de 57 % à 97 % selon les populations étudiées[122]. D'autres méthodes telles la recherche de réarrangements, délétions, insertions, duplications ou la méthode de balayage d’exons permettent de compléter l'analyse.
Chez un homme avec azoospermie ou oligospermie
La recherche d'une hypoplasie voire une agénésie des vésicules séminales et/ou des déférents par un urologue ou par d'imagerie médicale est la première étape. Si celle-ci est positive la recherche de mutation du gène CFTR est réalisée.
Diagnostic différentiel
Face à des éléments cliniques évoquant la mucoviscidose, se pose le problème d'un diagnostic différentiel avec d'autres maladies telles que :
- Une dilatation des bronches due à d'autres causes telles qu'un déficit immunitaire, un syndrome d'immobilité ciliaire, des séquelles de virose pulmonaire sévère (adénovirus), une pneumopathie négligée (tuberculose), une dysplasie bronchopulmonaire ;
- Un wheezing chronique, un asthme[170],[171] ;
- Un tabagisme passif pouvant entraîner des manifestations respiratoires peu spécifiques ;
- Une maladie de Hirschsprung ou un syndrome du bouchon méconial, dans les formes de mucoviscidose avec occlusion intestinale néonatale associée[172],[173] ;
- Un déficit en alpha-1-antitrypsine, avec emphysème pulmonaire et signes respiratoires ;
- Un syndrome de dyskinésie ciliaire dont la maladie de Kartagener, exceptionnelle ;
- Un syndrome de Shwachman-Diamond[174] ;
- Des pancréatites aiguës récidivantes[175],[176] ;
- Une insuffisance pancréatique chronique[177].
Dépistage
Dépistage néonatal systématique
Les arguments en faveur d'un dépistage systématique sont :
- L'existence d'un test fiable,
- Le diagnostic parfois tardif de la maladie en raison des formes frustes,
- Le bénéfice d'un diagnostic et d'une prise en charge précoce des enfants atteints : plus la prise en charge - nutritionnelle essentiellement - est précoce, meilleur est le pronostic.
Il se déroule en deux étapes[178],[179] :
- Le test consiste à doser la trypsine immuno–réactive (TIR), proenzyme sécrétée par le pancréas circulant dans le sang. Il est réalisé trois jours après la naissance de l'enfant à partir d'une goutte de sang séchée en même temps que le dépistage de la phénylcétonurie, de l'hypothyroïdie et de l'hyperplasie congénitale des surrénales.
- La détection d'un niveau anormalement élevé de trypsine (>60 μg/l) conduit à réaliser un diagnostic par génotypage à la recherche des mutations CFTR les plus fréquentes. Le test génétique nécessite au préalable l'accord écrit et signé des parents (en France la loi traitant de l’analyse de l’ADN à des fins médicales est le Décret no 2000-570 du [180]).
Les enfants chez lesquels une anomalie génétique (une ou deux mutations CFTR) est mise en évidence subiront dans le mois suivant leur naissance un test à la sueur pour déterminer leur statut de malade ou de porteur hétérozygote. Si aucune mutation n’est retrouvée, un contrôle de la trypsine est fait à J21.
Tous les programmes de dépistage utilisent maintenant ce test couplé TIR-ADN. La recherche des mutations comprend au minimum la mutation ΔF508 mais utilise le plus souvent des kits avec 20, 30 voire 50 mutations, représentant plus de 90 % des mutations existantes[179]. Ces programmes de dépistage ne sont pas encore figés et sont évolutifs afin de devenir le plus efficace possible.
- En France
La France a été le premier pays à instaurer un programme de dépistage néonatal systématique fin 2002, dans les 3 premiers jours de vie à la maternité[178]. Entre fin 2002 et fin 2005, 2 717 992 nouveau-nés ont bénéficié de ce programme. Une TIR élevée a été retrouvée chez 18 610 nouveau-nés (soit 0,7 % du total) ; 18 054 (soit 98 % d’entre eux) ont bénéficié d'une recherche des principales mutations du gène CFTR ; 3 469 enfants (soit 1,3 pour 1 000 nouveau-nés testés) ont été adressés à un CRCM (Centre de Références et de Compétences de la Mucoviscidose) parce qu’ils avaient 1 ou 2 mutations (n=2003) ou parce qu’ils avaient une hypertrypsinémie persistante à J21 (n=1466) ; 621 mucoviscidoses ont ainsi été diagnostiquées soit une incidence de 1 pour 4 376 naissances, très variables selon les régions (de 1/2 749 en Bretagne pour la plus forte à 1/7 077 en Midi-Pyrénées pour la plus faible)[181]. Le kit CF30 détectait 87 % des mutations[179].
Le , le Comité consultatif national d'éthique (CCNE) français a émis un avis s'opposant à l'information des parents des enfants hétérozygotes :
- « [Que] la révélation systématique du statut de porteur sain d'un nouveau-né ne soit pas encouragée, compte tenu de l'absence d'intérêt direct pour l'enfant. »
- « Il s'agit de ne pas transformer un être humain en un être enfermé dans son statut génétique, avec le risque de sacralisation du gène que cela comporte. »
L'information concernant l'hétérozygotie ne devrait être délivrée que sur une demande de l'enfant dépisté et arrivé en âge de procréer mais sachant que ces enfants hétérozygotes et leurs parents sont convoqués pour un test de la sueur, il est difficile de ne pas révéler cette information dès la naissance. De même, les parents d'enfants considérés comme hétérozygotes, sont en droit de s'interroger sur leur propre hétérozygotie notamment dans le cas où ils auraient l'intention d'avoir des enfants dans le cadre d'une autre union.
Dépistage prénatal
Un diagnostic anténatal ou pré-implantatoire est proposé si le conseil génétique détermine qu'un couple a un risque de 25 ou de 50 % d'avoir un enfant malade, ce qui est le cas chez les couples hétérozygotes déjà détectés lors de la naissance d'un enfant malade. Les demandes de couples à faible risque (fratrie de parents d'enfants malades) sont également de plus en plus fréquentes[182],[142].
Chez les couples hétérozygotes, l'analyse de l'ADN du fœtus pour recherche de mutation, par biopsie de villosité choriale peut être réalisée de façon fiable et précoce à 12 ou 13 semaines d'aménorrhée. Si cette analyse moléculaire est impossible on peut pratiquer une amniocentèse à 18 semaines pour le dosage des isoenzymes de la phosphatase alcaline dans le liquide amniotique. Un taux normal élimine une mucoviscidose alors qu'un taux effondré est évocateur mais non spécifique et nécessite la réalisation d'un caryotype[182],[142].
Une obstruction intestinale fœtale découverte de façon fortuite lors d'une échographie doit faire rechercher la mucoviscidose dont le risque est alors estimé entre 2 et 5 %. Cette anomalie peut être révélée par une hyperéchogénicité ou une dilatation intestinale et elle est secondaire à diverses affections telles qu'un illéus méconial, une atrésie jéjunoiléales, un syndrome de bouchon méconial, un volvulus ou une péritonite méconiale, qui peuvent toutes révéler une mucoviscidose. L'absence de visualisation de la vésicule biliaire au cours de l'échographie fœtale est aussi considérée comme un signe d'appel. Dans ces cas, un diagnostic prénatal est proposé aux parents[182],[183].
Le dépistage anténatal systématique à toutes les femmes enceintes n'a pas été recommandé par le Comité consultatif national d'éthique pour les sciences de la vie et de la santé (CCNE) dans son avis no 83 du [184] qui avait conclu que « le dépistage prénatal est entièrement justifié en cas d'antécédents familiaux ou de connaissance d'hétérozygotie chez un membre du couple, qu'il est à encourager au stade prénuptial ou préconceptionnel pour des familles à risque, qu'il peut trouver une légitimité dans les régions à prévalence importante du gène muté, mais qu'en revanche sa généralisation à l'ensemble d'une population pose des problèmes non seulement éthiques, mais aussi scientifiques, juridiques et économiques. »
Pour les grossesses à haut risque de transmission de la maladie, le diagnostic préimplantatoire est possible chez les couples devant recourir à une procréation médicalement assistée et chez qui la mutation a été identifiée. Ce diagnostic autorisé en France et aux États-Unis mais pas dans tous les pays, consiste à faire l'étude de l'ADN recueilli sur des cellules de l'embryon obtenu après fécondation in vitro. Seuls les embryons non porteurs de la mutation ou hétérozygotes sont transférés.
Conseil génétique

Le conseil génétique a pour but d'apprécier le risque de récurrence - d'apparition - de la maladie au sein d'une famille à risque. Il découle du mode de transmission de la maladie qui est récessive et non liée au sexe ce qui implique que le risque de récurrence est de 1 sur 4, c'est-à-dire que si deux parents sont porteurs hétérozygotes d'une mutation pathogène du gène CFTR, ils ont un risque de 25 % d'avoir un enfant homozygote malade. Ils ont également une chance sur 4 d'avoir un enfant sain porteur du gène normal et une chance sur 2 d'avoir un enfant hétérozygote, porteur sain d'une seule allèle anormale et non malade.
Risque pour les membres d'une famille d'un enfant mucoviscidosique
- Frères et sœurs d'un enfant malade
La probabilité d’être hétérozygote pour les frères et sœurs d'un malade est de 2 sur 3. Une recherche de mutation est possible afin de préciser le statut génétique de chaque membre de la fratrie. Cette recherche est importante dans le cadre d’un projet parental ; si un porteur sain est détecté, son conjoint peut également bénéficier d'une recherche de mutations afin de déterminer si un risque existe[182].
- Descendant d'un sujet atteint de mucoviscidose
Les femmes sont fertiles, mais il leur est difficile d'avoir un enfant. Environ 98%[185] des hommes atteints de la maladie sont stériles, à cause de l'atrésie bilatérale des canaux déférents et devront avoir recours aux techniques de procréation médicalement assistée. Chacun des descendants d'un couple dont un des membres est atteint de la mucoviscidose sera porteur d'un gène de la maladie, le risque d'être malade - d'être homozygote - dépendra du statut génétique du conjoint du patient; si celui-ci n'est porteur d'aucune mutation, le risque est très faible (mais possible dans le cas d'une mutation rare non détectée); s'il est hétérozygote, le risque sera de 1 sur 2[182]. Le dépistage des mutations du CFTR chez le conjoint dépendra de son historique génétique.
Dépistage des porteurs hétérozygotes
Pour que l'enfant présente la maladie, il faut que les deux parents soient porteurs d'une mutation du gène CFTR (porteurs sains hétérozygotes) ou plus rarement qu'un parent soit atteint de la maladie et l'autre porteur sain hétérozygote. Environ deux millions de personnes sont porteurs sains d'une mutation du gène CFTR en France.
Si les deux parents sont porteurs sains d'une mutation du gène alors l'enfant a une probabilité sur quatre de porter la maladie, si aucun des deux parents ou un seul est porteur d'une mutation du gène CFTR, la probabilité que leurs enfants à naître aient la maladie est extrêmement réduite[186]. Le dépistage d'un porteur sain ne peut se faire que par analyse de son ADN à l'aide de test moléculaire puisqu'il ne présente pas de symptôme. Pour déterminer si les parents d'un couple sont porteurs sains, notamment à l'occasion d'une grossesse, un dépistage de la femme peut être proposé (car c'est elle qui consulte le plus souvent), et en cas de test positif, un test peut être fait par la suite sur le père.
Toutefois, cette méthode ne permet pas l'éradication de la maladie. En effet, même si un test prénatal est effectué sur les deux parents, et que l'un de ces tests est négatif, cela ne garantit pas que l'enfant n'aura pas la maladie puisque l'analyse ADN du gène CFTR peut donner de faux négatifs, toutes les mutations du gène n'étant pas connues (la principale mutation ΔF508 représentant moins de 70 % des cas)[184].
Dépistage lors du don de sperme
En France, les généticiens proposent de ne pas dépister systématiquement les donneurs hétérozygotes pour rester dans la même situation qu'en procréation naturelle où le dépistage systématique n'est pas justifié[187].
Évolution et pronostic
Résumé
Contexte
L'espérance de vie des patients dépend des possibilités d'accès aux soins et augmente avec l'amélioration de la prise en charge, notamment nutritionnelle et respiratoire. L'espérance de vie des patients est comparable dans les différents pays développés, mais non dans les pays en voie de développement. En l'absence de traitement, la médiane de survie est de 3 à 5 ans[119].
Au Canada, en 1959, l'espérance de vie à la naissance[8] était de 4 ans[188] ; en 1977 la vie médiane[189] — qui est l’âge que devrait dépasser la moitié de la population — est de 22,8 ans ; en 1987 elle est de 28,8 ans, en 1997 de 33 ans et en 2002 de 37 ans[190].
En France, les données 2005 du Registre Français de la Mucoviscidose[9], reposant sur l'étude d'environ 80 % des patients français, indiquent pour la période 2003-2005 un âge moyen de décès de 24 ans, une espérance de vie à la naissance de 47 ans et une vie médiane de 46,7 ans. Les données 2015 du Registre Français de la Mucoviscidose indiquent un âge moyen de décès de 34 ans[191].
Une étude internationale a retrouvé que l'âge médian au décès était passé de 8 ans en 1974 à 21 ans en 1994[192]. Aux États-Unis, pour les enfants nés en 2006, l'espérance de vie est maintenant de 36,8 années, soit 5 années de plus par rapport au chiffre de 2002[193].
La mucoviscidose touche de façon égale les hommes et les femmes mais pour des raisons encore inexpliquées, l'atteinte est souvent plus grave chez les femmes, avec une infection par Pseudomonas aeruginosa plus précoce, une atteinte pulmonaire et des troubles nutritionnels plus sévères et une espérance de vie plus courte que pour les hommes[99],[100],[101].
Prise en charge et traitement de la maladie
Résumé
Contexte
Les progrès de la prise en charge de la mucoviscidose ont permis d'améliorer la qualité et l'espérance de vie des patients ; ainsi en France, l'espérance de vie à la naissance est passée de 7 ans en 1965 à 47 ans en 2005[9].
Les principaux objectifs de la prise en charge sont l'éducation du patient et de sa famille; la prévention, la détection et le traitement précoce des complications bronchopulmonaires, digestives, rénales, ORL et osseuses; le maintien d'une fonction respiratoire et d'un état nutritionnel optimal, un soutien psychologique régulier et une amélioration globale de la qualité de vie[194].
Aucun traitement curatif, médicamenteux ou thérapie génique, n'est actuellement disponible. Le traitement proposé est symptomatique, destiné à soulager les symptômes de la maladie, et nécessite une prise en charge multi-disciplinaire avec une bonne coordination entre divers spécialistes tels que le pédiatre, le kinésithérapeute, le diététicien ou le psychologue. Il consiste essentiellement en une prise en charge de l'atteinte respiratoire par un drainage bronchique et des antibiotiques, et de l'atteinte digestive et nutritionnelle par une supplémentation en extraits pancréatiques, vitamines et calories[88]. Depuis les années 2010, de nouvelles thérapies (elexacaftor/ivacaftor/tezacaftor) ciblant les dysfonctions liées à certaines mutations de la protéine CFTR ont considérablement amélioré les symptômes de la maladie[195].
La prise en charge particulièrement lourde et astreignante dans la mucoviscidose entraine pour le patient des contraintes importantes qui retentissent sur sa qualité de vie et sur celle de sa famille et qui favorisent la mauvaise observance thérapeutique, pouvant accélérer l'évolution délétère de la maladie[196].
Traitement palliatif symptomatique
Voies respiratoires
Le traitement palliatif de l'atteinte des voies respiratoires a deux objectifs principaux : l'aide à la clairance mucociliaire et le contrôle de l’infection. Pour cela on a recours à la kinésithérapie respiratoire, à des antibiothérapies, à des traitements par bronchodilatateurs, anti-inflammatoires ou fluidifiants mucolytiques. Dans les cas les plus sévères, une greffe pulmonaire ou cœur-poumon peut être envisagée.
Kinésithérapie
Plusieurs techniques mécaniques sont utilisées pour déloger les expectorations et favoriser leur expectoration. Une technique efficace pour le dégagement à court terme des voies respiratoires est la kinésithérapie respiratoire manuelle, au cours de laquelle un kinésithérapeute percute la poitrine d'une personne à la main plusieurs fois par jour, afin de décoller les sécrétions. Cela peut également être administré par des dispositifs. Ces appareils sont portables et adaptés à une utilisation à domicile. L'efficacité de la kinésithérapie manuelle est similaire à l'efficacité des dispositifs. Il n'y a pas de preuve d'effet à long terme sur la fonction pulmonaire[197].
Un autre dispositif efficace utilisé par les kinésithérapeutes est l'appareil à pression expiratoire positive (PEP). Il fournit une contre-pression aux voies respiratoires lors de l'expiration. La PEP s'utilise préférentiellement avec un masque plutôt qu'un tube en bouche afin d'éviter les fuites d'air par les voies respiratoires supérieures et la bouche. C'est la technique pratiquée par les kinésithérapeutes pour laquelle il y a le plus de preuve d'efficacité sur différents paramètres ventilatoires, même si les preuves sont de faible qualité[198].
Antibiothérapie


Les infections et surinfections bronchiques aiguës ou chroniques qui vont détériorer progressivement la fonction respiratoire, sont traitées par une antibiothérapie déterminée par les examens bactériologiques. La mise en culture des crachats (examen cytobactériologique des crachats) ou de prélèvements de sang (hémoculture) permet de déterminer le germe principal en cause, d'évaluer l'importance de la colonisation, et de savoir quels antibiotiques seront efficaces. Les germes principaux (Staphylococcus aureus, Pseudomonas aeruginosa et Burkholderia cepacia) développent habituellement et rapidement des résistances aux antibiotiques. Aussi, les posologies préconisées restent encore mal définies et sont souvent supérieures à celles préconisées dans l’AMM des produits. Il n'est donc pas rare que l'on utilise des doubles antibiothérapies par voie intraveineuse pouvant être accompagnées d'une antibiothérapie inhalée d'entretien. Les aérosols d'antibiotiques doivent être effectués après désencombrement et administration de bêta-2-mimétiques et de rhDNase[139].
Sont généralement utilisés :
- Les bêta-lactamines comme les pénicillines et les céphalosporines, parce que ce sont des antibiotiques à large spectre d'action et souvent bien tolérés même si la prévalence de l'allergie aux bêta-lactamines est plus importante que dans la population générale - de l'ordre de 6 à 22 % des patients - et que leur toxicité hépatique doit être contrôlée après chaque cure[139]. Parmi les antibiotiques utiles de cette classe, on peut citer la ceftazidime ou le méropénem...
- Les aminosides par voie intraveineuse en association avec d'autres antibiotiques contre le Pseudomonas[200], voir la tobramycine utilisée en nébulisation[201]. Leur ototoxicité doit être contrôlée par un audiogramme annuel, leur néphrotoxicité par des dosages du taux résiduel et par un contrôle de la créatininémie à chaque cure[139].
- Les fluoroquinolones sur le Pseudomonas, même chez les enfants[202] (risque majorée d’arthropathie et de tendinopathie[194]),
- La fosfomycine sur le Pseudomonas multirésistant[203],
- L'acide fucidique sur les Staphyloccoques[204],
- etc.
Concernant la stratégie thérapeutique à adopter vis-à-vis des principales infections, la Société française de pédiatrie donnait en 2002 les recommandations suivantes[139] :
- Dans l'infection à Staphylococcus aureus, elle ne recommandait pas de traitement prophylactique primaire chez le nourrisson et l’enfant. En première intention elle recommandait, dans les exacerbations à Staphylococcus aureus sensible à la méticilline (SASM), une bêta-lactamine per os, associée ou non à l’acide fusidique, pendant au moins 14 jours. Et dans l'exacerbation à Staphylococcus aureus résistant à la méticilline (SARM), une bithérapie pristinamycine-rifampicine. Elle ne donnait pas de recommandation, devant l'absence de consensus, pour l'antibioprophylaxie secondaire (ou traitement d'entretien).
- Dans l'infection à Pseudomonas aeruginosa (PA) elle recommandait en cas de primocolonisation l'association de deux antibiotiques bactéricides par voie intraveineuse pendant 14 à 21 jours (bêta-lactamine + aminoside), suivis ou non d'aérosols de colistine pendant 3 à 6 mois. Au stade de l'infection chronique, elle recommandait de traiter les exacerbations par une bithérapie afin d'éviter l'émergence de souches résistantes : association d’une bêta-lactamine et de tobramycine pendant au moins 14 jours, ou dans le cas de souches multirésistantes, une trithérapie non validée associant à la bithérapie la ciprofloxacine per os ou la colistine par voie IV. Un traitement d'entretien systématique programmé, par cure d'antibiotiques inhalés de 28 jours ou cures systématiques IV trimestrielles, si possible réalisé à domicile, pouvait être envisagé sans qu'aucune règle ne soit encore établie.
Mucolytiques
Des médicaments mucolytiques (expectorants ou fluidifiants bronchiques) sont utilisables pour rendre le mucus moins visqueux et faciliter son évacuation.
La rhDNase, ou dornase alfa (Pulmozyme) est une désoxyribonucléase recombinante humaine, similaire à l'enzyme humaine qui hydrolyse l'ADN extracellulaire[205]. Elle agit en 30 minutes en clivant l'ADN des composants du mucus, ce qui en diminue la viscosité et ce qui facilite la clairance liée à la toux. Son administration améliore la fonction respiratoire et diminue le nombre d'exacerbations nécessitant une antibiothérapie. Son efficacité clinique est inconstante et disparaît rapidement après l'arrêt du traitement. Elle est indiquée chez les patients de plus de 5 ans ayant une CVF supérieure ou égale à 40 % de la théorique. Elle s'administre à raison de 1 à 2 nébulisations par jour qui doivent être précédées d'un drainage bronchique proximal et suivies d'une séance de kinésithérapie respiratoire[139].
Bronchodilatateurs
Il n'y a pas assez de preuves de l'intérêt des bronchodilatateurs dans la mucoviscidose pour recommander leur prescription systématique[139]. Les anticholinergiques ne sont pas recommandés car ils n'ont pas démontré d'efficacité[206] et auraient même une action délétère[139]. Le constat reste vrai en 2021 pour les anticholinergiques à base de trotopium utilisés dans le traitement de la bronchopneumopathie chronique obstructive[207]. Les bêta-2-mimétiques peuvent être utilisés lors des périodes d'exacerbations, au long cours lors des périodes de stabilité et avant le début des séances de kinésithérapie[139]. Ils ont, selon une revue Cochrane de 2005, des effets bénéfiques sur les fonctions pulmonaires chez les patients présentant une hyperréactivité bronchique ou une réversibilité (complète ou partielle) du syndrome obstructif à la spirométrie[206].
Corticothérapie
La corticothérapie par voie orale est indiquée en cas d'absence d'amélioration au 14e jour d'une cure d'antibiothérapie ou d'antifongique prescrite dans le cadre d'une exacerbation. Elle doit être de courte durée, ne dépassant pas deux semaines, en raison des effets délétères sur l'équilibre glycémique et la croissance ainsi que du risque de favoriser l’émergence d’une colonisation à Pseudomonas aeruginosa[139].
La corticothérapie inhalée n'est pas recommandée en prescription systématique en l'absence d'études suffisantes. Elle est indiquée en présence d'un asthme associé ou inflammation chronique du aux germes ou/et colonisation fongique[139].
Oxygénothérapie
Au stade de l'insuffisance respiratoire chronique, une oxygénothérapie (transitoire, de déambulation ou de longue durée) ou une ventilation non invasive peuvent être nécessaires[194].
Greffe pulmonaire
Les patients atteints de mucoviscidose étaient considérés initialement comme de mauvais candidats à la greffe pulmonaire notamment à cause de la surinfection bactérienne chronique des voies aériennes et de leur état nutritionnel précaire. La première transplantation cœur-poumon chez un patient mucoviscidosique est réalisée en 1984 et entre cette date et 2003 plus de 700 transplantations pulmonaires ont été réalisées dans cette indication[208],[80]. En 1999, un comité d'experts publie une conférence de consensus sur la transplantation pulmonaire chez les personnes atteintes de mucoviscidose et conclut que chez le patient atteint de mucoviscidose présentant une insuffisance respiratoire avancée, la transplantation pulmonaire est une option thérapeutique valable[209].
Lorsqu'il y a atteinte sévère de la voie respiratoire, marquée cliniquement par une insuffisance respiratoire avancée, la greffe de poumon (voire cœur-poumon dans certains cas) permet de restaurer une fonction respiratoire correcte et de prolonger la vie du patient mais ne permet pas de guérir la maladie.
La technique de référence est la transplantation bipulmonaire et ses résultats et complications sont comparables à ceux observés dans d'autres indications. La plupart des patients reçoivent par la suite une triple thérapie immunosuppressive à vie. À court terme la principale complication est l'infection du greffon, à moyen et long terme c'est le rejet chronique du greffon pulmonaire qui se manifeste par une bronchiolite oblitérante. La survie après greffe pulmonaire est d'environ 70 % à 1 an, 45 % à 5 ans et 15 % à 10 ans, ces chiffres s'améliorant lentement au fil des années[208].
Une équipe de Los Angeles réalise avec de bons résultats des greffes de deux lobes pulmonaires provenant de donneurs vivants issus de la même famille ou non apparentés[208].
Système otorhinolaryngologique
L'atteinte ORL est presque constante dans la mucoviscidose avec notamment sinusite chronique et polypose nasale. La thérapeutique de ces troubles ne fait pas l'objet d'un consensus. La chirurgie généralement proposée face à une polypose, n'évite pas une récidive précoce (à 4 ans en moyenne)[210]. Une chirurgie par voie endoscopique s'est donc développée pour améliorer les suites post-opératoires[211]. Une antibiothérapie par instillation locale, associée à l'endoscopie, diminuerait également les récidives de sinusites et le recours à une chirurgie conventionnelle[212].
Certains antibiotiques, et particulièrement les aminosides utilisés dans la lutte contre la surinfection des voies aériennes par P. aeruginosa, ont une toxicité dose-dépendante sur le rein et l'oreille interne (ototoxicité) et peuvent entrainer des effets secondaires tels que baisse ou perte totale de l'audition. L'apparition d'un trouble de l'audition chez ces patients doit être détectée précocement par une surveillance audiométrique régulière[213].
Prise en charge nutritionnelle et digestive
Les prises en charge de la dénutrition, des manifestations digestives et hépatobiliaires, ainsi que du diabète sont indissociables de la prise en charge des manifestations pulmonaires car chacune de ces atteintes contribue à la morbidité et à la mortalité de la maladie et peut aggraver l’atteinte pulmonaire[196].
Nutrition
La fréquence de la dénutrition est importante dans la mucoviscidose, quel que soit le stade évolutif, et varie selon les études de 15 à 44 % des patients. Il semble qu'un déficit nutritionnel important se rattrape mal par la suite ce qui est en faveur d'une prise en charge précoce de la dénutrition. Dans la mucoviscidose, la dénutrition est due à la fois à la réduction des ingesta (anorexie, inconfort digestif, régimes trop restrictifs, troubles du comportement alimentaire) et à l'augmentation des pertes (insuffisance pancréatique, insuffisance intestinale et perte sudorale et augmentation de la dépense énergétique de repos). Même s'il n'existe pas sur le sujet d’études prospectives contrôlées de grande ampleur, il semble que la dénutrition aggrave fortement la maladie. Pour ces raisons, il faut réaliser une évaluation de l’état nutritionnel dès le dépistage, puis à intervalles réguliers, par évaluation des paramètres cliniques, estimation de la balance énergétique, évaluation des principaux paramètres plasmatiques et étude du statut minéral osseux[196].
Chez le nourrisson dépisté à la naissance, l'allaitement maternel peut être recommandé si la croissance est normale. Chez ceux présentant une insuffisance pancréatique sans cassure des courbes de croissance, les formules lactées classiques semblent tout à fait adaptées, en choisissant celles ayant les plus fortes teneurs en sodium. La diversification alimentaire se fait comme chez l'enfant normal, vers le 5e-6e mois[196].
Au quotidien, les apports énergétiques doivent être légèrement supérieurs aux apports journaliers recommandés (AJR), de l'ordre de 100 à 110 %, ce qui est habituellement suffisant au maintien d'un état nutritionnel normal. Des apports énergétiques supérieurs, de l'ordre de 120 à 150 % des AJR sont souvent inutiles ou difficiles à atteindre par voie orale. Pour maintenir une bonne croissance staturo pondérale, la majorité de patients nécessite moins de 120 % des AJR et seule une minorité a besoin de plus de 120 %, voire plus de 150 %. Pour assurer des apports énergétiques supérieurs aux AJR, on recommande une alimentation riche en calories glucidolipidiques mais il n'existe pas de consensus sur des valeurs optimales. Il faut orienter précocement les habitudes alimentaires et le goût de l'enfant vers des produits à haute valeur énergétique (produits laitiers, fromages et sucres lents). L'intérêt des compléments hyperénergétiques en l’absence de dénutrition n’est pas démontré. L'intervention d'un diététicien est indispensable et doit être précoce et régulière[196].
Pour prendre en charge l'insuffisance pancréatique exocrine (qui entraine une malabsorption des lipides, mais aussi des glucides et des vitamines liposolubles), on utilise des extraits pancréatiques gastro-résistants qui doivent être pris au début de chaque repas. Les doses recommandées sont exprimées en unités lipase (UL), elles varient selon l'âge du patient et doivent être adaptées à chaque cas. Pour une alimentation normale, elles sont chez le nourrisson de 2 000 à 4 000 UL pour 120 ml de lait, chez l'enfant de 1 000 UL/kg/repas ou de 500 UL/kg/collation, sans dépasser 100 000 UL/j, et chez l'adolescent et adulte de 250 000 UL/jour maximum[196].
De plus, d'autres points sont à surveiller[196] :
- les besoins en eau et en sodium majorés par une sudation importante, surtout pendant les périodes chaudes doivent être compensés ;
- des apports complémentaires en vitamines liposolubles A, D et E sont essentiels dès le diagnostic posé et sont apportés sous la forme de complexes polyvitaminiques solubles au double de la posologie habituelle. La vitamine K, rarement carentielle, n'est prescrite que pendant la première année de vie mais peut être nécessaire plus tard lors de traitements antibiotiques prolongés ;
- des suppléments en oligo-éléments (fer, zinc, sélénium, magnésium) sont également nécessaires si une carence a été démontrée.
En cas de dégradation de l'état nutritionnel une assistance nutritive est généralement proposée, sans que son bénéfice sur l'état nutritionnel et respiratoire n’ait été clairement démontré. Elle repose sur[196] :
- les suppléments nutritionnels oraux dont l'efficacité n'est pas démontrée et qui ont le désavantage de souvent remplacer les apports oraux habituels ;
- la nutrition entérale (les nutriments sont administrés directement dans l'estomac par une sonde nasogastrique ou une sonde de gastrostomie) semble d'autant plus efficace qu'elle est commencée tôt. Le mode d'administration est souvent mal toléré ou mal accepté ;
- la nutrition parentérale (les nutriments, sous forme d'une solution lipidique, sont administrés par voie intraveineuse) est lourde et couteuse et nécessite une voie veineuse centrale pour être efficace. Elle peut permettre un gain de poids transitoire mais expose le patient à certains effets secondaires et notamment un risque infectieux. Elle reste d’indication exceptionnelle (pancréatite, post-chirurgicale, refus de nutrition entérale dans un programme de prétransplantation)[194].
Prise en charge des troubles glucidiques
L'aggravation de l'atteinte respiratoire est corrélée à celle de l'atteinte du métabolisme glucidique et l’insulinothérapie améliore les paramètres respiratoires et nutritionnels. De plus avec l’allongement de l’espérance de vie des patients mucoviscidosiques, apparaissent les complications microangiopathiques habituellement rencontrées lors du diabète. C'est pourquoi toute hyperglycémie (au stade de diabète voire d'intolérance au glucose) doit être prise en charge précocement[196].
Le traitement doit privilégier l'insulinothérapie qui est la seule à avoir démontré un effet positif sur le plan nutritionnel, respiratoire, et infectieux. Les antidiabétiques oraux (ADO) sont envisageables dans les formes débutantes et asymptomatiques de diabète ou si l’insulinothérapie est refusée par le patient. Pour les ADO, seuls les insulino-sécrétagogues (sulfamides comme le glimépiride, ou glinides comme le répaglinide ou le natéglinide) sont utilisables. Concernant le choix de l'insuline et du schéma d'insulinothérapie, il est fait en prenant en compte le mode de vie du patient et sa compliance au traitement[196],[138].
Prise en charge de l'atteinte hépatobiliaire
L’atteinte du foie et des voies biliaires au cours de la mucoviscidose peut modifier le pronostic vital et doit être dépistée dès la naissance par un bilan biologique et une échographie. Environ 15 à 20 % des patients développent des lésions hépatobiliaires et cette fréquence augmente nettement à l’adolescence. Le traitement de l’atteinte hépatobiliaire repose sur l'acide ursodésoxycholique (AUDC) qui augmente la sécrétion biliaire et protège les hépatocytes et doit être introduit précocement. Il faut également porter une attention particulière à la toxicité gastrique et hépatique potentielle de certains médicaments. Les complications de la cirrhose menacent le pronostic vital, et l'hypertension portale (HTP) doit être contrôlée par des techniques endoscopiques, des shunts radiologiques ou chirurgicaux voir la transplantation hépatique[196].
Traitements ciblant la protéine CFTR
L'ivacaftor (Kalydeco), approuvée en 2012, agit sur les malades atteints de la mutation G551D et potentialise l'activité de la protéine CFTR. D'autres molécules agissent sur la quantité de cette protéine à la surface de la cellule. Ce sont le lumacaftor et le tezacaftor (en)[214]. Ces deux types de médicaments peuvent être utilisés en combinaison[215]. Ils permettent alors la diminution des crises d'exacerbation ainsi que les symptômes respiratoires. La trithérapie elexacaftor/tezacaftor/ivacaftor, dite Trikafta ou Kaftrio, a été approuvée par la FDA en 2019 pour la mutation F508del, la plus courante. Le prix est alors de 311 000 $ par an aux Etats-Unis.
Le Kaftrio est disponible en France depuis le [216] pour tous les patients de 12 ans et plus, homozygotes pour la mutation F508del du gène CFTR[217] ou « hétérozygotes pour la mutation F508del du gène CFTR et porteurs de l’une des mutations de défaut de régulationou d’une mutation à fonction résiduelle »[218]. Cela concerne près de 80 % des patients non greffés. Elle est administrée en association avec l'ivacaftor (Kalydeco)[218]. Le , la HAS étend l'indication de l'association Kaftrio/Kalydeco aux enfants de 2 ans et plus[219].
Autres thérapeutiques et hygiène de vie
Toutes les vaccinations du calendrier vaccinal en vigueur (diphtérie, tétanos, polio, coqueluche acellulaire, Haemophilus influenzae type B, pneumococcique, hépatite B, rougeole-oreillons-rubéole) sont recommandées, ainsi que les vaccins contre l’hépatite A et la grippe[194].
Les malades de la mucoviscidose doivent avoir une bonne hydratation et une supplémentation en sel lors des périodes d'efforts et de forte chaleur[220],[221]. La canicule d' en France a vu l'augmentation du nombre de cas de déshydratation dans la population des patients mucoviscidosiques[222].
La pratique d’une activité physique ou sportive régulière et adaptée aux capacités respiratoires est fortement conseillée. Un pic VO2 élevé serait associé à une meilleure survie[223]. Une activité physique régulière, par le biais notamment de programme de réhabilitation respiratoire permettrait d'atténuer l'aggravation progressive de l'atteinte de la fonction pulmonaire[224],[225],[226], d'améliorer l'aptitude physique aérobie[225], d'apporter un bien être psychologique[224] et d'augmenter la qualité de vie et la force musculaire des patients[227]. Il n'y a pas encore de standardisation des programmes d'entrainement sportif chez les mucoviscidosiques et des études supplémentaires doivent être menées, afin de valider plus solidement les effets bénéfiques du sport sur ces patients et de mieux déterminer la nature des entrainements et notamment la répartition des exercices aérobies et en résistance[228].
Pour tous les malades de la mucoviscidose (sous n'importe quelles formes) : afin de maintenir un environnement respiratoire de bonne qualité il faut éviter le tabagisme actif ou passif, éviter les métiers à risques, réduire les risques allergéniques et privilégier un mode de garde individuel plutôt que collectif[194].
Il faut de plus favoriser, par l'élaboration d'un projet individualisé, l'intégration scolaire puis professionnelle. L'intervention de l’assistante sociale et du psychologue doit permettre de faire face aux différentes difficultés[194].
Breathing Games est un Communs de santé canadien en libre accès qui distribue des jeux et du matériel diffusés sous licence open source et copyleft, pour promouvoir la santé respiratoire et prévenir l'asthme, la mucoviscidose / fibrose kystique et d'autres maladies respiratoires chroniques[229],[230].
Fertilité chez les femmes
Les troubles du cycle sont fréquents en cas d'atteinte sévère en rapport avec les troubles de la nutrition de la maladie plus que par la maladie elle-même.
Bien que la glaire cervicale soit plus épaisse chez ces femmes leur fertilité semble peu touchée. Une contraception orale est possible malgré une diminution de l'absorption des stéroïdes sexuels qui sont liposolubles chez ces patientes dont l'absorption des graisses est perturbée[231].
Des moyens contraceptifs supplémentaires sont souhaitables lors des traitements antibiotiques par voie veineuse.
Grossesse chez une personne atteinte de mucoviscidose
La première grossesse allant jusqu'à son terme chez une femme atteinte de mucoviscidose fut décrite en 1960, à une époque où la médiane de survie n'était que de 10 ans. La patiente décéda six semaines après son accouchement et les médecins conclurent que la maladie était sérieusement aggravée par la grossesse[232]. Depuis des études ont attesté qu'une grossesse pouvait être envisagée sans trop de risque chez les femmes ayant une bonne fonction pulmonaire[233],[234],[235].
Avec l'amélioration de la qualité et de l'espérance de vie des malades, les grossesses sont de plus en plus nombreuses. En 1992, 4 % des femmes mucoviscidosiques aux États-Unis sont enceintes. La grossesse devrait être planifiée et une recherche des mutations les plus fréquentes doit être faite chez le futur père. Le diagnostic par prélèvement du chorion est fait si le père est porteur d'une mutation puisque le fœtus a un risque sur deux d'être atteint dans ce cas.
En cas d'atteinte sévère, la femme doit être avertie d'un décès possible au cours de la grossesse ou dans le post partum. L'anesthésie générale est compliquée par l'atteinte des poumons. Néanmoins les données disponibles sur les risques exacts de la grossesse chez une femme mucoviscidosique sont faibles. Une réduction de 60 % du volume expiratoire forcé devrait être une contre-indication absolue à une grossesse.
Bien que des grossesses se soient déroulées sans complication après une transplantation cœur-poumon[236], celles-ci sont déconseillées en raison d'une augmentation du rejet du greffon et en raison des risques tératogènes des médicaments anti-rejet.
Organisation des soins et prise en charge sociale
Coordinations des soins
La France a organisé ses soins aux patients malades de mucoviscidose autour de structures spécialisées, les centres de ressources et de compétence de la mucoviscidose. Créés par la circulaire no 502 du [237], ces centres sont développés dans des structures hospitalières. Leur rôle est de coordonner les soins délivrés aux malades, de former les professionnels de santé, d'organiser les dépistages, les annonces de diagnostics, de soutenir la recherche sur la maladie, et d'évaluer tout ce qui tourne autour de la maladie et sa prise en charge. Son travail se développe avec la participation active d'associations de malades, des familles et des patients.
Associations de lutte contre la maladie
Les associations de malades ont pour mission d'encourager la recherche, d'aider au quotidien les malades et leur famille et de former les professionnels de santé. En France, les associations telles que Vaincre la mucoviscidose (organisatrice, en particulier, des virades de l'espoir) se proposent d'améliorer la qualité des soins et la qualité de vie des malades et de leurs familles[238]. Plus récemment, l'association Grégory Lemarchal, du nom du chanteur vainqueur de Star Academy 4 ou même le téléthon ont donné un élan médiatique à la maladie. L'association Mucoviscidose Innovation est à l'origine d'un programme de recherche « Meveol » qui a obtenu la désignation médicament orphelin en Europe et aux États-Unis.
En plus de son soutien à la recherche et au développement de médicaments contre la mucoviscidose, la Cystic Fibrosis Foundation américaine contribue à financer un réseau national de plus de 115 centres de soins spécialisés consacrés à traiter les gens atteints de mucoviscidose[239],[240].
De nombreux pays où la maladie sévit ont une association d'aide aux malades[241].
Prise en charge financière
En France, la mucoviscidose est une maladie ouvrant droit à la prise en charge en affection de longue durée depuis 1987 (ALD no 18)[194]. L'organisme de sécurité sociale estime le cout annuel des soins remboursés de chaque patient mucoviscidosique à 21 500 euros en moyenne, soit plus de 110 millions d’euros pour l’ensemble des patients. En 2004, concernant les postes de dépense, les médicaments arrivent les premiers avec 8 000 euros (37 %), devant l’hospitalisation avec 7 300 euros (34 %), les dispositifs médicaux (aérosols, oxygénothérapie, perfusion et certains nutriments) avec 2 300 euros (11 %), la kinésithérapie avec 2 200 euros (10 %) et enfin les soins infirmiers avec 900 euros. Les coûts de prise en charge varient selon le stade de la maladie. Ainsi la moitié des malades ont une dépense annuelle inférieure à 12 356 euros ce qui ne représente que 10,8 % des dépenses alors que pour 10 % des patients, les coûts s'élève à plus de 51 200 euros[242].
En 1996, en Californie, une petite étude sur une population de souscripteurs à une assurance médicale, estime le cout des soins aux patients mucoviscidosiques en moyenne à 13 300 $ avec des écarts allant de 6 200 $ pour des patients peu atteints et jusqu'à 43 300 $ pour les formes plus sévères de la maladie[243].
L'étude des variations des couts des soins médicaux ont permis de retrouver des facteurs prédisposant aux soins plus onéreux. Une étude sur des patients de la Province d'Alberta retrouve l'âge, le sexe, l'utilisation de rhDNAse et les infections à Pseudomonas et Burkholderia comme des déterminants majorant les couts de traitement[244].
Organisation académique
En France ont été publiées en 2002, sous l'égide de la Société française de pédiatrie (SFP) et de la Haute Autorité de santé (HAS), des recommandations à l'usage des professionnels de la santé, portant sur les poumons et l'infectiologie[139] d'une part, et sur l'aspect nutritionnel, gastro-entérologique et métabolique[196] d'autre part.
L’European Cystic Fibrosis Society est composée de médecins impliqués dans la prise en charge de la maladie et a été formée depuis la fin des années 1960[245]. Il édite une revue scientifique entièrement consacrée à ce sujet, The Journal of cystic fibrosis[246]. Il publie également des recommandations sur les différents aspects de la prise en charge de la maladie[247].
Voies de recherches
Résumé
Contexte
Phagothérapie
La phagothérapie semble constituer une voie d'avenir pour les cas de mucoviscidose aggravés d'une résistance aux antibiotiques, que ce soit par Pseudomonas aeruginosa[248],[249],[250],[251],[252] ou par Burkholderia cepacia[253],[254]. En , une équipe internationale de l'Université de Pittsburgh a réussi à traiter avec succès un patient hospitalisé à Londres atteint de mucoviscidose et victime d'une infection généralisée par Mycobacterium abscessus, en utilisant un cocktail de phages modifiés génétiquement administré par voie intraveineuse[255].
Modèle animal
Un des objectifs essentiels pour faire avancer la recherche sur la mucoviscidose est la création d'un modèle animal permettant une meilleure compréhension des mécanismes physiopathologiques de la maladie, une identification des gènes et des facteurs environnementaux modifiant la sévérité du phénotype, l'expérimentation de nouvelles stratégies pharmacologiques modifiant la sévérité de la maladie et l'étude de protocoles de thérapie génique corrigeant la défaillance du transport ionique[256].
En 1992, trois ans à peine après la découverte du gène CFTR, la première souris « knockout » pour CFTR est créé par ciblage génétique ; elle présente à l'état homozygote de nombreux symptômes communs avec les jeunes patients humains, tels une stérilité, un iléus méconial, des altérations des glandes muqueuses et séreuses et des obstructions des structures glandulaires, entrainant la mort par obstruction intestinale avant 40 jours de vie[257]. Par la suite ont été décrits de nombreux autres modèles murins modifiés génétiquement de façon à entrainer soit une absence complète d’expression de CFTR, soit l'expression d'un CFTR muté[256]. Ces modèles animaux présentaient des similitudes, mais aussi des différences avec la maladie humaine : ainsi la plupart développaient des anomalies du transport ionique et des symptômes digestifs similaires à l'homme, mais ne présentaient pas les lésions pulmonaires caractéristiques retrouvées chez les patients humains, alors que l'atteinte digestive leur était en général fatale[256]. Afin de contourner cette absence de phénotypie respiratoire, des modèles de souris différemment sensibles à certains pathogènes respiratoires ont été créés, permettant de mettre en évidence une susceptibilité augmentée pour ces pathogènes chez les souris déficientes en CFTR[258]. Cependant ces modèles étaient peu satisfaisants car ils ne reproduisaient pas les manifestations de la maladie pulmonaire chez l’humain[259].
Après 15 ans de recherche d'un modèle animal permettant d'étudier la physiopathologie de l'atteinte pulmonaire de la mucoviscidose, Mall et coll. décrivent en 2004 un nouveau modèle murin présentant un phénotype respiratoire très proche de celui retrouvé dans la mucoviscidose chez l’homme. Pour créer ce modèle ils se sont basés sur la surexpression du canal au Na+ ENaC contrôlé par CFTR, et non pas sur la déficience du CFTR[260]. Leur modèle sous entend que c'est l'altération de la clairance mucociliaire qui entraine l'inflammation bronchique, et que celle-ci précède l'infection chronique ce qui permet d'envisager de nouvelles voies de recherches thérapeutiques en cherchant à corriger le défaut de régulation des flux de Sodium trans-épithéliaux[259].
Traitement curatif
Thérapie génique
La mucoviscidose étant une maladie monogénétique, c'est-à-dire ne concernant qu'un seul gène, c'est naturellement que de grands espoirs de guérison sont nés avec l'apparition du concept de la thérapie génique. Les progrès de la recherche qui ont amené progressivement à l'avènement de la thérapie génique offrent un grand espoir aux personnes atteintes étant donné que la thérapie génique permettrait de rétablir la fonction du gène CFTR.
Des analyses de la quantité d'ARN messager (ARNm) dans les cellules saines ont révélé un nombre extrêmement faible d'ARNm codant CFTR, entre deux et trois copies par cellule. En théorie, même avec un taux de transfert très faible, il serait possible de restaurer une fonction de sécrétion normale dans les cellules pulmonaires en apportant une ou deux copies du gène sain intégré dans un vecteur. La fonction restaurée, le mucus devrait se fluidifier et permettre une clairance mucociliaire satisfaisante. En effet, les infections des voies pulmonaires par des pathogènes et l'inflammation qui s'ensuit est l'une des causes de la perte de la fonction respiratoire[réf. nécessaire].
Le vecteur choisi a été l'adénovirus car il infecte de manière sélective les cellules pulmonaires. On réalise une infusion de virus transformés directement dans les bronches du patient. Malgré un principe relativement simple, la thérapie génique bute sur plusieurs points[261],[262]. Le système immunitaire du patient lutte contre le vecteur adénoviral et le détruit. En outre les cellules ayant intégré le transgène expriment des protéines du virus et sont donc identifiées puis éliminées par le système immunitaire cellulaire. De par la présence d'un mucus bronchique épais, la pénétration de l'adénovirus dans les cellules cibles est considérablement ralentie. Par ailleurs, le transgène n'est pas intégré de manière définitive dans les cellules cibles et il est assez rapidement éliminé.
D'autres thérapies relatives ou proches de la thérapie génique sont également développées afin de permettre la synthèse d'une protéine CFTR saine, comme[263] l'édition du gène muté CFTR ("gene editing") grâce au "ciseau moléculaire" CRISPR Cas-9 en remplaçant la zone défectueuse par la partie normale du gène (technique très prometteuse), ou encore l'utilisation d'oligonucléotides antisens (OAS) afin de modifier l'ARNm produit à partir du gène muté. Enfin, une autre technique prometteuse est actuellement développée. Elle consiste à apporter directement in situ aux cellules des ARNm sains, qui permettraient donc la traduction d'une protéine CFTR fonctionnelle[263].
Thérapie protéique
La connaissance des mécanismes physiopathologiques dans la mucoviscidose laisse la possibilité d'un traitement pharmacologique visant à intervenir pour pallier leur défaillance.
Activation de la protéine CFTR
De nombreuses molécules semblent pouvoir intervenir sur la maturation de la protéine ΔF508-CFTR et empêcher son blocage prématuré par l'appareil de Golgi, augmentant ainsi le nombre de molécules transmembranaires CFTR atteignant la paroi apicale des cellules ciliées et fournissant un travail de transfert du chlore.
Parmi elles, il y a eu des essais avec le butyrate et ses composés[264] ; in vitro, de hautes concentrations de glycérol ou de N-oxyde triméthylamine, le myoinositol et la taurine[265] peuvent partiellement neutraliser le défaut de transfert de la protéine ΔF508 CFTR vers la surface membranaire.
Le miglustat[266] est testé depuis septembre 2007 dans un essai clinique de niveau II comme inhibiteur de l'enzyme de glycosylation de la protéine F508del-CFTR. La glycosylation entraînant une dégradation accélérée de la protéine par le réticulum endoplasmique, son inhibition permet de laisser le CFTR, même muté, prendre ses fonctions sur la membrane apicale de la cellule ciliée[267].
Activation de voies alternatives de sécrétion
Devant l'échec de la thérapie génique, d'autres stratégies thérapeutiques sont envisagées ; l'une d'entre elles consiste en l'activation de voies de sécrétion saines.
Le canal chlorure CFTR n'est pas le seul canal chlorure apical présent dans les épithéliums. L'idée sous-jacente de cette stratégie thérapeutique est d'activer à l'aide de médicaments spécifiques des canaux déjà présents dans la membrane apicale. Les études sont rendues difficiles de par la difficulté que représente l'obtention d'un épithélium de poumon fonctionnel. C'est la raison pour laquelle la grande majorité des travaux sont faits sur l'épithélium colique, un autre épithélium qui présente une sécrétion de chlorure de sodium dépendante de l'AMPc. À l'aide de cet outil, plusieurs voies alternatives ont été décrites par les chercheurs. Parmi celles-ci, on peut citer la tentative d'activer la sécrétion de chlorure dépendant du calcium en activant les canaux purinergiques P2X à l'aide d'ATP. Le traitement testé a donc consisté en l'injection, à l'aide d'un inhalateur, d'un agoniste des récepteurs purinergiques P2X. La liaison de l'agoniste sur ces récepteurs provoque une augmentation de calcium intracellulaire, calcium qui va activer la sécrétion de chlorure en activant un canal chlorure apical dépendant du calcium. À la différence de la sécrétion de chlorure passant par CFTR, la sécrétion ainsi induite n'est pas soutenue mais transitoire, des phénomènes de rétroinhibition stoppant assez rapidement l'activation de cette voie.
Personnalités atteintes de la mucoviscidose
Résumé
Contexte
| Nom | Naissance et décès | Notes | Référence |
|---|---|---|---|
| Lisa Bentley | (1968 -) | Ironman triathlète canadienne. | [268] - (Lisa Bentley) |
| Christopher Davies (joueur de cricket australien) (en) | (1978 -) | Ancien joueur de cricket des Southern Redbacks et actuel entraîneur du Melbourne Cricket Club. | [269] - (en (en)) |
| Bob Flanagan | (1952 – 1996) | Écrivain, poète, artiste de performance et comique américain. | [270] - (Bob Flanagan) |
| Nolan Gottlieb | (1982 -) | Ancien joueur de basket-ball NCAA de l'Anderson University et actuel entraîneur assistant du même club. | [271] - (Nolan Gottlieb) |
| Grégory Lemarchal | (1983 - 2007) | Chanteur français, vainqueur de la quatrième saison de Star Academy. | [272] |
| Alice Martineau | (1972 - 2003) | Chanteuse et modèle britannique. | [273] - (Alice Martineau) |
| Andrew Simmons | (1984 -) | Catcheur britannique. | [274] - (Andrew Simmons) |
| Bill Williams | (1960 - 1998) | Développeur informatique. | [275] - (Bill Williams (créateur de jeu vidéo)) |
| Claire Wineland | (1997-2018) | Activiste américaine | (en-US) « Board of Directors – Claire's Place Foundation », sur clairesplacefoundation.org (consulté le ) |
Certains scientifiques polonais, se basant sur des faits de la vie de Frédéric Chopin, soupçonnent ce dernier d'être mort d'une mucoviscidose et non d'une tuberculose comme la thèse actuelle le laisse penser[276]. Cependant, le gouvernement polonais a refusé l'analyse ADN du cœur du pianiste actuellement conservé dans une église de Varsovie.
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

