Loading AI tools
尚未被發現、原子序數為119的化學元素 来自维基百科,自由的百科全书
Ununennium(化學符號為Uue)是一種尚未被發現的化學元素,原子序數是119。直到這個元素被發現、確認並確定了永久名稱之前,Ununennium和Uue分別為這個元素的暫時系統命名和化學符號。在擴展元素週期表裏,Uue預測是s區元素和鹼金屬,也是第一個第8週期元素。它是目前最輕的未發現元素。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 名稱·符號·序數 | Ununennium·Uue·119 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 未知 可能為鹼金屬 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 1·8·s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | [315](預測)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [Og] 8s1(預測[2]) 2, 8, 18, 32, 32, 18, 8, 1(預測) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 液體(有可能為固體)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室溫) 3(預測)[2] g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 273–303 K,0–30 °C,32–86(預測)[2] °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 903 K,630 °C,1166(預測)[1] °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 2.01–2.05(外推)[3] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 1, 3(預測)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 0.86(預測)[4](鮑林標度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:463.1 kJ·mol−1 第二:1698.1(預測)[5] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 240(預測)[2] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 263-281(外推)[3] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 面心立方晶系(外推)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
日本的理化學研究所正在嘗試合成該元素,俄羅斯杜布納聯合原子核研究所也在計劃合成。理論和實驗證據表明,Uue等第八週期元素的合成很可能比之前的元素要困難得多,Uue甚至可能是目前技術所能合成的倒數第二個元素。
Uue所處的第七種鹼金屬的位置表明它會和較輕的同族元素有相似的性質。不過,相對論效應可能會導致Uue的某些性質與直接用元素周期律推測的性質不同。舉個例子,Uue預測會比銫和鈁更不活潑,反應性反而更像鉀或銣。此外,Uue除了預計會有鹼金屬特徵性的+1氧化態外,也有學者預測它能形成其它鹼金屬都未知的+3氧化態。

超重元素[a]的原子核是在兩個不同大小的原子核[b]的聚變中產生的。粗略地說,兩個原子核的質量之差越大,兩者就越有可能發生反應。[13]由較重原子核組成的物質會作為靶子,被較輕原子核的粒子束轟擊。兩個原子核只能在距離足夠近的時候,才能聚變成一個原子核。原子核都帶正電荷,會因為靜電排斥力而相互排斥,所以只有兩個原子核的距離足夠短時,強核力才能克服這個排斥力並發生聚變。粒子束因此被粒子加速器大大加速,以使這種排斥力與粒子束的速度相比變得微不足道。[14]施加到粒子束上以加速它們的能量可以使它們的速度達到光速的十分之一。但是,如果施加太多能量,粒子束可能會分崩離析。[14]
不過,只是靠得足夠近不足以使兩個原子核聚變:當兩個原子核逼近彼此時,它們通常會融為一體約10−20秒,之後再分開(分開後的原子核不需要和先前相撞的原子核相同),而非形成單一的原子核。[14][15]這是因為在嘗試形成單個原子核的過程中,靜電排斥力會撕開正在形成的原子核。[14]每一對目標和粒子束的特徵在於其截面,即兩個原子核彼此接近時發生聚變的概率。[c]這種聚變是量子效應的結果,其中原子核可通過量子穿隧效應克服靜電排斥力。如果兩個原子核可以在該階段之後保持靠近,則多個核相互作用會導致能量的重新分配和平衡。[14]
兩個原子核聚變產生的原子核處於非常不穩定,[14]被稱為複合原子核的激發態。[17]複合原子核為了達到更穩定的狀態,可能會直接裂變,[18]或是放出一些中子來帶走激發能量。如果激發能量太小,無法放出中子,複合原子核就會放出γ射線來帶走激發能量。這個過程會在原子核碰撞後的10−16秒發生,並創造出更穩定的原子核。[18]原子核只有在10−14秒內不衰變,IUPAC/IUPAP聯合工作小組才會認為它是化學元素。這個值大約是原子核得到它的外層電子,顯示其化學性質所需的時間。[19][d]
粒子束穿過目標後,會到達下一個腔室——分離室。如果反應產生了新的原子核,它就會存在於這個粒子束中。[21]在分離室中,新的原子核會從其它核素(原本的粒子束和其它反應產物)中分離,[e]到達半導體探測器後停止。這時標記撞擊探測器的確切位置、能量和到達時間。[21]這個轉移需要10−6秒的時間,因此原子核需要存在這麼長的時間才能被檢測到。[24]若衰變發生,衰變的原子核被再次記錄,並測量位置、衰變能量和衰變時間。[21]
原子核的穩定性源自於強核力,但強核力的作用距離很短,隨着原子核越來越大,強核力對最外層的核子(質子和中子)的影響減弱。同時,原子核會被質子之間,範圍不受限制的靜電排斥力撕裂。[25]強核力提供的核結合能以線性增長,而靜電排斥力則以原子序數的平方增長。後者增長更快,對重元素和超重元素而言變得越來越重要。[26][27]超重元素理論預測[28]及實際觀測到[29]的主要衰變方式,即α衰變和自發裂變都是這種排斥引起的。[f]幾乎所有會α衰變的核素都有超過210個核子,[31]而主要通過自發裂變衰變的最輕核素有238個核子。[29]有限位勢壘在這兩種衰變方式中抑制了原子核衰變,但原子核可以隧穿這個勢壘,發生衰變。[26][27]

放射性衰變中常產生α粒子是因為α粒子中的核子平均質量足夠小,足以使α粒子有多餘能量離開原子核。[33]自發裂變則是由靜電排斥力將原子核撕裂而致,會產生各種不同的產物。[27]隨着原子序數增加,自發裂變迅速變得重要:自發裂變的部分半衰期從92號元素鈾到102號元素鍩下降了23個數量級,[34]從90號元素釷到100號元素鐨下降了30個數量級。[35]早期的液滴模型因此表明有約280個核子的原子核的裂變勢壘會消失,因此自發裂變會立即發生。[27][36]之後的核殼層模型表明有大約300個核子的原子核將形成一個穩定島,其中的原子核不易發生自發裂變,而是會發生半衰期更長的α衰變。[27][36]隨後的發現表明預測存在的穩定島可能比原先預期的更遠,還發現長壽命錒系元素和穩定島之間的原子核發生變形,獲得額外的穩定性。[37]對較輕的超重核素[38]以及那些更接近穩定島的核素[34]的實驗發現它們比先前預期的更難發生自發裂變,表明核殼層效應變得重要。[g]
α衰變由發射出去的α粒子記錄,在原子核衰變之前就能確定衰變產物。如果α衰變或連續的α衰變產生了已知的原子核,則可以很容易地確定反應的原始產物。[h]因為連續的α衰變都會在同一個地方發生,所以通過確定衰變發生的位置,可以確定衰變彼此相關。[21]已知的原子核可以通過它經歷的衰變的特定特徵來識別,例如衰變能量(或更具體地說,發射粒子的動能)。[i]然而,自發裂變會產生各種分裂產物,因此無法從其分裂產物確定原始核素。[j]
嘗試合成超重元素的物理學家可以獲得的信息是探測器收集到的信息,即原子核到達探測器的位置、能量、時間以及它衰變的信息。他們分析這些數據並試圖得出結論,確認它確實是由新元素引起的。如果提供的數據不足以得出創造出來的核素確實是新元素的結論,且對觀察到的現象沒有其它解釋,就可能在解釋數據時出現錯誤。[k]超重元素是通過核聚變產生的。根據產物複合原子核的激發能量,這些核聚變反應可以分為熱核聚變和冷核聚變。[l]在熱核聚變中,非常輕、高能量的發射體加速砸向非常重的目標(錒系元素),產生的複合原子核有高激發能量(~40–50 MeV)。它們可能會直接裂變,或是放出多顆(3到5)中子。[50]在冷核聚變反應中,會使用更重的第4周期元素發射體,以及較輕的鉛和鉍目標。產生的複合原子核的激發能量相對較低(~10–20 MeV),減少了直接裂變的可能性。當產生的複合原子核回到基態後,它們只需要發射一到兩顆中子。不過,熱核聚變反應可以產生有更多中子的產物,因為錒系元素在所有可以大量製造的元素中有最高的中子/質子比。[51]
Uue和Ubn(元素119和120)都是還沒被發現的元素中,原子序最低的。由於反應的截面減少,半衰期也可能很短(微秒級別[2][52]),嘗試合成它們將突破當前技術的極限。[53]Ubu(元素121)之後的元素因為半衰期太短,會在到達探測器之前的一微秒內衰變,所以當前技術可能無法檢測到它們。檢測到元素121到124的可能性在很大程度上取決於所使用的理論模型,因為它們的半衰期預計非常接近一微秒。[53]此前,超重元素合成中的重要幫助來自𨭆-270周圍變形的核殼層,增加了周圍核素的穩定性。此外,接近穩定的富中子同位素鈣-48可用作發射體,產生更多超重元素的富中子同位素。[54]超重元素原子核的中子越多,它就預計越接近穩定島。[m]即便如此,合成出來的同位素的中子數仍然比穩定島中預期的要少。[57]此外,使用鈣-48發射體來合成Uue需要鎄做的目標,後者難以大量製備(只能合成微克級別,而錇和鐦可以做到毫克級別),所以更重的超重元素更實際的合成方法將會需要比48Ca重的發射體。[54]
1985年,人們在加州伯克利的superHILAC加速器通過用鈣-48離子轟擊鎄-254,首次嘗試合成Uue:
反應沒有檢測到任何原子,截面上限為300 nb。[58]之後的計算認為3n反應(產物為299Uue和三個中子)的截面實際上少了六十萬倍,為0.5 pb。[59]
1999年,勞倫斯伯克利國家實驗室通過208Pb和86Kr的反應,聲稱合成了293Og。因此,類似的反應209Bi + 86Kr和208Pb + 87Rb被提議用於合成元素119和它未知的α衰變產物——元素117、115和113。[60]2001年這些結果的撤回[61]和最近對冷聚變反應截面的計算對這種可能性提出了質疑。舉個例子,209Bi + 86Kr反應的橫截面上限預測為2 fb。[62]放射性的發射體可以提供利用鉛或鉍目標的替代方法,可以產生更多富中子的同位素。[62]
從2012年4月到9月,在德國達姆施塔特亥姆霍茲重離子研究中心通過用鈦-50轟擊錇-249,嘗試合成295Uue和296Uue。[63][64]249Bk和50Ti的反應被預測為實際上製備Uue最有利的反應,[64]因為反應比較不對稱,[53]儘管反應有點冷。[65]254Es和48Ca的反應更好,但是製備毫克量級的254Es來作為目標很難。[53]而且,錇-249會衰變成下一個元素鐦-249,半衰期只有短短的327天,所以可以同時尋找元素119和120。[66]然而,由於發射體從48Ca改成了50Ti,Uue的預期產量將除以二十倍,因為產量在很大程度上取決於聚變反應的不對稱性。[53]由於預計Uue的半衰期較短,GSI團隊使用了能夠在微秒內記錄衰變事件的新型快速電子設備。[64][53]
元素119和元素120都沒有被發現,這意味着在這些反應中生成元素119的限制截面為65 fb,而生成元素120的限制截面為200 fb。[65][66]在該反應中生產元素119的預測實際橫截面約為40 fb,是當前技術的極限。[53](記錄中有最低截面的成功反應是209Bi和70Zn反應產生鉨的反應,為30 fb。)[53]這個實驗原本會持續到2012年11月,[67]但實驗人員把發射體改成48Ca以確認鿬的發現,提早結束實驗。[65]
位於日本埼玉縣和光市的理化學研究所團隊在2018年6月開始用釩-51轟擊鋦-248目標來合成Uue。[68]由於較重的錇或鐦難以製備,他們選擇了鋦來作為目標。[69]由於反應的不對稱性降低,預計的截面大約減半,需要至少30 fb的靈敏度。[66]這些248Cm目標由橡樹嶺國家實驗室提供,他們也為鿬(元素117)的合成中提供了249Bk目標。實驗開始於回旋加速器,而理化學研究所於2020年升級了它的直線加速器。[70]兩台機器都可以繼續轟擊,直到觀察到第一個事件,該實驗目前是間歇性運行,每年至少進行100天。[68][69]理化學研究所仁科中心主任延與秀人預測,到2022年時可能會發現元素119和120。[71]理化學研究所團隊的嘗試會由天皇資助。[72]
產生的Uue同位素預計會α衰變兩次,產生已知的鏌同位素(288Mc和287Mc)。在這之後已知會發生五個α衰變事件,就可以證實它們的發現。這些反應的預測截面約為10 fb。[69]
俄羅斯杜布納聯合原子核研究所的團隊計劃開始使用249Bk + 50Ti反應來合成Uue。[73][74][75][76][77][78]
日本的理化學研究所和俄羅斯的JINR實驗室最適合這些實驗,因為它們是世界上唯一可以進行低截面反應的實驗室。[79]
根據門捷列夫對未發現元素的命名方法,Uue可稱為eka-鈁。1979年,IUPAC發佈了有關新元素命名的建議,根據這一規則119號元素應稱為ununennium,化學符號Uue。[80]儘管這在化學界的各個層面,從化學課堂到高級教科書都在廣泛使用,但在超重元素理論或實驗上工作的科學家中,這些建議大多被忽視,並將這個元素稱之為「元素119」,化學符號E119、(119)或119。[2]

原子核的穩定性在鋦(元素96)之後迅速下降,它的半衰期比其它原子序更高的元素高了四個數量級。鍆(元素101)之後的元素的半衰期都少於30個小時。在鉛(元素82)之後的元素都沒有穩定同位素。[81]儘管如此,由於尚未完全了解的原因,在原子序110至114周圍的原子核的穩定性略微增加,這導致了核物理學中所謂的「穩定島」的出現。加利福尼亞大學伯克利分校的格倫·西奧多·西博格教授提出的這個概念解釋了為什麼超重元素的半衰期比預測的要長。[82]
291–307Uue預測的α衰變半衰期都是微秒級別的,其中294Uue的α衰變半衰期最長,預測約485微秒。[83][84][85]不過如果算上所有的衰變方式,它們的半衰期預測只剩幾十微秒。[2][52]更重的同位素應該會更穩定。1971年,Fricke和Waber預測315Uue是Uue最穩定的同位素。[1]這會對Uue的合成產生影響,因為半衰期低於一微秒的同位素會在到達探測器之前衰變,而較重的同位素無法通過任何已知可用目標和發射體的碰撞來合成。[2][52]然而,新的理論模型表明,質子軌道2f7/2(會在元素114填充)和2f5/2(會在元素120填充)之間的能量差距比預期的要小,使得元素114不再是穩定的球形封閉原子核,而這個能隙可能會增加元素119和120的穩定性。下一個有雙幻數的原子核預計在306Ubb(元素122)周圍,但是該核素預期的低半衰期和低截面使其合成具有挑戰性。[86]
Uue作為第一個第8周期元素,預測會是鹼金屬,在元素週期表中位於鋰、鈉、鉀、銣、銫和鈁之下。鹼金屬最外層的s軌道中都有一個價電子(價電子排布ns1),在化學反應中可以輕易失去,形成+1氧化態,因此反應性很高。Uue預計會延續這個趨勢,價電子的排布為8s1,因此Uue的行為預計很像它的較輕的同類物。然而據預測,它在某些特性上與較輕的鹼金屬不同。[2]
Uue和其它鹼金屬有不同之處的主要原因是自旋-軌道作用——電子運動與自旋之間的相互作用。自旋-軌道作用對於超重元素尤其強烈,因為它們的電子比輕原子中的電子移動得更快,速度與光速相當。[87]在Uue原子中,7p和8s電子能級下降,對應的電子變得穩定,但有兩個7p電子能級要比其它四個更穩定。[88]這個效應被稱為亞層分裂,因為它將7p亞層分裂成更穩定和更不穩定的部分。計算化學家將這種分裂理解為角量子數 l 從1分裂成1/2和3/2,分別為7p亞層較穩定和較不穩定的部分。[87][n]因此,Uue外層的8s電子變得穩定,會比預期更難移除,而7p3/2電子則變得不穩定,可能允許它們參與化學反應。[2]最外層s軌道(在鈁中就已經很重要)的這種穩定性是影響Uue的化學性質的關鍵因素,並會導致鹼金屬的原子和分子性質的所有趨勢在銫之後反轉。[4]
 |
 |
 |
由於外層的8s電子變得穩定,Uue的第一電離能(從電中性原子中移除一個電子所需的能量)預測為4.53 eV,比鉀之後的所有鹼金屬都高,甚至比121號元素Ubu的4.45 eV都高。因此,第8周期的鹼金屬Uue不是整個周期電離能最低的,這和之前的所有周期不同。[2]Uue的電子親和能預計遠大於銫和鈁。它的電子親和能比所有更輕的鹼金屬都高,為0.662 eV,接近於鈷(0.662 eV)和鉻(0.676 eV)。[90]相對論效應也會導致Uue的極化性大幅下降[2]到169.7 a.u.。[91]事實上,計算出來的Uue的靜態偶極極化性(αD)很小,接近於鈉。[92]
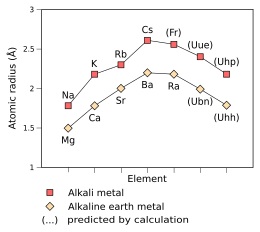
Uue的類氫原子(只有一個電子的原子)——Uue118+的電子預測會非常快地移動,使得它的質量是靜止電子的1.99倍,是相對論效應的特徵。作為比較,鈁的類氫原子的電子質量為1.29,銫的則為1.091。[87]根據相對論的簡單外推,這間接表明了Uue的原子半徑會收縮[87]到只有240 pm,[2]很接近銣的247 pm,而Uue的金屬半徑也相應降低到260 pm。[2]Uue+的離子半徑預測為180 pm。[2]
Uue的熔點預測在0℃和30℃之間,所以在室溫下可能是液體。[5]人們還不知道這是否符合熔點繼續降低的趨勢,因為銫的熔點為28.5℃,而鈁的熔點估計約為8.0℃。[93]Uue的沸點預測在630℃左右,類似鈁的620℃左右,它們都比銫的671℃低。[1][93]Uue的密度預計在3到4 g/cm3之間,符合隨着族往下密度一直增加的趨勢:鈁的密度預測為2.48 g/cm3,而銫的密度是1.93 g/cm3。[1][3][93]
| 化合物 | 鍵長(Å) | 鍵解離能(kJ/mol) |
|---|---|---|
| Li2 | 2.673 | 101.9 |
| Na2 | 3.079 | 72.04 |
| K2 | 3.924 | 53.25 |
| Rb2 | 4.210 | 47.77 |
| Cs2 | 4.648 | 43.66 |
| Fr2 | ~4.61 | ~42.1 |
| Uue2 | ~4.27 | ~53.4 |
Uue的化學性質預測類似鹼金屬,[2]但它的性質比起銫或鈁,會更像鉀[95]或銣[2]。這是由於相對論效應導致的,如果不存在相對論效應,元素周期律將預測Uue比銫和鈁更具反應性。由於相對論效應穩定了它的價電子,增加了第一電離能,使得Uue的反應性、金屬半徑和離子半徑降低了。[95]這個效應在鈁中就已經出現了。[2]
+1氧化態的Uue的化學性質比起鈁會更像銣。另一方面,由於變得不穩定而比其它p軌道大的7p軌道,Uue+的離子半徑預測大於Rb+。除了其它鹼金屬特徵性且主要的+1氧化態以外,Uue可能也有在其它鹼金屬都未發現[96]的+3氧化態。[2]這是因為7p3/2軌道的不穩定和膨脹,導致其電子的電離能低於預期。[2][96]由於成鍵時也涉及了7p3/2電子,很多Uue的化合物都預計有很大的共價性。這個效應也在鈁中出現,其中超氧化鈁(FrO2)的成鍵中有一些6p3/2的成分。[87]因此,Uue不能替代銫,成為電正性最高的元素,而它的電負性最有可能接近鈉的0.93(鮑林標度)。[4]Uue+/Uue的標準電極電勢預測為−2.9 V,和Fr+/Fr一樣只是略微大於K+/K的−2.931 V。[5]
| 化合物 | 鍵長(Å) | 鍵解離能(kJ/mol) |
|---|---|---|
| KAu | 2.856 | 2.75 |
| RbAu | 2.967 | 2.48 |
| CsAu | 3.050 | 2.53 |
| FrAu | 3.097 | 2.75 |
| UueAu | 3.074 | 2.44 |
在氣相中以及在非常低溫下的凝聚相中,鹼金屬會形成以共價鍵鍵合的雙原子分子。在這些M2分子裏,它們的金屬-金屬鍵長從Li2到Cs2一直增加,但由於上述8s軌道的相對論效應,Uue2的鍵長下降。在這些分子的鍵解離能中有相反的趨勢,其中Uue–Uue鍵應該比K–K鍵略強。[4][94]Uue的升華熱(ΔHsub)預測為94 kJ/mol(鈁的值在77 kJ/mol左右)。[4]
由於Uue的高電子親和能,UueF分子預計有顯著的共價性。UueF中的成鍵主要是Uue的7p軌道和氟的2p軌道成的鍵,來自氟的2s軌道和Uue的8s、6dz2和其它兩個7p軌道對鍵的貢獻較少。這和其它s區元素、金和汞的行為非常不同,它們使用s軌道(有時混合d軌道)來成鍵。Uue–F鍵因為相對論效應把7p軌道分成7p1/2和7p3/2而擴張,這和氫化物AtH和TsH的鍵擴張類似。[97]Uue–Au鍵將會是金和鹼金屬之間最弱的鍵,但仍然是穩定的。通過外推,可以給出Uue的吸附焓(−ΔHads):在金上為106 kJ/mol(鈁的值是136 kJ/mol)、在鉑上為76 kJ/mol、在銀上為63 kJ/mol,都是鹼金屬之中最低。這些數據表明,在由貴金屬製成的表面上研究Uue的色譜法吸附是可行的。[4]Uue在聚四氟乙烯表面的吸附焓預測為17.6 kJ/mol,是鹼金屬當中最低的。這些信息對於Uue未來的化學實驗非常有用。[91]鹼金屬的ΔHsub和−ΔHads值都不成比例相關,因為它們會隨着原子序數的增加而向相反的方向變化。[4]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.