銫
原子序數為55的化學元素 来自维基百科,自由的百科全书
1860年,兩位德國化學家羅伯特·威廉·本生和古斯塔夫·基爾霍夫通過剛剛研究出來的焰色反應發現銫,並以拉丁文「caesius」(意為天藍色)作為新元素的名稱。銫最早的小規模應用是作為真空管以及光電池的吸氣劑。1967年,國際單位制中的秒開始以銫-133的發射光譜中一個特殊的頻率作為定義。自此之後,銫廣泛地用於原子鐘。二十世紀九十年代以來,銫元素的最大應用是用於鑽井液的甲酸銫,它在化學工業以及電子工業等領域也有重要用途。其放射性同位素銫-137的半衰期大約為30年,可以用於醫學、工業測量儀器以及水文學等。雖然銫僅有輕微的化學毒性,但銫金屬的高活潑性使之被歸類為危險性物質,而其放射性同位素則會對人體健康和環境生態造成重大危害。
性質

銫是一種非常柔軟、延展性很強的的黃白色金屬,其莫氏硬度在所有的元素中最低,僅0.2。銫在存在痕量氧氣的情況下就會變暗[5][6][7]。銫的熔點為28.4℃,為少數幾種在接近室溫的條件下為液態的金屬元素。汞是唯一的熔點低於銫的金屬元素[註 2][9]。此外,該金屬具有較低的沸點,僅有641℃,為除了汞以外沸點最低的金屬元素。銫的化合物燃燒時具有藍色[10][11]或者紫色[11]。

銫可以和其它鹼金屬以及金形成合金,並且與汞形成汞齊。在溫度低於650℃的條件下,銫無法和鈷、鐵、鉬、鎳、鉑、鉭或者鎢形成合金。銫可以和銻、鎵、銦以及釷形成具有感光性的金屬互化物[5]。銫可以和除鋰之外的鹼金屬混合形成合金,並且摩爾比例為41%銫,47%鉀以及12%鈉的合金的熔點為-78℃,在所有已知的金屬合金中熔點最低[9][12]。
金屬銫具有高度的活性,並且非常容易自燃。除了在空氣中能夠自發燃燒以外,銫在很低溫度下就能夠與水發生爆炸性地反應,比鹼金屬中的其他元素更劇烈[5]。銫可以在溫度低達-116℃的條件下與冰發生反應[9]。由於其高度活性,該金屬被分類為危險性物質。銫通常在諸如礦物油等的乾燥的飽和烴中儲存和運輸。類似的,必須在惰性氣體的保護下處理銫,例如氬。然而,銫-水的爆炸威力通常比同樣量的鈉-水的威力小,這是由於銫在接觸到水的時候立即爆炸,使得聚集起氫氣的時間很少[14]。銫可以儲存於真空密封的矽硼酸鹽玻璃製造的安瓿中。若銫的量超過100克,需要將銫放置在密封的不鏽鋼容器中運輸。
銫的化學性質與其他鹼金屬類似,但是更接近於元素週期表中其上面的元素銣的化學性質[15]。由於銫是一種鹼金屬,可以預期其通常的化合價為+1[註 3]。由於銫具有較高的原子量,並且比其他非放射性鹼金屬電正性更強,有一些較小的區別[18]。銫是電正性最強的穩定化學元素[註 4]。銫離子也比較大,並且與其他更輕的鹼金屬相比較軟。
銫化合物多數都含有Cs+
離子,它能與很多種離子形成離子鍵。一個值得注意的例外是銫化物中含有Cs−
。[20] 其他例外還包括一些低氧化物(參見下面的氧化物章節)。
回到普通的銫化合物,Cs+的鹽通常是無色的,除非陰離子有顏色。 許多簡單的鹽具有潮解性,但比更輕的其他鹼金屬弱。銫的乙酸鹽、碳酸鹽、鹵化物、氧化物、硝酸鹽和硫酸鹽可溶於水。 複鹽通常溶解度較小,硫酸鋁銫溶解度較小的性質常用來從礦石中提純銫。與銻(例如CsSbCl
4)、鉍、鎘、銅、鐵和鉛形成的復鹽通常溶解度很小。
氫氧化銫(CsOH)是一種具有強烈吸水性的強鹼[15]。它能迅速腐蝕半導體材料(例如矽)的表面。[21] 過去化學家曾認為CsOH是「最強的鹼」,因為大陽離子Cs+與OH-的相互作用很微弱[10]。氫氧化銫確實是鹼性最強的阿倫尼烏斯鹼,但是許多無法存在於水溶液中的化合物的鹼性遠比CsOH強,例如正丁基鋰和氨基鈉[15]。
銫與金的化學計量1:1的混合物加熱後可以反應形成黃色的金化銫。這裏的金陰離子表現為擬鹵素。該化合物能夠與水發生劇烈反應,生成氫氧化銫、金屬金以及氫氣。在液氨中,金化銫可以與銫特定的離子交換樹脂反應以產生四甲基金化銨[22]。類似的鉑化物,紅色的鉑化銫Cs
2Pt包含表現得像擬硫族的鉑陰離子[23]。
與所有的金屬陽離子類似,Cs+與路易斯鹼在溶液中形成複合物。由於該粒子較大,Cs+通常的配位數大於6,而較輕的鹼金屬陽離子的典型配位數為6。這個趨勢在CsCl中很明顯,其配位數為8。銫離子較高的配位數以及軟度(形成共價鍵的趨勢)是將其與其它陽離子分離的基礎,在實踐中用於對核廢料的整治,也就是將137Cs+與大量的非放射性的K+分離[24]。
氟化銫(CsF)是一種易潮解的白色固體,經常用於有機氟化學中作為氟陰離子的來源[25]。氟化銫具有石鹽結構,也就是Cs+和F−以和氯化鈉中的Na+和Cl−相同的方式堆積成立方緊密堆積陣列[15]。值得注意,銫和氟在所有已知的元素中分別具有最高和最低的電負性。
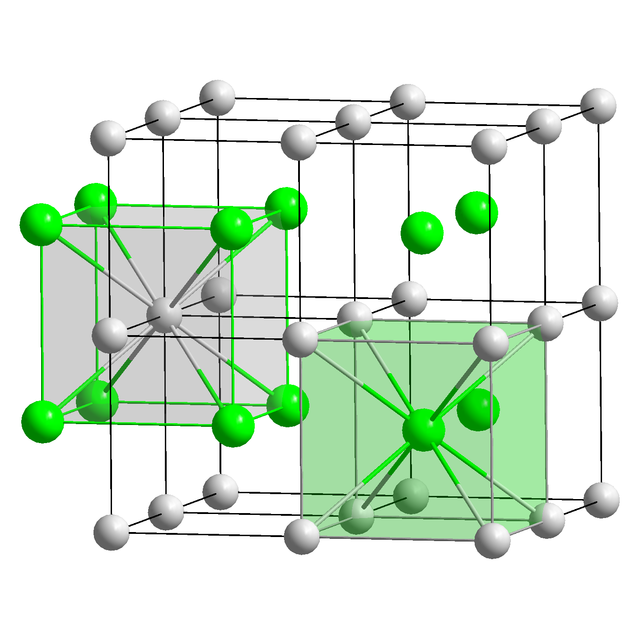
氯化銫以簡單立方晶系結晶。該結構包含以雙原子為基礎的立方晶格原胞,每個配位數都是8,也被稱為氯化銫結構[18]。氯原子位於立方的頂點上,而銫原子位於立方中央。該結構與溴化銫、碘化銫以及許多其它不包含銫離子的化合物相同。相反,大多數其它的鹼金屬鹵化物採用氯化鈉結構[18]。採用氯化銫結構的原因是Cs+的離子半徑為174 pm,而Cl−
的半徑為181 pm[26]。

11O
3 簇合物球棍模型
銫可以和氧形成比其它鹼金屬更多元的二元化合物。當銫在空氣中燃燒時,主要產生超氧化銫(CsO
2)[27]。氧化銫(Cs
2O)為橙黃色的六方晶體[28],並且為僅有的反氯化鎘結構氧化物[29]。它在250℃時揮發,並且在溫度超過400℃時分解為金屬銫和過氧化銫(Cs
2O
2)[30]。除了超氧化銫和臭氧化銫(CsO
3),[31][32],銫還有一些具有明亮顏色的低氧化物[33],包括Cs
7O、Cs
4O、Cs
11O
3、Cs
3O(暗綠色[34])、CsO、 Cs
3O
2[35]以及Cs
7O
2[36][37]。後者可以通過在真空中加熱以產生Cs
2O[29]。銫也能與硫、硒以及碲等形成二元化合物[5]。
銫一共有39種已知的同位素,其質量數(原子核中的核子數)在112至151之間。其中一些同位素在年老的恆星中由較輕的元素通過捕獲慢中子(S-過程)合成[38],也可以在超新星爆發的過程R-過程中合成[39]。然而,銫僅有唯一的穩定同位素,也就是具有78個中子的銫-133(133Cs)。儘管其原子核自旋量子數較大(7/2+),可以在其共振頻率11.7 MHz處對該同位素進行核磁共振的研究[40]。
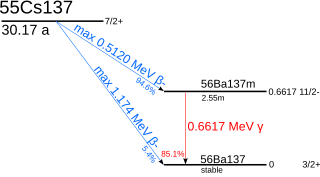
銫-137以94.6%的概率通過β衰變發射出512keV的電子衰變為鋇-137m(I=11/2-,t=2.55分),隨後以85.1%的概率通過662keV的伽瑪衰變轉變為鋇-137。此外,銫-137可以以0.4%的概率通過beta衰變直接轉變為鋇-137。
放射性同位素135Cs具有非常長的半衰期,大約230萬年,而137Cs 和134Cs的半衰期分別為30年和2年。137Cs通過β衰變轉變為分解為壽命很短的137mBa,隨後轉變為非放射性的鋇,而134Cs直接轉變為134Ba。具有質量數為129、131、132以及136的同位素的半衰期在一天和兩周之間,而大多數其它的同位素的半衰期僅數秒或者少於一秒。至少有21種亞穩核同質異能素,除了134mCs(半衰期少於3小時),都很不穩定,並且半衰期僅數分鐘甚至更短[41][42]。
同位素135Cs是鈾的長壽命裂變產物之一,可以在核反應堆中產生[43]。然而,其裂變產物產量在大多數反應堆中都會比較少,這是由於其前體,135Xe是極強的中子毒物,經常在衰變為135Cs之前嬗變為穩定的136Xe[44][45]。
由於銫137能夠β衰變為137mBa,它是一種很強的伽瑪射線發射體[46]。其半衰期使得它和90Sr一同成為中等壽命裂變產物。由於這兩種同位素,乏核燃料在經過數年的冷卻後仍在數百年內具有放射性[47]。例如,137Cs和90Sr一起成為了切爾諾貝爾核事故之後其周圍區域內最大的放射源[48] 。由於其較低的中子捕獲率,無法通過中子捕獲處理銫-137,所以必須讓它進行衰變[49]。
幾乎所有的核裂變產生的銫都由開始富含中子的裂變產物的β衰變產生,例如各種碘的同位素以及氙的同位素[50] 。由於碘和氙容易揮發,並且可以通過核燃料或者空氣擴散,輻射性的銫經常在遠離裂變地點的地方產生[51]。自從1945年開始進行核試驗,銫-137被釋放入大氣層並作為放射性塵埃落回地球表面[5]。

銫是一種相對比較稀有的元素,估計在地殼中的化學元素豐度約為3ppm(百萬分之三)[52]。銫在所有元素中豐度排第45名,而在所有金屬中豐度排第36名。儘管如此,銫的豐度要高於銻、鎘、錫以及鎢,並且比銀和汞的豐度高了兩個數量級,然而其豐度僅為銣的3.3%[5]
由於其離子半徑很大,銫是「不相容成分」之一[53]。在分級結晶的過程中,銫在液相中濃縮,並且最後結晶。因此,銫的大礦床為在富集過程中形成的偉晶岩。由於銫不像銣那樣可以將鉀置換出來,鹼蒸發鹽礦物天然氯化鉀(KCl)和光鹵石(KMgCl
3·6H
2O)中僅含0.002%的銫。所以銫僅能在若干種礦物中找到。銫含量較豐富的礦物包括綠柱石(Be
3Al
2(SiO
3)
6)和氟硼鉀石((K,Cs)BF
4)。在密切相關的礦物銫柱石(Cs(Be2Li)Al2Si6O18)中Cs
2O的質量百分比可達15%,而在稀有礦物硼銫鋁鈹石((Cs,K)Al
4Be
4(B,Be)
12O
28)中可達8.4%,在分佈更廣的硼鋰鈹礦中含量較少[5]。銫榴石Cs(AlSi
2O
6)是唯一的有經濟意義的含銫礦物,在世界上某些地方的偉晶岩中可以找到,並且它和有更重要的商業應用的鋰礦石
鋰雲母和透鋰長石共生。在偉晶岩中,晶粒比較大並且容易與礦石其它部分分離,是採礦的高品質礦石[54]。
世界上最重要的也是儲量最豐富的銫產地是位於加拿大馬尼托巴的伯尼克湖的堂科礦。估計其礦床中有35萬噸銫榴石礦石,佔世界儲量的2/3[54][55] 儘管銫榴石中的銫的化學計量含量為42.6%,來自該礦床的純淨銫榴石樣品中銫的含量僅約34%,平均含量24%[55]。商業用銫榴石包含19%的銫[56]。津巴布韋的比基塔偉晶岩礦床生產透鋰長石,但是也有大量的銫榴石。納米比亞的卡里比布沙漠中也在開採大量的銫榴石[55]。目前世界的年開採量為5-10噸,目前的儲量可供開採數千年[5]。
生產
開採銫榴石是一種選別工藝,和其他大多數金屬採礦相比僅以小規模進行生產。首先將礦石擊碎,並且進行手工篩選,但是經常不做富集,然後將礦石粉碎。隨後主要通過三種方式將銫從銫榴石中提取出來:酸消解、鹼分解、以及直接還原[5][57]。
在酸消解中,矽酸鹽銫榴石的岩石溶解在諸如鹽酸(HCl)、硫酸(H
2SO
4)、氫溴酸(HBr)或者氫氟酸(HF)中。採用鹽酸可以產生可溶解氯化物的混合物,而無法溶解的銫的氯化物復鹽以氯化銫銻(Cs
4SbCl
7)、氯碘化銫(Cs2ICl)或者氯化銫鈰(Cs
2(CeCl
6))的形式沉澱出來。分離之後,將提純的沉澱復鹽分解,在水分蒸發後得到純的氯化銫。採用硫酸的消解的方法將得到無法溶解的復鹽銫礬(CsAl(SO
4)
2·12H
2O)。銫礬與碳一起烘烤後將轉化為不溶於水的氧化鋁,得到的產物通過瀝濾得到硫酸銫(Cs
2SO
4)溶液[5]。
將銫榴石與碳酸鈣和氯化鈣一同烘烤可以得到不易溶解的矽酸鹽和可溶解的氯化銫。通過用水瀝濾或者用氨水稀釋,可以得到稀釋的氯化銫溶液。該溶液可以通過蒸發以得到氯化銫或者轉變為銫礬或者碳酸銫。還可以在真空罐中使用鉀、鈉或者鈣對礦石直接還原以直接獲得金屬銫,但是該方法在經濟上不可行。
大多數以鹽的形式開採的銫直接轉化為用於諸如油井等應用的甲酸銫(HCOO−Cs+)。為了向發展中的市場供貨,卡博特公司在1997年在位於加拿大馬尼托巴的伯尼克湖附近的堂科礦建立了生產廠,年產甲酸銫溶液1900m3[58]。銫的主要小規模商用化合物為氯化銫以及硝酸銫[59]。
此外,金屬銫可以通過從礦石中得到的提純化合物獲得。氯化銫以及其它鹵化銫可以在700℃至800℃的高溫下與鈣或者鋇一同加熱以將銫還原,然後通過蒸餾得到金屬銫。採用相同的方法,碳酸銫以及氫氧化銫等等可以通過使用鎂來還原[5]。銫還可以通過電解熔融的氰化銫來得到。極純淨並且無氣體的銫可以通過以390℃加熱疊氮化銫使其分解來得到,而疊氮化銫可以通過硫酸銫溶液和疊氮化鋇反映得到[57]。在真空中,重鉻酸銫可以和鋯反應得到純淨的銫,而不產生其它氣體產物[59]:
- Cs
2Cr
2O
7 + 2 Zr → 2 Cs + 2 ZrO
2+ Cr
2O
3。
2009年純度為99.8%的銫(金屬含量)大約為每克10美元,但是其化合物便宜很多[55]。
歷史

1860年,羅伯特·威廉·本生和古斯塔夫·基爾霍夫在來自德國巴德迪爾克海姆的礦泉水中發現了銫。由於該元素在其發射光譜中明亮的藍色線,他們選擇了拉丁文中意為天藍色的單詞caesius為其命名[註 5][60][61] 。銫是第一種採用光譜學的方法發現的元素,與本生和基爾霍夫發明光譜儀相隔僅僅一年[9]。
為了獲得純淨的銫樣品,需要蒸發44000升水以得到240千克濃縮的鹽溶液。鹼土金屬或者以硫酸鹽的形式或者草酸鹽的形式沉澱,而溶液中僅僅剩下鹼金屬。在轉化為硝酸鹽並採用乙醇提取後,可以獲得不含鈉的混合物。該混合物中的鋰可以用碳酸銨沉澱出來。鉀、銣和銫可以與氯鉑酸形成不溶鹽,然而這些鹽在熱水中的溶解度有差別。這樣更不易溶於水的的銣和銫的六氯鉑酸鹽可以通過分級結晶的辦法獲得。在使用氫氣還原六氯鉑酸鹽之後,可以利用銣和銫的碳酸鹽在酒精中的溶解度差異分離開。該工藝可以從最初的44000升水中生產出9.2克氯化銣和7.3克氯化銫[60]。
本生和基爾霍夫使用所獲得的氯化銫估計這種新元素的原子量為123.35(目前接受的值為132.9)[60]。他們試圖使用電解熔融氯化銫的方法來生成銫單質,但是沒有獲得金屬物質,只獲得了一種藍色的各項同性的物質,"不論用肉眼還是在顯微鏡下"都無法觀察到最細微的金屬物質的特徵。因此,他們認為它是低氯化物Cs
2Cl。實際上他們獲得的可能是金屬銫和氯化銫的膠體混合物[62]。使用水銀電極電解氯化銫的水溶液可以得到銫汞齊,在有水的條件下可以分解[60]。純淨的銫單質最終由德國化學家卡爾·賽特貝格在跟隨凱庫勒和本生讀取博士學位的時候獲得。1882年,他通過電解氰化銫獲得了金屬銫,而沒有出現氯化銫的問題[63]。
歷史上,銫的的最重要的用途是用於研究和開發,主要是用在化學和電子領域。20世紀20年代用於無線電真空管之前,銫幾乎沒有任何應用。銫在真空管中起兩個作用,吸收製造完畢後剩餘的氧氣的吸氣劑以及可以起到增加加熱的陰極的導電性作用的塗層。一直到20世紀50年代,銫才開始被認為是高性能的工業金屬[64]。無放射性的銫開始被用於光電池、光電倍增管、紅外光譜儀、多種有機反應的催化劑,閃爍計數器以及磁流體發電[5]。
自從1967年,國際單位制基於銫的性質定義了其時間單位,也就是秒。國際單位制將一秒定義為不受外場干擾的銫-133的原子基態的兩個超精細結構能級間躍遷所對應的輻射的9,192,631,770個周期的持續時間[65]。
應用
目前非放射性銫的最大的用途是石油提取工業中使用的基於甲酸銫的鑽井液[5]。通過使氫氧化銫與甲酸反應製成的甲酸銫的水溶液(HCOO–Cs+)在20世紀90年代中期開始用於油井鑽井以及完井液。甲酸銫作為鑽井液的功能是潤滑鑽頭,將切下來的岩石帶至地表,並且在鑽井期間維持對地層的壓力。完井液的作用是在鑽井完成後生產前輔助控制硬件進駐,而甲酸銫在其中的作用是維持壓力[5]。
甲酸銫鹽溶液的密度很高,達2.3 g/cm3[66],再加上大多數銫化合物所具有的相對良性的性質,減少了鑽井液中有毒的高密度懸浮固體的需求。與其它許多高密度液體的成分不同,相對來說甲酸銫不會破壞環境[66]。因此該技術具有很大的技術優勢、工程優勢以及環境優勢。甲酸銫鹽溶液可以與甲酸鉀、甲酸鈉混合以將液體的密度降低至水的密度(1.0 g/cm3)。此外,甲酸銫還可以生物降解以及回收,並且可以循環使用,考慮到其較高的價格(每桶4000美元),這一點非常重要。[67]。鹼金屬的甲酸鹽可以安全的處理,而且不像他們所替代的高密度鹽溶液(如溴化鋅溶液)那樣具有腐蝕性,因此不會對生產底層或者井下的金屬造成損害。使用這些甲酸鹽也減少了清潔和處理的費用[5]。

銫原子鐘觀察銫-133原子在超精細結構之間躍遷產生的電磁輻射,並以此作為參考點。1955年,第一個精確的銫原子鐘由路易斯·艾森在英國國家物理實驗室建成[68]。在過去的半個多世紀中,人們不停的改進銫原子鐘,並且使用它作為標準時間和頻率測量的基準。這些鐘測量頻率的精度為2-3×10-14,相當於時間測量的精度為每天2納秒,或者140萬年1秒。目前最先進的銫原子鐘的精度超過了10-15,這意味着從6600萬年前恐龍滅絕的時代起其誤差僅為2秒鐘[5],被認為是「人類目前所達到的最精確的單位實現」[65]。
銫原子鐘也用於監控手機時間傳輸以及互聯網信息流的網絡中[69]。
銫蒸氣熱離子發電機是將熱能轉化為電能的低功率裝置。在雙電機真空管轉換器中,銫將在陰極聚集的空間電荷清除,並通過這種方式增強電流[70]。
銫也因其具有光電發射的性質而重要,它可以將光能轉化為電流。由於諸如金屬化合物K
2CsSb等的銫基陰極發射電子的電壓閾值較低,通常將銫用於光電池中[71]。使用銫的光電發射裝置包括光學字符識別裝置、光電倍增管以及攝像管[72][73]。儘管如此,鍺、銣、硒、矽、碲以及其他幾種元素可以替代銫作為光電發射材料[5]。
碘化銫(CsI)、溴化銫(CsBr)以及氟化銫(CsF)晶體可以用於閃爍計數器中的閃爍體。由於閃爍計數器適用於檢測伽瑪射線和X射線,它們廣泛的用於礦物勘探以及粒子物理學研究中。由於銫的原子量較大,可以提供較好的停止能力,因此可以提高檢測能力。銫化合物也提供了更快的響應速度(CsF)並且不易吸水(CsI)。
銫蒸氣用於許多普通磁強計中[74]。銫也在分光光度法中作為內部標準使用[75]。和其它鹼金屬類似,銫和氧的聯繫緊密,因此在真空管中銫被用作吸氣劑[76]。銫還用於高能激光、蒸氣輝光燈以及蒸氣整流器中[5]。
由於其密度較高,氯化銫、硫化銫、以及三氟乙酸銫通常在分子生物學中用於密度梯度離心操作[77]。該技術主要用於分離生物樣本中的病毒顆粒、細胞器以及核酸[78]。

銫在化學上的應用相對較少[79]。銫的化合物通常用於增強若干化學品生產中的金屬-離子催化劑的作用,這些化學品包括丙烯酸、環氧乙烷、蒽醌、甲醇、鄰苯二甲酸酐、苯乙烯、甲基丙烯酸甲酯單體以及各種烯烴等等。銫化合物也用於在硫酸生產中將二氧化硫催化轉化為三氧化硫的過程中[5]。
氟化銫在有機化學中被用作鹼[15]或者氟離子的來源[80]。銫鹽在合成環狀化合物、酯以及聚合等有機合成中有時用來替代鉀鹽或者鈉鹽。
銫-137在工業應用中是一種非常常見的作為伽瑪射線發射源的同位素。其優勢在於它的半衰期大約30年,可以通過核燃料循環獲得,並且其最終產物鋇-137是一種穩定的同位素。其較高的水溶性是其缺點,使得它無法用在用於食品和醫療用品的大型池式輻射器中[81]。銫-137已經被用在農業、癌症治療、食品消毒、污水污泥處理以及外科手術設備中。[5][82]。銫的放射性同位素可以用在放射線療法中針對某些癌症治療[83],然而由於目前已經有了更好的替代品,且放射源中易溶於水的氯化銫可能造成大範圍污染,放療中逐漸不再採用銫放射源[84][85]。在許多工業測量計中都採用了銫-137,包括濕度計、密度計、水平儀以及厚度計[86]。測井設備中也會使用銫-137來測量與岩層中的電子密度[87]。
銫-137也用於水文學研究中。銫是核裂變反應的產物。自從大約1945年核試驗開始,一直到20世紀80年代中期,銫137被釋放進入大氣層,然後立即被吸收入水溶液中。那個時期的年度變化與土壤和沉積層有相關性。銫-134以及含量更少的銫-135也用於水文學研究作為核電工業中產生的銫的度量。這兩種同位素不像銫-133或者銫-137那樣常見,而且僅能通過人為過程產生[88]。

在早期的為長距離星際航行的航天器推進器設計的離子推力器中使用銫和汞作為推進劑。在離子化方法中,需要通過與加載電壓的鎢電極接觸剝去推進劑的外層電子。考慮到銫對飛船部件的腐蝕作用,對離子推進器的研發轉向使用惰性氣體推進劑,例如氙。在地面測試中處理惰性氣體推進劑,並且其對飛船造成影響的可能性也更小[5]。最終在1998年發射的試驗飛船深空1號中使用氙作為推進劑[89][90]。儘管如此,已經建造的場發射電子推進推力器仍然使用加速諸如銫等的金屬離子的簡單系統來形成推力。[91]
在紅外照明彈中使用硝酸銫作為氧化劑和煙火着色劑來燃燒矽[92],例如LUU-19照明彈[93]。這是因為硝酸銫的大部分輻射光都位於近紅外光譜中[94]。銫也被用來減少SR-71黑鳥式偵察機的尾焰的雷達特徵[95]。銫也經常和銣一起以碳酸鹽的形式加入玻璃以減少玻璃的導電性並且增加光纖與夜視設備的穩定性和持久性。氟化銫或者氟化鋁銫也用在以含鎂鋁合金釺焊的焊劑配方中[5]。
健康以及安全危害

大多數人極少能接觸到銫的化合物,但是由於銫的化學性質接近鉀,大多數銫化合物只有輕微的毒性。暴露在大量的銫化合物中會引起應急過度以及痙攣,但是由於在自然情況下不會遇到這樣大的劑量,銫並不是重要的化學環境污染物[96]。在小鼠試驗中,氯化銫的半致死量(LD50)為每千克體重2.3克,與氯化鉀和氯化鈉的半致死量相近[97]。
| NFPA 704 |
|---|
| 金屬銫的菱形警示危險標識。 |
金屬銫是最活潑的元素之一,並且接觸水後會發生爆炸。銫接觸水後產生大量的熱,加熱了同時產生的氫氣並將其點燃,引起猛烈地爆炸。其它的鹼金屬也能發生相似的情況,但是銫和水的反應最為劇烈,甚至和冷水也能發生爆炸性反應[5]。銫的自燃溫度為-116°C,因此銫極度容易自燃,並且在空氣中會發生爆炸性的燃燒,形成超氧化銫以及各種氧化物。超氧化銫是一種非常強的鹼,可以迅速的腐蝕玻璃[98]。
由於人類的活動,生物圈中存在少量銫的放射性同位素銫-134和銫-137,並且在不同地點放射強度也有所不同。 放射性的銫不會像許多其它裂變產物(例如放射性碘和放射性鍶)那樣在人體內聚集。大約10%的吸收進人體的放射性銫會迅速通過汗和尿排出體外,而剩餘的90%其生物半衰期在50天至150天[99]。放射性銫和鉀類似,傾向於在植物的組織中聚集,如水果和蔬菜[100][101][102]。亦曾記錄放射性污染的森林中的蘑菇將銫聚集在其子實體中[103] 。切爾諾貝爾核事故之後,人們高度擔心銫-137在湖水中聚集[104][105]。使用狗進行的實驗表明每千克體重3.8毫居里的劑量(4.1微克銫-137)會在三周內致死[106] 較小劑量可能導致不育或者癌症[107]。國際原子能機構以及其它機構警告諸如銫-137的放射性材料可以用於放射性散佈裝置(亦稱髒彈)中[108]。
註釋
參考資料
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.




