热门问题
时间线
聊天
视角
鿫
原子序數是118的化學元素 来自维基百科,自由的百科全书
Remove ads
![]() )(英語:Oganesson),是一種人工合成的化學元素,化學符號為Og,原子序數為118,是當前所有已發現的元素中原子序數最大的元素。鿫是一種放射性極強、極為不穩定的超重元素,所有同位素的半衰期都極短,其當前唯一的已知同位素為294Og,半衰期僅0.69毫秒。鿫不存在於自然界中,只能在實驗室內以粒子加速器人工合成,於2002年用鈣-48離子撞擊鐦而發現。自2005年起,科學家只成功合成出五個(亦可能為六個)鿫-294原子。[14]
)(英語:Oganesson),是一種人工合成的化學元素,化學符號為Og,原子序數為118,是當前所有已發現的元素中原子序數最大的元素。鿫是一種放射性極強、極為不穩定的超重元素,所有同位素的半衰期都極短,其當前唯一的已知同位素為294Og,半衰期僅0.69毫秒。鿫不存在於自然界中,只能在實驗室內以粒子加速器人工合成,於2002年用鈣-48離子撞擊鐦而發現。自2005年起,科學家只成功合成出五個(亦可能為六個)鿫-294原子。[14]
2002年,一個俄美合作的科學家團隊在位於俄羅斯杜布納的聯合核研究所首次合成出鿫。國際純化學和應用化學聯合會(IUPAC)及國際純粹與應用物理學聯合會(IUPAP)所組成的聯合工作小組在2015年12月確認此項發現。為肯定俄羅斯核物理學家尤里·奧加涅相在超重元素合成工作上的重大貢獻[15],IUPAC於2016年11月28日正式將此元素命名為「Oganesson」。[16][17]鿫和𨭎是僅有的兩種用當時仍在世的人命名的元素,鿫也是唯一一個名稱所紀念者今日仍健在的元素。[a]
在元素週期表中,鿫位於p區,是第7週期的最後一個元素,屬於第18族。由於合成鿫的難度極高且成本高昂,產出的鿫同位素又不夠穩定,會立刻發生衰變,因此科學家很難通過實驗來判斷其性質以及可能存在的化合物。不過,科學家仍然能夠通過理論計算做出不少的預測,其中包括一些出人意料的性質。例如,第18族中的其他元素均為反應性低的貴氣體,但同屬18族的鿫卻可能有非常高的反應性。[1]科學家曾經認為鿫在標準狀況下是一種氣體,但因相對論效應,鿫在標準狀況下應該是一種固體。[1]
Remove ads
概論
超重元素的合成

超重元素[b]的原子核是在兩個不同大小的原子核[c]的聚變中產生的。粗略地說,兩個原子核的質量之差越大,兩者就越有可能發生反應。[25]由較重原子核組成的物質會作為靶子,被較輕原子核的粒子束轟擊。兩個原子核只能在距離足夠近的時候,才能聚變成一個原子核。原子核都帶正電荷,會因為靜電排斥力而相互排斥,所以只有兩個原子核的距離足夠短時,強核力才能克服這個排斥力並發生聚變。粒子束因此被粒子加速器大大加速,以使這種排斥力與粒子束的速度相比變得微不足道。[26]施加到粒子束上以加速它們的能量可以使它們的速度達到光速的十分之一。但是,如果施加太多能量,粒子束可能會分崩離析。[26]
不過,只是靠得足夠近不足以使兩個原子核聚變:當兩個原子核逼近彼此時,它們通常會融為一體約10−20秒,之後再分開(分開後的原子核不需要和先前相撞的原子核相同),而非形成單一的原子核。[26][27]這是因為在嘗試形成單個原子核的過程中,靜電排斥力會撕開正在形成的原子核。[26]每一對目標和粒子束的特徵在於其截面,即兩個原子核彼此接近時發生聚變的概率。[d]這種聚變是量子效應的結果,其中原子核可通過量子穿隧效應克服靜電排斥力。如果兩個原子核可以在該階段之後保持靠近,則多個核相互作用會導致能量的重新分配和平衡。[26]
兩個原子核聚變產生的原子核處於非常不穩定,[26]被稱為複合原子核的激發態。[29]複合原子核為了達到更穩定的狀態,可能會直接裂變,[30]或是放出一些中子來帶走激發能量。如果激發能量太小,無法放出中子,複合原子核就會放出γ射線來帶走激發能量。這個過程會在原子核碰撞後的10−16秒發生,並創造出更穩定的原子核。[30]原子核只有在10−14秒內不衰變,IUPAC/IUPAP聯合工作小組才會認為它是化學元素。這個值大約是原子核得到它的外層電子,顯示其化學性質所需的時間。[31][e]
衰變和探測
粒子束穿過目標後,會到達下一個腔室——分離室。如果反應產生了新的原子核,它就會存在於這個粒子束中。[33]在分離室中,新的原子核會從其它核種(原本的粒子束和其它反應產物)中分離,[f]到達半導體探測器後停止。這時標記撞擊探測器的確切位置、能量和到達時間。[33]這個轉移需要10−6秒的時間,因此原子核需要存在這麼長的時間才能被檢測到。[36]若衰變發生,衰變的原子核被再次記錄,並測量位置、衰變能量和衰變時間。[33]
原子核的穩定性源自於強核力,但強核力的作用距離很短,隨着原子核越來越大,強核力對最外層的核子(質子和中子)的影響減弱。同時,原子核會被質子之間,範圍不受限制的靜電排斥力撕裂。[37]強核力提供的核結合能以線性增長,而靜電排斥力則以原子序數的平方增長。後者增長更快,對重元素和超重元素而言變得越來越重要。[38][39]超重元素理論預測[40]及實際觀測到[41]的主要衰變方式,即α衰變和自發裂變都是這種排斥引起的。[g]幾乎所有會α衰變的核種都有超過210個核子,[43]而主要通過自發裂變衰變的最輕核種有238個核子。[41]有限位勢壘在這兩種衰變方式中抑制了原子核衰變,但原子核可以隧穿這個勢壘,發生衰變。[38][39]

放射性衰變中常產生α粒子是因為α粒子中的核子平均質量足夠小,足以使α粒子有多餘能量離開原子核。[45]自發裂變則是由靜電排斥力將原子核撕裂而致,會產生各種不同的產物。[39]隨着原子序數增加,自發裂變迅速變得重要:自發裂變的部分半衰期從92號元素鈾到102號元素鍩下降了23個數量級,[46]從90號元素釷到100號元素鐨下降了30個數量級。[47]早期的液滴模型因此表明有約280個核子的原子核的裂變勢壘會消失,因此自發裂變會立即發生。[39][48]之後的核殼層模型表明有大約300個核子的原子核將形成一個穩定島,其中的原子核不易發生自發裂變,而是會發生半衰期更長的α衰變。[39][48]隨後的研究發現預測存在的穩定島可能比原先預期的更遠,還發現長壽命錒系元素和穩定島之間的原子核發生變形,獲得額外的穩定性。[49]對較輕的超重核種[50]以及那些更接近穩定島的核種[46]的實驗發現它們比先前預期的更難發生自發裂變,表明核殼層效應變得重要。[h]
α衰變由發射出去的α粒子記錄,在原子核衰變之前就能確定衰變產物。如果α衰變或連續的α衰變產生了已知的原子核,則可以很容易地確定反應的原始產物。[i]因為連續的α衰變都會在同一個地方發生,所以通過確定衰變發生的位置,可以確定衰變彼此相關。[33]已知的原子核可以通過它經歷的衰變的特定特徵來識別,例如衰變能量(或更具體地說,發射粒子的動能)。[j]然而,自發裂變會產生各種分裂產物,因此無法從其分裂產物確定原始核種。[k]
嘗試合成超重元素的物理學家可以獲得的信息是探測器收集到的信息,即原子核到達探測器的位置、能量、時間以及它衰變的信息。他們分析這些數據並試圖得出結論,確認它確實是由新元素引起的。如果提供的數據不足以得出創造出來的核種確實是新元素的結論,且對觀察到的現象沒有其它解釋,就可能在解釋數據時出現錯誤。[l]
Remove ads
歷史
在氦、氖、氬、氪、氙和氡之後的第七種貴氣體存在的猜測在貴氣體族被發現時不久就產生了。丹麥化學家Hans Peter Jørgen Julius Thomsen在1895年4月,氬發現後的第二年表示有一系列和氬類似的貴氣體會連接鹵素和鹼金屬,而他預測和釷、鈾同一週期的那個貴氣體(也就是今天的鿫)的原子量為292,與今天的數值294相近。[61]最早猜測118號元素有可能存在的,是丹麥物理學家尼爾斯·玻爾。他在1922年寫道,這一元素在元素週期表上應位於氡以下,成為第七種貴氣體。[62]阿里斯蒂德·馮·格羅塞在1965年發表的論文中預測了118號元素的性質。人工合成元素的方法在1922年還未被研發出來,同樣,在1965年還沒有出現穩定島這一理論概念,因此這兩項是具有先見之明的理論預測。從玻爾預測至鿫終於被成功合成,經過了八十年。不過,鿫的化學性質是否遵循同族元素的規律,仍有待揭曉。[8]
1998年末,波蘭物理學家羅伯特·斯莫蘭楚克發表聚合原子核來合成超重原子的所需計算,其中也包括鿫。他的計算顯示,在嚴格控制的環境下聚合鉛和氪,就能製成鿫,反應的發生概率(截面)和此前合成𨭎所用的鉛鉻聚合反應相當。然而,也有理論預測顯示,隨着所產生元素的原子序的提高,利用鉛或鉍的聚變反應截面會指數下降,這和斯莫蘭楚克的計算相悖。[63]
1999年,勞倫斯伯克利國家實驗室的研究人員利用這些計算,宣佈製成鉝和鿫,並將發現發表於《物理評論快報》。[64]不久後,此項發現又登上《科學》。[65]研究團隊宣稱成功進行以下核反應:
- 86
36Kr
+ 208
82Pb
→ 293
118Og
+
n
.
翌年,由於其他的實驗室及勞倫斯伯克利國家實驗室本身都未能重複這些結果,研究團隊因此撤回這項發現。[66]2002年6月,實驗室主任宣佈原先兩個元素的發現結果,是建立在第一作者維克托·尼諾夫所假造的數據上的。[67][68]
新的實驗結果和理論計算都證實,隨着所產生核種的原子序的提高,以鉛或鉍為目標體的聚變反應截面的確會指數下降。[69]
Remove ads
2002年,一個由美國和俄羅斯科學家所組成的團隊在位於俄羅斯杜布納的聯合核研究所首次真正探測到鿫原子的衰變。團隊由亞美尼亞裔俄籍核物理學家尤里·奧加涅相領導,成員包括來自美國加州勞倫斯利福摩爾國家實驗室的科學家。[70]團隊並沒有即時公佈此項發現,因為294Og的衰變能量與212mPo吻合,而後者是超重元素合成過程中聚變反應的常見雜質。要直到2005年再一次實驗證實之後,團隊才正式宣佈發現新元素。[71]研究人員在2006年10月9日宣佈[11]間接地探測到一共三個(可能為四個)鿫-294原子核:包括2002年探測到的一個(或兩個),[70]以及2005年探測到的另外兩個。合成反應為:[72][73][74][75][76]
- 249
98Cf
+ 48
20Ca
→ 294
118Og
+ 3
n
.

2011年,國際純化學和應用化學聯合會(IUPAC)在評估過杜布納和利福摩爾合作團隊2006年的研究結果後宣佈:「觀測到的三次Z = 118同位素衰變事件有比較好的內部冗餘,但這些事件都沒有以已知原子核作為基礎,所以不滿足正式發現的條件。」[77]
由於核聚變反應的發生概率很低(聚變截面為~0.3–0.6 pb,即(3–6)×10−41 m2),所以實驗一共花時四個月,在向鐦目標體發射一共2.5×1019個鈣離子之後,才首次探測到與鿫成功合成相符的事件。[78]該事件隨機發生的可能性估計小於100,000分之1,所以研究人員很有把握這並不是誤測。[79]
實驗共觀測到三個鿫-294原子經α衰變成為鉝-290,也有可能觀測到一個鿫原子發生自發裂變。由於只觀測到三個原子的衰變,因此計算出來的半衰期有着很大的不確定性:0.89+1.07
−0.31 ms。[11]α衰變的反應式為:
- 294
118Og
→ 290
116Lv
+ 4
2He
為了確定產生的是294
Og,科學家再用48
Ca離子束撞擊245
Cm目標體,製成290
Lv原子核:
- 245
96Cm
+ 48
20Ca
→ 290
116Lv
+ 3
n
然後比較290
Lv和294
Og的衰變鏈是否吻合。[11]290
Lv原子核極不穩定,14毫秒後便衰變成286
Fl,再經自發裂變或α衰變成為282
Cn,最後發生自發裂變。[11]
根據量子穿隧模型所做的預測,294
Og的α衰變半衰期為0.66+0.23
−0.18 ms,[80]實驗Q值於2004年發表。[81]理論Q值比實驗Q值稍低。[82]
Remove ads
2015年12月,國際純化學和應用化學聯合會(IUPAC)及國際純粹與應用物理學聯合會(IUPAP)所組成的聯合工作小組承認118號元素的確實發現,並肯定發現者為杜布納和利福摩爾合作團隊。[83]此次能夠承認發現的原因包括,294
Og和286
Fl衰變產物的性質在2009年和2010年得到勞倫斯伯克利國家實驗室證實,杜布納團隊又於2012年再次觀測到294
Og的衰變鏈,且衰變參數與先前所測量的相符。聯合核研究所的那項研究原本是為了通過249Bk(48Ca,3n)反應合成294
Ts,但因為249
Bk的半衰期非常短,目標體有一大部分已衰變為249
Cf,合成反應因此產生出鿫,而非鿬。[84]
為了合成295
Og和296
Og這兩個更重的同位素,杜布納團隊又在2015年至2016年進行類似的實驗,以48
Ca作為發射體,並以249
Cf、250
Cf和251
Cf同位素的混合物為目標體。實驗共利用兩個離子束能量:252 MeV和258 MeV。用較低能量束時,只探測到一個原子,其衰變鏈和先前已知的294
Og相符(即最終衰變至286
Fl,然後自發裂變);用較高能量束時,並未觀測到任何原子。[85]
Remove ads

德米特里·門捷列夫為有待命名或尚未發現的元素發明一套命名法,根據這套命名法,鿫應稱為「eka-氡」(1960年代之前則稱為「eka-emanation」,emanation是氡的舊稱)。[10]1979年,IUPAC訂下一套元素系統命名法,118號元素應稱為「ununoctium」,化學符號為「Uuo」。[86]IUPAC建議在元素經證實發現之前,應該以此名稱代替。[87]儘管各級化學教科書都廣泛使用着IUPAC的命名,但行內的科學家卻一般稱之為「118號元素」,化學符號為「E118」、「(118)」或「118」。[2]
在2001年研究結果被撤回之前,勞倫斯伯克利國家實驗室的研究人員曾建議,以團隊的領導成員阿伯特·吉奧索命名新元素為「ghiorsium」(符號Gh)。[88]
俄羅斯科學家最早在2006年宣佈合成118號元素。根據IUPAC建議,新元素的命名權屬於其最早發現者。[89]聯合核研究所主任曾經在2007年表示,研究團隊正考慮兩個名字:以杜布納的研究實驗室創立人格奧爾基·弗廖羅夫命名為「flyorium」(現成為114號元素鈇的名稱,flerovium),及以研究所所在地莫斯科州命名為「moskovium」(現成為115元素鏌的名稱,moscovium)。[90]他也認為,雖然此項發現是俄美團隊合作的成果(目標體元素鐦是由美國團隊提供),但118號元素名正言順地應以俄羅斯的人物或地點命名,因為聯合核研究所的弗廖羅夫核反應實驗室是世界上唯一一座能取得這種成果的設施。[91]
除氦(helium)以外,貴氣體的名稱均以「-on」結尾:氖(neon)、氬(argon)、氪(krypton)、氙(xenon)和氡(radon)。在鿫發現當時,IUPAC規定所有新元素名稱都必須以「-ium」結尾,一般以「-ine」結尾的鹵素和一般以「-on」結尾的貴氣體元素也不例外。[92]做臨時代替之用的系統命名「ununoctium」就符合這項規定。不過,IUPAC在2016年又公佈了新的命名建議:新的18族元素,無論性質是否屬於貴氣體,其名稱都要以「-on」結尾。[93]
2016年6月,IUPAC宣佈118號元素的發現者考慮把它命名為「oganesson」(符號Og),以肯定亞美尼亞裔俄籍核物理學家尤里·奧加涅相在超重元素研究上的重大貢獻。奧加涅相投身核物理研究六十年,106號到118號元素就是直接利用他和他的團隊所研發的方法來合成的。[94]2016年11月28日,「oganesson」成為118號元素的正式名稱。[15]奧加涅相事後對新元素以他命名表達以下的感想:[95]
這對我來說是一項榮譽。118號元素是由俄羅斯聯合核研究所以及美國勞倫斯利福摩爾國家實驗室的科學家們發現的,「Oganesson」這個名字也是我的同事們所提出的。我的子孫都已在美國定居多年,但我的女兒給我寫信,說她在聽聞這個消息之後,一宿未眠,因為她一直在哭。[95]
— 尤里·奧加涅相
Remove ads
2017年1月15日,中華人民共和國全國科學技術名詞審定委員會聯合國家語言文字工作委員會組織化學、物理學、語言學界專家召開113號、115號、117號、118號元素中文定名會,將此元素命名為「鿫」(讀音同「奧」)。[97][98]2017年4月5日,中華民國國家教育研究院的化學名詞審譯委員會審譯修正通過之「化學元素一覽表」將此元素命名為「鿫」,音同「澳」。[99]2018年6月5日,「鿫」字被正式加入統一碼11.0版本中,碼位為U+9FEB。
性質

從96號元素鋦開始,原子序越高,原子核的穩定性越低。鋦以後所有元素的半衰期都比鋦短四個數量級。原子序超過101(鍆)的所有同位素都會發生放射性衰變,半衰期都在30個小時以下。原子序超過82(鉛)的元素均沒有穩定的同位素。[100]這是因為原子核中,質子和質子之間的庫侖相斥力隨着質子數量的上升而加強,以致強核力無法再避免原子核發生自發裂變。計算顯示,假如不考慮其他增加穩定性的因素,質子數超過104(鑪)的所有元素都不可能存在。[101]然而,科學家在1960年代提出,當質子數和中子數分別在114和184附近時,核殼層處於滿充、閉合狀態,原子核的穩定性應獲得增強。這就是所謂的「穩定島」,島上核種的半衰期理論上可以達到數千年甚至數百萬年。人工合成實驗固然還沒有達到穩定島範圍內的同位素,但單從包含鿫在內的超重元素存在的事實,就足以證明增強穩定性的效應是存在的。整體趨勢是,已知超重核種的壽命的確隨着靠近穩定島區域而指數上升。[102][103]具有放射性,半衰期不到一毫秒,但這個數值已經比一些預測值高。[80][104]這幾點都是穩定島存在的間接證據。[105]
根據量子穿隧模型計算,預計存在若干個富含中子,半衰期接近1 ms的鿫同位素。[106][107]
理論計算顯示,鿫的一些同位素可能比已知的294
Og更為穩定,這包括293
Og、295
Og、296
Og、297
Og、298
Og、300
Og和302
Og。其中297
Og能產生長壽原子核的可能性最高,[80][108]從而很可能成為未來鿫合成研究的目標方向。313
Og附近一些中子數高得多的同位素也有可能有較長的壽命。[109]這些更重、更穩定的同位素對研究鿫的化學性質有很大的幫助,所以位於杜布納的科學團隊計劃在2017年下半年進行一系列實驗,以249
Cf、250
Cf和251
Cf的混合物作為目標體,並以48
Ca為發射體,目標是合成295
Og和296
Og這兩個新的同位素。聯合核研究所計劃在2020年重複此項實驗,產生297
Og。同一條反應也有可能會生成293
Og及其子同位素289
Lv。聯合核研究所和日本理化學研究所計劃在2017年至2018年利用248
Cm和50
Ti的聚變反應來合成295
Og和296
Og。[85][110][111]
Remove ads
鿫屬於18族元素,不含價電子。同族的其他元素統稱貴氣體,對大部分常見的化學反應(如燃燒反應等)呈惰性。這是因為這些元素的最外電子殼層由八個電子充滿,參與化學反應的價電子被緊緊束縛住,使原子處於十分穩定的最低能量排布。[112]同樣,鿫的最外電子殼層相信也是閉合的,價電子排佈為7s27p6。[1]
有科學家推測,鿫的物理和化學性質和同族其他元素相近,特別是和週期表上位於它以上的氡類似。[113]單從元素週期規律推斷,鿫的反應性會比氡稍高。然而,理論計算卻指出,鿫的反應性會比氡高得多。[6]除此之外,鿫甚至有可能比鈇和鎶更加活躍,後二者在週期表上位於反應性更高的鉛和汞之下。鿫反應性之所以會有大大提升,是因為其最後一個充滿的7p亞電子殼層從能量考量上穩定性降低,且亞殼層有徑向擴張的現象。更準確地說,7p電子和惰性7s電子之間強大的自旋-軌道作用使得價電子殼層到了鈇就已閉合,鿫的閉合殼層的穩定性故此會大大降低。[1]計算還顯示,和其他貴氣體不同,鿫在結合一個電子時會釋放能量,也就是說,它的電子親和能為正數。[114][115]這是因為在相對論效應下,8s能級的穩定性會提高,7p3/2能級的穩定性則會降低。[116]根據預測,鎶和鈇沒有電子親和性。[117][118]但另一方面,量子電動力學效應卻會大大降低這種親和性。這意味着,此類效應所帶來的修正項對超重元素的性質有很大的影響。[114]
鿫預計會有很強的極化性,幾乎是氡的兩倍。根據貴氣體的趨勢推算,鿫的沸點在320和380 K之間,[1]比先前估算的263 K[119]和247 K高得多。[120]儘管這些計算的不確定性很大,但足以斷定,鿫在標準情況下呈氣態的可能性很低。[1]而且,其他貴氣體的液態溫度範圍較窄,只有2至9 K,所以鿫在標準情況下最有可能是固體。假如鿫在標準情況下的確是氣體,就算是單原子氣體,它也會是標準情況下密度最高的氣態物質之一。
由於極化性極高,所以鿫的電離能會異乎尋常的低(和鉛相近,[5]且比鈇低得多[121]),而且具有標準凝聚態。[1]相對論效應對鿫的原子核和電子雲結構都有較強的影響:鿫的7p軌態在自旋-軌道效應下有很強的分裂,所以價電子和核心電子亞殼層會「散開」成為均勻的電子費米氣體,這和相對論效應較弱的氡和氙不同。在核子(特別是中子)方面也有類似的情況。這種現象在中子殼層閉合的302
Og原子核開始出現,並在殼層閉合,尚未發現的472164超重原子核(含164個質子,308個中子)尤為突出。[122]
Remove ads

4的結構呈平面四方形
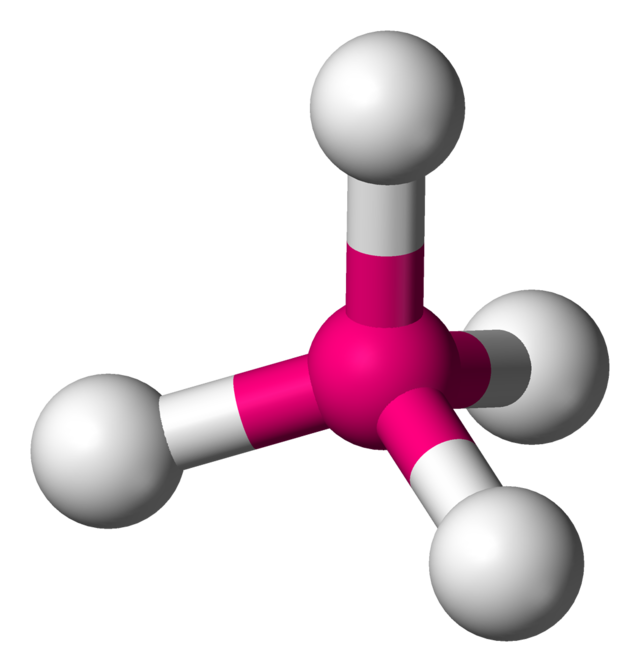
4的結構預計將是四面體形
目前唯一一種經證實存在的鿫同位素294
Og半衰期太短,其化學性質無法通過實驗直接探究。因此,科學家至今還沒有合成任何鿫化合物。[71]不過,自1964年開始,科學家就對鿫的化合物做過不少的理論計算。[10]他們預測,如果電離能足夠高的話,鿫就會很難氧化,所以它最常見的氧化態就會和其他貴氣體一樣為零。[123]但是,也有科學家發表過與之相悖的理論預測。[8]
計算顯示,雙原子分子Og
2的鍵合作用強度與Hg
2相當,鍵離解能為6 kJ/mol,大約為Rn
2的四倍。[1]出乎意料的是,計算出的鍵長比Rn
2短0.16 Å,意味着鿫原子之間有着很強的鍵合作用。[1]另一方面,OgH+的鍵離解能(即鿫的質子親和能)則比RnH+低。[1]
根據預測,鿫和氫之間的作用力非常弱,可以視為純粹的范德華力,而不是真正的化學鍵。不過,鿫會和高電負性元素形成化學鍵,所產生的化合物預計比鎶或鈇所形成的化合物更穩定。[5]+2和+4氧化態預計可以在OgF
2和OgF
4中穩定存在。[124]因為7p1/2亞殼層被緊緊束縛,所以+6態的穩定性會相對較低。[8]這個現象,和鿫反應性比正常高的現象,都源自同一個原理。例如,鿫和F
2結合形成OgF
2時,會釋放106 kcal/mol的能量,其中46 kcal/mol就來自自旋-軌道作用。以相似的分子RnF
2做類比,它形成時所釋放的49 kcal/mol能量之中,有10 kcal/mol出自自旋-軌道作用。[5]該作用也提高了OgF
4分子四面體形Td構型的穩定性,這有別於XeF
4的平面四方D4h構型(估計也是RnF
4的分子構型)。[124]鿫氟鍵更有可能屬於離子鍵,而非共價鍵,所以鿫氟化物都不具揮發性。[6][125]根據預測,由於鿫有很高的電正性,所以OgF
2屬於半離子分子。[126]同樣因為電正性,鿫能夠和氯成鍵。[6]
參見
註釋
- 超重元素的原子核的質量通常無法直接測量,所以是根據另一個原子核的質量間接計算得出的。[51]2018年,勞倫斯伯克利國家實驗室首次直接測量了超重原子核的質量,[52]它的質量是根據轉移後原子核的位置確定的(位置有助於確定其軌跡,這與原子核的質荷比有關,因為轉移是在有磁鐵的情況下完成的)。[53]
- 自發裂變由蘇聯科學家格奧爾基·弗廖羅夫發現,[54]而他也是杜布納聯合原子核研究所的科學家,所以自發裂變就成了杜布納聯合原子核研究所經常討論的課題。[55]勞倫斯伯克利國家實驗室的科學家認為自發裂變的信息不足以聲稱合成元素,他們認為對自發裂變的研究還不夠充分,無法將其用於識別新元素,因為很難確定複合原子核是不是僅噴射中子,而不是質子或α粒子等帶電粒子。[32]因此,他們更喜歡通過連續的α衰變將新的同位素與已知的同位素聯繫起來。[54]
參考資料
參考書目
延伸閱讀
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


