手性助剂是一种在有机合成中为了控制的合成产物立体构型而暂时引入的化合物或结构单元。[1][2]手性助剂的手性结构会影响一个或多个后续反应的立体选择性。而且引入的手性助剂通常可通过脱除来回收利用。

大部分的生物分子和标靶药物为两种可能的镜像异构体(又称对映异构)中一种,因此这类天然产物和药物的合成通常以得到单一手性产物为目标,即纯度为对映纯或光学纯(enantiomerically pure,enantiopure)[3]。为了达到这一目标,采用手性助剂就是一种常用的合成方法[4]。
1975年艾里亚斯·詹姆斯·科里用手8-苯基薄荷醇(chiral 8-phenylmenthol)为例首次向人们介绍何谓手性助剂,而后1980年巴里·特罗斯特也以手性扁桃酸来介绍之。由于薄荷醇制备困难,所以在1985年J. K. Whitesell以反-2-苯基环己醇为例来介绍手性助剂。
非对称合成
为了控制化合物立体中心的绝对构型,手性助剂会在合成路线中引入。在众多使用手性助剂的合成实例中。大卫·A·伊凡斯发明的大环内酯类抗生素胞变菌素的不对称合成被认为是一个经典例子。当中采用了𫫇唑烷酮手性辅助剂参与了1个不对称烷基化反应和4个不对称羟醛缩合反应,得到了含有9个手性中心的绝对构型胞变菌素[5]。

一个采用手性助剂进行非对称合成的典型反应有三个步骤:第一,手性助剂与反应底物进行共价结合;其次结合产物会经历至少一个立体选择性反应;最后手性助剂在不引起产物外消旋化的情况下被移除[4]。虽然用到的对应化学计量的手性助剂成本较高,以及需额外步骤对手性助剂进行引入和脱除使得这种合成方法看起来效率很低很不划算,但对于许多化合物的合成来说,唯一可以产生立体选择性的方法必须用到手性助剂。此外,采用手性助剂的合成反应适用范围很广,且研究得较为透彻,可以最省时地获得对映体纯的产物[2]。
8-苯基薄荷醇
在早期使用手性助剂进行不对称合成的范例中,艾里亚斯·詹姆斯·科里等人介绍了一种由(-)-8-苯基薄荷醇丙烯酸酯与5-苄氧甲基环戊二烯之间的不对称狄尔斯-阿尔德环加成反应[7]。反应产物经过一系列后续反应得到一种碘代内酯化合物,这种碘代内酯是Corey法合成前列腺素的经典中间体。在反应中,因为丙烯酸酯的背面被手性助剂阻挡,所以[狄尔斯-阿尔德加成只能发生在烯烃的前方。

(-)-8-苯基薄荷醇可以从任一长叶薄荷酮的对映体制备[8],即使没有一个途径更高效率。基于8-苯基薄荷醇在不对称合成中的广泛使用,例如反式-2-苯基环己醇[9]和反式-2-(1-苯基-1-甲基乙基)环己醇[10]等更易合成的替代品被开发出来。
1,1'-联-2-萘酚(BINOL)
1,1'-联-2-萘酚(BINOL)自1983年起一直被用作不对称合成的手性助剂[11][12]。

山本尚首次利用(R)-BINOL作为手性助剂,对环状单萜烯进行不对称合成。以(R)-BINOL作为手性助剂,通过单硅化和烷基化反应制备出(R)-BINOL 单萜醚。随后用有机铝试剂还原,合成出产率较低(产率29%)且对映体过剩率适中(最高64% ee)的柠檬烯[12]。

京都大学化学研究所的富士薫以轴手性BINOL作为手性助剂,通过手性甘氨酸衍生物的烷基化,可以制备多种对映体纯的自然界罕见的R-氨基酸。根据不同的亲电试剂,对映体过剩率从69%到86%不等[13]。

用(R)-BINOL保护醛基,芳基乙二醛与格氏试剂进行非立体选择性反应,得到保护的阻转乳醛结构,具有中等至优异的非对映体过量和高产率[14]。

在金属催化C-P键不对称耦合得到手性磷化合物中,也用到了BINOL手性助剂。Mondal等人发现轴向手性BINOL基亚磷酰胺与芳基卤或三氟甲磺酸芳酯的Pd催化C-P交叉偶联反应中,由于BINOL存在于P反应中心附近,使得反应具有出色的立体选择性[15]。
反式-2-苯基环己醇

1985年,James K. Whitesell等人发明了一种基于反式-2-苯基环己醇结构单元的手性助剂,并在烯反应中采用了其乙醛酸酯作为手性助剂[16]。

天然产物(−)-heptemerone B和(−)-guanacastepene E的全合成中,就用到了反式-2-苯基环己醇手性助剂。乙醛酸反式-2-苯基环己醇酯与2,4-二甲基-2-戊烯在四氯化锡作用下得到以反式加成为主的产物(反式:顺式=10:1)[17]。

为了更好地控制构型,将苯基换成三苯甲基可得到反式-2-三苯甲基环己醇(TTC)。2015年,Browm研究组发表了一种高效的手性高锰酸盐介导的环氧化反应,其中就使用了TTC[18]。

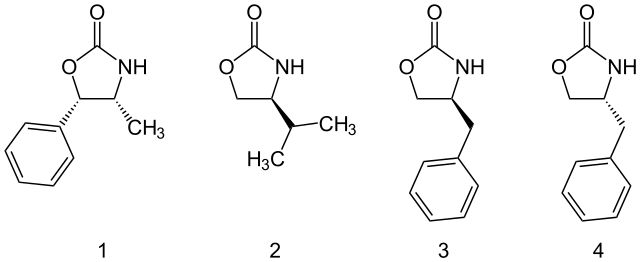
𫫇唑烷酮
𫫇唑烷酮类手性助剂由大卫·A·伊凡斯推广,现如今已被应用到许多立体选择性合成上,包括羟醛缩合反应[19]、烷基化反应,[20]和狄尔斯 - 阿尔德反应[21][22]等。这类助剂中,𫫇唑烷酮的4和5号位被取代基取代,并透过空间位阻引导了各种基团取代的方向。而𫫇唑烷酮助剂可透过水解等方式进行脱除。
𫫇唑烷酮类助剂可以从氨基酸或从容易取得的氨基醇中制备得到。而且量大的𫫇唑烷酮类助剂也均有市售,包括以下四种:

使用二异丙基氨基锂等强碱对𫫇唑烷酮酰亚胺的α-碳进行去质子化能选择性地产生(Z)-烯醇盐,其可以进行立体选择性烷基化反应。

不对称羟醛缩合最常用的手性助剂就是𫫇唑烷酮类助剂。
采用路易斯酸三氟甲磺酸二丁硼(Bu2BOTf)和二异丙基乙胺(i-Pr2NEt)作为碱对𫫇唑烷酮类助剂进行软烯醇化,得到相应的(Z)-烯醇产物。而此化合物可与醛进行非对称羟醛缩合产生连个相邻的手性中心。

其反应机理可用羟醛缩合Zimmerman-Traxler过渡态模型解释,如下图所示,甲基和仲醇在Zimmerman-Traxler六元环过渡态中处于顺位(syn)关系,烯醇氧原子和醛基氧原子同时与硼原子相连。醛发生取向使得氢处于准-轴向位(pseudo-axial),以最大限度地减少1,3-二轴相互作用。两个立体中心的绝对立体构型由手性助剂分子的手性控制。在过渡态结构中,手性助剂的羰基远离烯醇氧,以使分子的净偶极最小化;烯醇的一个面被手性助剂分子上的取代基阻挡,产生立体选择性。

𫫇唑烷酮助剂有多种脱除方法,进而可以产生不同的官能基。

樟脑磺内酰胺
樟脑磺内酰胺也是一种经典的手性助剂。
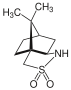
大阪市立大学的大船泰史研究组在不对称全合成大环脂肽抗生素manzacidin B中,就用到了樟脑磺内酰胺作为手性助剂得到manzacidin B中核心𫫇唑啉结构。相比于𫫇唑烷酮助剂,樟脑磺内酰胺有更高的(2S,3R)构型选择性[23]。

樟脑磺内酰胺在不对称迈克尔加成中也有运用。在有机锂强碱的作用下,硫醇与N-甲基丙烯酰樟脑磺酰胺发生立体选择性迈克尔加成,得到较高的非立体选择性加成产物[24]。

樟脑磺内酰胺也可用在不对称克莱森重排反应中。以2,6-二叔丁基对甲酚作为自由基淬灭剂,香叶醇与樟脑磺内酰胺的甲苯溶液装入密封管中以140°C加热,以72%的产率生成主要重排产物 (2R,3S)异构体,产生包括两个相邻季碳立体中心[25]。

伪麻黄碱和伪麻黄酰胺
(R,R)-和(S,S)-伪麻黄碱皆可作为手性助剂。[26]伪麻黄碱与羧酸、酸酐和酰氯反应形成伪麻黄酰胺(pseudoephedrine amide)。
羰基的α-氢原子很容易被非亲核碱移除产生烯醇化物。加成化合物(例如烷基卤化物)的构型由甲基决定。因此,任何加成产物都将与甲基呈顺式(syn),与羟基呈反式(anti)。之后可通过使用适当的亲核试剂裂解酰胺键来脱除伪麻黄碱手性助剂。
伪麻黄碱的两种对映体皆有市售。因为伪麻黄碱可以用于制备非法物质甲基苯丙胺,所以无论是学术用途还是工业用途,购买伪麻黄碱都收到严厉的监管。为了克服这一点,Myers等人开发利用伪麻黄酰胺作为烷基化手性助剂的替代方法[27]。即使没有市售的伪麻黄酰胺,但其可由二苯基乙二酮进行简单合成得到,而且不能用于合成甲基苯丙胺。


伪麻黄酰胺借由二异丙基胺基锂(LDA)等强碱进行去质子反应而得到相应的(Z)-烯醇锂盐。采用这些烯醇锂盐进行烷基化拥有很高的反应面选择性。

伪麻黄酰胺的这种反应面选择性常被认为是其结构所致,因为烯醇锂的其中一个面被烷基仲醇锂以及溶剂化锂离子阻挡,烷基化反应倾向于在另一面进行。根据这一理论,产物立体选择性与氯化锂和溶剂四氢呋喃用量高度相关。通常,4至6摩尔当量的氯化锂足以在反应浓度下使THF中的烯醇盐溶液饱和。

伪麻黄碱酰胺不对称烷基化的主要优势之一是酰胺烯醇盐通常具有足够的亲核性,可在 -78 °C 至 0 °C 的温度下与伯卤甚至叔卤化物发生反应。通过α-支链酰胺烯醇盐的烷基化构建季碳手性中心也是可能的,但对于反应性较低的亲电试剂,必须添加DMPU[29]。
目前已经发展出将伪麻黄酰胺转化成不同类型对映体化合物的脱除方法,如羧酸、醇、醛和酮类。

反应完成后,被脱除的伪麻黄酰胺可以重新利用。
叔丁基亚磺酰胺
乔纳森·埃尔曼(Jonathan Ellman)研究组已经广泛研究出利用手性亚磺酰胺(sulfonamide)衍生物作为手性助剂的方法。[30]

任一叔丁基亚磺酰胺的对映异构体可借由叔丁基二硫经两步合成得到:催化不对称氧化反应以高产率和对映体选择性生成二硫键氧化产物硫代亚磺酸酯。接着以在氨基锂的氨溶液中处锂该化合物,即可得到光学纯的逆产物。

以醛或酮来进行叔丁基亚磺酰胺的缩合反应,会以高产率和高对映体过剩率地得到(E)-异构体的N-亚磺酰醛亚胺或N-亚磺酰酮亚胺。

将格氏试剂加成到叔丁烷亚磺酰基醛亚胺或酮亚胺中,可发生不对称加成生成支链亚磺酰胺。该现象可以用六元环过渡态模型进行合理解释,其中亚磺酰亚胺的氧与氮皆会与镁配位。


SAMP与RAMP
手性体(S)-1-氨基-2-(甲氧基甲基)吡咯(SAMP)和(R)-1-氨基-2-(甲氧基甲基)吡咯(RAMP)的腙烷基化反应,是由迪特·恩德斯和艾里亚斯·詹姆斯·科里研发。[31][32]
SAMP可借由(S)-脯胺酸经六步反应制备,而RAMP则可借由(R)-谷胺酸经六步反应制备。

SAMP或RAMP经与醛或酮缩合反应会得到相应(E)-肼类化合物,随后利用强碱LDA去质子化以及卤代烷加成就得到相应烷基化产物。手性助剂可由臭氧化反应或水解进行脱除。

工业中的手性助剂
手性助剂通常可靠且用途广泛,能够以省时的方式合成大量对映体纯化合物。因此手性助剂通常是药物开发早期阶段的首选方法[2]。
HIV蛋白酶抑制剂替拉那韦是一种已上市的治疗HIV感染药物。替拉那韦的首个立体选择性合成路线涉及有机铜酸盐与手性迈克尔受体进行迈克尔共轭加成[33]。迈克尔受体中的手性恶唑烷酮结构控制替拉那韦分子中两个手性中心当中一个的立体构型。然而替拉那韦的最终商业化合成路线没有用到手性助剂;这个手性中心反而是利用不对称加氢反应得到的[34]。

阿托伐他汀的钙盐在市场上的商品名为立普妥(Lipitor),是一种降血中胆固醇的药物。阿托伐他汀的首个立体选择性药物合成路线依赖于手性酯的非立体选择性醇醛缩合反应来控制两个醇立体中心其中一个立体构型[35]。在阿托伐他汀的商业合成路线中,这一手性中心构型则是从常用的食品添加剂异抗坏血酸的手性继承得到[36]。

另请参见
- 反式-2-苯基-1-环己醇作为手性助剂的合成范例:尾岛内酯
- 缬胺酸在Schöllkopf方法中担任手性助剂。
参考
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.