Loading AI tools
来自维基百科,自由的百科全书
手性,又称对掌性(英语:chirality、/kaɪˈrælɪtiː/)一词源于希腊语词干“手”χειρ(ch[e]ir),在多种学科中表示一种重要的对称特点。

如果某物体与其镜像不同,则其被称为“手性的(英语:chiral)”,且其镜像是不能与原物体重合的,就如同左手和右手互为镜像而无法叠合。手性物体与其镜像被称为对映体(enantiomorph,希腊语意为“相对/相反形式”);在有关分子概念的引用中也被称为对映异构体。可与其镜像叠合的物体被称为非手性的(achiral),有时也称为双向的(amphichiral)。
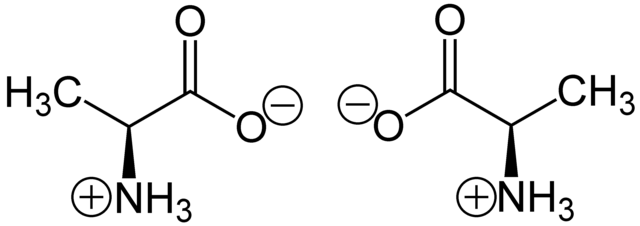
若一个手性分子或离子存在于互为镜像的两种立体异构体中,该两个异构体称为对映异构体;他们通常根据绝对配置或其他一些标准被区分为“右手性”或“左手性”。这两种对映体具有相同的化学性质,除了与其他手性化合物反应时。它们通常具有相反的光学性质,除此以外其他物理性质相同。两种对映体等份的均匀混合物被称为外消旋体,它通常在化学和物理上与纯对映体不同。
手性分子通常具有产生手性的立体异构元素。最常见的立体元素类型是立体中心。在有机化合物的情况下,立体中心最常见的形式是一个碳原子,四个不同的基团以四面体几何形状连接在它上面。一个立体中心有两种可能的构型,在具有一个或多个立体中心的分子中产生立体异构体(非对映异构体和对映异构体)。对于具有一个或多个立构中心的手性分子,对映异构体对应于其中每个立构中心具有相反构型的立体异构体。只有一个立体异构碳的有机化合物总是手性的。另一方面,具有多个手性碳的有机化合物通常但不总是手性的。特别是,如果立体中心的配置方式使分子具有内部对称平面,则该分子是非手性的,称为内消旋化合物。不太常见的是,其他原子如 N、P、S 和 Si 也可以用作立体中心,前提是它们有四个不同的取代基(包括孤对电子)连接到它们上。
由一个或多个立体中心产生的具有手性的分子被归类为具有中心手性。还有两种其他类型的立体元素可以产生手性,立体轴(轴手性)和立体平面(平面手性)。最后,分子的固有曲率也能产生手性(固有手性 inherent chirality)。这些类型的手性远不如中心手性常见。1,1'-联-2-萘酚是轴手性分子的典型例子,而反式环辛烯是平面手性分子的常见例子。最后,螺旋烯具有螺旋手性,这是一种固有手性。
手性是立体化学和生物化学的一个重要概念。大多数与生物学相关的物质都是手性的,例如碳水化合物(糖、淀粉和纤维素)、构成蛋白质的氨基酸和核酸。在活生物体中,人们通常只发现手性化合物的两种对映异构体中的一种。出于这个原因,消耗手性化合物的生物体通常只能代谢其一种对映体。出于同样的原因,手性药物的两种对映异构体通常具有截然不同的效力或作用。
分子的手性基于其构象的分子对称性。一个分子的构象是手性的当且仅当它属于 Cn、Dn、T、O、I 点群(手性点群)。然而,分子本身是否手性取决于它的手性构象是否持久(即至少在原则上异构体可以分离并独立存在),或者在给定的温度和时间尺度下是否能够通过低能构象快速相互转换变化(使分子非手性)。例如,尽管丁烷具有属于 C2 点群的手性左旋构象异构体,但丁烷在室温下被认为是非手性的,因为围绕中心 C-C 键的旋转会迅速相互转化对映异构体(3.4 kcal/mol 势垒)。同样,顺-1,2-二氯环己烷由不同镜像的椅型构象组成,但两者可以通过环己烷椅子翻转(~10 kcal/mol 势垒)相互转换。作为另一个例子,具有三个不同取代基 (R1R2R3N:) 的胺也被视为非手性分子,因为它们的对映体金字塔构象异构体能通过平面过渡态(~6 kcal/mol 势垒)快速反转和相互转化。
然而,如果所讨论的温度足够低,则与给定的时间尺度相比,相互转换对映体手性构象的过程会变得缓慢。然后该分子将被认为在该温度下具有手性。相关时间尺度在某种程度上是任意定义的:有时使用 1000 秒,因为这被认为是实际意义上对映异构体的化学或色谱分离所需时间量的下限。由于单键旋转受限(旋转势垒 ≥ 约 23 kcal/mol)而在室温下呈手性的分子被认为表现出阻转异构现象。
手性化合物不能包含不正当的旋转轴 (Sn),其中包括对称面和反转中心。不对称分子总是手性的。[1]
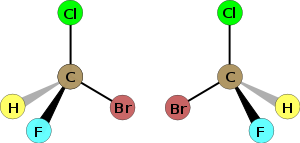
若某原子上两个配体(连接的基团)的位置交换后会产生与原始分子立体异构的分子,则该原子为所属分子的立体中心。例如,一个常见的情况是四面体碳与四个不同的基团 a、b、c 和 d(Cabcd)键合,其中交换任何两个基团(例如 Cbacd)会产生原始的立体异构体,因此中心 C 是立体中心。许多手性分子具有点手性,即与原子重合的单个手性立体中心。这个手性中心通常有四个或更多键连接到不同的基团,可能是碳(如在许多生物分子中)、磷(如在许多有机磷酸酯中)、硅或金属(如在许多手性配位化合物中)。然而,手性中心也可以是键不在同一平面上的三价原子,例如 P-手性膦 (PRR'R″) 中的磷和 S-手性亚砜 (OSRR') 中的硫,此时中心原子存在一孤电子对而不是第四个键。
类似地,立体轴(或平面)被定义为分子中的轴(或平面),使得连接到轴(或平面)的任何两个配体的交换产生立体异构体。例如,C2 对称物质1,1'-联-2-萘酚(BINOL)和 1,3-二氯丙二烯具有手性轴并表现出轴手性,而 (E)-环辛烯和许多带有两个或多个取代基的二茂铁衍生物则具有立体平面并表现出平面手性。
手性也可能源于原子之间的同位素差异,例如在氘代苯甲醇 PhCHDOH 中;它具有手性和光学活性([α]D = 0.715°),即使非氘代化合物 PhCH2OH 不是。[2]
如果两种对映异构体容易相互转化,则纯对映异构体实际上可能无法分离,只能观察到外消旋混合物。例如,大多数具有三个不同取代基 (NRR'R″) 的胺就是这种情况,因为氮转化的能垒较低。
手性物质不必具有手性元素。例子包括某些螺烯、杯芳烃和富勒烯,它们具有固有手性。此外,分子的手性中心可能位于不对应原子中心(因此,立体中心)的位置,例如1,3,5(,7)-取代的金刚烷(例如显示在侧框中的 (1S,3R,5R,7S)-3-甲基-5-苯基金刚烷-1-羧酸)。

当对映体的旋光度对于实际测量来说太低时,该物质被认为表现出隐手性。
系统标准名会包括分子绝对配置的详细信息。由于手性是分子身份的固有部分,因此亦会被包含在标准名内(R/S、D/L 或其他名称)。
手性及手性物质可以分子的绝对构型分为两类:“左手性”和“右手性”。有时为了对比,另外加上一种无手性(也称“中性手性”)。左手性用S表示,右手性用R表示,中性手性用M表示。此外,手性分子亦可根据其将偏振光旋转的方向可以分为右旋对映体(用(+)-、d-前缀来表示)和左旋对映体(用(-)-、l-前缀来表示)。
分子的绝对构型(R、S 构型)是通过顺序规则确定,与其旋光性无绝对对应关系,必须通过实验测量或计算机模拟来确定二者的联系[4]。
除了利用偏光照射所产生的角度偏差正负值相反外,对映异构体的物理特性大致相同。除了与其他手性化合物反应时外,对映异构体的化学特性亦基本相同。
例子:碳的四个键结以接近(看所键结原子不同而有稍微偏差)正四面体分布,如右图。以丙氨酸的甲基(CH3-)为纵轴旋转可发现两分子无法重叠,互为对映异构体。
 |
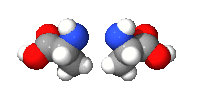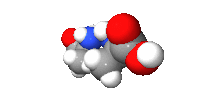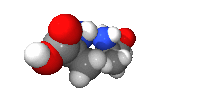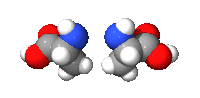 |
大多数的化学反应,如生成物可能含有对映异构体,则生成物会含有两种或以上的对映异构体。而绝大多数的药物都只含一个对映异构体,因为另一对映异构体可能有不良的效果、或没有效果。例如:维生素C的对映异构体并不为身体所吸收,而会被排出体外,所以一片含有化学生产的1000毫克维生素C片,可能实际可吸收的维生素C只有一半分量。
手性分子广泛用于生命科学,也用于药物的生产,2001年,三位利用手性催化剂生产手性药物的科学家被授予诺贝尔化学奖。 如今,手性合成已成为21世纪的重要研究领域。[10]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.