立体中心
来自维基百科,自由的百科全书
立体中心是分子的立体异构焦点,该焦点可以是原子(中心)、轴或平面;也就是说,当至少三个不同的基团与立体中心结合时,交换任意两个不同的基团会产生一个新的立体异构体。[1][2]

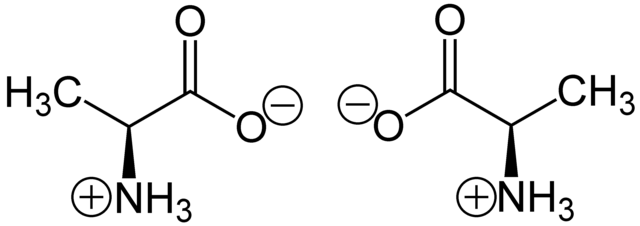
立体中心在几何上被定义为分子中的一个点(位置);立体中心通常但不总是一个特定的原子(通常是碳)。[2][3]立体中心可以存在于手性或非手性分子上;立体中心可以包含单键或双键。[1] 立体异构体的预设数量为 2n ,其中 n 是四面体立体中心的数量;然而,内消旋化合物等例外情况会使立体异构体的实际数量降低到 2n 以下。[4]
立体中心一词是Mislow和Siegel于1984年最早使用的。[5]
手性中心则是一种具有四个不同取代基的立体中心;手性中心是立体中心的一个特定子集,因为它们只能有 sp3 杂化,这意味着它们只能有单键。[6]
手性中心
手性中心是立体中心的一种。手性中心定义为在其镜像上不可叠加的空间排列中包含一组四个不同配体(原子或原子团)的原子。手性中心必须是 sp3 杂化的,这意味着手性中心只能有单键。[6]在有机化学中,手性中心通常指碳、磷或硫原子,但其他原子也可能是手性中心,特别是在有机金属和无机化学领域。
按照国际纯粹与应用化学联合会的定义,手性中心是“不对称碳原子”概念的拓展。不对称碳原子指的是连有四个不同的基团的碳原子,交换连在该原子上的两个基团的位置会得到原化合物的立体异构体。手性中心的概念则将该概念由碳扩展至任何原子,具有四个不同连接基团的任何原子,若其中任何两个连接基团的交换能产生对映异构体,则该原子为分子的手性中心。[7]
立体异构体的数目
一个分子可以同时具有多个立体中心,因而具有多个立体异构体。若一个化合物的立体异构体全部由于立体中心产生,且所有的立体中心都以四面体的立体结构成键,则该化合物的立体异构体的理论数目不会超过2n,其中n是手性中心的总数。若分子有一定的对称性,则分子的立体异构体数目一定小于这个值。
两个手性中心连接的基团相同且位置上具有对称性时,会得到非手性的内消旋化合物 。由于位阻的原因,部分构型可能不能存在。环状化合物即使具有手性中心,由于二重轴的存在,也可能不显示手性。手性化合物也不一定具有手性中心,例如在平面手性和轴手性的情形。
手性碳
“手性碳”或“不对称碳”指的是具有不对称型的碳原子,通常用C*表示。
一个碳原子要成为手性碳需满足两个条件:该碳原子必须是sp3-杂化,且连有四个不同的基团。
碳原子的其它成键方式都会在分子中形成对称从而不具有手性。如, sp 或 sp2杂化的碳原子会使分子该部分呈平面型,因而具有对称面。碳原子上连有两个相同基团时,两基团与碳原子所成夹角的角平分面会成为对称面。
其它手性中心
碳原子在有机化学中的普遍性使得其成为最重要的手性中心,不过手性中心并不限于碳原子,三价氮原子和磷原子的成键也具有四面体的特点。当瓦尔登翻转引起的构型转换受限时,或在形成季铵盐和𬭸盐时,手性就有可能出现。
在配合物中,具有四面体构型与八面体构型的中心金属原子也可能成为手性中心。 对于八面体构型来说,有多种可能的情况。若手性中心只与两种配体配合,而各种配体的数量均是三个,同一种配体沿中线(meridian)排列时,就会给出mer-异构体;同一种配体形成一个面(face)时,就会给出fac-异构体。此外,有三个双齿配体时,就有一对对映异构体,用标记 Λ 和 Δ 表示。
参见
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
