En İyi Sorular
Zaman Çizelgesi
Sohbet
Bakış Açıları
Enfeksiyon
hastalığa neden olan patojenlerin veya organizmaların bir konağı istila etmesi ve çoğalması ve konak dokuların tepkisi Vikipedi'den, özgür ansiklopediden
Remove ads
Enfeksiyon, patojenlerin dokuları istila etmesi, çoğalması ve konak dokuların enfeksiyöz ajana ve ürettikleri toksinlere tepki vermesidir.[1] Bulaşıcı hastalık olarak da bilinen enfeksiyon hastalığı, bir enfeksiyondan kaynaklanan bir hastalıktır.
Remove ads
Enfeksiyonlara, başta bakteriler ve virüsler olmak üzere çok çeşitli patojenler neden olabilir.[2] Konaklar bağışıklık sistemlerini kullanarak enfeksiyonlarla mücadele edebilirler. Memeli konaklar enfeksiyonlara genellikle iltihaplanmayı içeren doğuştan gelen bir yanıtla tepki verir ve bunu adaptif bir yanıt izler.
Enfeksiyonları tedavi etmek için kullanılan spesifik ilaçlar arasında antibiyotikler, antiviraller, antifungaller, antiprotozoaller[3] ve antihelmintikler yer almaktadır. Bulaşıcı hastalıklar 2013 yılında 9,2 milyon ölüme yol açmıştır (tüm ölümlerin yaklaşık %17'si).[4] Enfeksiyonlara odaklanan tıp dalı enfeksiyon hastalıkları olarak adlandırılır.[5]
Remove ads
Türler
Özetle
Bakış açısı
Enfeksiyonlara, aşağıdakileri içeren bulaşıcı ajanlar (patojenler) neden olur:
- Bakteriler (örneğin Mycobacterium tuberculosis, Staphylococcus aureus, Escherichia coli, Clostridium botulinum ve Salmonella spp.)
- Virüsler ve viroidler gibi ilgili ajanlar. (Örneğin HIV, Rinovirüs, Kuduz virüsü gibi Lyssavirüsler, Ebolavirüs ve Şiddetli akut solunum sendromu koronavirüsü 2 )
- Mantarlar ayrıca alt sınıflara ayrılır:
- Candida (en yaygın mantar enfeksiyonu) gibi mayaları içeren Ascomycota; Aspergillus gibi filamentli mantarlar; Pnömosistidomiset türleri; ve insanlarda deri ve diğer yüzeysel yapılarda enfeksiyona neden olan bir grup organizma olan dermatofitler.[6]
- Basidiomycota, insan patojeni Kriptokok cinsi dahil.[7]
- Parazitler genellikle ikiye ayrılır:[8]
- Tek hücreli organizmalar (örn. sıtma, Toksoplazma, Babesia)
- Parazitik yuvarlak solucanlar ve kıl kurtları gibi nematodlar, tenyalar (cestodlar) ve flukeler (şistozomlar gibi trematodlar) dahil makroparazitler (solucanlar veya helmintler).[9] Helmintlerin neden olduğu hastalıklar bazen enfestasyon olarak adlandırılır, ancak bazen de enfeksiyon olarak adlandırılır.
- Keneler, akarlar, pireler ve bitler gibi eklembacaklılar da kavramsal olarak enfeksiyonlara benzeyen insan hastalıklarına neden olabilir, ancak bir insan veya hayvan vücudunun bu makroparazitler tarafından istila edilmesi genellikle enfestasyon olarak adlandırılır.
- Prionlar (toksin salgılamamalarına rağmen)
Remove ads
Belirtiler ve semptomlar
Özetle
Bakış açısı
Bir enfeksiyonun belirti ve semptomları hastalığın türüne bağlıdır. Yorgunluk, iştahsızlık, kilo kaybı, ateş, gece terlemesi, üşüme, ağrı ve sızı gibi bazı enfeksiyon belirtileri genel olarak tüm vücudu etkiler. Diğerleri ise deri döküntüleri, öksürük veya burun akıntısı gibi vücudun belirli bölgelerine özgüdür.[10]
Bazı durumlarda, bulaşıcı hastalıklar belirli bir konakta seyrinin büyük bir kısmında veya hatta tamamında asemptomatik olabilir. İkinci durumda, hastalık yalnızca asemptomatik bir taşıyıcıyla temas ettikten sonra ikincil olarak hastalanan konakçılarda bir "hastalık" (tanım gereği bir hastalık anlamına gelir) olarak tanımlanabilir. Bazı enfeksiyonlar konakçıda hastalığa neden olmadığından enfeksiyon, bulaşıcı hastalık ile eş anlamlı değildir.[11]
Bakteriyel veya viral
Bakteriyel ve viral enfeksiyonların her ikisi de aynı tür semptomlara neden olabileceğinden, belirli bir enfeksiyonun nedeninin hangisi olduğunu ayırt etmek zor olabilir.[12] Viral enfeksiyonlar antibiyotiklerle tedavi edilemezken bakteriyel enfeksiyonlar tedavi edilebildiğinden bu ikisini birbirinden ayırmak önemlidir.[13]
Remove ads
Patofizyoloji
Özetle
Bakış açısı

Enfeksiyonlar için geçerli olan ve bazen enfeksiyon zinciri[15] veya bulaşma zinciri olarak adlandırılan genel bir olaylar zinciri vardır. Zincir, enfeksiyöz ajan, rezervuar, duyarlı bir konağa giriş, çıkış ve yeni konaklara bulaşmayı içeren çeşitli adımları içerir. Bir enfeksiyonun gelişmesi için her bir halkanın kronolojik bir sırayla mevcut olması gerekir. Bu adımların anlaşılması, sağlık çalışanlarının enfeksiyonu hedef almasına ve ilk etapta oluşmasını önlemesine yardımcı olur.[16]
Kolonizasyon

Enfeksiyon, bir organizma vücuda başarıyla girdiğinde, büyüdüğünde ve çoğaldığında başlar. Bu, kolonizasyon olarak adlandırılır. Çoğu insan kolayca enfekte olmaz. Bağışıklık sistemi zayıflamış veya zayıflatılmış olanların kronik veya kalıcı enfeksiyonlara karşı duyarlılığı artar. Bağışıklık sistemi baskılanmış olan bireyler fırsatçı enfeksiyonlara karşı özellikle hassastır. Konak-patojen arayüzünde konağa giriş, genellikle ağız boşluğu, burun, gözler, genital organlar, anüs gibi deliklerdeki mukozadan gerçekleşir veya mikrop açık yaralardan girebilir. Birkaç organizma ilk giriş yerinde büyüyebilirken, birçoğu göç eder ve farklı organlarda sistemik enfeksiyona neden olur. Bazı patojenler konakçı hücrelerin içinde (hücre içi) büyürken diğerleri vücut sıvılarında serbestçe büyür.[17]
Yara kolonizasyonu, yara içinde çoğalmayan mikroorganizmaları ifade ederken, enfekte yaralarda çoğalan organizmalar mevcuttur ve doku yaralanmıştır.[18] Tüm çok hücreli organizmalar bir dereceye kadar dışsal organizmalar tarafından kolonize edilir ve bunların büyük çoğunluğu konak ile ya mutualistik ya da kommensal bir ilişki içinde bulunur. İlkine örnek olarak memeli kolonunu kolonize eden anaerobik bakteri türleri, ikincisine örnek olarak ise insan derisinde bulunan çeşitli stafilokok türleri verilebilir. Bu kolonizasyonların hiçbiri enfeksiyon olarak kabul edilmez.
Enfeksiyon ve kolonizasyon arasındaki fark genellikle sadece bir durum meselesidir. Patojenik olmayan organizmalar belirli koşullar altında patojenik hale gelebilir ve en virülans organizmanın bile tehlike arz eden bir enfeksiyona neden olması için belirli koşullar gerekir. Corynebacteria sp. ve Viridans streptokok gibi bazı kolonize bakteriler, patojen bakterilerin yapışmasını ve kolonizasyonunu önler ve böylece konakçı ile simbiyotik bir ilişki kurarak enfeksiyonu önler ve yara iyileşmesini hızlandırır.

Bir konağın bir patojen tarafından aşılanması ve nihai sonuçla ilgili değişkenler şunları içerir:
- patojenin giriş yolu ve konak bölgelere erişimi
- belirli bir organizmanın içsel virülansı
- başlangıç inokülasyonunun miktarı veya yükü
- kolonize olan konağın bağışıklık durumu
Örnek olarak, bazı stafilokok türleri cilt üzerinde zararsızdır, ancak eklem kapsülü veya periton gibi normalde steril bir alanda bulunduklarında direnç göstermeden çoğalır ve zarar verirler.[22]
Gaz kromatografisi-kütle spektrometresi, 16S ribozomal RNA analizi, omik ve diğer gelişmiş teknolojilerin son yıllarda insanlar için daha belirgin hale getirdiği ilginç bir gerçek, mikrobiyal kolonizasyonun insanların neredeyse steril olduğunu düşündüğü ortamlarda bile çok yaygın olduğudur.
Bakteriyel kolonizasyonun normal olması nedeniyle, hangi kronik yaraların enfekte olarak sınıflandırılabileceğini ve ne kadar ilerleme riski olduğunu bilmek zordur. Klinik uygulamada görülen çok sayıda yaraya rağmen, değerlendirilen semptom ve bulgular için sınırlı sayıda kaliteli veri bulunmaktadır.
Journal of the American Medical Association'ın "Rasyonel Klinik Muayene Serisi"nde kronik yaralar üzerine yapılan bir inceleme, enfeksiyon göstergesi olarak artan ağrının önemini ölçmüştür.[23] İnceleme, en faydalı bulgunun ağrı seviyesindeki artışın [olabilirlik oranı (LR) aralığı, 11-20] enfeksiyonu çok daha olası hale getirdiğini, ancak ağrının olmamasının (negatif olabilirlik oranı aralığı, 0,64-0,88) enfeksiyonu dışlamadığını göstermiştir (özet LR 0,64-0,88).
Hastalık
Hastalık, konağın koruyucu bağışıklık mekanizmaları tehlikeye girdiğinde ve organizma konağa zarar verdiğinde ortaya çıkabilir. Mikroorganizmalar çeşitli toksinler veya yıkıcı enzimler salgılayarak doku hasarına neden olabilir. Örneğin, Clostridium tetani kasları felç eden bir toksin salgılar ve stafilokok şok ve sepsis üreten toksinler salgılar. Tüm enfeksiyon etkenleri tüm konakçılarda hastalığa neden olmaz. Örneğin, çocuk felci ile enfekte olan bireylerin %5'inden azında hastalık gelişir.[24] Öte yandan, bazı bulaşıcı ajanlar oldukça öldürücüdür. Deli dana hastalığına ve Creutzfeldt-Jakob hastalığına neden olan prion, enfekte olan tüm hayvanları ve insanları her zaman öldürür.[25]
Kalıcı enfeksiyonlar, vücudun ilk enfeksiyondan sonra organizmayı temizleyememesi nedeniyle ortaya çıkar. Kalıcı enfeksiyonlar, bulaşıcı organizmanın sürekli varlığı ile karakterize edilir, genellikle aktif enfeksiyonun ara sıra tekrarlayan nüksleri ile birlikte latent enfeksiyon olarak görülür. Vücudun farklı hücrelerini enfekte ederek kalıcı bir enfeksiyonu sürdürebilen bazı virüsler vardır. Bazı virüsler bir kez bulaştıktan sonra vücudu asla terk etmezler. Tipik bir örnek, sinirlerde saklanma eğiliminde olan ve belirli koşullar ortaya çıktığında yeniden aktif hale gelen herpes virüsüdür.[26]
Kalıcı enfeksiyonlar her yıl dünya çapında milyonlarca kişinin ölümüne neden olmaktadır.[27] Parazitlerden kaynaklanan kronik enfeksiyonlar, birçok az gelişmiş ülkede yüksek morbidite ve mortaliteye neden olmaktadır.[28][29]
Bulaş

Enfekte eden organizmaların hayatta kalması ve diğer konaklarda enfeksiyon döngüsünü tekrarlaması için, kendilerinin (veya yavrularının) mevcut bir rezervuarı terk etmesi ve başka bir yerde enfeksiyona neden olması gerekir. Enfeksiyonun bulaşması birçok potansiyel yolla gerçekleşebilir:[30]
- Solunum yolu olarak da bilinen damlacık teması ve bunun sonucunda ortaya çıkan enfeksiyon hava yoluyla bulaşan hastalık olarak adlandırılabilir. Enfekte bir kişi başka bir kişinin üzerine öksürür veya hapşırırsa, sıcak, nemli damlacıklar içinde asılı kalan mikroorganizmalar burun, ağız veya göz yüzeylerinden vücuda girebilir.
- Fekal-oral bulaşma, gıda maddelerinin veya suyun kontamine olması (insanların yiyecek hazırlamadan önce ellerini yıkamaması veya arıtılmamış kanalizasyonun içme suyu kaynağına karışması) ve bunları yiyen veya içen kişilerin enfekte olması. Fekal-oral yolla bulaşan yaygın patojenler arasında Vibrio cholerae, Giardia türleri, rotavirüsler, Entamoeba histolytica, Escherichia coli ve bant solucanları yer almaktadır.[31] Bu patojenlerin çoğu gastroenterite neden olur.
- Cinsel yolla bulaşma ve bunun sonucunda ortaya çıkan hastalık cinsel yolla bulaşan hastalık olarak adlandırılır
- Ağız yoluyla bulaşma, öncelikle ağız yoluyla bulaşan hastalıklar öpüşme gibi doğrudan ağız teması yoluyla veya bir içki bardağını veya bir sigarayı paylaşmak gibi dolaylı temas yoluyla yakalanabilir.
- Doğrudan temasla bulaşma, doğrudan temasla bulaşabilen bazı hastalıklar arasında atlet ayağı, impetigo ve siğiller yer almaktadır.
- Araçla bulaşma, cansız bir rezervuar (gıda, su, toprak) ile bulaşma[32]
- Hamilelik veya doğum sırasında doğrudan anneden embriyoya, fetüse veya bebeğe dikey bulaşma. Önceden var olan bir enfeksiyonun veya hamilelik sırasında edinilen bir enfeksiyonun sonucu olarak ortaya çıkabilir.
- Enfekte materyalin enjeksiyonu veya nakli gibi tıbbi prosedürler nedeniyle iyatrojenik bulaşma.
- Vektör kaynaklı bulaşma, kendisi hastalığa neden olmayan ancak patojenleri bir konaktan diğerine taşıyarak enfeksiyonu ileten bir organizma olan vektör tarafından bulaştırılır.[33]
Virülans ile bulaşıcılık arasındaki ilişki karmaşıktır; yapılan çalışmalar ikisi arasında net bir ilişki olmadığını göstermiştir.[34][35] Yine de virülans ve bulaşıcılık arasında kısmen bir bağlantı olduğunu gösteren az sayıda kanıt bulunmaktadır.[36][37][38]
Remove ads
Tanı
Özetle
Bakış açısı
Bu bölümdeki bilgilerin doğrulanabilmesi için ek kaynaklar gerekli. (Kasım 2023) |
Enfeksiyon hastalıklarının tanısı bazen doğrudan ya da dolaylı olarak bir enfeksiyon etkeninin tanımlanmasını gerektirir.[39] Pratikte siğiller, deri apseleri, solunum sistemi enfeksiyonları ve ishalli hastalıklar gibi çoğu küçük bulaşıcı hastalık, klinik görünümlerine göre teşhis edilir ve spesifik etken hakkında bilgi sahibi olmadan tedavi edilir.
Hastalığın nedenine ilişkin sonuçlar, hastanın belirli bir etkenle temas etmiş olma olasılığına, mikrobun toplumdaki varlığına ve diğer epidemiyolojik değerlendirmelere dayanmaktadır. Yeterli çaba gösterildiğinde, bilinen tüm bulaşıcı etkenler spesifik olarak tanımlanabilir. Ancak, çoğu zaman spesifik bir tedavi olmadığından, neden açık olduğundan veya enfeksiyonun sonucu iyi huylu olduğundan, tanımlamanın faydaları genellikle maliyetten çok daha ağır basmaktadır.
Enfeksiyon hastalıklarının tanısı neredeyse her zaman tıbbi öykü ve fizik muayene ile başlatılır. Daha ayrıntılı tanı teknikleri, bir hastadan izole edilen enfeksiyon etkenlerinin kültürünü içerir. Kültür, mikroskobik özelliklerini inceleyerek, patojenler tarafından üretilen maddelerin varlığını tespit ederek ve bir organizmayı genotipine göre doğrudan tanımlayarak bulaşıcı organizmaların tanımlanmasını sağlar. Diğer teknikler (X-ışınları, CAT taramaları, PET taramaları veya NMR gibi), bulaşıcı bir ajanın büyümesinden kaynaklanan iç anormalliklerin görüntülerini üretmek için kullanılır. Bu görüntüler, örneğin bir kemik apsesinin veya bir prion tarafından üretilen spongiform ensefalopatinin tespit edilmesinde faydalıdır.
Semptomatik tanı
Bulaşıcı bir hastalığı olan herhangi bir bireyde mevcut semptomlar tanıya yardımcı olur, ancak şüphenin doğrulanması için genellikle ek tanı tekniklerine ihtiyaç duyulur. Bazı belirtiler özellikle karakteristiktir ve bir hastalığın göstergesidir ve patognomonik belirtiler olarak adlandırılır; ancak bunlar nadirdir. Tüm enfeksiyonlar semptomatik değildir.[40]
Çocuklarda siyanoz, hızlı solunum, zayıf periferik perfüzyon veya peteşiyal döküntü varlığı ciddi enfeksiyon riskini 5 kattan fazla artırır.[41] Diğer önemli göstergeler arasında ebeveyn endişesi, klinik içgüdü ve 40 °C'den yüksek ateş yer alır.[41]
Mikrobiyal kültür

Birçok tanısal yaklaşım, uygun klinik örnekten bir patojeni izole etmek için mikrobiyolojik kültüre dayanır.[42] Mikrobiyal kültürde, belirli bir etken için bir üreme ortamı sağlanır. Potansiyel olarak hastalıklı doku veya sıvıdan alınan bir numune daha sonra bu besiyerinde üreyebilen bir enfeksiyöz ajanın varlığı açısından test edilir.
Birçok patojenik bakteri, bol miktarda su ile birlikte büyüme için gerekli karbonhidrat ve proteinleri sağlayan bir tür katı besiyeri olan besin agarı üzerinde kolayca üreyebilir. Tek bir bakteri, plakanın yüzeyinde koloni adı verilen ve diğer kolonilerden ayrılmış veya bir "çim" halinde birleşmiş olabilen görünür bir tümsek halinde büyüyecektir.
Bir koloninin boyutu, rengi, şekli ve biçimi bakteri türünün, spesifik genetik yapısının (suşu) ve büyümesini destekleyen ortamın karakteristiğidir. Tanımlamaya yardımcı olmak için genellikle plakaya başka bileşenler de eklenir. Plakalar bazı bakterilerin üremesine izin verip diğerlerinin üremesine izin vermeyen ya da bazı bakterilere tepki olarak renk değiştirip diğerlerine tepki olarak renk değiştirmeyen maddeler içerebilir. Bu gibi bakteriyolojik plaklar, bulaşıcı bakterilerin klinik tanımlanmasında yaygın olarak kullanılır.
Mikrobiyal kültür, virüslerin tanımlanmasında da kullanılabilir: bu durumda ortam, virüsün enfekte edebileceği ve daha sonra değiştirebileceği veya öldürebileceği kültürde yetiştirilen hücrelerdir. Viral tanımlama durumunda, ölü hücrelerden oluşan bir bölge viral büyümeden kaynaklanır ve "plak" olarak adlandırılır. Ökaryotik parazitler de belirli bir ajanı tanımlamanın bir yolu olarak kültürde yetiştirilebilir.[43]
Uygun plaka kültürü tekniklerinin yokluğunda, bazı mikropların canlı hayvanlarda kültüre alınması gerekir. Mycobacterium leprae ve Treponema pallidum gibi bakteriler hayvanlarda üretilebilir, ancak serolojik ve mikroskobik teknikler canlı hayvan kullanımını gereksiz kılar. Virüsler de genellikle kültürde veya hayvanlarda büyümeye alternatifler kullanılarak tanımlanır. Bazı virüsler embriyonlu yumurtalarda yetiştirilebilir.
Bir başka faydalı tanımlama yöntemi de ksenodiagnoz veya bulaşıcı bir ajanın büyümesini desteklemek için bir vektörün kullanılmasıdır. Chagas hastalığı bunun en önemli örneğidir, çünkü bir hastada Trypanosoma cruzi etkeninin varlığını doğrudan göstermek zordur, bu da kesin tanı koymayı zorlaştırır. Bu durumda ksenodiagnoz, enfekte olduğundan şüphelenilen bir kişiden kan alan enfekte olmamış bir triatomin böceği olan Chagas ajanı T. cruzi'nin vektörünün kullanılmasını içerir. Böcek daha sonra bağırsaklarında T. cruzi üremesi açısından incelenir.[44]
Mikroskobi
Bulaşıcı hastalıkların teşhisinde kullanılan bir diğer temel araç mikroskobidir.[45] Yukarıda tartışılan kültür tekniklerinin neredeyse tamamı, bir noktada, bulaşıcı ajanın kesin olarak tanımlanması için mikroskobik incelemeye dayanmaktadır. Mikroskobi, bileşik ışık mikroskobu gibi basit aletlerle veya elektron mikroskobu gibi karmaşık aletlerle gerçekleştirilebilir. Hastalardan alınan numuneler doğrudan ışık mikroskobu altında görüntülenebilir ve genellikle hızlı bir şekilde tanımlamaya yol açabilir.
Mikroskopi genellikle biyokimyasal boyama teknikleriyle birlikte kullanılır ve antikor bazlı tekniklerle birlikte kullanıldığında son derece spesifik hale getirilebilir. Örneğin, yapay olarak floresans hale getirilmiş antikorların (floresans işaretli antikorlar) kullanımı, bir patojen üzerinde bulunan belirli bir antijene bağlanmak ve onu tanımlamak üzere yönlendirilebilir. Floresans mikroskobu daha sonra klinik numuneler veya kültürlenmiş hücrelerdeki içselleştirilmiş antijenlere bağlı floresan etiketli antikorları tespit etmek için kullanılır. Bu teknik özellikle ışık mikroskobunun bir virüsü doğrudan tanımlayamadığı viral hastalıkların teşhisinde faydalıdır.[46]
Diğer mikroskobik prosedürler de enfeksiyöz ajanların tanımlanmasına yardımcı olabilir. Negatif yüklü hücresel moleküller ile boya üzerindeki pozitif yük arasındaki elektrostatik çekim nedeniyle neredeyse tüm hücreler bir dizi temel boya ile kolayca boyanır. Bir hücre normalde mikroskop altında şeffaftır ve bir boya kullanmak hücrenin arka planıyla kontrastını artırır.
Bir hücrenin Giemsa boyası veya kristal viyole gibi bir boya ile boyanması, mikroskopistin hücrenin boyutunu, şeklini, iç ve dış bileşenlerini ve diğer hücrelerle ilişkilerini tanımlamasına olanak tanır. Bakterilerin farklı boyama prosedürlerine verdiği yanıt, mikropların taksonomik sınıflandırılmasında da kullanılır.
Gram boyama ve aside dirençli boyama olmak üzere iki yöntem, bakterilerin sınıflandırılmasında ve hastalıkların teşhisinde kullanılan standart yaklaşımlardır. Gram boyası, her ikisi de birçok önemli insan patojenini içeren Bacillota ve Actinomycetotabakteri gruplarını tanımlar. Asit-hızlı boyama prosedürü, Actinomycetota cinsi Mycobacterium ve Nocardia'yı tanımlar.[47]
Biyokimyasal testler
Bulaşıcı ajanların tanımlanmasında kullanılan biyokimyasal testler, belirli bir bulaşıcı ajanın karakteristik metabolik veya enzimatik ürünlerinin tespitini içerir. Bakteriler karbonhidratları kendi cins ve türlerine özgü şekillerde fermente ettiklerinden, fermantasyon ürünlerinin tespiti bakteriyel tanımlamada yaygın olarak kullanılır. Asitler, alkoller ve gazlar genellikle bakteriler seçici sıvı veya katı ortamlarda yetiştirildiğinde bu testlerde tespit edilir.[48]
Enfekte dokudan enzimlerin izolasyonu, bulaşıcı bir hastalığın biyokimyasal teşhisinin temelini de sağlayabilir. Örneğin, insanlar ne RNA replikaz ne de ters transkriptaz üretebilir ve bu enzimlerin varlığı belirli viral enfeksiyon türlerinin karakteristik özelliğidir. Viral protein hemaglutininin kırmızı kan hücrelerini tespit edilebilir bir matris halinde birbirine bağlama kabiliyeti de viral enfeksiyon için biyokimyasal bir test olarak nitelendirilebilir, ancak kesin olarak konuşmak gerekirse hemaglutinin bir enzim değildir ve metabolik bir işlevi yoktur.[49]
Serolojik yöntemler, mikroorganizmaları tanımlamak için kullanılan son derece hassas, spesifik ve genellikle son derece hızlı testlerdir. Bu testler bir antikorun spesifik olarak bir antijene bağlanma yeteneğine dayanmaktadır. Genellikle bulaşıcı bir ajan tarafından üretilen bir protein veya karbonhidrat olan antijen, antikor tarafından bağlanır. Bu bağlanma daha sonra teste bağlı olarak çeşitli şekillerde gözle görülebilen bir olaylar zincirini başlatır. Örneğin, "Strep boğaz" genellikle dakikalar içinde teşhis edilir ve hastanın boğazından pamuklu çubukla alınan etken madde S. pyogenes tarafından üretilen antijenlerin görünümüne dayanır.
Serolojik testler, mevcutsa, genellikle tercih edilen tanımlama yoludur, ancak testlerin geliştirilmesi maliyetlidir ve testte kullanılan reaktifler genellikle soğutma gerektirir. Bazı serolojik yöntemler son derece maliyetlidir, ancak "strep testi" gibi yaygın olarak kullanıldıklarında ucuz olabilirler.[11]
Karmaşık serolojik teknikler, immünoassay olarak bilinen teknikler olarak geliştirilmiştir. İmmünoassayler, temel antikor - antijen bağlanmasını, bir tür enstrümantasyonla tespit edilebilen bir elektromanyetik veya parçacık radyasyon sinyali üretmek için temel olarak kullanabilir. Bilinmeyenlerin sinyali, hedef antijenin miktarının belirlenmesini sağlayan standartlarınki ile karşılaştırılabilir.
Bulaşıcı hastalıkların teşhisine yardımcı olmak için immünoassayler, bulaşıcı ajanlardan veya yabancı bir ajana yanıt olarak enfekte bir organizma tarafından üretilen proteinlerden gelen antijenleri tespit edebilir veya ölçebilir. Örneğin, immünoassay A bir virüs partikülünden gelen bir yüzey proteininin varlığını tespit edebilir. Öte yandan İmmünoassay B, bir organizmanın bağışıklık sistemi tarafından üretilen ve virüsü nötralize etmek ve yok edilmesini sağlamak için yapılan antikorları tespit edebilir veya ölçebilir.
Enstrümantasyon, antikor - antijen bağlanmasına bağlı ikincil reaksiyonlar tarafından oluşturulan son derece küçük sinyalleri okumak için kullanılabilir. Enstrümantasyon; numune alma, reaktif kullanımı, reaksiyon süreleri, sinyal tespiti, sonuçların hesaplanması ve veri yönetimini kontrol ederek bulaşıcı hastalıkların teşhisi için uygun maliyetli otomatik bir süreç sağlayabilir.
PCR tabanlı tanı

Polimeraz zincir reaksiyonu (PCR) yöntemine dayalı teknolojiler, birkaç nedenden ötürü yakın gelecekte neredeyse her yerde bulunan altın standart tanı yöntemleri haline gelecektir. İlk olarak, enfeksiyon etkenleri kataloğu, insan popülasyonundaki önemli enfeksiyon etkenlerinin neredeyse tamamının tanımlandığı noktaya ulaşmıştır. İkincisi, bulaşıcı bir ajanın hastalığa neden olması için insan vücudunda büyümesi gerekir; esasen bir hastalığa neden olmak için kendi nükleik asitlerini çoğaltması gerekir. Enfekte dokudaki bu nükleik asit amplifikasyonu, PCR kullanarak enfeksiyöz ajanı tespit etme fırsatı sunar. Üçüncüsü, PCR'ı yönlendirmek için gerekli araçlar, primerler, enfeksiyöz ajanların genomlarından türetilmiştir ve halihazırda değilse bile zamanla bu genomlar bilinecektir.[50]
Dolayısıyla, herhangi bir enfeksiyöz ajanı hızlı ve spesifik bir şekilde tespit edebilecek teknolojik kabiliyet şu anda mevcuttur. PCR'ın standart bir tanı aracı olarak kullanılmasının önündeki tek engel maliyet ve uygulamadır, ancak bunların hiçbiri aşılamaz değildir. Bazı klostridyal hastalıklar (tetanos ve botulizm) gibi birkaç hastalığın tanısı PCR yöntemlerinin geliştirilmesinden fayda sağlamayacaktır. Bu hastalıklar temelde, son derece güçlü nörotoksinler üreten nispeten az sayıda enfeksiyöz bakterinin neden olduğu biyolojik zehirlenmelerdir. Enfeksiyöz ajanın önemli ölçüde çoğalması gerçekleşmez, bu da PCR'ın herhangi bir bakterinin varlığını tespit etme yeteneğini sınırlar.[50]
Metagenomik sıralama
Zayıflatıcı ve yaşamı tehdit eden hastalıklara neden olan çok çeşitli bakteriyel, viral, fungal, protozoal ve helmintik patojenler göz önüne alındığında, enfeksiyonun nedenini hızlı bir şekilde belirleme yeteneği önemlidir, ancak genellikle zordur. Örneğin, beyni etkileyen ciddi bir hastalık olan ensefalit vakalarının yarısından fazlasına, standart bakım (mikrobiyolojik kültür) ve son teknoloji klinik laboratuvar yöntemleri kullanılarak yapılan kapsamlı testlere rağmen tanı konulamamaktadır.
Metagenomik dizileme tabanlı tanı testleri şu anda klinik kullanım için geliştirilmektedir ve her şeyi kapsayan tek bir test kullanarak enfeksiyonu teşhis etmenin hassas, spesifik ve hızlı bir yolu olarak umut vadetmektedir. Bu test mevcut PCR testlerine benzer; ancak spesifik bir enfeksiyöz ajan için primerler yerine hedeflenmemiş bir tüm genom amplifikasyonu kullanılır. Bu amplifikasyon adımını yeni nesil dizileme veya üçüncü nesil dizileme, hizalama karşılaştırmaları ve binlerce patojen ve kommensal referans genomdan oluşan geniş veritabanları kullanılarak taksonomik sınıflandırma takip eder. Eşzamanlı olarak, patojen ve plazmid genomları içindeki antimikrobiyal direnç genleri, antimikrobiyal yönetimi kolaylaştırmak ve bir hastanın enfeksiyonu için en etkili ilaçları kullanarak tedavinin optimizasyonuna izin vermek için antibiyotik duyarlılık testine benzer bir antimikrobiyal direnç profili oluşturmak üzere dizilenir ve taksonomik olarak sınıflandırılmış patojen genomlarıyla hizalanır.
Metagenomik dizileme, hasta bağışıklık sistemi baskılanmış olduğunda tanı için özellikle yararlı olabilir. Giderek daha geniş bir yelpazeye yayılan enfeksiyöz ajanlar bağışıklık sistemi baskılanmış bireylere ciddi zararlar verebilir, bu nedenle klinik taramanın genellikle daha geniş kapsamlı olması gerekir. Ek olarak, semptomların ifadesi genellikle atipiktir, bu da sunuma dayalı bir klinik tanıyı daha zor hale getirir. Üçüncü olarak, antikorların tespitine dayanan tanı yöntemlerinin başarısız olma olasılığı daha yüksektir. Bu nedenle, bilinen tüm insan patojenleri için antikorlar yerine organizmanın DNA'sının varlığını tespit eden hızlı, hassas, spesifik ve hedeflenmemiş bir test oldukça arzu edilmektedir.
Testlerin endikasyonu

Bir enfeksiyon etkeninin spesifik olarak tanımlanması için genellikle sadece böyle bir tanımlamanın hastalığın tedavisine veya önlenmesine yardımcı olabileceği veya etkili terapötik veya önleyici tedbirlerin geliştirilmesinden önce bir hastalığın seyri hakkında bilgi sahibi olmak için bir endikasyon vardır. Örneğin, 1980'lerin başında, AIDS tedavisi için AZT'nin ortaya çıkmasından önce, sonuç hastaya daha fazla tedavi seçeneği sunmayacak olsa bile, hasta kan örneklerinin bileşimi izlenerek hastalığın seyri yakından takip ediliyordu. HIV'in belirli topluluklarda ortaya çıkışına ilişkin bu çalışmalar, kısmen virüsün bulaşma yoluna ilişkin hipotezlerin geliştirilmesine olanak sağlamıştır. Hastalığın nasıl bulaştığının anlaşılmasıyla, yeni enfeksiyonların sayısını azaltmayı amaçlayan kampanyalarda kaynaklar en büyük risk altındaki topluluklara yönlendirilebilmiştir. HIV'in spesifik serolojik tanısal tanımlaması ve daha sonra genotipik veya moleküler tanımlaması, virüsün zamansal ve coğrafi kökenlerine ilişkin hipotezlerin yanı sıra sayısız başka hipotezin geliştirilmesini de sağlamıştır.[11]
Moleküler tanı araçlarının geliştirilmesi, doktorların ve araştırmacıların anti-retroviral ilaçlarla tedavinin etkinliğini izlemelerini sağlamıştır. Moleküler tanı yöntemleri artık sağlıklı kişilerde HIV'in hastalık başlamadan çok önce tespit edilmesinde ve HIV enfeksiyonuna genetik olarak dirençli kişilerin varlığının gösterilmesinde yaygın olarak kullanılmaktadır. Dolayısıyla, AIDS için hala bir tedavi olmasa da virüsün tanımlanmasının ve enfekte bireylerin kanlarındaki virüs seviyelerinin izlenmesinin hem hasta hem de genel olarak toplum için büyük terapötik ve öngörücü faydaları vardır.
Sınıflandırma
Subklinik ve klinik (latent ve belirgin)
Semptomatik enfeksiyonlar belirgin ve klinik iken, aktif olan ancak fark edilebilir semptomlar üretmeyen bir enfeksiyon belirsiz, sessiz, subklinik veya gizli olarak adlandırılabilir. İnaktif veya uykuda olan bir enfeksiyona latent enfeksiyon denir.[51] Latent bakteriyel enfeksiyona örnek olarak latent verem verilebilir. Bazı viral enfeksiyonlar da latent olabilir, latent viral enfeksiyonlara örnek olarak Herpesviridae ailesinden herhangi biri verilebilir.[52]
Enfeksiyon kelimesi, belirli bir patojenin varlığını (ne kadar az olursa olsun) ifade edebilir, ancak aynı zamanda sıklıkla klinik olarak belirgin bir enfeksiyonu (başka bir deyişle, bir bulaşıcı hastalık vakasını) ima eden bir anlamda kullanılır. Bu gerçek zaman zaman bazı belirsizlikler yaratmakta veya kullanım tartışmalarına yol açmaktadır; bu durumu aşmak için sağlık uzmanlarının bazı patojenlerin mevcut olduğunu ancak klinik olarak belirgin bir enfeksiyon (hastalık yok) olmadığını kastettiklerinde kolonizasyondan (enfeksiyon yerine) bahsetmeleri yaygındır.[53]
Enfeksiyonun seyri
Enfeksiyonların zaman içinde nasıl ve nerede ortaya çıktığını tanımlamak için farklı terimler kullanılır. Akut enfeksiyonda semptomlar hızla gelişir; seyri hızlı ya da uzun süreli olabilir. Kronik enfeksiyonda, semptomlar genellikle haftalar veya aylar içinde kademeli olarak gelişir ve çözülmesi yavaştır.[54] Subakut enfeksiyonlarda semptomların gelişmesi akut enfeksiyonlara göre daha uzun sürer ancak kronik enfeksiyonlara göre daha hızlı ortaya çıkar. Fokal enfeksiyon, organizmaların kan dolaşımı yoluyla vücudun başka bir bölgesine geçtiği ilk enfeksiyon bölgesidir.[55]
Birincil ve fırsatçı
Çok sayıda mikroorganizma çeşidi arasında nispeten azı sağlıklı bireylerde hastalığa neden olur.[56] Bulaşıcı hastalıklar, bu az sayıdaki patojen ile enfekte ettikleri konakçıların savunmaları arasındaki etkileşimden kaynaklanır. Herhangi bir patojenden kaynaklanan hastalığın görünümü ve şiddeti, o patojenin konağa zarar verme yeteneğinin yanı sıra konağın patojene karşı koyma yeteneğine bağlıdır. Bununla birlikte, bir konağın bağışıklık sistemi de enfeksiyonu kontrol altına almak amacıyla konağın kendisine zarar verebilir. Bu nedenle klinisyenler, enfeksiyöz mikroorganizmaları veya mikropları konak savunmasının durumuna göre birincil patojenler veya fırsatçı patojenler olarak sınıflandırır.[57]
Birincil patojenler
Birincil patojenler normal, sağlıklı konakta bulunmalarının veya faaliyet göstermelerinin bir sonucu olarak hastalığa neden olurlar ve içsel virülansları (neden oldukları hastalığın şiddeti) kısmen üreme ve yayılma ihtiyaçlarının gerekli bir sonucudur. İnsanlarda en sık görülen birincil patojenlerin çoğu yalnızca insanları enfekte eder, ancak birçok ciddi hastalığa çevreden edinilen veya insan olmayan konakçıları enfekte eden organizmalar neden olur.[58]
Fırsatçı patojenler
Fırsatçı patojenler, direnci azalmış (bağışıklık yetmezliği) bir konakçıda veya vücudun içine olağandışı bir şekilde eriştiklerinde (örneğin travma yoluyla) bulaşıcı bir hastalığa neden olabilirler. Fırsatçı enfeksiyon, gastrointestinal veya üst solunum yollarındaki patojen bakteriler veya mantarlar gibi normalde konakçı ile temas halinde olan mikroplardan kaynaklanabileceği gibi, diğer konakçılardan (Clostridium difficile kolitinde olduğu gibi) veya travmatik giriş sonucu (cerrahi yara enfeksiyonları veya bileşik kırıklarda olduğu gibi) çevreden edinilen (normalde zararsız olan) mikroplardan da kaynaklanabilir.
Fırsatçı bir hastalık, genetik kusurlar (kronik granülomatöz hastalık gibi), antimikrobiyal ilaçlara veya bağışıklık sistemini baskılayan kimyasallara maruz kalma (zehirlenme veya kanser kemoterapisi sonrasında ortaya çıkabileceği gibi), iyonlaştırıcı radyasyona maruz kalma veya bağışıklık sistemini baskılayıcı aktiviteye sahip bulaşıcı bir hastalık (kızamık, sıtma veya AIDS gibi) sonucunda ortaya çıkabilen konak savunmasının bozulmasını gerektirir. Birincil patojenler ayrıca direnci azalmış bir konakta normalde bağışıklık sistemi yetersiz bir konakta meydana gelenden daha şiddetli hastalığa neden olabilir.[11]
İkincil enfeksiyon
Birincil enfeksiyon pratikte bireyin mevcut sağlık sorununun temel nedeni olarak görülebilirken, ikincil enfeksiyon bu temel nedenin bir sekeli veya komplikasyonudur. Örneğin, yanık veya penetran travmaya (temel neden) bağlı bir enfeksiyon ikincil bir enfeksiyondur. Birincil patojenler genellikle birincil enfeksiyona ve sıklıkla da ikincil enfeksiyona neden olur. Genellikle fırsatçı enfeksiyonlar ikincil enfeksiyonlar olarak görülür (çünkü bağışıklık yetmezliği veya yaralanma predispozan faktördür).[57]
Diğer enfeksiyon türleri
Diğer enfeksiyon türleri karma, iyatrojenik, nozokomiyal ve toplum kaynaklı enfeksiyonlardan oluşur.
Karma enfeksiyon, iki veya daha fazla patojenin neden olduğu bir enfeksiyondur. Buna örnek olarak Bacteroides fragilis ve Escherichia coli'nin neden olduğu apandisit verilebilir. İkincisi ise iyatrojenik bir enfeksiyondur. Bu tür bir enfeksiyon, bir sağlık çalışanından hastaya bulaşan bir enfeksiyondur. Nozokomiyal enfeksiyon da bir sağlık hizmeti ortamında meydana gelen bir enfeksiyondur. Nozokomiyal enfeksiyonlar hastanede kalış sırasında edinilir. Son olarak, toplum kaynaklı enfeksiyon, enfeksiyonun tüm toplumdan edinildiği bir enfeksiyondur.[55]
Bulaşıcı ya da değil
Belirli bir hastalığın bulaşıcı olduğunu kanıtlamanın bir yolu, Koch postülatlarını (ilk olarak Robert Koch tarafından önerilmiştir) yerine getirmektir; bu postülatlar, ilk olarak, bulaşıcı ajanın sağlıklı kontrollerde değil, yalnızca hastalığı olan hastalarda tanımlanabilir olmasını ve ikinci olarak, bulaşıcı ajana yakalanan hastaların da hastalığa yakalanmasını gerektirir. Bu varsayımlar ilk olarak Mycobacteria türlerinin vereme neden olduğunun keşfedilmesinde kullanılmıştır.[59]
Ancak Koch'un önermeleri etik nedenlerden dolayı modern uygulamada genellikle test edilemez. Bunların kanıtlanması, sağlıklı bir bireyin saf kültür olarak üretilen bir patojenle deneysel olarak enfekte edilmesini gerektirecektir. Tersine, açıkça bulaşıcı hastalıklar bile her zaman bulaşıcılık kriterlerini karşılamaz; örneğin, frengiye neden olan spiroket, Treponema pallidum in vitro olarak kültürlenemez - ancak organizma tavşan testislerinde kültürlenebilir. Saf bir kültürün konak olarak hizmet veren bir hayvan kaynağından geldiği, plaka kültüründen türetilen mikroplardan elde edildiğinde olduğundan daha az açıktır.[60]
Epidemiyoloji veya hastalığın kimde, neden ve nerede ortaya çıktığının ve çeşitli popülasyonların bir hastalığa sahip olup olmadığını neyin belirlediğinin incelenmesi ve analizi, bulaşıcı hastalığı anlamak için kullanılan bir diğer önemli araçtır. Epidemiyologlar, belirli yaş gruplarının daha yüksek veya daha düşük enfeksiyon oranına sahip olup olmadığı; farklı mahallelerde yaşayan grupların enfekte olma olasılığının daha yüksek olup olmadığı ve cinsiyet ve ırk gibi diğer faktörler gibi bir popülasyon içindeki gruplar arasındaki farklılıkları belirleyebilir. Araştırmacılar ayrıca bir hastalık salgınının sporadik mi yoksa ara sıra mı ortaya çıktığını; bir bölgede düzenli vakaların görüldüğü endemik mi olduğunu; bir bölgede hızlı bir şekilde ortaya çıkan ve alışılmadık derecede yüksek sayıda vakanın görüldüğü epidemik mi olduğunu; yoksa küresel bir salgın olan pandemik mi olduğunu değerlendirebilir. Bulaşıcı hastalığın nedeni bilinmiyorsa epidemiyoloji enfeksiyon kaynaklarının izlenmesine yardımcı olmak için kullanılabilir.[61]
Kontajiyözlük
Bulaşıcı hastalıklar, hasta bir kişiyle veya salgılarıyla (örneğin grip) temas yoluyla kolayca bulaştığında bazen kontajiyöz hastalıklar olarak adlandırılır. Dolayısıyla kontajiyöz hastalık, özellikle enfektif olan veya kolayca bulaşan bulaşıcı hastalıkların bir alt kümesidir. Vektör bulaşması veya cinsel yolla bulaşma gibi daha özel enfeksiyon yollarına sahip diğer bulaşıcı, aktarılabilir veya bulaşıcı hastalık türleri genellikle "kontajiyöz" olarak kabul edilmez ve genellikle etkilenenlerin tıbbi izolasyonunu (bazen gevşek bir şekilde karantina olarak adlandırılır) gerektirmez. Bununla birlikte, "kontajiyöz" ve "kontajiyöz hastalık" kelimelerinin bu özel çağrışımına (kolay bulaşabilirlik) popüler kullanımda her zaman saygı gösterilmez.
Bulaşıcı hastalıklar genellikle doğrudan temas yoluyla insandan insana bulaşır. Temas türleri kişiden kişiye ve damlacık yoluyla yayılmadır. Hava yoluyla bulaşma, kontamine nesneler, yiyecek ve içme suyu, hayvan insan teması, hayvan rezervuarları, böcek ısırıkları ve çevresel rezervuarlar gibi dolaylı temas da bulaşıcı hastalıkların bir diğer bulaşma yoludur.[62]
Anatomik konuma göre
Enfeksiyonlar, enfekte olan anatomik konuma veya organ sistemine göre sınıflandırılabilir:[kaynak belirtilmeli]
- İdrar yolu enfeksiyonu
- Cilt enfeksiyonu
- Solunum yolu enfeksiyonu
- Odontojenik enfeksiyon (dişin içinden veya yakın çevre dokulardan kaynaklanan bir enfeksiyon)
- Vajinal enfeksiyonlar
- Amniyon içi enfeksiyon
Buna ek olarak, enfeksiyonun en yaygın neden olduğu iltihaplanma yerleri arasında zatürre, menenjit ve salpenjit bulunur.[kaynak belirtilmeli]
Remove ads
Korunma
Özetle
Bakış açısı

El yıkama, önlük giyme ve yüz maskesi takma gibi teknikler enfeksiyonların bir kişiden diğerine geçmesini önlemeye yardımcı olabilir. Aseptik teknik 19. yüzyılın sonlarında tıp ve cerrahide kullanılmaya başlanmış ve cerrahiden kaynaklanan enfeksiyonların görülme sıklığını büyük ölçüde azaltmıştır. Sık sık el yıkama, istenmeyen organizmaların yayılmasına karşı en önemli savunma olmaya devam etmektedir.[64] Yasa dışı uyuşturucu kullanımından kaçınmak, prezervatif kullanmak, eldiven giymek ve dengeli beslenme ve düzenli egzersiz ile sağlıklı bir yaşam tarzına sahip olmak gibi başka korunma yöntemleri de vardır. Yiyecekleri iyi pişirmek ve uzun süre dışarıda bırakılmış yiyeceklerden kaçınmak da önemlidir.[kaynak belirtilmeli]
Enfeksiyonların bulaşmasını önlemek için kullanılan antimikrobiyal maddeler şunları içerir:
- canlı dokuya/cilde uygulanan antiseptikler
- canlı olmayan nesneler üzerinde bulunan mikroorganizmaları yok eden dezenfektanlar.
- antibiyotikler, enfeksiyonun tedavisinden ziyade önlenmesi amacıyla verildiğinde profilaktik olarak adlandırılır. Ancak antibiyotiklerin uzun süreli kullanımı bakterilerin direnç kazanmasına neden olur. İnsanlar antibiyotiklere karşı bağışıklık kazanmazken, bakteriler kazanır. Bu nedenle, antibiyotikleri gereğinden uzun süre kullanmaktan kaçınmak, bakterilerin antibiyotik direncine yardımcı olan mutasyonlar oluşturmasını önlemeye yardımcı olur.
Bulaşıcı hastalıkların bulaşmasını önlemenin veya yavaşlatmanın yollarından biri, çeşitli hastalıkların farklı özelliklerini tanımaktır.[65] Değerlendirilmesi gereken bazı kritik hastalık özellikleri arasında virülans, etkilenenlerin kat ettiği mesafe ve bulaşıcılık düzeyi yer almaktadır. Örneğin, Ebola virüsünün insan türleri, enfekte olanları son derece hızlı bir şekilde etkisiz hale getirir ve kısa süre sonra öldürür. Sonuç olarak, bu hastalıktan etkilenenlerin ilk enfeksiyon bölgesinden çok uzağa seyahat etme fırsatı yoktur.[66] Ayrıca bu virüsün deri lezyonları ya da göz gibi geçirgen zarlar yoluyla yayılması gerekir. Bu nedenle, Ebola'nın ilk aşaması çok bulaşıcı değildir, çünkü kurbanları sadece iç kanama yaşarlar. Yukarıdaki özelliklerin bir sonucu olarak, Ebola'nın yayılması çok hızlıdır ve genellikle nispeten sınırlı bir coğrafi alanda kalır. Bunun aksine, insan bağışıklık yetmezliği virüsü (HIV) kurbanlarının bağışıklık sistemine saldırarak onları çok yavaş bir şekilde öldürür.[11] Sonuç olarak, kurbanlarının çoğu hastalığı taşıdıklarının farkına bile varmadan virüsü diğer bireylere bulaştırmaktadır. Ayrıca, nispeten düşük virülans, kurbanlarının uzun mesafeler kat etmesine olanak tanıyarak epidemi olasılığını artırır.[kaynak belirtilmeli]
Bulaşıcı hastalıkların bulaşma oranını azaltmanın bir diğer etkili yolu da küçük dünya ağlarının etkilerini tanımaktır.[65] Salgın hastalıklarda, genellikle merkezler veya enfekte birey grupları içinde yoğun etkileşimler ve duyarlı bireylerden oluşan ayrık merkezler içinde diğer etkileşimler vardır. Ayrık merkezler arasındaki düşük etkileşime rağmen, hastalık, enfekte bir merkezle tek veya birkaç etkileşim yoluyla duyarlı bir merkeze sıçrayabilir ve yayılabilir. Dolayısıyla, küçük dünya ağlarındaki enfeksiyon oranları, enfekte merkezler içindeki bireyler arasındaki etkileşimler ortadan kaldırılırsa bir miktar azaltılabilir. Bununla birlikte, ana odak noktası aktarım merkezleri arasındaki aktarım sıçramalarının önlenmesi ise enfeksiyon oranları büyük ölçüde azaltılabilir.
HIV'li uyuşturucu kullanıcılarının yoğun olduğu bölgelerde iğne değişim programlarının kullanılması, bu tedavi yönteminin başarılı bir şekilde uygulanmasına bir örnektir.[67] Bir başka örnek de 2001 yılında şap virüsünün yayılmasını önlemek için komşu çiftliklerdeki potansiyel olarak duyarlı hayvanların halka şeklinde itlaf edilmesi ya da aşılanmasıdır.[68]
Vektör kaynaklı patojenlerin bulaşmasını önlemek için genel bir yöntem haşere kontrolüdür.
Enfeksiyondan yalnızca şüphelenildiği durumlarda, kuluçka dönemi geçip hastalık kendini gösterene veya kişi sağlıklı kalana kadar bireyler karantinaya alınabilir. Gruplar karantinaya alınabilir veya topluluklar söz konusu olduğunda, enfeksiyonun topluluğun ötesine veya koruyucu tecrit durumunda bir topluluğa yayılmasını önlemek için bir cordon sanitaire uygulanabilir. Halk sağlığı yetkilileri bir salgını kontrol altına almak için okulların kapatılması, sokağa çıkma yasakları veya geçici kısıtlamalar (örn. devre kesiciler) gibi diğer sosyal mesafe biçimlerini uygulayabilir.[69]
Bağışıklık

Çoğu patojenle enfeksiyon, konağın ölümüyle sonuçlanmaz ve hastalık belirtileri azaldıktan sonra organizma nihayetinde temizlenir.[56] Bu süreç, patojenin inokülümünü öldürmek veya etkisiz hale getirmek için bağışıklık mekanizmalarını gerektirir. Bulaşıcı hastalıklara karşı spesifik edinilmiş bağışıklığa antikorlar ve/veya T lenfositler aracılık edebilir. Bu iki faktörün aracılık ettiği bağışıklık şu şekilde ortaya çıkabilir:
- bazı bakterilerde olduğu gibi antikorla başlatılan kompleman bağımlı bakteriyoliz, opsonoizasyon, fagositoz ve öldürme gibi bir patojen üzerinde doğrudan bir etki,
- virüslerin nötralize edilmesi, böylece bu organizmaların hücrelere girememesi,
- veya bir mikroorganizma tarafından parazitlenmiş bir hücreyi öldürecek olan T lenfositleri tarafından.
Bir mikroorganizmaya karşı bağışıklık sisteminin verdiği tepki genellikle yüksek ateş ve iltihaplanma gibi semptomlara neden olur ve mikrobun neden olduğu doğrudan hasardan daha yıkıcı olma potansiyeline sahiptir.[11]
Enfeksiyona karşı direnç (bağışıklık) bir hastalık sonrasında, patojenin asemptomatik olarak taşınmasıyla, benzer yapıya sahip bir organizmanın barındırılmasıyla (çapraz reaksiyon) veya aşılama yoluyla kazanılabilir. Koruyucu antijenler ve spesifik edinilmiş konakçı bağışıklık faktörleri hakkındaki bilgi, fırsatçı patojenlere kıyasla birincil patojenler için daha eksiksizdir. Ayrıca, nüfusun yeterince büyük bir kısmı belirli enfeksiyonlara karşı bağışıklık kazandığında, aksi takdirde savunmasız olan kişilere bir ölçüde koruma sağlayan sürü bağışıklığı olgusu da vardır.[70]
Bulaşıcı bir hastalığa karşı bağışıklık direnci, konak patojenle karşılaştığında antijene özgü antikorların ve/veya T hücrelerinin kritik düzeyde olmasını gerektirir. Bazı bireyler, etkenle çok az temas etmelerine veya hiç temas etmemelerine rağmen bazı etkenlerin yüzey polisakkaritlerine karşı doğal serum antikorları geliştirir, bu doğal antikorlar yetişkinlere spesifik koruma sağlar ve yenidoğanlara pasif olarak aktarılır.
Konak genetik faktörleri
Belirli bir enfeksiyöz ajanın enfekte edici etkisinin hedefi olan organizmaya konak denir. Olgun veya cinsel olarak aktif bir evrede olan bir etkeni barındıran konağa kesin konak denir. Ara konak larva evresi sırasında temas eder. Konak canlı herhangi bir şey olabilir ve eşeysiz ve eşeyli üremeye ulaşabilir.[71]
Patojenlerin temizlenmesi, tedaviye bağlı veya spontan olarak, bireysel hastalar tarafından taşınan genetik varyantlardan etkilenebilir. Örneğin, ribavirin ile birlikte Pegile interferon-alfa-2a veya Pegile interferon-alfa-2b (marka isimleri Pegasys veya PEG-Intron) ile tedavi edilen genotip 1 hepatit C için, interferon lambda 3'ü kodlayan insan IL28B geni yakınındaki genetik polimorfizmlerin virüsün tedaviye bağlı temizlenmesinde önemli farklılıklarla ilişkili olduğu gösterilmiştir. İlk olarak Nature dergisinde rapor edilen bu bulgu,[72] IL28B geni yakınında belirli genetik varyant alelleri taşıyan genotip 1 hepatit C hastalarının, diğerlerine kıyasla tedavi sonrasında sürekli virolojik yanıt elde etme olasılığının daha yüksek olduğunu göstermiştir. Nature dergisinde daha sonra yayınlanan rapor,[73] aynı genetik varyantların genotip 1 hepatit C virüsünün doğal temizlenmesiyle de ilişkili olduğunu göstermiştir.
Remove ads
Tedaviler
Özetle
Bakış açısı
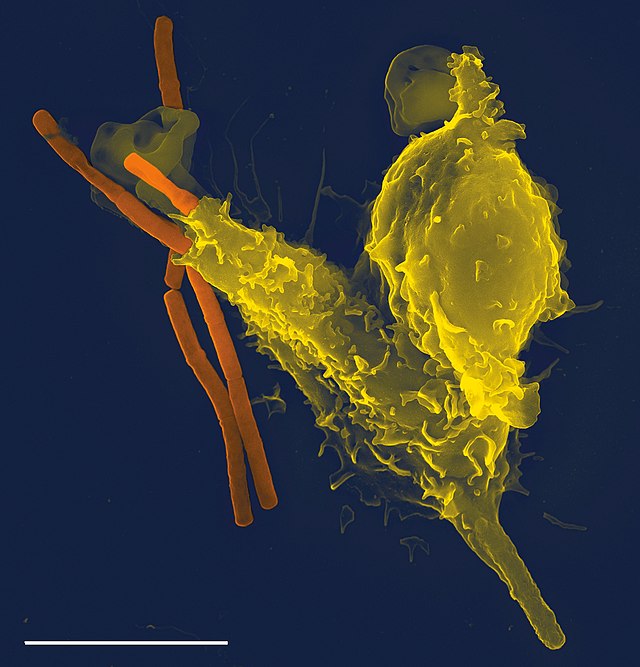
Enfeksiyon vücuda saldırdığında, antienfektif ilaçlar enfeksiyonu baskılayabilir. Hedeflenen organizmanın türüne bağlı olarak çeşitli geniş antienfektif ilaç türleri mevcuttur; bunlar arasında antibakteriyel (antibiyotik; antitüberküloz dahil), antiviral, antifungal ve antiparazitik (antiprotozoal ve antihelmintik dahil) ajanlar bulunur. Enfeksiyonun ciddiyetine ve türüne bağlı olarak antibiyotik ağızdan veya enjeksiyon yoluyla verilebilir veya topikal olarak uygulanabilir.
Beynin ciddi enfeksiyonları genellikle intravenöz antibiyotiklerle tedavi edilir. Bazen, bir antibiyotiğe karşı direnç olması durumunda birden fazla antibiyotik kullanılır. Antibiyotikler sadece bakteriler için çalışır ve virüsleri etkilemez. Antibiyotikler bakterilerin çoğalmasını yavaşlatarak veya bakterileri öldürerek çalışır. Tıpta kullanılan en yaygın antibiyotik sınıfları penisilin, sefalosporinler, aminoglikozitler, makrolidler, kinolonlar ve tetrasiklinlerdir.[74][75]
Tüm enfeksiyonlar tedavi gerektirmez ve kendi kendini sınırlayan birçok enfeksiyon için tedavi faydadan çok yan etkiye neden olabilir. Antimikrobiyal yönetim, sağlık hizmeti sağlayıcılarının bir enfeksiyonu özellikle hedef patojen için en kısa sürede iyi sonuç veren bir antimikrobiyal ile tedavi etmesi ve yalnızca ilaca yanıt vereceği bilinen veya şüphelenilen bir patojen olduğunda tedavi etmesi gerektiği kavramıdır.[76]
Remove ads
Enfeksiyona duyarlılık
Özetle
Bakış açısı
COVID-19 gibi pandemiler, insanların enfeksiyona karşı duyarlılıklarının önemli ölçüde farklılık gösterdiğini ortaya koymaktadır. Bunun nedeni genel sağlık, yaş veya bağışıklık durumları, örneğin daha önce enfekte olmaları olabilir. Bununla birlikte, enfeksiyona yatkınlığı belirleyen genetik faktörler olduğu da anlaşılmıştır. Örneğin, SARS-CoV-2 enfeksiyonlarının %40'a kadarı asemptomatik olabilir, bu da birçok insanın doğal olarak hastalıktan korunduğunu göstermektedir.[77]
Büyük genetik çalışmalar, şiddetli SARS-CoV-2 enfeksiyonları için risk faktörlerini tanımlamış ve şiddetli COVID-19'lu 659 hastanın genom dizileri, yaşamı tehdit eden hastalıkla ilişkili görünen genetik varyantları ortaya çıkarmıştır. Bu çalışmalarda tanımlanan genlerden biri tip I interferondur (IFN). Yaşamı tehdit eden COVID-19 hastalarının %13,7'sinde tip I IFN'lere karşı otoantikorlar bulunmuştur; bu da genetik ve bağışıklık sistemi arasındaki karmaşık bir etkileşimin Covid'e karşı doğal direnç için önemli olduğunu göstermektedir.[78]
Benzer şekilde, endoplazmik retikulum aminopeptidaz 2'yi kodlayan ERAP2 genindeki mutasyonlar, Yersinia pestis bakterisi enfeksiyonunun neden olduğu veba hastalığına duyarlılığı artırıyor gibi görünmektedir. Genin tam bir varyantının iki kopyasını miras alan kişilerin vebadan kurtulma olasılığı, kesilmiş bir varyantın iki kopyasını miras alanlara göre iki kat daha fazlaydı.[79]
Duyarlılık, farklı popülasyonların enfeksiyonları etkileyen farklı genetik ve çevresel koşullara sahip olduğu göz önüne alındığında, enfeksiyonun epidemiyolojisini de belirlemiştir.
Remove ads
Epidemiyoloji
Özetle
Bakış açısı

28–81
82–114
115–171
172–212
213–283
284–516
517–1193
1194–2476
2477–3954
3955–6812

- veri yok
- ≤250
- 250–500
- 500–1000
- 1000–2000
- 2000–3000
- 3000–4000
- 4000–5000
- 5000–6250
- 6250–12.500
- 12.500–25.000
- 25.000–50.000
- ≥50.000
2010 yılında yaklaşık 10 milyon kişi bulaşıcı hastalıklar nedeniyle ölmüştür.[81]
Dünya Sağlık Örgütü, Hastalıkların Uluslararası Sınıflaması (ICD) kod kategorilerine göre küresel ölümler hakkında bilgi toplamaktadır. Aşağıdaki tabloda 2002 yılında ölüm sayısına göre en çok görülen bulaşıcı hastalıklar listelenmektedir. Karşılaştırma için 1993 verileri de eklenmiştir.
Tek başına en çok ölüme yol açan üç hastalık HIV/AIDS, verem ve sıtmadır. Neredeyse tüm hastalıklara bağlı ölümler azalırken, HIV/AIDS'e bağlı ölümler dört kat artmıştır. Çocukluk çağı hastalıkları arasında boğmaca, çocuk felci, difteri, kızamık ve tetanos yer almaktadır. Çocuklar ayrıca alt solunum yolları ve ishal kaynaklı ölümlerin de büyük bir kısmını oluşturmaktadır. 2012 yılında yaklaşık 3,1 milyon kişi alt solunum yolu enfeksiyonları nedeniyle ölmüştür ve bu sayı dünyada önde gelen 4. ölüm nedenidir.[84]
Tarihi pandemiler

Öngörülemeyen ve patlayıcı etki potansiyelleri ile bulaşıcı hastalıklar insanlık tarihinin önemli aktörleri olmuştur.[85] Pandemi (veya küresel epidemi), geniş bir coğrafi alanda insanları etkileyen bir hastalıktır. Örneğin:
- 541-542 yılları arasında yaşanan Jüstinyen Vebası, Avrupa nüfusunun %50 ila %60'ını öldürmüştür.[86]
- 1347'den 1352'ye kadar süren Kara Ölüm, beş yıl içinde Avrupa'da 25 milyon kişinin ölümüne neden olmuştur. Veba, 14. yüzyılda eski dünya nüfusunu tahminen 450 milyondan 350 ila 375 milyona düşürmüştür.
- Çiçek hastalığı, kızamık ve tifüsün 15. ve 16. yüzyıllarda Avrupalı kaşifler tarafından Orta ve Güney Amerika bölgelerine getirilmesi, yerli halk arasında salgınlara neden olmuştur. 1518 ve 1568 yılları arasındaki hastalık salgınlarının Meksika nüfusunun 20 milyondan 3 milyona düşmesine neden olduğu söylenmektedir.[87]
- İlk Avrupa grip salgını 1556 ile 1560 yılları arasında meydana gelmiş ve tahmini ölüm oranı %20 olmuştur.[87]
- Çiçek hastalığı 18. yüzyıl boyunca tahminen 60 milyon Avrupalıyı öldürmüştür[88] (yılda yaklaşık 400.000).[89] Enfekte olanların %30'u, 5 yaşın altındaki çocukların %80'i de dahil olmak üzere, hastalıktan ölmüş ve hayatta kalanların üçte biri kör olmuştur.[90]
- 19. yüzyılda tüberküloz Avrupa'daki yetişkin nüfusun tahminen dörtte birini öldürmüştür;[91] 1918'de Fransa'da her altı ölümden biri tüberkülozdan kaynaklanmaktaydı.
- 1918'deki grip pandemisi (ya da İspanyol gribi) 25-50 milyon insanın (1.7 milyarlık dünya nüfusunun yaklaşık %2'si) ölümüne neden olmuştur.[92] Günümüzde grip her yıl dünya çapında yaklaşık 250.000 ila 500.000 kişiyi öldürmektedir.
Ortaya çıkan hastalıklar
Çoğu durumda, mikroorganizmalar mutual veya kommensal etkileşimler yoluyla konakçılarıyla uyum içinde yaşarlar. Hastalıklar, mevcut parazitler patojenik hale geldiğinde veya yeni patojenik parazitler yeni bir konağa girdiğinde ortaya çıkabilir.
- Parazit ve konak arasındaki birlikte evrim, konakların parazitlere karşı dirençli hale gelmesine yol açabilir veya parazitler daha fazla virülans geliştirerek immünopatolojik hastalığa yol açabilir.
- İnsan faaliyetleri, çevresel değişimin bir parazitin yeni nişler işgal etmesini sağlaması gibi, ortaya çıkan birçok bulaşıcı hastalıkla ilgilidir. Bu gerçekleştiğinde, uzak bir habitatla sınırlı olan bir patojen daha geniş bir dağılıma ve muhtemelen yeni bir konak organizmaya sahip olur. İnsan olmayan konaklardan insan konaklara atlayan parazitler zoonoz olarak bilinir. Hastalık istilası altında, bir parazit yeni bir konak türü istila ettiğinde, yeni konakta patojenik hale gelebilir.[93]
Çeşitli insan faaliyetleri virüsler, bakteriler, protozoalar ve riketsiyalar[94] dahil olmak üzere zoonotik insan patojenlerinin ortaya çıkmasına ve vektör kaynaklı hastalıkların yayılmasına yol açmıştır,[93] ayrıca bkz. küreselleşme ve hastalık ve yaban hayatı hastalığı:
- Yaban hayatı habitatlarına tecavüz. Kırsal alanlarda yeni köylerin inşa edilmesi ve konutların yapılması, hayvanları yoğun popülasyonlar halinde yaşamaya zorlayarak mikropların mutasyona uğraması ve ortaya çıkması için fırsatlar yaratmaktadır.[95]
- Tarımdaki değişiklikler. Yeni mahsullerin piyasaya sürülmesi, yeni mahsul zararlılarını ve taşıdıkları mikropları çiftçi topluluklarına çekerek insanları bilmedikleri hastalıklara maruz bırakır.
- Yağmur ormanlarının yok edilmesi. Ülkeler yağmur ormanlarından yararlanırken, ormanların içinden yollar inşa ederken ve yerleşim ya da ticari girişimler için alanları açarken, insanlar daha önce bilinmeyen mikroorganizmaları barındıran böcekler ve diğer hayvanlarla karşılaşırlar.
- Kontrolsüz kentleşme. Gelişmekte olan birçok ülkede şehirlerin hızla büyümesi, çok sayıda insanı sağlık koşullarının yetersiz olduğu kalabalık alanlarda toplama eğilimindedir. Bu koşullar bulaşıcı hastalıkların yayılmasını teşvik etmektedir.
- Modern taşımacılık. Gemiler ve diğer kargo taşıyıcıları genellikle hastalıkları uzak noktalara yayabilecek istenmeyen "yolcular" barındırır. Uluslararası jet-uçak seyahatlerinde ise, bir hastalığa yakalanan insanlar, ilk belirtiler ortaya çıkmadan önce hastalığı uzak diyarlara ya da evlerine, ailelerine taşıyabilirler.
Remove ads
Hastalık yapıcı miktop teorisi
Özetle
Bakış açısı
Klasik Antik Çağ'da, Yunan tarihçi Thukididis (MÖ y. 460 - y. 400) Atina'daki veba salgınını anlatırken hastalıkların enfekte olmuş bir kişiden diğerlerine yayılabileceğini yazan ilk kişidir.[96][97] Greko-Romen hekim Galen, Farklı Ateş Türleri Üzerine (y. MS 175) adlı eserinde, vebanın havada bulunan "bazı veba tohumları" tarafından yayıldığını öne sürmüştür.[98] Sushruta Samhita'da, eski Hint hekim Suşruta şu teoriyi ortaya atmıştır: "Cüzzam, ateş, verem, göz hastalıkları ve diğer bulaşıcı hastalıklar cinsel birleşme, fiziksel temas, birlikte yemek yeme, birlikte uyuma, birlikte oturma ve aynı giysilerin, çelenklerin ve macunların kullanılması yoluyla bir kişiden diğerine yayılır."[99][100] Bu kitap yaklaşık olarak MÖ altıncı yüzyıla tarihlendirilmiştir.[101]
Bulaşma teorisinin temel bir biçimi İranlı hekim İbn-i Sina tarafından, daha sonra 16. yüzyıla kadar Avrupa'daki en yetkili tıp ders kitabı haline gelen El-Kanun fi't-Tıb'da (1025) önerilmiştir. IV. kitabında İbn Sina salgın hastalıkları tartışmış, klasik miazma teorisinin ana hatlarını çizmiş ve bunu kendi erken dönem bulaşma teorisiyle harmanlamaya çalışmıştır. İnsanların nefes yoluyla başkalarına hastalık bulaştırabileceğinden bahsetmiş, tüberküloz bulaşıcılığına dikkat çekmiş ve hastalığın su ve kir yoluyla bulaşmasını tartışmıştır.[102] Görünmez bulaşma kavramı daha sonra Eyyubi Sultanlığı'ndaki bazı İslam alimleri tarafından tartışılmış ve bu alimlerden necaset ("saf olmayan maddeler") olarak bahsedilmiştir. Fıkıh alimi İbnü'l-Hac el-Abdari (y. 1250-1336), İslami beslenme ve hijyen konularını tartışırken bulaşıcı hastalıkların su, yiyecek ve giysilere bulaşabileceği ve su kaynakları yoluyla yayılabileceği konusunda uyarılarda bulunmuş ve bulaşıcı hastalıkların görünmeyen parçacıklar olduğunu ima etmiş olabilir.[103]
Kara Ölüm hıyarcıklı vebası 14. yüzyılda Endülüs'e ulaştığında, Arap hekimler İbn Hatim (y. 1369) ve Lisannüddin bin Hatip (1313-1374) bulaşıcı hastalıklara "küçük cisimlerin" neden olduğu hipotezini ortaya atmış ve bunların giysiler, kaplar ve küpeler yoluyla nasıl bulaşabileceğini tarif etmişlerdir.[104] Bulaşma fikirleri Avrupa'da Rönesans döneminde, özellikle de İtalyan hekim Girolamo Fracastoro'nun yazılarıyla daha popüler hale gelmiştir.[105] Anton van Leeuwenhoek (1632-1723) mikroorganizmaları ilk gözlemleyen kişi olarak mikroskobi bilimini geliştirmiş ve bakterilerin kolayca görüntülenmesini sağlamıştır.
19. yüzyılın ortalarında John Snow ve William Budd, kirli su yoluyla tifo ve koleranın bulaşıcılığını ortaya koyan önemli çalışmalar yapmıştır. Her ikisi de suyun kirlenmesini önlemeye yönelik tedbirler alarak kendi şehirlerindeki kolera salgınlarını azaltmışlardır.[106] Louis Pasteur, bazı hastalıkların bulaşıcı etkenlerden kaynaklandığını şüpheye yer bırakmayacak şekilde kanıtlamış ve kuduz için bir aşı geliştirmiştir. Robert Koch, bulaşıcı hastalıkların incelenmesine Koch postülatları olarak bilinen bilimsel bir temel sağlamıştır. Edward Jenner, Jonas Salk ve Albert Sabin çiçek hastalığı ve çocuk felci için etkili aşılar geliştirmiş ve daha sonra bu hastalıkların sırasıyla ortadan kaldırılmasını ve neredeyse yok edilmesini sağlamıştır. Alexander Fleming dünyanın ilk antibiyotiği olan penisilini keşfetmiş, Florey ve Chain de bunu geliştirmiştir. Gerhard Domagk, ilk geniş spektrumlu sentetik antibakteriyel ilaçlar olan sülfonamidleri geliştirdi.[kaynak belirtilmeli]
Tıbbi uzmanlar
Bulaşıcı hastalıkların tıbbi tedavisi enfeksiyon hastalıkları tıp alanına girer ve bazı durumlarda yayılma çalışması epidemiyoloji alanıyla ilgilidir. Genel olarak, enfeksiyonlar ilk olarak birinci basamak hekimleri veya iç hastalıkları uzmanları tarafından teşhis edilir. Örneğin, "komplike olmayan" bir zatürre genellikle dahiliye uzmanı veya pulmonolog (akciğer doktoru) tarafından tedavi edilecektir. Bu nedenle enfeksiyon hastalıkları uzmanının işi, hem hastalar ve pratisyen hekimlerle hem de laboratuvar bilimcileri, immünologlar, bakteriyologlar ve diğer uzmanlarla çalışmayı gerektirir.[kaynak belirtilmeli]
Bulaşıcı hastalık ekibi şu durumlarda uyarılabilir:
- İlk incelemeden sonra hastalık kesin olarak teşhis edilememişse
- Hastanın bağışıklık sistemi baskılanmışsa (örneğin AIDS veya kemoterapi sonrası);
- Enfeksiyon etkeni nadir görülen bir yapıdaysa (örn. tropikal hastalıklar);
- Hastalık birinci basamak antibiyotiklere yanıt vermemişse;
- Hastalık diğer hastalar için tehlikeliyse ve hastanın izole edilmesi gerekirse
Toplum ve kültür
Özetle
Bakış açısı
Çeşitli çalışmalar, bir bölgedeki patojen yükü ile insan davranışı arasındaki ilişkileri rapor etmiştir. Daha yüksek patojen yükü, bir bölgedeki etnik ve dini grupların boyutunun azalması ile ilişkilidir. Bunun nedeni yüksek patojen yükünün diğer gruplardan kaçınmayı destekleyerek patojen bulaşmasını azaltması veya yüksek patojen yükünün ortak bir kültürü uygulayan büyük yerleşimlerin ve orduların kurulmasını engellemesi olabilir.
Daha yüksek patojen yükü, patojen bulaşmasını azaltabilecek daha kısıtlı cinsel davranışla da ilişkilidir. Aynı zamanda eşlerde sağlık ve çekicilik için daha yüksek tercihlerle de ilişkilidir. Daha yüksek doğurganlık oranları ve çocuk başına daha kısa veya daha az ebeveyn bakımı, daha yüksek ölüm oranını telafi edebilecek bir başka ilişkidir. Ayrıca, daha yüksek patojen yükü nedeniyle yüksek genetik dirence sahip erkeklerin seçilmesini giderek daha önemli hale getiren polijiniyle de bir ilişki vardır.
Daha yüksek patojen yükü aynı zamanda daha fazla kolektivizm ve daha az bireycilik ile ilişkilidir, bu da dış gruplarla ve enfeksiyonlarla temasları sınırlayabilir. İlişkilerin en azından bazıları için alternatif açıklamalar vardır, ancak bu açıklamalardan bazıları nihayetinde patojen yüküne bağlı olabilir. Dolayısıyla, çok eşlilik bu bölgelerde erkek: kadın oranının daha düşük olmasından da kaynaklanıyor olabilir, ancak bu sonuçta erkek bebeklerin bulaşıcı hastalıklardan daha fazla ölüm oranına sahip olmasından kaynaklanıyor olabilir. Bir başka örnek de zayıf sosyoekonomik faktörlerin kısmen ekonomik kalkınmayı engelleyen yüksek patojen yükünden kaynaklanıyor olabileceğidir.[107]
Fosil kayıtları

Fosil kalıntılarındaki enfeksiyon kanıtları, soyu tükenmiş yaşam formlarında yaralanma ve hastalık oluşumlarını inceleyen bilim insanları olan paleopatologlar için ilgi çekici bir konudur. Etobur dinozorların kemiklerinde enfeksiyon belirtileri keşfedilmiştir. Ancak mevcut olduğunda, bu enfeksiyonlar vücudun yalnızca küçük bölgeleriyle sınırlı olma eğilimindedir.
Erken etobur dinozor Herrerasaurus ischigualastensis'e atfedilen bir kafatası, şişmiş ve gözenekli kemikle çevrili çukur benzeri yaralar sergilemektedir. Yaraların etrafındaki kemiğin alışılmadık dokusu, kısa ömürlü, ölümcül olmayan bir enfeksiyondan etkilendiklerini gösteriyor. Kafatasını inceleyen bilim insanları, ısırık izlerinin başka bir Herrerasaurus ile yapılan bir kavgada alındığını tahmin ediyor.
Belgelenmiş enfeksiyon kanıtlarına sahip diğer etobur dinozorlar arasında Acrocanthosaurus, Allosaurus, Tyrannosaurus ve Kirtland Formasyonu'ndan bir tiranozor bulunmaktadır. Her iki tiranozorun enfeksiyonları da Herrerasaurus örneğinde olduğu gibi bir kavga sırasında ısırılma sonucu oluşmuştur.[108]
Dış uzay
2006 yılında Space Shuttle'da yapılan bir deney, gıda zehirlenmesine neden olabilen bir bakteri olan Salmonella typhimurium'un uzayda yetiştirildiğinde daha virülans hale geldiğini ortaya koymuştur.[109] 29 Nisan 2013'te NASA tarafından finanse edilen Rensselaer Polytechnic Enstitüsündeki bilim insanları, Uluslararası Uzay İstasyonu'ndaki uzay uçuşu sırasında mikropların uzay ortamına "Dünya'da gözlemlenmeyen" ve "büyüme ve virülansta artışa yol açabilecek" şekillerde uyum sağladığını bildirdi.[110] Daha yakın bir tarihte, 2017 yılında, bakterilerin antibiyotiklere karşı daha dirençli oldukları ve uzayın neredeyse ağırlıksız ortamında geliştikleri tespit edilmiştir.[111] Mikroorganizmaların uzay boşluğundaki vakumda hayatta kaldıkları gözlemlenmiştir.[112][113]
Ayrıca bakınız
Notlar
- Alt solunum yolu enfeksiyonları arasında çeşitli pnömoniler, influenzalar ve akut bronşit yer almaktadır.
- Tropikal hastalıklar arasında Chagas hastalığı, dang humması, lenfatik filariasis, layşmanyaz, onkoserkiyaz, şistozomiyaz ve tripanozomiyaz yer almaktadır.
Kaynakça
Dış bağlantılar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

