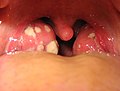
İnflamasyon
iltihaplanma Vikipedi'den, özgür ansiklopediden
İnflamasyon (enflamasyon ve yangı olarak da bilinir), canlı dokunun her türlü canlı, cansız yabancı etkene veya içsel/dışsal doku hasarına verdiği sellüler (hücresel), humoral (sıvısal) ve vasküler (damarsal) bir seri vital yanıttır. İnflamasyon normalde patolojik bir durum olmasına karşın, inflamatuar reaksiyon fizyolojik olarak vücudun gösterdiği bir tepkidir. Halk arasında iltihap tabiri yangı için kullanılmasına rağmen sık sık apseler için de iltihap denmesinden dolayı inflamasyon (inflammare) terimini kullanmak daha yerinde olacaktır. Hücre dejenerasyonu ile birlikte inflamasyon konusu, hastalıkların patolojik temelini oluşturmaktadır.

Tarihi ve temel özellikleri
Özetle
Bakış açısı
Birçok hastalığın seyri sırasında inflamatuar bir takım reaksiyonlar meydana gelmektedir. Bunlar başlıca enfeksiyöz hastalıklar ve inflamatuar idiopatik otoimmun hastalıklardır. Tarih boyunca bu olgular farklı şekillerde yorumlanmış, birçok hastalık için tanrının gazabı veya bazı dengelerin bozulması sonucu (örneğin Ying ve Yang) meydana geldiği sanılmıştır. Bugün bilindiği üzere enfeksiyöz hastalıklarda veya söz konusu diğer sebeplerin bir sonucu olarak bağışıklık sistemi tarafından inflamasyon ve inflamatuar reaksiyonlar indüklenmektedir. Bu sebeple inflamasyon konusu oldukça derin ve immunoloji disiplini çerçevesinde incelenmesi gereken bir konudur. Otoimmun hastalıklarda etkenin bilinmemesinden dolayı bu gibi olguların genetik bazı defektler veya özel genler aracılığıyla gerçekleşmesinin yanında henüz bilinmeyen bir takım virüslerin de sebep olabileceği düşünülmektedir.
inflamasyonun tarihsel gelişimi incelenecek olursa en eski veriler antik çağa dayanır. Bu dönemin hekimleri inflamasyonu ciddi derecede tanıyor ve tanımlıyorlardı. Bilinen en eski tıbbi kitap, Mısırlılar tarafından kaleme alınan Edwin Smith papirüsü; organizmanın yaraya verdiği tepkiye şemet adını vermişti. Bu papirüsün ortaya çıkmasından yaklaşık 1000 yıl sonra Yunan hekim Hipokrat inflamasyon için kabaca "yanan şey" anlamına gelen flegmon terimini kullanmıştır. Milattan sonra 1. yüzyılda yine Romalı yazar Cornelius Celcus inflamasyonun bugün bile kabul görmüş tanımını yapmıştır; Rubor et tumor cum, calore et dolore, yani ateş ve ağrının eşlik ettiği kızarıklık ve şişkinlik.[1]
Milattan sonra 400-500 yılları döneminde Hipokrat'a ait literatürlerde "inflamasyon" terimi geçmemekte ancak inflamasyonun karakteristik özellikleri ve temel özellikleri bilinmekteydi. Hipokrat, yaşamı, ışık vererek, ısıtarak kendi benliğini tüketen bir lambaya benzetmekteydi. Vücudun sıcaklığının lokal olarak ve sınırlı bir şekilde yükselmesine inflamasyon denirken, bütün vücutta meydana gelen bir sıcaklık artışı febris (ateş) olarak tanımlanmıştır.
Modern anlamdaki çalışmalar ise 1860'lara dayanır. Bu dönemde patolog Julius Cohnheim canlı kurbağaların dilleri üzerine kostik (yakıcı, dağlayıcı) nitelikte maddeler vermiş ve meydana gelen değişimleri mikroskopik olarak incelemiştir.
İnflamasyonun tipik beş belirtisi vardır.[2] Bunlar:
- Kızarıklık (Rubor): inflamasyon olan alanda birçok medyatörün etkisi sonucu damar geçirgenliği (vasküler permeabilite) ve damar genişliği arttığı (vazodilatasyon) için bölge daha fazla aktif olarak kanlanır, yani hiperemiktir. Rubor, inflamasyonun erken evresi ve hafif seyreden reaksiyonlarda, alerjilerde oldukça tipiktir.[3]
- Isı artışı (Calor): Damar genişlemesi (vazodilatasyon) sebebiyle bölgeye daha fazla kan akımı olacaktır. Daha fazla kan akımı ile bölgedeki sürtünme artacağından dolayı bölgede ısı artışı olur. Çünkü kan aynı zamanda organizmada ısıl dengede son derece öneme sahiptir. Akut inflamasyonun en önemli bulgusu calordur.
- Şişkinlik (Tumor): Damar geçirgenliği (permeabilite) artması sonucu bölgeye kan plazması sızar ve bu da bölgede şişkinliğe neden olur (ödem). Ancak şişkinliğin tek sebebi ödem değildir. Proliferatif karakterde inflamasyonlarda meydana gelen granülomlar veya hiperplaziler, fibrotik değişiklikler de söz konusu şişliğe neden olabilir. Dışarıdan görülebilen oluşumlarda inflamatuar reaksiyonlarda şişkinlik ön plandadır. Vücudun daha iç kısımlarında bulunan organ ve dokularda; örneğin bir akciğerde bu şişkinliği dış bakıda gözlemlemek olanaksızdır. Zira bu organda meydana gelen örneğin akut bir pnömoni, akciğerlerden köpüklü sıvı gelmesine veya patolojik akciğer seslerinin duyulmasına neden olur.
- Ağrı (Dolor): Bölgedeki sinirler sürekli ağrı uyarımına neden olur. Ağrının şekillenmesindeki en önemli iki sebep; inflamasyonu tetikleyici prostaglandinlerin organizmada ağrı oluşumunda rol alması ve inflamatuar ödemden kaynaklanan sinir uçlarına basıdır. Kronik duruma geçen inflamasyonlarda dolor, zamanla arka planda kalmaya başlar. Ancak romatoid artrit gibi bozukluklar ne kadar kronik seyretse de böyle olaylarda ağrı ön plana çıkar.
- Kapsanan organlarda disfonksiyon yani işlev bozukluğu (Functio laesa): Doğal olarak inflamasyonlu organ işlevlerini yerine tam olarak getiremez.[4]

Bu beş nitelikten ilk dördü antik zamanlardan beri bilinmektedir ve Celsus'a;[5] functio laesa ise inflamasyon tanımına 1858'de Rudolf Virchow tarafından eklenmiştir.[2]
| Latince | Türkçe |
|---|---|
| Rubor | Kızarıklık |
| Tumor | Şişlik |
| Calor | Sıcaklık |
| Dolor | Ağrı |
| Functio laesa | Fonksiyon kaybı |
İnflamasyon vücudun savunma sisteminin bir sonucu olarak gelişir ve organizmayı korumaya yöneliktir. Fakat inflamasyon oluşması her zaman istenmez. Örneğin beyinde veya kalpte oluşabilecek bir inflamasyon hayatı tehdit edebilir. Bu sebeple inflamasyon önleyici ilaçlar kullanılabilir (Antiinflamatuar ilaçlar).
İnflamasyonun çok çeşitli sebepleri vardır. Bunlar infeksiyöz etkenler, mikroorganizmalar oldukları gibi parazitler veya cansız cisimler (kıymık, silika vb) de olabilirler. Travmalar, kontüzyonlar (ezilmeler), kesikler de inflamasyon ile sonuçlanır. İnflamasyona ilişkin bir önemli özellik, inflamasyonun daima interstisiyumda gerçekleşmesidir. Parankimatöz inflamasyon olmaz, ancak inflamasyonun etkileri parankim dokuda görülebilir.[6] Bunların dışında inflamasyonlar akut (birkaç günden bir haftaya kadar gelişen) olabildikleri gibi kronik (uzun süreli) de olabilirler. İnflamasyonun organizmada üç temel amacı vardır. Bunlar, hastalık etkenini yok etmek, etkenleri yok edemiyorsa vücuttan ayrı tutmak (demarkasyon) ve hasarlı dokuları ortadan kaldırmaktır. Örneğin nekrotik dokularda, nekrozun yayılmasını ve bu ölü dokuların intoksik etkisini engellemek amacıya nekrotik saha inflamatuar bir kuşakla, yani demarkasyon bölgesi ile sınırlandırılmaya çalışılır.
İnflamasyonnın temel 4 amacı şunlardır:
- Vücuda yabancı olan ve patojen nitelikte olan tüm etkenleri yok etmek.
- Yok edilemeyen etkenleri sınırlandırarak vücuttan ayrı tutmaya çalışmak.
- Yara iyileşmesinin sağlanması için gerekli uyarım ve biyoaktivite.
- Nekroz ve gangrenin sınırlandırılması.
Nedenleri
Özetle
Bakış açısı
İnflamasyonun başlıca sebepleri aşağıda sıralanmıştır:[7] Canlı: İnflamasyona sebep olan en önemli etken mikroorganizmalardır. Bakteri, virus, riketsiya, mantar, protozoon ve helmintler bu gruba girer. Bu gibi etkenler sahip oldukları antijenler ve yüzey reseptörleri aracılığıyla nötrofilik kemotaksise neden olurlar ve sonuçta inflamasyon gelişir. İnflamatuar değişikliğin karakterini özellikle canlı etkenler belirler. Birçok mikroorganizma özellikle de bakteriler (örneğin Streptokoklar, Pseudomonaslar) irin oluşumuna neden olurlar. İnflamasyon normal olarak doğal bağışıklık sisteminin bir unsurudur. Canlı etkenlerin sebep olduğu inflamasyonların birincil amacı etkeni yok etmektir. Bu başarılamazsa organizma bu etkenleri sınırlandırarak veya baskılayarak vücuttan uzak tutmaya çalışır. Bu da başarısız olursa enfeksiyon ve genel sistemik olaylar (örneğin toksemi veya septisemi gibi) meydana gelir.
- Fiziksel etkenler
- Mekanik travmalar (kesici ve delici cisimler, vurma, çarpma gibi darbeler vs.) sıcak ve soğuk etkiler, elektrik, ultraviyole ışınlar, iyonizasyon yapan ışınlar, çeşitli yabancı cisimler (silika, asbest, kıymık, tel vb.). Bu tür etkilerde inflamatuar reaksiyon klasik olarak oluşur. Organizmaya yabancı bir durum gelişmiştir ve şekillenen inflamasyon adeta standart bir cevaptır.Fiziksel etkiler asepsi-antisepsi özelliğine göre iki şekildedir.Bunlardan biri şirurjikal; yani cerrahi travmaya bağlı gelişen inflamatuar reaksiyondur. Bu tür olgular steril kabul edilirler. Ancak steril olmayan tüm fiziksel etkilerden ileri gelen sıyrık, kesi, abrazyon, laserasyon gibi olaylar septiktir ve enfekte nitelik taşırlar. Ancak laserasyonlar kas veya tendo gibi dokuda aşırı bir gerilme kaynaklı ise şekillenen inflamasyon aseptik karakterde olur.
- Kimyasal nedenler
- Asitler, alkaliler, dezenfektanlar, ağır metal bileşikleri (örneğin sublime), organizmada fazlaca oluşan metabolizma ürünler; örneğin üremi gibi vücutta fazla miktarda üre birikmesi. Bir başka örnek ise idrar kesesi yırtılması ve buna bağlı ortaya çıkan peritonitis'tir. İdrarın asit pH'sının etkisi olarak peritonda inflamatuar reaksiyon meydana gelir ve aseptiktir. Endojen ve eksojen toksinler ve bazı ilaçlar inflamasyona neden olan önemli sebeplerdendir. Genellikle neden oldukları doku yıkımı, dejenerasyon; immun yanıt şeklinde inflamasyon oluşumuna neden olur ki söz konusu doku hasarı sınırlandırılsın. Ahırda yaşayan hayvanlarda en büyük kimyasal sorun üre-amonyaktır. Bu madde solunum yoluyla alındığı takdirde solunum yollarını ciddi şekilde irkilti eder. Asit maddeler hızla doku yıkımına neden olduklarından inflamatuar yanıt hızlı gelişir.
- İmmunolojik reaksiyona neden olan maddeler
- Yabancı proteinler (örneğin katgüt dikiş ipliği), hipersensibilite yaratan eksojen ve endojen kaynaklı maddeleri transplantasyon'da doku ve organ reddi, immunkompleksler. Gerek homoiyoplastik, gerek heteroplastik olsun; tüm doku/organ nakilleri immun yanıta neden olur. Vücudun bir başka yerinden alınmış dahi olsa yabancı doku daima yabancıdır ve şekillenen immun yanıt da bir çeşit inflamasyondur.
- Anoksemi ve nekroz
- Dokulara gelen kanın azalması veya kesilmesi bu bölgenin çevresinde inflamatuar reaksiyon oluşur ve bu nekrozun yayılmasını önler (demarkasyon). Örneğin infarktuslar çevresinde inflamasyonlu alan (demarkasyon zonu) görülebilir.
- İdiopatik (sebebi bilinmeyen) inflamasyonlar
- Bazı inflamatuar hastalıkların sebebi tam olarak ortaya konulamamıştır. Örneğin SLE veya Sarkoidozis gibi hastalıklarda inflamatuar reaksiyonlara neyin neden olduğu tam olarak ortaya konulamamıştır.
- Doku hasarı ve iyileşme
- Doku hasarının beraberinde gelişen tüm iyileşmeler birer inflamatuar prosestir.Örneğin bir ameliyat sonrası kesi atılan dokuların iyileşmesi inflamatuar bir süreci de beraberinde getirir.
- Kontakt inflamasyon
- Vücudun bir bölümündeki inflamasyon sık sık yakın dokulara sirayet eder. Bu en çok idrar yolu ve üst solunum yolları enfeksiyonlarında görülür.
Patogenezi ve hücreleri
Özetle
Bakış açısı

İnflamasyona ilişkin vasküler değişiklikleri ilk defa Cohnheim incelemiştir. Daha sonraları Lewis, damarlardaki çap değişikliklerini üçlü yanıt deneyi ile açıklamıştır. Bu deneyde Lewis bir cetvelin ince kenarı ile deriye vurmuş ve olayları şöyle incelemiştir:[7]
- Önce kapillarlarda daralma olur ve bölge solar. Fakat 30-60 saniye içinde çizgi halinde kırmızılık belirir. Bu kırmızılık kapillar ve venüllerin genişlemesi sonucudur ve birinci yanıt olarak bilinir.
- 1-3 dakika içinde kırmızı alan genişler. İlk oluşan kırmızı alan etrafında düzensiz kırmızı ikinci bir çeper meydana gelir. Bu da ikinci yanıttır. Bu esnada bölgede sıcaklık artar. Kapillar ve venül genişlemesine arteriel genişleme eşlik eder.
- Birkaç dakika ile 40 dakika arasındaki sürede o bölgede şişme ile beraber solma görülür (üçüncü yanıt). Bu şişlik ve solgunluk damarlardan sıvı çıkmasına yani ödeme bağlıdır.
Nötrofiller yangı sinyallerini takiben şu aşamaları izlerler:
- Emigrasyon: Normal kan dolaşımında lökositler merkezde, eritrositler lökositlerin etrafında kuşak şeklinde ve en dışta (damar duvarına en yakın) trombositler ile plazma konuşlanır. Yangısal uyarımın alındığı ilk andan itibaren nötrofiller merkezden perifere doğru göçe başlar. Bu olay emigrasyondur ve takibinde derhal marginasyon gerçekleşir.
- Marginasyon: Emigrasyona uğrayan nötrofillerin, merkezden uzaklaşarak damar duvarına yaklaşmış olması durumudur.
- Adherens: Marjine olan nötrofiller, damar endoteli ile yüzey molekülleri aracılığıyla (ICAM-1,2 ve VCAM-1,2 gibi) etkileşime girmesi olayına adherens denir.
- Diapedezis: Psödopodlara (yalancı ayak) sahip nötrofillerin aynı zamanda damar endotellerini enzimatik olarak yıkımlayarak damar dışına çıkması olayıdır.
İmmun sistem hücreleri yangının patogenezinde önemli rol oynar. Yangının ilk evrelerinde damarlardaki normal akımın seyri değişir. Normal kan akımında damar lumeninin en iç yüzünde lökositler, bunların etrafında eritrositler, daha dışarıda trombositler ve damar lumenine en yakın olarak da plazma yer alır. Herhangi bir sebeple yangı reaksiyonu başlarsa öncelikle devreye giren histamin, prostoglandin, kinin-bradikinin ve diğer yangı stimule edici (proinflamatuvar) ajanlarca damar geçirgenliği artar ve yangısal ortamda lökositlerin (özellikle monositer makrofajlar ve nötrofiller) daha uygun hareket etmeleri için uygun ortamı hazırlamak üzere plazma eksudasyonu (ödem) gerçekleşir.Yangısal ödem daima hücre göçünden önce olur. Daha sonra damarlardaki normal akım bozulur ve en içteki lökositler damar lumenine yaklaşmaya başlar (marginasyon). Bunun ardından damar lumenine gelen lökositler geçirgenliği artmış damar duvarından yalancı ayaklar (pseudopodlar) vasıtasıyla ve salgıladıkları bazı litik enzimler (özellikle nötral ve asit proteazlar) aracılığı ile damar dışına sızarlar (lökodiapedesis). Artık yangı başlamış ve vücut düşmanla savaşmak için gerekli hazırlıklarını yapmıştır.

Nötrofiller
Yangının başlarında en öncü hücreler nötrofillerdir. Nötrofillerin bu özelliğinin kemotaksis'e olan duyarlılığının neden olduğu sanılmaktadır. Bu duyarlılıkta özellikle hücre membranı yüzeyinde bulunan komplemen proteinlerin türü ve yoğunluğu önem taşır. Akut yangısal olaylar veya bakteriyel enfeksiyonlar nötrofil yapımını ve yangısal infiltrasyonunu artırır.[8] Viruslara karşı gelişen immun yanıttan nötrofiller değil lenfositler sorumludur. Ancak bunun istisnaları vardır. (Örneğin FIP hastalığı). Nötrofillerden üretilen proteazlar, proteinleri ve hücre zarlarını tahrip eder ve komplemanların proteolitik aktivasyonundan, koagulasyondan (çökelme, pıhtılaşma) ve kinin kaskadından sorumludur. Kinin-bradikinin; tıpkı histamin benzeri bir etki göstererek yangısal reaksiyonu indükler.[9] Kemik iliğinde kök hücreye kök hücre faktörü, interleukin IL-3, IL-6, IL-11, granulosit koloni uyarıcı faktör (G-CSF)gibi büyüme faktörleri ve sitokinlerin etkisi ile progenitor hücreler granülositler şeklinde olgunlaşır ve çoğalır.[10] Yangısal reaksiyonlar ve enfeksiyonlara bağlı olarak gelişen nötrofili, kemik iliği depo havuzundan nötrofil salınması sebebiyle ortaya çıkar.[11] Dolaşımdan nötrofil salınmasının azalmasına bağlı olarak, CR3 reseptörü olan CD11b/CD18 eksikliğine bağlı nötrofili gelişebilir. Bu durum Lökosit adhezyon eksikliği olarak bilinir ve nötrofiller kapiller endotele yapışmaz. Bundan dolayı enfeksiyon ortaya çıktığında yangı bölgesine ulaşamazlar.[12][13]
Nötrofillerin yangısal yanıtta sahip oldukları önem son derece büyüktür. Bunun en önemli sebeplerinden biri de sahip oldukları granüler yapıların immunolojik özelliğidir.
- Primer granüller; Myeloperoksidaz, defensin,[14] katepsin-G, Proteinaz 3, Lizozim, Azurosidin, gibi enzimlere sahiptir. Bunlar mikrobiyal yıkımı sağlar.[14]
- Sekonder granüller; Lizozim, laktoferrin, kollajenaz, sitokrom b558, alkalin fosfataz ve plazminojen gibi enzimler esahip olup migrasyon ile mikrobiyal yıkımı sağlar.
- Tersiyer granüller; Jelatinaz, lizozim, asetil transferaz, asit fosfataz, sitokrom b558, nramp-1 gibi moleküllere sahiptir. Bunlar da damar dışına göçten sorumludur.
- Sekretorik veziküller; Alkalin fosfataz, sitokrom b558, plazma proteinleri gibi bileşenleri içerir. Sekretorik veziküller adhezyondan sorumludur.
Cathepsin-G, defensin ve myeloperoksidaz gibi enzimler güçlü oksidatif ve proteolitik etki göstererek fagosite edilmiş yabancı materyali veya etkeni yıkımlayan protein yapısında enzimlerdir. Cathepsin-G, Serin endopeptidaz benzeri aktivite gösterir.[15] Bunun yanı sıra heparini bağlar.[16] Cathepsin-G'nin organizmadaki asıl önemli fonksiyonları ise proteinlerin yıkımlanması, mantarlara karşı bağışıklık yanıtı ve nötrofil aracılı gram negatif bakteri yıkımıdır.[17][17]
Lenfositler
Bağışıklık sisteminin temel hücre gruplarından olan lenfositler kandaki çekirdekli hücrelerin (granülositler) yaklaşık olarak %25'ini oluştururlar. CD4+ T lenfositler MHC Sınıf II aracılığı ile antijen tanırken, CD8+ hücreler MHC Sınıf I aracılığı ile antijen tanımaktadırlar. Lenfositlerin birçok alt tipi vardır. Bunlar; CD4+ helper, CD8+ sitotoksik, Treg hücreler, B hücreler, Doğal öldürücü hücreler ve NKT hücrelerdir.[18]
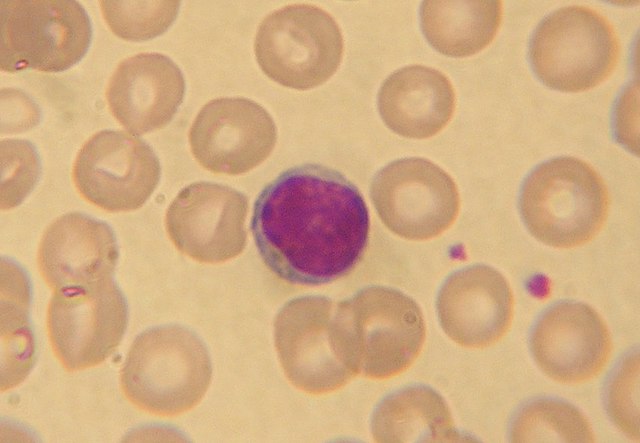
- Yangısal CD4+ T Hücreleri: CD4+ T yardımcı hücreleri öncelikle timusta naif T hücresi olarak oluşmakta ve dolaşıma verilmektedir. Bunu izleyen süreçte bu hücreler antijenlerle karşılaştıktan sonra uygun sitokin ortamı etkisiyle belli T hücre gruplarına farklılaşmaktadırlar. Olgunlaşmış T hücreleri kendi reseptörlerine uygun yapıda olan antijeni, antijen taşıyan antijen sunucu hücrenin MHC molekülü üzerinde algılar; CD3 ve CD28 kostimülasyonu da sağlandığında ve yine ortamda IFN-δ veya IL-12 sitokini baskın ise Th1 hücresi olarak farklılaşırlar.[19] Antijenleri tanıdığı vakit, saldırı emri alan TH1 hücreleri, IFN-δ ve TNF sitokinlerini sentezler. Bu sitokinlerin, daha doğrusu CD4+ T Hücrelerinin temel fonksiyonu makrofaj aktivasyonudur. Seçilmiş TH1 hücreleri de sitotoksisiteye neden olabilir.[20]
M Hücreleri
Luminal yüzeyden aldıkları antijenleri dar yapıdaki sitoplazmalarından geçirmek suretiyle parçalı olan bazal membranından bağ dokuda bulunan lenfositlere ileterek IgA yapımını indükler.[21]
Makrofaj
Nötrofillerden başka en önemli yangı hücrelerinden biri de makrofajlardır. Makrofajlar, dolaşımdaki monositlerin farklılaşmasıyla gelişirler. Granülasyon dokusu oluşumunun başlamasında ve gelişiminde oldukça önemli rol oynarlar. Diğer makrofaj kaynağı ise dokulardaki makrofajlar yani histiosit lerdir. Makrofajlar her ne kadar enfeksiyon etkenlerini fagositoz ve yok etme amacıyla görev alsa da bazı yüksek virulansa sahip hastalık etkenleri; örneğin Mycobacterium tuberculosis dolaşıma geçirerek tüm vücuda da yayabilir.Bu yüzden gerek yangıda, gerek bir hastalığın patogenezisinde oldukça önemlidirler. Makrofajlar ayrıca vazoaktif medyatörler (damar geçirgenliğini artırıcı), proteaz gibi enzimler, kemotaktik ve büyüme faktörleri gibi biyolojik olarak aktif maddeleri de üretirler. Granülasyon dokusu oluşacağı zaman veya fibrozis gibi bir nedbeleşme olaylarında bölgede yeni oluşacak kan damarları, fibroblast göçü yine makrofajların sorumluluğunda gerçekleşir.[22][23]
Bunların dışında yangıların karakteristiğine göre bölgeye birçok hücre de gelebilir. Bunların başında B ve T lenfositler yer alır. Lenfositler genellikle kronik yangılarda sayıca üstün oldukları gibi viral bir infeksiyona bağlı yangı oluşmuşsa yine sayıca üstün hücre olurlar. Şayet yangının karakteri alerjik veya parazitik ise bu defa sayıca üstün hücreler eozinofiller olurlar. Bu duruma allerjen maddelerin antikorlarla oluşturdukları kompleksler ve yine antijenin türünden dolayı üretilen ECF (Eosinophilic chemotactic factor) aracı olmaktadır.
Bir başka önemli yangı hücresi ise fibroblastlardır. Aslında fibroblastların yangı bölgesinde olmasının en önemli nedeni makrofajların salgıladığı büyüme faktörleridir. Bunun sonucu olarak bağ doku ve fibrin oluşumu ile karakterize fibrozis meydana gelir. Bu durum akciğer gibi bir organda olmuş ise adı karnifikasyon olur. Pneumoconiosis ve benzeri olaylarında yangı sonucu bağ doku oluşumu görülür. Fibroblastlar proliferatif karakterde reaksiyonların ve doku kayıplarının giderildiği olayların baş aktörleridir.
Bazı yangılarda teşhiste de rol oynayan spesifik hücreler bulunur. Bunlar dev hücreleri olarak adlandırılır. Bilinen dev hücreler; Langhans dev hücresi, Sternberg dev hücresi, Epulis dev hücresi, yabancı cisim dev hücresi, tümör dev hücresi, sinsityal hücrelerdir. Epulis dev hücresi dışındaki dev hücreler makrofaj veya epiteloid hücrelerden köken alırlar. Sinsityal hücrelerin oluşum mekanizması oldukça ilginçtir. Viral enfeksiyonların önemli bir mikroskopik bulgusu olan bu dev hücrelerin oluşumu, patojen virusun enfekte ettiği hücreyi terk etmeden çoğalmasını sağlar. Üretilen fizyon proteinleri hücreleri bir araya çekerek öncelikle sinsityum oluşumu sağlar.
Yangı mediatörleri
Bir yangısal reaksiyonda belirli süreçleri tetikleyen kimyasal maddelerdir. Kompleks olmayan bir inflamasyonda bu maddeler birbirlerini karşılıklı olarak aktive ederler veya baskılarlar; böylece, inflamasyondaki bireysel adımlar koordineli bir defansif (savunmacı) reaksiyon oluştururlar. Bunlar (kininlerde olduğu gibi) ölü dokulardan elde edilebilir ya da canlı dokulardan oluşturulabilir.
Hücrelerden elde edilen mediatörler: Bunlar ya bunları aktive biçimde salgılayan belirli hücreler içinde depolanmış mediatörlerdir ya da hücreler tarafından özellikle sentezlenen mediatörlerdir. Histamin mast hücre ve bazofil granüllerinde depolanır. Bu inflamasyonun alerjik formlarında kilit bir rol oynar. Histamin; Antijen-antikor kompleksleri tarafından salgılanır ve hücrelerin membrana bağlı IgM molekülleri tarafından önceden duyarlılığı gerektirir.Serotonin trombositlerden ve ince bağırsaktaki enretokromoffin hücrelerden gelir. Etkileri histamininkine benzer. Damar geçirgenliğinde artışa neden olur.
ICAM-3: İnterselüler adhezyon molekülü-3 olarak da bilinir.Lökositlerin hücre yüzeyinde bulunan bu molekül, antijen sunan hücreler ile T-lenfositlerin etkileşiminde son derece önemli rol oynar. Bu etkileşim, hem ICAM-1, ICAM-2 ve ICAM-3'ün LFA-1 molekülleri ile etkileşime girmesi hem de T hücre yüzeyinde bulunan CD2 molekülü ve APC'nin sunduğu LFA-3'ün etkileşime girmesi sayesinde gerçekleşir.[24]
Sitokinler'in (lenfokinlerin) rolleri
Sitokinler (lenfokinler) hücresel düzenleyici proteinlerdir. Çeşitli uyarılara karsı cevap olarak özel hücreler (T Lenfositler) tarafından salgılanır ve hedeflenen hücrelerin davranışını etkilerler. Belli bir sitokin çeşitli hücreler tarafından farklı dokularda salgılanır ancak aynı benzeri biyolojik etkinliği gösterir. Sitokinlerin etkileri sistemik veya lokaldir.[25] Lenfosit kaynaklı sitokinler; IL-2, IL-4, IL-5, IL-12, IL-15, TGF-β (transforming growth factor). IL-10 ve TGF-β immun yanıtı azaltırken, IL-2, IL-4 lenfosit gelişimini indüklemer. Yangısal olaylarda genel olarak stimulan (proinflamatuvar) veya depresif (antiinflamatuvar) etki gösterirler. Sitokinlerin temel görevleri arasında makrofajlarda kemotaksisinin başlatılması, damar permeabilitesinde (geçirgenlik) artış ve immunite (bağışıklık) sayılabilir.
Makrofaj/monosit kaynaklı sitokinler ise (monokin); IL-1α ve β, TNF-α'dır. Bazı sitokinler tedavi amacıyla ilaç olarak kullanılmaktadır; IFN'ların kanser (IFN-α), hepatitis (IFN-α), kronik granülomatoz hastalık (IFN-γ) ve multipl skleroz (IFN-β) ve IL-2'nin renal kanser ve melanoma tedavisinde yer edinmiştir. Th2 hücreleri(Tip-2 Yardımcı T Lenfosit), bağışıklık sisteminde T-hücre reseptörleri aracılığıyla hem allerjen peptitleri doğrudan tanıyan hem de interlöykinlerin (IL) salınımı sağlayan tek hücre sistemidir ve bu da alerjik yangıda IgE antikoru üreten B hücreleri (IL-4, IL-13), mast hücreleri (IL-4, IL-10) ve eozinofil'ler (IL-5) ile ilişkisini ortaya koyar.Lökosit kemotaksis'i ve kemokinezis'ini etkileyen sitokinler arasında; IL-8, eotaksin ve makrofaj enflamatuvar protein-1α bulunmaktadır.[26]
Sitokinleri iki başlık altında toplanabilir. Bunlar doğal immun yanıtı regüle edenler ve edinsel immun yanıtı regüle edenlerdir.
Doğal immun yanıtı regüle eden sitokinler
Bunlar makrofaj ve diğer mononükleer fagositlerden salınırlar. Bunların dışında T Lenfosit, NK (Natural Killer, Doğal Katil) hücreleri, endotel hücreleri ve mukozal epitel hücrelerince de salınabilirler. Doğal bağışıklık gelişmesinde önemli rol oynayan; IL-1, TNF-α, IL-6, özel olmayan yangısal cevabı başlatır; IFN tip 1 ise antiviral etkilidir.[27]
- TNF (Tümör Nekrozis Faktör),Gram negatif bakterilere ve diğer infeksiyöz mikroplara akut yangısal yanıtın düzenleyicileridir. TNF'ye TNF-α adı da verilir ve böylece TNF-β (lenfotoksin)'den ayrılır. Nötrofil ve monositleri uyararak infeksiyon bölgesine toplamak ve aktive ederek mikropların ortadan kaldırılmasını sağlar. Endotelyal hücreleri ve makrofajları kemokin salmak üzere uyarır. Mononüklear fagositlerden IL-1 salınımını uyarır. IL-1'nin, TNF'ye benzer bir rolü vardır. Bazı hücre tiplerinde (örneğin virus ile enfekte veya tümöral hücreler) apoptozis'i indükler. TNF, hipotalamus üzerine etki ederek vücut sıcaklığının artışına, dolayısıyla ateşe neden olur. Bu nedenle endojen pirojen olarak bilinir. TNF'ye (ve IL-1'e) yanıt olarak gelişen ateş oluşumu, sitokinle uyarılan hipotalamik hücrelerden salınan prostoglandinler aracılığıyla (PG) düzenlenir. Örneğin Aspirin PG sentezini inhibe ederek TNF ve IL-1'in bu etkisini bloke ederek ateşi düşürür. Hepatositleri bazı serum proteinlerinin (örneğin serum amiloid A ve fibrinojen) sentezi için uyarır. TNF'nin uzamış üretimi, kas ve yağ dokusu hücrelerinin zayıflamasına neden olur. Bu zayıflama, TNF aracılığı ile iştahsızlıktan ve lipoprotein lipazın azalan sentezinden kaynaklanır. TNF miktarı aşırı arttığında miyokardiyal kasılabilirlik ve damar düz kas tonusu inhibe olur. Bu durumda, kan basıncı düşer. Dolaşımda fazla TNF olması kan glukoz düzeyinin azalması gibi metabolik bozukluklara neden olur. TNF trombomodulin (trombin reseptörü-pıhtılaşma inhibitörü) ekspresyonunu inhibe ederek tromboz oluşumuna neden olur.
- Interlöykin-1 (IL-1) Makrofajlardan salınan İnterlökin 1(IL-1), araşidonat kaskadını aktive eder, platelet aktivating faktör(PAF) oluşturur ve kinin sistemini aktive eder. Akut yangısal reaksiyonları destekler. Karaciğerden akut faz proteinlerinin salınımını artırır. Skatriks (nedbe) için gerekli olan kollagen ve kollagenaz aktiviteyi uyarır.
- Interlöykin-12 (IL-12) İntrasellüler etkenlere karşı gelişen erken primitif immun yanıttan sorumludur. Hücresel immunitenin tetikleyicisidir. T lenfosit ve NK'lerden Interferon-φ (IFN-Gama) sentezini uyarır.
- Interlöykin-6 (IL-6), IL-1'in ilk iki etkisine ek olarak B lenfosit proliferasyonunu uyarır ve nötrofil sayısında artışı destekler.
- Interlöykin-10 (IL-10), Aktif makrofaj ve dendritik hücreleri ile IL-12'nin etkinliğini baskılar. Bu özelliğinden dolayı antiinflamatuvar'dır.

Edinsel immun yanıtı regüle eden sitokinler
- Interlöykin-2 (IL-2), NK ve lenfositler için gelişim faktörüdür. Diğer sitokinlerin sentezisi uyardığı gibi B lenfositlerden antikor salınımını artırır. Antijenle uyarılan T lenfositler için bir büyüme faktörüdür ve antijenle etkileştikten sonra T hücrelerinin çoğalmasından (klonal ekspansiyon) sorumludur.
- Interlöykin-4 (IL-4), NK hücreleri, CD4+ TH1 hücreler ve CD8+ T hücreler tarafında üretilir. Helmint ve artropod infeksiyonlarından kaynaklanan yangısal reaksiyonlarda, Immunglobulin-E (IgE) aktivasyonunu artırır. IL-4, IFN-Gama antagonistidir.Kısmen antiviral aktiviteye de sahiptir.
- Interlöykin-5 (IL-5), IL-4 ile ortak göreve sahip olan bu sitokin eozinofil aktivasyonunu tetikler.
- IFN-Gama, Makrofaj aktivasyonunun en önemli sitokinlerinden biridir.
- Lenfotoksin (LT), T lenfositlerinden ve diğer hücrelerden üretilir. %30 oranında makrofaj kaynaklı TNF ile homoloji gösterir ve benzer fonksiyonlara sahiptir. Bu nedenle LT, TNF-β olarak adlandırılır. Endotel hücreleri ve nötrofilleri aktive eder, bu nedenle akut inflamatör yanıtın bir mediatörü olarak görev yapar. Bu biyolojik etkinliği TNF'ninkine benzer.
- Interlöykin-13 (IL-13), makrofajlar gibi lenfoid olmayan hücreler üzerine etki eder ancak T ve B lenfositlere etkisi IL-4 kadar değildir. Major etkisi makrofajların aktivitesini inhibe etmektir ve IFN-gama'ya antagonisttir. Akciğer epitelyal hücrelerde mukus üretimini arttırır.
Araşidonik asit metabolitleri
Prostaglandinler ve lökotriyenler AA metabolizması sonucu açığa çıkan ürünler birçok biyolojik olayları etkiler. Her hücre yaralanması, fosfalipaz A 2 yi aktive ederek araşidonik asit gibi 20 karbonlu poliansature yağ asitleri oluşturur. Bu olaylardan biri de yangıdır. AA poliansature bir yağ asididir ve hücre zarındaki fosfolipid'lerde önemli miktarlarda bulunur.İnflamatuvar etkinlik ya da C5a gibi kimyasal mediatörler aracılığıyla sellüler fosfolipaz aktivasyonu sonucu membran fosfolipid'lerinden açığa çıkar.Yangısal reaksiyon esnasında, nötrofil lizozomlarının, fosfolipaz'ların önemli düzeyde kaynağı olduğunu sanılmaktadır.Lökotriyenler özellikle alerjik reaksiyonlarda indükleyici görev görür. Reaksiyon başladıktan sonra AA metabolizması iki temel yoldan birini seçer.Bunlar;
- Siklooksijenaz yolu
- Lipooksijenaz yolu'dur.
Lipooksijenaz lökotrienleri oluşturmak üzere parçalar(LT). Siklooksijenaz ise nonsterodial antiinflamatuar ajanlar tarafından inhibe edilebilen bir süreçte prostoglandinleri(birçok hücrede bulunan) oluşturur. Prostosiklin kapiller endotel ve vasküler duvar, tromboksan trombositler tarafından oluşturulur.
Prostaglandinin etkileri:
- Yaygın vazodilatasyon.
- Ağrı reseptörlerinin uyarılması.
- Ateş yükselmesidir.
Lökotienlerin etkileri:
- Nötrofilik ve eozinofilik granüllerin kemokinleri ve kemotaksisi.
- Vazokonstriksiyon.
- Bronkonstriksiyondur.
Antiinflamatuvar etkinlik
Antiinflamatuvar etki yangısal reaksiyonu diğer mediatörlerin aksine baskılar. Vücutta doğal antiinflamatuvar mediatörler olduğu gibi dışarıdan alınan birçok etken maddenin de antiinflamatuvar etkisi vardır.
Birçok antiinflamatuvar mediatör etkisini prostaglandin sentezini inhibe ederek gösterir. Arachidonik asit üzerinden siklooksijenaz yolunun blokajı ve lipooksijenaz yolunun blokajı temel mekanizmalardan biridir.
Doğal antiinflamatuvarlar
Bunlar vücut tarafından üretilen mediatörlerdir. En bilinen antiinflamatuvar mediatörler başlıca kortizon ve diğer glikokortikoid'lerdir.
Nonsteroid (steroid olmayan) antiinflamatuvarlar
Kısaca NSAID olarak bilinirler. Bunların birçoğunun analjezik ve antipiretik etkileri vardır. Yani hem ağrı kesici hem de ateş düşürücü etkilere sahiptirler. Ağrı kesici etkileri de prostoglandin sentezinin inhibisyonunun bir sonucudur. En bilinen NSAID'ler metamizol, diklofenak, naproksen sodyum ve ketoprofen türevi bileşiklerdir. Çoğu NSAİİler siklooksijenaz yolunu non-selektif olarak inhibe ederek etkirler. Siklooksijenaz-1 (COX-1) ve siklooksijenaz-2 (COX-2) izoenzimlerinin her ikisini de inhibe ederler. Siklooksijenaz araşidonik asitten tromboksan ve prostaglandin yapımında katalizör görevi görür. Prostaglandinler inflamasyon oluşum sürecinde diğer görevli maddelerle birlikte iletim molekülü olarak rol oynar.Bu etki mekanizması John Vane tarafından ortaya çıkarıldı ve bilim adamı bu şekilde Nobel ödülü sahibi oldu.
Fibronektin faktörü
Fibronektinler 450.000 Dalton boyutunda, genellikle dimerik yapıdaki glikoproteinlerdir. Hem plazmada çözünür formda (plazma fibronektin), hem de hücre dışı alanda çözünmez formda (sellüler fibronektin) bulunurlar.[28] Fibronektin opsonik aktivitesi nedeniyle retiküloendotelial sistemde(RES) ve pıhtı stabilizasyonunda rol oynar. Diğer fonksiyonlarının yanında hücre adhezyonu, migrasyonu, büyüme ve farklılaşmada görev alırlar. Başlıca üretim yerleri karaciğer hücreleri, endotelyal hücreler ve fibroblastlardır.[29][30][31]
Yara iyileşmesi birbiriyle kompleks oluşturmuş dört fazda incelenebilir. Bunlar; koagülasyon, inflamasyon, granülasyon dokusu oluşumu ve matriks formasyonu-yeniden yapılanmadır. Fibronektin'in bu fazların hepsinde fonksiyon gördüğü bilinmektedir.[32] Yangının iyileşme sürecinde gelişen granülasyon dokusunun oluşumunda fibronektin olmazsa olmaz denilebilecek derece roller üstlenir.[33]
Fibronektin, kuvvetli opsonik bir α-2-glikoproteindir. Aynı zamanda kanın pıhtılaşmasında primer tıkaç oluşması için gerekli hücre göçünden sorumlu mediatörleri de üretir.
Akut faz proteinleri
Yangısal alanda nötrofil gibi granulositler ve mononüklear hücrelerin aktive edilmesiyle birlikte TNF-alfa ve İnterlökin-6 gibi proinflamatör (yangıyı tetikleyici) sitokinlerin salınımı ile birlikte akut faz proteinleri (APP) olarak bilinen glikoproteinlerin karaciğerden üretimini destekler.[34] Bunun dışında akut faz proteinlerinin üretimi için gerekli uyarımlar İnterlökin-1 tarafından da stimule edilir. Günümüzde akut faz proteinleri lökositozis ve/veya nötrofili gibi geleneksel hematolojik değerlendirmelerde kullanılan yangısal parametrelere göre daha duyarlı oldukları tespit edildiği için yangısal reaksiyonların belirlenmesinde daha etkili ve hassas bir yöntem olmuştur.[35]
C-Reaktif Protein (CRP):Yangının yanı sıra enfeksiyon ve travmanın sebep olduğu doku hasarını takiben, yangısal bir olaylar zincirinde üretilen akut faz proteinlerden biri de CRP'dir.[36][37][38] Yapılan birçok çalışmada CRP'nin yangısal cevabı takiben 24 saat içinde artış gösterdiği ve yangısal uyarımların bitiminden itibaren yavaşça azaldığı gözlenmiştir.[39][40] CRP seviyesinin gastrointestinal sistemdeki mukozal hasarının da tespitinde belirteç olarak kullanılması söz konusudur.[41]
Diğer önemli akut faz proteinleri:
- Serum Amiloid (A-SAA): A-SAA, yangının akut fazında üretilir. Safra için üretilen kolesterolün taşınımı, yangısal alana immun sistem hücrelerinin göçü ve ekstraselüler matrikse enzimlerin girişini sağlar. Amiloidozis, romatoid artrit ve aterosklerozis gibi yaygın, kronik inflamatuvar hastalıklardan sorumlu olduğu düşünülmektedir.[42] Farelerde üç izoformu bildirilmiştir. Bunlar; SAA-1, SAA-2 ve SAA-3'tür. Yangı boyunca SAA-1 ve SAA-2 karaciğerden üretilirken, SAA-3 ise farklı dokulardan üretilmektedir. SAA-1 ve SAA-2 genlerinin kontrolü ise sitokinlerden IL-1, IL-6 ve TNF-α'dır.[43]
- Haptoglobin (Hp): Oksidatif aktivite sonucu ertirositlerden plazmaya salınan serbest hemoglobini bağlar, hasara uğrayan böbreklerden ileri gelen demir kaybını önler.[44]
- Alfa-1Asid Glikoprotein (AGP)
- Seruloplazmin (Cp)
- Fibrinojen (Fb)
Adezyon, migrasyon ve diapedezde görevli yüzey molekülleri
Bunlar başlıca Hücre aracılı bağlanma reseptörleri ve Soluabl (çözülebilir) yüzey molekülleri olmak üzere iki temel sınıfa ayrılır.

Hücre aracılı bağlanma reseptörleri:
- Toll Benzeri Reseptörler: Bakteriyel lipopolisakkaritler, peptidoglikanlar, viral nükleik asitler ve bazı parazitlerin yüzey molekülleri ile etkileşime girmeyi sağlayan bu moleküller başlıca plazma membranı, dendritik hücrelerin endozomal membranı (hücre içi uyarım), fagositler, B hücreleri ve diğer birçok hücre yüzeyinde bulunur. İmmun sistem hücrelerini uyararak yangının başlamasını sağlarlar.
- NOD Benzeri Reseptör: Bakteriyel hücre duvarı, flagellin, muramyl dipeptid ve hasara uğrayan hücrelerin metabolitleri ile bağlanır. Başlıca fagositlerin sitoplazmalarında bulunur.
- RIG Benzeri Reseptör Viral RNA ile etkileşime girer. NOD benzeri reseptörlerde olduğu gibi fagosit sitoplazmasında bulunurlar. RIG-1 ve MDA-5 bu reseptörlere başlıca örnektir.
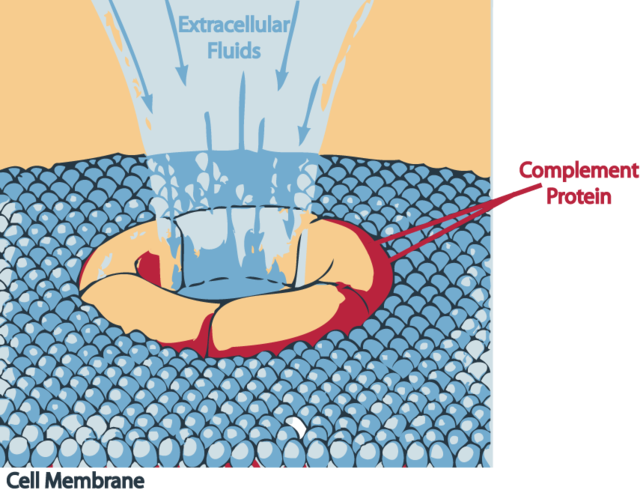
- C Tipi Lektin Bağlayıcı Reseptör Bakteriyel hücre duvarı yüzeyinde bulunan mannoz ve fruktozun yanı sıra mantar hücre duvarında bulunan glukanlar ile reaksiyona girer. Fagositlerin plazma membranında bulunur. Komplement sistemin aktivasyonundan sorumludur. Bu moleküllere örnek olarak Mannoz reseptörü, Trombomodulin ve Dektin verilebilir.
Soluabl yüzey molekülleri:
- Pentraksinler: Mikrobiyal fosforil kolin ve fosfatidil etanolamin gibi moleküllerle etkileşime girerler. Plazmada bulunurlar. Örneğin, C-Reaktif Protein.
- Kolektinler: Mikrobiyal yapı ürünleri ile etkileşime girerler. Mannoz bağlayıcı lektin ve Surfaktan proteinleri SP-A, SP-D gibi proteinlerdir. Başlıca plazma ve alveollerde bulunurlar.
- Selektinler: CD62 molekülü olarak da adlandırılmaktadır. Selektinler, tek zincirli transmembran glikoproteinleridir. Hücre adezyonlarından sorumludurlar.[3] Endotelyal hücrelerde E-selektin, lökositlerde L-selektin, plateletler ve endotel hücrelerinde ise P-selektin konuşlanmıştır.
- Komplement: Mikrobiyal yüzey molekülleri ile etkileşime girer. En önemli iki örneği Komplement 3 ve 5'tir. Başlıca plazmada bulunurlar.
Nitrik oksit ve reaktif yanıt
Nitrik oksit organizmada birçok role sahip özel bir biyolojik moleküldür. Makrofajlarca fagosite edilmiş, sindirilmiş mikroorganizmalara karşı oldukça güçlü bir yanıt gösterir.[45] Hücre içi sinyal iletiminde de bazı fonksiyonları vardır. Nitrik oksit kısa süreli ve güçlü bir reaktif etkiye sahiptir. Böylece fagosite edilen mikroorganizmaların yıkımlanmasını sağlar. Nitrik oksitin bunların yanında ayrıca nörotransmitter bir maddedir ve dolaşımda stabilizasyonu sağlar. Nitrik oksitin tepkimeye girmesiyle bakterilerin sitrik asit siklusu engellenir. Bunun yanında viral replikasyonu, yani virusların hücre içinde üremesini, çoğalmasını da engeller.
Çeşitleri
Özetle
Bakış açısı
Yangılar akut ve kronik olmalarının yanında eksudasyonlarına göre de birçok şekilde sınıflandırılabilir. Bunlar eksudatif, alteratif ve proliferatif yangılardır.
Akut yangı
Akut yangılar hızlı bir şekilde başlar ve kısa sürede şekillenir (birkaç saat ile bir gün arasında). Hızlıca oluştukları için yangılı alana sayıca hakim hücreler nötrofil lökositlerdir. Bunun yanında makrofajlar da sıkça görülür. Sayıca az da olsa lenfositler görülebilir.
Kronik yangı
Kronik yangılar uzun sürede (3-4 hafta ve daha fazla) gelişirler. Akut yangılara nispeten ağrı duyusu daha azdır. Mikroskopik incelemede yangılı alanda sayıca lenfositlerin üstün olduğu görülür. Genellikle bu tür yangılarda fibrinleşme görülür. Bunun yanında akut yangılar zamanla kronik hale de gelebilirler.
| Komponent | Akut yangı | Kronik yangı |
|---|---|---|
| Baskın hücreler | Nötrofil, makrofaj | Lenfosit, plazmasit, fibroblast |
| Süresi | Birkaç günden bir haftaya kadar | 4 hafta ve daha fazla |
| Sıcaklık artışı | Belirgin | Belirgin değil |
| Ağrı durumu | Daha etkin | Daha hafif |
| Baskın özellik | Eksudasyon | Proliferasyon |
Eksüdatif yangı
Eksudatif yangılar, yangının bir semptomu olan tumor ile karakterizedir. Yani bu tip yangılar sıvı eksudasyonu ile kendilerini belli ederler. Bundan başka genel olarak yangıların ilk evreleri de eksudatif yangı kabul edilir. Eksudatif yangılar yangı içeriğine ve eksudatın yoğunluğuna göre sınıflandırılabilir:[7][46][47]

- Seröz yangı. Bunlar en hafif yangısal reaksiyonlardır. En tipik örnekleri burun nezlesi, alerjik reaksiyonlar, böcek-sinek ısırmaları ve 2. derece yanıklardır. Şekillenen eksudat, transudata oldukça yakın kıvamdadır. Bu tür yangısal reaksiyonlar hemen hemen tamamen rezolüsyona uğrarlar. İyileşme süreçleri kısadır.Belirgin bir eksudasyondan başka herhangi bir reaksiyon görülmez. Yangısal hiperemi ve sıcaklık artışının ardından tıpkı birer vezikül ya da bül görünümünü alırlar. Kataral (serö-müköz) yangı'lar daha çok sindirim ve solunum sistemi kanallarında rastlanır.
- Fibrinli (fibrinöz) yangı. Genellikle serozalarda veya mukozalarda oluşurlar. Eğer seroz zarlar arasında oluşursa adhezyon'lara (yapışma, sineşi) neden olabilir. Fibrinli yangılar sıklıkla fibrin ağı, nötrofiller ve ölü mikroorganizmalardan oluşan bir koleksiyonla örtülür. Bu yapıya pseudomembran adı verilir. Bir pseudomembranın yapısını nötrofil, ölü mikroorganizmalar ve fibrin parçaları içerir. Pseudomembran, altında bulunan bağ doku ile ilişki halinde değildir ve bulunduğu yerden kolaylıkla ayrılır. Bazen pseudomembranlar altlarında bulunan bağ doku ile sıkı bir organizasyona girebilirler ki bu durumda "difterik/difteroid pseudomembran" adını alırlar. Pseudomembran oluşumundaki en önemli sebep yangısal bölgenin sürekli temasa maruz kalmasıdır. Örneğin ağız mukozası, sindirim kanalı mukozası sürekli içerik ile temasa maruz kaldığı için bir bakıma koruyucu mekanizma olarak pseudomembran oluşur.
- İrinli (purulent, suppuratif) yangı. Ölü ve canlı nötrofiller ile enfeksiyon etkenlerinin (ki söz konusu bakterilerdir) oluşturduğu asit pH'da bir yangı ürünüdür irin. Bunların en önemli komplikasyonu, irinin kana karışarak tüm vücuda yayılması, yani piyemi'dir. İrinli yangıların en önemli kaynağı piyojen mikroorganizmalardır. Bunun yanında terpentin, kroton yağı gibi yüksek derece irkiltici maddeler aseptik irin denilen yapının oluşmasına neden olur.İrinli yangılar genellikle bağ dokudan organize olmuş bir kapsül aracılığıya sınırlandırılarak apseleri oluşturur. Asit pH'ya sahip irin daima fistülleşme eğilimi gösterir. Yani bir bölgeden oluşan kanal (fistül) yardımı ile dışarı açılır. Apseye neden olan etkenlerin arasında anaerob veya mikroaerofilik streptococ'lar, bacteriodes gibi diğer anaeroblar, staphylococcus'lar, actinomyces, nocardia yer alır. Mantarların da apse yapabildiği sanılmaktadır. İçi boşlukluk organlarda irin birikebilir. Bu olaya empiyem denir. Örneğin sinusitis purulenta, sinus empiyemidir. Yine piyometra, uterus empiyemi'dir.
- Hemorajik yangı: Eksüdada eritrositlerin bol olduğu yangı şeklidir. Genellikle virulansı yüksek mikroorganizmalardan ileri gelen enfeksiyonların seyri sırasında ortaya çıkar.Yangısal reaksiyon çok şiddetli olduğu için artan kapiller permeabilite eritrositlerin de damar dışına sızmasına neden olur. Bunun yanında bazı toksinler de damar geçirgenliğini aşırı derecede artırabilir veya pıhtılaşma faktörlerinin bir ya da birkaçını engelleyerek kanama eğilimini artırır. Yangısal yanıt ile birlikte kan sızması da söz konusudur. Kanamanın bir başka sebebi de şiddetli doku yıkımı ve buna bağlı gelişen kapiller hasardır. Fazla miktarda üretilen opsonin ve komplementlerin damar geçirgenliği artırması kanamalara neden olur. Akut yangılardaki eksüdasyon sırasında damarlardan tek tük eritrosit çıkabilir. Toksik etkilerin çok güçlü olduğu durumlarda kapillerler ağır zarara uğrar, permeabilite aşırı derecede bozulur ve pasif nitelikte eritrosit diapedesisi başlar. Yangının en ağır türlerinden biridir. Örnekler: Şarbon (antrax), çiçek hastalığının ve difterinin malign şekilleri, ağır grip olguları, veba pnömonisi, akut hemorajik pankreatit, hemorajik glomerülonefrit, tifüs, kanser kemoterapisinde kullanılan ilaçların (cyclophosphamide ve busulfan) yan etkisine bağlı hemorajik sistit, eroin bağımlılarındaki akciğerin hemorajik mantar infeksiyonları.
Nekrozlu yangı
Nekrozlu yangı olgularında, ön plandaki bulgu nekrozdur. Çevresinde eksüdatif ya da proliferatif yangı bulunur. Nekrozun ilk dakikalarında nekrotik hücrelerden çevreye onlarca-yüzlerce zararlı molekül saçılır. Çoğu protein yapısında olan moleküllerin büyük bölümü 24 saat içinde etkisizleştirilir. Etkili oldukları sürece akut yangısal tepkilere neden olurlar;
- Öncelikle mast hücreleri aktive olur, histamin salınır. Bunu başkaca kimyasal medyatörlerin salınımı izler.
- Yöresel kapillerlerde trombosit kümeleşmesi başlar. Trombositler dağılan damarlardan dokulara geçer ve içerdikleri onlarca kimyasal maddeyi (medyatör) boşaltırlar.
- Kimyasal maddeler akyuvarları bölgeye çeker (kemotaksis). Bölgeye gelen akyuvarlardan onlarca enzim ve mikrop öldürücü (bakterisid) etkisi olan peptidler salınır.
- Kan elemanları kollajen liflere bulaştığı anda Hageman faktörü aktive olur; zincirleme enzimatik tepkiler çok sayıda medyatörü ve komplemanı etkinleştirir.
- Kompleman aktivasyonuyla birlikte anafilatoksinler olarak bilinen C3a, C4a ve C5a oluşur.
- Dendritik hücreler parçalanan hücrelerden açığa çıkan proteinleri fagosite eder ve bölgesel lenf düğümlerine taşıyarak sitotoksik T-lenfositlerine (CD8+) ulaştırırlar.
- İyileşme küçük nekrozlarda rejenerasyon, büyük nekrozlarda granülasyon dokusu ve onarım (reparasyon) ile gerçekleşir.
Nekrozlu yangı türleri: Nekrozlu yangılar bulundukları bazı yerlere ve şekillerine göre özel adlar alır:
- Nekrozlu Membranlı Yangı: Deri ve mukozaların pıhtılaşma (koagülasyon) nekrozuna “nekrozlu membran”, erime (kollikuasyon) nekrozunun yüzeysel olanına “erozyon” derin olanlarına “ülser” denir. Nekrozlu membrana da gerçek membran denir. Değişik genişlikteki alanlarda deri veya mukoza pıhtılaşma nekrozuna uğrar. Yüzeyde esmer-sarımtırak renkli bir örtü görülür. Örnek: basilli dizanterinin üçüncü dönemi (nekrozlu membranlı dönem).
- Erozyon ve Ülser : Deri ve mukozalardaki yüzeysel nekrozla erozyon (erosion) denir. Yalnız epitel tabakası ortadan kalkmıştır (erozyonlu gastrit, erozyonlu stomatitler). Rejenerasyonla iz bırakmadan iyileşir ya da derinleşerek ülser halini alır. Bir ülserde, deri ve mukozanın epitel örtüsüyle birlikte daha derin katmanlar da nekroza uğrar, erir ve yerinde defekt bırakır.
- Kavern ve Gom: Organlardaki erime nekrozu “kavern” olarak nitelenirken, pıhtılaşma nekrozu “gom” olarak nitelendirilir. Kavernler tüberküloza, gomlar ise sifilisin 4.evresine özgü bulgulardır.
Proliferatif yangı

Proliferatif yangılarda, genellikle ortadan kaldırılamayan canlı etkenlerin (mikobakteri, mantar, parazit) çevreye yayılmasını ve yabancı cisimlerin (silisyum, talk, sütür, vb) olumsuz etkilerini önlemek için makrofajlar devreye girer. Makrofajlar, doku makrofajları ve kandan gelerek dokulara giren monositlerin değişimleri sonrasında ortaya çıkan fagositlerdir. Makrofajlar fagosite ettikleri partikülleri sindiremezlerse hareket yeteneklerini yitirirler. Eritilemeyen partiküllerin bulunduğu bölgedeki yığınak yoğunluk kazanır, kandan gelen monositlerin ve doku makrofajlarının sayısı olağanüstü artar. Bir süre sonra özellikle ortadan kaldırılamayan canlı etkenleri (mikobakteri, leishmania, aspergillus, vd) fagosite eden makrofajlarda sitoplazma ince granüllü pembemsi bir görünüm alır. Bu değişimi gösteren makrofajlara “epiteloid hücre” ya da “epiteloid histiosit” adı verilir (bu tür hücreler epitel hücreleri gibi yan yana gelirler).
İsimlendirme
Özetle
Bakış açısı
Organlarda ve dokularda yangısal reaksiyonlar isimlendirilirken genel bir kural olarak -itis eki kullanılır. Beşeri hekimlikte sıklıkla isimlendirme kısaca yapılır, yani -it eki getirilir. Ancak bazı oluşumların yangıları isimlendirilirken bu sözü edilen ekler kullanılamaz. Bu durumda o yapıya özel yangı terimi kullanılır. Yangısal hücre infiltrasyonunun bulunduğu yere veya organdaki konumuna göre de yangılar isimlendirilirken belirli hususlara dikkat edilir. Örneğin tek başına pneumoni akciğerlerde alveolerde eksudat birikmesi ile karakterize bir tabloyu alveolitis ifade eder. Organın interstisiyumunda şekillenen yangılar ifade edilirken daima interstisiyel ibaresi belirtilir.Örneğin interstisiyel pneumoni, böbrek korteksine ilişkin yangıda nefritis, glomerullerde yangısal hücre infiltrasonu için glomerulonefritis veya böbrek medullasını da içine alıyorsa piyelonefritis gibi. Bunların bazı örnekleri aşağıda verilmiştir:
- Mide (Ventriculus, gaster): Gastritis (Gastrit)
- Karaciğer (Hepar): Hepatitis (Hepatit)
- Bağırsaklar: Enteritis (Enterit)
- Yumurta kanalı (Oviduct, salphinx, tuba uterina): Salpingitis (Salpingit)
- Sinus: Sinusitis (Sinuzit)
- Yutak (Pharynx): Pharyngitis (Farenjit)
- Kör Bağırsak (Caecum): Tiflitis (Tiflit)
- Böbrek (Ren): Nephritis (Nefrit)
- Yumuşak Damak (Palatum molle): Angina (Anjin)
- Sert Damak (Palatum durum): Palatitis (Palatit)
- Bademcik (Tonsilla): Tonsillitis (Tonsillit)
- Akciğer (Pulmo): Pneumonia (Pnömoni)
- Diyafram (Diaphragma): Phrenitis (Frenit)
Yangının klinik patolojisi
Özetle
Bakış açısı
Organlarda yangısal değişikliklere bağlı olarak söz konusu organ ve ona ilişkin sistemlerde bir takım aksaklıklar ve buna bağlı olarak gelişen klinik bulgularda söz edilmesi olasıdır.
Organizmada meydana gelen yangısal değişiklikleri laboratuvar analizleri ile belirlemek klinik patoloji bakımından önem taşır. Akut yangısal olgularda kan nötrofil sayısı artarken (nötrofili), kronik olgularda lenfosit sayısında artış lenfositoz göze çarpar. Bununla birlikte yangısal reaksiyonlarda serum bakır düzeyinde artış gözlemlenmiştir. Yangısal reaksiyonun şekillendiği bölge hastalığın seyri veya ölümcül olup olmaması ile yakından ilgilidir. Beyin ve beyin zarlarının yangılarının ölüm riski son derece yüksektir. Bir periton yangısı büyük oranda ölümle sonuçlanır. İç organlarda şekillenen yangılar, organın da fonksiyonuna göre sistemik, görevsel veya bölgesel klinik belirtilerle ortaya çıkar.
Yangısal reaksiyonlar sırasında açığa çıkan sitokinlerin aynı zamanda sistemik etkilerinin de göz önünde bulundurulması gerekir. Örneğin interlökin-1 vücut sıcaklığında artış, iştah azalması gibi sistemik etkilere de neden olmaktadır. Benzeri etkiler yine interlökin-1,6 ve TNF-alfa gibi sitokinlerin karaciğerden akut faz proteinlerinin üretimini indüklemesi sonucu sistemik etkileri meydana getirmektedir.
Yangıya ilişkin 5. temel semptom; yani functio laesa, söz konusu organdaki fonksiyon bozuklarından bahseder.

- Karaciğere ait yangısal olgular: sarılık, hemoglobinuri, kusma gibi semptomlarla kendini belli eder. Hücre içi ATP konsantrasyonu, NAD/NADH2 oranı yükselir. Hücre membran geçirgenliği artar ve mitokondriyal, sitoplazmik ve lizozomal enzimlerin aktivitesinden dolayı metabolizma ürünleri ve potasyum kaybı görülür. Hasara uğray Yine organın bulunduğu bölgenin elle muayenesinde ağrıya yanıt alınır. Akut gelişen hepatit ve karaciğer an hepatositlerden açığa çıkan serbest karaciğer enzimleri; özellikle ALT(Alanin aminotransferaz), AST(Aspartat aminotransferaz) ve ALP(Alkalen fosfataz) kanda yüksek değerde görülür. Özellikle AST'nin yüksek çıkması karaciğerde akut hasarın habercisidir. yetmezliklerine sıklıkla ensefalopati de eşlik eder. Ensefalopati'nin sebebi karaciğerin fonksiyon gösteremeyerek portal ven'den gelen Amonyağı, üreye çevirememesi ve bundan dolayı bu maddenin beyin dokusuna zarar vermesidir. Kronik inflamasyonlardan farklı olarak akut olaylar genellikle geri dönüşümlüdür. Yavaş gelişen ve uzun vadede seyreden hepatitis'ler fibrozis oluşumuna neden olur. En kötü sonuç ise karaciğer sirozudur.
- Solunum sisteminde gelişen yangılar: Güç solunum, bazen hipoksi, öksürük gibi semptomlarla seyreder. Herhangi bir yolla solunum yollarına ulaşabilen infeksiyöz ya da non infeksiyöz etkenler gerek üst solunum yolu infeksiyonları (ÜSYE), gerek alt solunum yolları infeksiyonları (bronchitis, pneumoni gibi) meydana getirir. Yabancı cisimlerin aspirasyonu (solunum yollarına kaçması) Gangrenli pneumoni denilen ciddi bir olguya neden olur. İnfeksiyöz etkenler ise salgıladıkları toksinler vb ürünlerle akciğerlerde harabiyete neden olurlar. Pneumoni'lerin en tipik bulgusu yangısal eksudasyona bağlı balgam üretimi (viral infeksiyonlarda görülmez) ve soluma güçlükleridir.
- Üriner sisteme ait yangısal reaksiyonlar: disüri, anüri, hematüri, hemoglobinüri gibi semptomlarla seyreder. Yangının bulunduğu bölgeye göre de klinik belirtilerim şiddeti farklılık gösterir. Örneğin bir nefrit olayları lokalden ziyade sistemik etkilere(üremi, hiperkalemi, metabolik asidozis gibi) sahiptir. Alt üriner sistem yollarında ise daha çok hematüri ve disüri klinik bulgulardır.
- Eklemlerde şekillenen yangısal olaylar; örneğin arthritis yürüyüş bozuklukları, topallama gibi belirtiler gösterir. İlerleyen olaylar eklemlerde post distrofik kireçlenmeye veya ankiloz denilen hareketsiz pozisyon almasına neden olur. Bu olay yangının kronikleşmesi ve fibröz dokunun aşırı oranda üremesinden dolayıdır.
- Sindirim sisteminde gelişen yangılar: En temel semptomu ishaldir.Bunun nedeni sindirim kanalı duvarında gelişen eksudasyon ve epitel hücre yıkımıdır. Ancak her ishal görülen durum bir enteritis olgusuna işaret etmez.Zira ishale sebep olan ve yangısal nitelikte olmayan birçok sebep vardır ve göz önünde bulundurulmalıdır.
- Merkezi sinir sisteminin yangısal reaksiyonları: Prognoz(hastalığın gidişatı) açısından sıkıntılı, hatta olumsuzdur. Çünkü bu dokuların rejenerasyon yeteneği yok kabul edilir ve geri dönüşü olmayan hasarlar meydana gelir. MSS yangısal olayları daha dramatik klinik bulgularla seyreder. Örneğin ataksi, titremeler, vücut sıcaklığında ciddi derecede artış gibi. Beyin omurilik sıvısında yangısal hücre elemanları görülür.
Ancak yangı, diğer yangısal olmayan bazı semptomlarla veya bozukluklarla karıştırılabilir.Bunların ayrımı yapmak tanı ve uygulanacak tedavi açısından önemlidir.Yangısal değişiklikler başlıca şu olgularla karıştırılabilir:
Bunların yangısal oluşumlardan ayrımını yapmak mümkündür.
İnflamasyon sistemik etkiler
Özetle
Bakış açısı
Etkene karşı oluşan güçlü bir yangısal tepkiden önce lezyonun sınırlandırılması beklenir. Sınırlandırılarak yayılması önlenen etkenin ve medyatörlerden zarar görerek parçalanan doku artıklarının temizlenmesini, kayıpların giderilmesi ve normal işlevlere dönüşün sağlanması (iyileşme) süreci izler. İyileşme sürecindeki başarı, bağışıklık sisteminin gücü ve tıbbi desteğin katkılarına bağlıdır. Herhangi bir etkene karşı gösterilen tepki her zaman istenildiği biçimde sonuçlanmaz:
- Canlı etken sınırlandırılmazsa kan dolaşımına girer, sepsis ve septik şok tablosu gelişir (streptokok infeksiyonları).
- Etkenin temizlenmesi uzarsa süreç kronikleşir (tüberküloz).
- Kayıpların giderilmesinde ve parçalanan doku artıklarının temizlenmesi sonrasında sekeller kalabilir (seröz zarlarda fibrozise bağlı yapışıklıklar).
Yukarıda örnekleriyle verilen aksaklıkların klinik yansımalarındaki bulguların büyük bölümü yangı sürecinde beliren medyatörlerin etkisiyle ortaya çıkar.[7][46][47] Bu bulguların başlıcaları aşağıda verilmiştir:
Akut Faz Proteinleri
Yangı sürecine karşı gelişen fizyolojik savunma tepkileridir. Klinikte ateş, lökositoz, dalgınlık, uyku bozuklukları saptanır. Laboratuvar incelemelerinde plazmadaki “akut faz proteinleri (reaktanları)”nin düzeylerinde değişmeler bulunur; sayıları 30 kadar olan proteinlerin büyük bölümü karaciğerde üretilir. Akut yangı, travma, cerrahi operasyon, vb etkilerle ortaya çıkan sitokinlerin tetiklemesiyle dolaşıma verilirler. En güçlü tepkiler travma, infeksiyon, yanık, infarkt ve kanser gibi etkilerle ortaya çıkar. Doğum ve güçlü ekzersizler orta derecede etkilidir. Akut faz proteini üretimini kamçılayan sitokinlerin (IL-1, IL-6, TNF-α) büyük bölümü makrofajlarca ve miktarda da endotel hücreleri ile fibroblastlar tarafından üretilir. Söz konusu proteinler “akut faz” gibi bir niteleme alsa da kronikleşen yangılarda, otoimmun hastalıklarda ve kanserlerde de saptanırlar. Sedimentasyon (ESR) yükselmesi, doku yıkımının varlığını ve akut faz proteinlerinin düzeyindeki artışı gösteren en önemli bulgulardan biridir.
Önemli akut faz proteinleri: C-reaktif protein (CRP), fibrinojen, ferritin, serum amiloid A (S-AA) proteini, α-1 antikimotripsin, α-1 antitripsin, haptoglobulin ve seruloplazmindir.
Akut faz tepkilerinde plazma değerlerinde saptanan bulgular şunlardır;
- Plazma düzeyi yükselenler: C3, seruloplazmin, CRP, α-1 antitripsin, fibrinojen, SAA.
- Plazma düzeyi azalanlar: ferritin.
Akut faz proteinleri @ işlevleri (örnekler):
- CRP: Opsonizasyon
- Fibrinojen: Koagülasyon
- α-1 antitripsin: Serine protease inhibitörü
- Seruloplazmin: Antioksidan
- Serum amiloid A proteini: proinflammatuvar ve proaterojen
Ateş
Yangıya özgü en önemli göstergelerden biridir. Ekzojen pirojenlerin büyük bölümü endotoksin üretebilen canlı etkenlerdir (bakteri, virüs). Endojen pirojenler ise lökositlerce üretilir ya da zarar gören dokulardan (lösemi, lenfoma) açığa çıkar. Ateş pirojen maddelerin anterior hipotalamustaki “termoregülasyon” merkezini etkilemesinin sonucudur. Yangı sürecinin başlamasıyla birlikte ortaya çıkan çeşitli sitokinler (interlökinler) ve interferonlar endojen pirojenler olarak bilinirler. TNF, IL-1, IL-6 ve MPI-1 monositlerin ürettiği endojen piretiklerdir. Örneğin ateş yükselmesinde önemli etkisi olan IL-1, prostoglandin (PGE2) sentezini uyararak hipotalamustaki termoregülasyon merkezini etkiler. Ateşin yükselmesiyle birlikte titreme, bazal metabolizma hızlanması, kalp ritminde hızlanma, periferik vazodilatasyon bulguları ve terleme izlenir. Hastaya verilen aspirin prostoglandin sentezini “cyclooxygenase” aşamasında bozarak antipiretik etkisini gösterir; vazodilatasyon ve terleme ateşin düşmesine yardımcı olur.
Tıp tarihinin ilginç tedavi yöntemlerinden biri Nobel ödülüyle ödüllendirilmiştir (Wagner-Jauregg, 1927); araştırmacılar sifilis tedavisinde hastalara malarya bulaştırarak ateşlerini yükseltmiş böylece etkenin temizlenmesini sağlamıştır (T.pallidum 41 °C üzerinde canlı kalamaz). Pnömokoklar 40 °C'den yüksek ısılarda ölürler.
Ağrı
Ağrı eşiği bireyler arasında farklılıklar gösterir. Ortalama bir ağrı uyaranı bir bireyde yaşamı çekilmez yapabilirken başka birinde hafif bir yakınmayla geçiştirilir. Bazı bireylerde ise ağrıya yol açabilecek hiçbir neden olmasa da ağrı yakınmaları vardır (fantom ağrıları, psikosomatik ağrılar gibi soyut ağrılar). Bir başka hasta grubunun batma-yanma gibi yakınmalarla tanımladığı ağrı türleri periferik nöropatilerin sonucudur. Yangılarda ve doku zararlarında saptanan somut ağrıların algılanmasında 3 aşama vardır.
- (a) Ağrı reseptörlerinin uyarılması (nociception),
- (b) Ağrının algılanması,
- (c) Ağrıya tepki ve/veya ağrıdan yakınma.
Ağrı reseptörleri mekanik (travma, çekme, vb), kimyasal (yangı medyatörleri, asidler, alkaliler, vb) ve ısı değişiklikleri (sıcak, soğuk) gibi uyaranlara oldukça duyarlıdır. Reseptörlerce algılanan ağrı sensitif sinir lifleri aracılığıyla beyne iletilir. Ağrıyı algılayan beyin etkenden uzaklaşmaya yönelik eylemi sağlar. Örnek; elimize iğne battığını varsayalım, hemen elimizi çeker ve bekleriz. Ağrı geçerse eylem tamamlanmış olur. Ağrı geçmezse, kurtulmak için yeni girişimlerde bulunuruz (ağrı kesici almak, vb).
Yangı ağrılarında en önemli neden kininler, histamin, NO, prostanoidler, sitokinler ve büyüme faktörleri gibi medyatörlerdir. Kinin ailesinden bradikinin grubu özellikle “B tipi” ağrı reseptörlerinin uyararak etkili olur. TNF-α, IL-1, IL-6, IL-8 gibi sitokinler ile prostoglandinler ve büyüme faktörleri ağrıya duyarlılığı arttırır.
Sepsis ve Septik Şok
Akut infeksiyon (özellikle Gram-) hastalıklarında canlı etkenlerin kan dolaşımına girmesi (sepsis) ile birlikte çok sayıda medyatör devreye girer. İnterlökinler ile TNF-α başta olmak üzere birçok sitokin ve başkaca medyatörler şoka kadar gidebilen komplikasyonlara yol açabilir (bkz Sepsis ve Septik şok). Olguların bir bölümünde yaygın trombus oluşumu (dissemine intravasküler koagülasyon-DIC) nedeniyle fibrinojenin tüketilmesine bağlı güçlü kanama eğilimi ortaya çıkar. Canlı etkenlerin neden olduğu kronik yangılardaki akut alevlenmelerde de sepsis oluşabilir.
Fonksiyonların bozulması
Genellikle sikatrislere bağlıdır. Örneğin lümeni pek geniş olmayan yerlerdeki ülserler stenoz yapar (mide ülserindeki pilor ve kardia stenozu gibi). Plevra yapışıklıklarında solunum güçlüğü saptanır.
Kanama
Kavern ve ülser gibi nekrozlu yangılardaki geniş doku yıkımı içeren lezyonlarda damarlar yırtılabilir (diabrosis kanaması). Kanama bazan öldürücüdür. DIC tablosunun geliştiği olgularda yaygın kanamalar meydana gelir.
Amiloidozis
Sekonder amiloidoz; serum amiloid A proteinin vücutta çeşitli dokularda tutulumu ile karakterize bir hastalıktır. Doku yıkımlarının yoğun olduğu kronik yangısal süreçler sekonder amiloidozu ortaya çıkarabilir Serum amiloid A proteinin düzeyi sağlıklı insanlarda düzeyi 3 mg/litreyi geçmezken kronik yangılarda düzeyi 2000 mg/litre seviyelerine çıkabilir. Fakat yoğun yangısal sürece sahip kronik hastalarda bile sadece %5 lik bir kesimde sekonder amiloidoz gelişir. SAA proteinin tek başına yüksek olması hastalığın gelişmesi için yeterli bir kriter değildir. Henüz keşfedilmemiş birtakım genetik ve çevresel faktörler hastalığın patogenezinde rol oynamaktadır. Serum amiloid A genetik altyapısı olan kronik hastalarda çeşitli dokularla SAA etkileşerek AA depositlerini meydana getirir. Böylece AA amiloidozu (sekonder amiloidoz) AA depositlerinin birikimi olan hastalık olarak ortaya çıkar. Sekonder amiloidoza neden olan başlıca kronik yangısal süreçler şunlardır.
- Romatoid Artrit, Crohn, Ankilozan Spondilit gibi romatolojik ve immunolojik bozukluklar
- Tüberküloz, Kronik Osteomiyelit, Bronşiektazi gibi kronik enfeksiyonlar
- FMF, Muckle Wells Sendromu, TNF Reseptör İlişkili Periyodik Sendrom, Ailesel Soğuk Otoinflamatuar sendrom gibi periyodik ateş sendromları
- Çeşitli kanser türleri
Kanserleşme
İnsan organizmasında ortaya çıkan kanserlerin bir bölümünün nedeni kronik yangılardır. Kronik yangılarda kanser riskini ortaya çıkaran başlıca nedenler şunlardır;
- Metaplazi: kronik yangılarda özgün epitel örtüleri çok katlı yassı epitele değişebilir (metaplazi). Metaplazik epitelden karsinom çıkma oranı yüksektir (kronik bronşitteki bronş epiteli metaplazisinden gelişen bronş karsinomu). Metaplazi ve kanserleşme etyolojisi:
- Süregen hücre proliferasyonu: kronik yangıda oluşan doku defektlerinin kapatılmaya çalışılması sürecinde meydana gelen mutasyonlar (ülseratif kolit, kronik mide ülseri),
- Serbest radikallerin metabolitleri: genom zararı oluşturan metabolitlerin (nitrözamin) belirmesi,
- Bağışıklık sisteminin sürekli uyarılması: hücresel bağışıklık sistemini inhibe eden sitokinlerin üretimindeki artış,
- Apoptozisin inhibisyonu: kronik yangılarda hücre proliferasyonu artar apoptozis olgusu azalır. Böylece mutasyon gösteren hücrelerin sayısı artar.
- Angiogenezis: kronik doku defektlerinin kapatılmasını desteklemek için oluşan yeni damarlar mutasyon gösteren hücreleri besler.
İmmun Sistem ve RES Değişiklikleri
Bölgesel lenf düğümlerinde reaktif hiperplazi saptanır; germinatif merkezler çoğalır ve genişler, sinüslerde endotel hücresi proliferasyonu vardır. Bakteri ya da toksinleri tüm dolaşıma girerse etkisi de genelleşir; genel bir lenf düğümü büyümesi (lenfadenomegali) ve dalak büyümesi (splenomegali) saptanır. Sıvısal bağışıklık sistemi uyarıldığı sürece antikor yapımı vardır. Antikor yapımının yüksek düzeylerde olduğu olgularda hipergammaglobulinemi saptanır. Kronik antikor yapımını izlenen hastalıklarda (tüberküloz, lepra, romatoid artrit) amiloidoz görülebilir.
Kan Tablosu Bulguları
Akut yangıda ve kronik yangıda farklı olabilir.
Lökositoz (leukocytosis)
Akut bakteri infeksiyonlarında ve geniş doku yıkımı olgularında periferik kandaki nötrofil polimorf sayısı artar. Dolaşımdaki nötrofillerin bazıları immatürdür. Makrofajların ve T-lenfositlerinin ürettiği özgün proteinler (colony-stimulating factor'ler) kemik iliğini uyararak lökosit üretimini arttırır. Kemik iliğindeki matür ve immatür nötrofillerin periferik kana dökülmesinde nedenleri arasında makrofaj kökenli medyatörler ilk sırada yer alır. Bazı olgulardaki aşırı lökositoz “lösemi” izlenimi verebilir; bu tür lökositozlar için “lökemoid reaksiyon” tanımı kullanılır. Virüs infeksiyonlarında saptanan lökositozda periferik kandaki lenfosit sayısı artmıştır (lenfositoz). Parazit infeksiyonlarında ve alerji olgularında ise eozinofil polimorf sayısı yüksektir (eozinofili). Lökositoz yapan önemli nedenler;
- Fizyolojik nedenler (ruhsal ve fiziksel yüklenme)
- İnfeksiyon hastalıkları
- Yanıklar
- İnfarktlar
- Otoimmun hastalıklar
- Metabolik hastalıklar (üremi, gut, eklampsi, ketoasidoz)
- Tümörler
- Akut eritrosit kaybı (hemoliz, kanama)
Lökopeni (leukopenia)
Lökositozun tersini anlatır; periferik kanda total lökosit sayısındaki azalmadır. Kemik iliği inhibisyonunun sonucudur. Bağışıklık sisteminin önemli düzeylerde güçsüzleştiği kronik yangılarda, beslenme bozukluklarında, irradyasyon sonrasında, bazı ilaçların uzun süreli kullanımı nedeniyle ve kanser olgularında belirir. Bazı bakteri (salmonella, brusella), virüs ve riketsiya infeksiyonlarında da lökopeni gelişir.
Nötropeni (neutropenia)
Kandaki nötrofil polimorf sayısının azalmasıdır. Nedenleri:
- Nötrofil üretiminde azalma: radyasyon, ilaçlar (kemoterapi, antihistaminikler, antibiyotikler, vd), infeksiyon hastalıkları (tüberküloz, tifo, hepatit, malarya, sepsis), beslenme bozuklukları (anoreksi, açlık), folik asid eksikliği, B12 eksikliği.
- Nötrofil yıkımında artma: splenomegali, otoimmun hastalıklar (otoimmun nötropeni, SLE), anafilaksi, kardiyopulmoner bypass.
Anemi (anemia)
Malaryada, clostridium ve mycoplasma infeksiyonları ile kronik infeksiyonlarda en sık saptanan sonuçlardan biridir; genellikle normokromik normositik tiptedir. Nekrozlu yangılardaki yineleyen kanamalar hipokromik mikrositik anemi'lere yol açabilir.
Monositopeni (monocytopenia)
Kandaki monosit sayısının azalmasıdır. Nedenleri:
- Akut infeksiyonlar
- Kortikosteroid tedavisi
- Splenektomi
Hipofiz-Adrenal Aksı Etkilenmesi
Çoğu kronik yangı olgusunun gidişi hipotalamus-hipofiz-adrenal aksı tarafından yönetilir. Endokrin üçlünün güçlü çabasıyla üretilen glukokortikoidlerin anti-inflamatuvar yapısı kronik yangının sürecini etkiler. Sürrenal korteksi işlevlerinin yetersizliği prognozun kötüleşmesine yol açar.
Öteki Değişiklikler
Başağrıları, eklem ve kas ağrıları, iştahsızlık, kilo kaybı, yorgunluk, libido kaybı, vb bulgular serbest radikallerin ve çeşitli sitokinlerin neden olduğu başlıca bulgulardır.
Yangıyı etkileyen genel faktörler
Özetle
Bakış açısı
Yangının oluşması ve gidişi üzerinde değişiklik yapan çeşitli faktörler vardır.[7][46][47]
Hormonlar: Yangı arttırıcı etkisi olanlara proflojistik hormonlar, azaltıcılara da antiflojistik hormonlar denir.
- Proflojistik hormonlar: somatotrop hormon (STH), tireotrop hormon, desoxycorticosteron acetate (DCA veya DOCA). Bu hormonlar eksüdasyonu arttırır. Yangının iyileşme döneminde fibrositlerin gelişmesi, lif ve esas madde yapması, damarlanma üzerinde arttırıcı etkileri vardır. Bağ dokusu (ECM) polimerizasyonu azaldığından, etkenin ve eksüdanın doku içinde yayılması kolaylaşır.
- Antiflojistik hormonlar: Adrenokortikotrop hormon (ACTH), kortizon, hidrokortizon gibi. Bunlar eksüdasyonu ve granülasyon dokusu yapımını azaltırlar. Eksüdasyonun azalması, bu hormonların kapiller permeabilitesini azaltmasına bağlıdır; yangılı dokuda çok az serum, fibrin ve lökosit görülür. Lökositlerin marginasyonu, diapedesisi ve emigrasyonu önlenir. Granülasyon dokusunda fibroblast, ECM ve yeni damar yapımına engel olunur. ECM'nin az üretilmesine karşın yüksek derecede polimerize olması etkenin ve eksüdanın doku içinde yayılmasını önler. RES bloke edilir. Vücudun etkenlere karşı direnci azalır, sepsis olasılığı artar. Gerek yangı bölgesinde, gerekse timus ve lenf bezlerinde plazmositler ve lenfositler azalır. Ateş düşer. Periferik kandaki lenfositler ve eozinofiller azalır.
İlaçlar: Anti-inflamatuvar ilaçların büyük bölümü lökositlerin işlevlerini ve sayısını değiştirerek yangı sürecini etkiler. Lokal anestetikler, salisilatlar ve steroidler kemotaksis hızını keser.
Vitaminler: C vitamini eksikliğinde antikor yapımı bozulmaz. Buna karşın kapillerlerin bazal membranlarında ve ECM yapısında bozukluk vardır. Kanamalar olur. Yangı sınırlandırılamaz, etken yayılır. Nötrofil polimorfların fagositoz gücü azalır. Riboflavin, biotin, pyridoxin eksikliğinde antikor yapımı azalır.
Protein Eksikliği: Yetersiz protein alan hastalarda antikor yapımı azalır. Nefrotik sendromda idrarla (bol proteinle birlikte) antikorlar çıkar, vücudun direnci azalır. Opsonin eksikliğinde lökositlerin fagositoz yapması zorlaşır.
Alkolizm: Nötrofil polimorf işlevleri bozulur. Folik asid ve B12 eksikliğine bağlı anemi nedeniyle hipoksik yansımalar görülür. Akciğer infeksiyonları görece sıktır.
Diabetes Mellitus: Diabetlilerdeki yangılarda dokudaki laktik asid ve şeker niceliği görece daha fazladır. Şekerden zengin bir ortamda bakteriler daha kolay çoğalır. Diabette böbrek lezyonları (Kimmelstiel-Wilson hastalığı) sonucu opsoninler ve öbür antikorlar idrarla atıldığından lökositlerin fagositoz gücü azalır infeksiyonlara direnç giderek ortadan kalkar. Diabetiklerin nötrofil polimorflarındaki işlev bozuklukları prognozu etkiler.
Kan Hastalıkları: Ağır kan hastalıklarında antikor yapımı da etkilenir. Anemilerdeki oksijen eksikliği yangı hücrelerinin işlevlerini olumsuz biçimde etkiler. Agranülositozda fagositoz yapacak hücreler çok azaldığından saprofitler bile ağır (nekrozlu) yangı yapabilirler. Lösemi hastalarının normal lökositleri çok azdır.
Dolaşım Bozuklukları: Organizmanın kendisini iyi savunabilmesi için yangı sırasında o bölgeye yeterince kan gelmesi ve boşalabilmesi gerekir. Bu bakımdan damar hastalıkları ve genel dolaşım bozuklukları yangı üzerinde olumsuz etki yapar. Örnekler: diabette yangının daha ağır olması ve geniş nekrozlar meydana gelmesinde, ateroskleroz ve diabetik mikroangiopatinin önemli rolü vardır. Gençlere göre yaşlılarda yangının daha zor iyileşmesi başka faktörlerle birlikte ateroskleroza bağlıdır. Varisli ekstremitelerde yangının gidişi uzar ve iyileşmesi gecikir.
Etkenin Özellikleri: Etkenin cinsi, etki süresi, niceliği ve gücü, yangının tipi ve başka özellikleri üzerinde değişiklik yapar.
Tümörler: Kanserlerin büyük bölümünde periferik kanda kemotaksisi inhibe eden maddelere rastlanır. Kemoterapi ilaçlarının çoğu kemik iliğinde inhibisyona neden olur.
İnfeksiyon Hastalıkları: Tüberküloz, tifo, hepatit, malarya gibi infeksiyon hastalıklarında ve sepsis olgularında nötrofil sayısı azalır.
Kaynakça
Ayrıca bakınız
Konuyla ilgili yayınlar
Dış bağlantılar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.