Loading AI tools
atom numarası 16, atom ağırlığı 32,06 olan, 119 °C'de eriyen ve 444 °C'de kaynayan, doğada saf veya başka cisimlerle birleşik olarak bulunan, sarı renkli element, sülf (simgesi S) Vikipedi'den, özgür ansiklopediden
Kükürt, simgesi S, atom numarası 16 olan, limon sarısında ametal, yalın katı bir elementtir.
 | |||||||||||||||||||||||||||||||
| Görünüş | limon sarısı | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Standart atom ağırlığı Ar, std(S) | [32,059, 32,076] geleneksel: 32,06 | ||||||||||||||||||||||||||||||
| Periyodik tablodaki yeri | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Atom numarası (Z) | 16 | ||||||||||||||||||||||||||||||
| Grup | 16. grup (kalkojenler) | ||||||||||||||||||||||||||||||
| Periyot | 3. periyot | ||||||||||||||||||||||||||||||
| Blok | p bloku | ||||||||||||||||||||||||||||||
| Elektron dizilimi | [Ne] 3s2 3p4 | ||||||||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 6 | ||||||||||||||||||||||||||||||
| Fiziksel özellikler | |||||||||||||||||||||||||||||||
| Faz (SSB'de) | Katı | ||||||||||||||||||||||||||||||
| Erime noktası | 388,36 K (115,21 °C, 239,38 °F) | ||||||||||||||||||||||||||||||
| Kaynama noktası | 717,8 K (444,8 °C; 832,64 °F) | ||||||||||||||||||||||||||||||
| Yoğunluk (OS) | Alfa: 2,07 g/cm3 Beta: 1,96 g/cm3 Gama: 1,92 g/cm3 | ||||||||||||||||||||||||||||||
| sıvıyken (en'de) | 1,819 g/cm3 | ||||||||||||||||||||||||||||||
| Kritik nokta | 1314 K, 20,7 MPa | ||||||||||||||||||||||||||||||
| Erime entalpisi | Mono: 1,727 kJ/mol | ||||||||||||||||||||||||||||||
| Buharlaşma entalpisi | Mono: 45 kJ/mol | ||||||||||||||||||||||||||||||
| Molar ısı kapasitesi | 22,75 J/(mol·K) | ||||||||||||||||||||||||||||||
Buhar basıncı
| |||||||||||||||||||||||||||||||
| Atom özellikleri | |||||||||||||||||||||||||||||||
| Yükseltgenme durumları | -2, -1, 0, +1, +2, +3, +4, +5, +6 güçlü asidik | ||||||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 2,58 | ||||||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| ||||||||||||||||||||||||||||||
| Kovalent yarıçapı | 105±3 pm | ||||||||||||||||||||||||||||||
| Van der Waals yarıçapı | 180 pm | ||||||||||||||||||||||||||||||
| Diğer özellikleri | |||||||||||||||||||||||||||||||
| Kristal yapı | Ortorombik | ||||||||||||||||||||||||||||||
| Isı iletkenliği | 0,205 W/(m·K) (amorf) | ||||||||||||||||||||||||||||||
| Elektrik direnci | 2×1015 Ω·m (20 °C'de) (amorf) | ||||||||||||||||||||||||||||||
| Manyetik düzen | Diyamanyetik[1] | ||||||||||||||||||||||||||||||
| Manyetik alınganlık | (α) -15,5×10-6 cm3/mol (298 K)[2] | ||||||||||||||||||||||||||||||
| Hacim modülü | 7,7 GPa | ||||||||||||||||||||||||||||||
| Mohs sertliği | 2,0 | ||||||||||||||||||||||||||||||
| CAS Numarası | 7704-34-9 | ||||||||||||||||||||||||||||||
| Tarihi | |||||||||||||||||||||||||||||||
| Keşif | Antik Çin'de (MÖ 2000 öncesi) | ||||||||||||||||||||||||||||||
| Element olarak tanınması | Antoine Lavoisier (1777) | ||||||||||||||||||||||||||||||
| Ana izotopları | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Kükürt doğada yaygın olarak bulunan bir elementtir (yer kürenin % 0,06'sını oluşturur). Özellikle en önemli kükürt yataklarının yer aldığı Sicilya, Louisiana ve Japonya'da eski volkanların yakınında, alçı taşı ya da kireç taşı katmanları arasında doğal halde bulunur. Çoğunlukla metallerle birleşmiş olarak görülür. Demir, bakır, kurşun ve çinko sülfürler, bu metallerin en önemli cevridir. Kalsiyum sülfatı ya da başka deyişle alçıtaşını saymak gerekir.
Doğada çeşitli bileşikler halinde bulunan kükürt dahilen hafif laksatif olarak kullanılır. Dıştan sürüldüğü zaman (losyonlar, merhemler) asalakları öldürücü seboreyi giderici ve keratin eritici nitelikler gösterir. Pek çok maddelerin moleküllerinde bir ya da birçok kükürt atomu bulunur. Kükürdün varlığı bu maddelere sülfamit örneğinde olduğu gibi bakteri öldürücü özellikler kazandırır.
Kükürt gidermek bir maddeyi bileşiminde bulunan kükürtten ya da bir sülfürden arındırmak (dökme demirde bulunan kükürt kireç ferromanganez ya da sodyum karbonat katılarak giderilir). Kükürt sütü bir asidin hiposültid üzerine etkimesi sonunda oluşan kolodal kükürt asıltısıdır. Çubuk kükürt, silindir biçiminde dökülmüş kükürttür.
Hidrojenle kükürt giderme bir benzinin bir mazotun kükürdünü bir katalizör eşliğinde gidermek için hidrojen kullanan arıtma yöntemidir. Kükürt taşı aşırı derecede kükürtlenmiş şaraplarda duyulan hoşa gitmeyen taddır.
Kükürt, antikçağda bilinen dokuz yalın cisimden biriydi. Kükürdün kimyasal bir element olduğu 1777'de Lavoisier'dan ortaya attı. 1810'a doğru Gay Lussac ile Thenard tarafından deneysel olarak doğrulandı. Kükürt tatsız, kokusuz bir katıdır, ısı ve elektriği iyi iletmez. Sıcak suya bir parça kükürt atıldığında hafif çatırtılar çıkar ısıtıldığında 113° dereceye doğru eriyerek açık sarı bir sıvı verir, bu sıvı daha yüksek sıcaklıkta ağdalı bir kıvama erişerek esmerleşir. 220° dereceye doğru kararır ve akışkanlığını yitirir. Daha sonra akışkanlığını yeniden kazanmasına karşın rengini korur ve 444,6° derecede kaynar buharının yoğunluğu sıcaklığa göre değişir. Kükürt molekülündeki atom sayısının değiştiğini de gösterir. Suda çözünmemesine karşın benzende hafifçe çözünür ama en önemli çözücüsü karbon sülfürdür.
Kükürt kimyasal olarak oksijenle birçok benzerlik gösterir ve bileşmelerde oksijenin yerine geçer. Ama daha az elektronegatifdir; Metaller, oksijenle olduğu gibi kükürt buharında yanarak sülfürleri meydana getirir. Nitekim demir talaşı ve kükürt çiçeği hafifçe ısıtıldığında akkor hale gelerek yapay demir sülfürüne dönüşür. Kükürt oksijen ve halojenlere karşı elektropozitiftir.

Kükürdün birçok kullanım alanı vardır. Ham kükürdün büyük bölümü, kükürt dioksit gazı, sülfürik asit, karbon sülfür, tiyosülfat vb. üretiminde kullanılır. Arı kükürt, kara barut ve havai fişeklerin bileşimine girer. Kükürtten ayrıca kibrit yapımında, kauçuğun kükürtlenmesinde, ebonit üretiminde yararlanılır. Bu aralarda bağlarda görülen külleme hastalığına karşı yapılan kükürtleme ile deri hastalıklarının tedavisinde kullanılan pomat ve şampuanların hazırlanmasında kükürtten yararlanıldığını özellikle belirtmek gerekir. Kükürt dioksit, amfizemin ve süreğen bronşitlerin oluşumunda önemli rol oynar, çocuklarda solunum hastalıklarının sayısını artırır. Bitkilerde oldukça kısa süreli temaslarda yaprak nekrozlarına neden olur. Daha düşük yoğunlukta, ama daha uzun süreli temaslarda metabolizma etkinliğinde azalma yapar.
Kükürt, hem dahilen hem de haricen kullanılan bir halk ilacıdır. Uyuz ve egzamada mangal külüyle karıştırılan kükürt, zeytin yağıyla pomat yapılarak hasta bölgeye sürülür. Alerjiye karşı toz kükürt, leblebi unu ya da balla karıştırılarak hastaya yedirilir. Yanıklarda bir miktar kükürt kireçle karıştırılıp pomat haline getirilerek deriye sürülür. Kulak hastalıklarını sağaltmak için, çocuk düşürmek içinde kullanılır. Anadolu'nun bazı yörelerinde hayvan uyuzunda ve hayvanların mide bağırsak parazitlerini düşürmek üzere de dahilen kükürt kullanılır.[kaynak belirtilmeli]
Kükürt Minerali' nin Görevi: Bağ dokusu, deri, tırnak üretimi, kan şekeri seviyesinin kontrolü, vücudun zehirlerden temizlenmesi, safra üretimi. Sağlıklı saç, cilt ve tırnaklar için gereklidir. Oksijen dengesinin muhafazasına yardımcı olur, bu da beyin fonksiyonları için çok önemlidir. Sülfür aynı zamanda B-grubu vitaminlerinin işlevlerini yerine getirmesine ve karaciğerde safranın salgılanmasına yardımcı olur.[kaynak belirtilmeli]
Kükürt, doğada bol bulunan bir elementtir; taş kürenin %0,06'sını oluşturur. Özellikle en önemli kükürt yataklarının yer aldığı Sicilya, Luisiana ve Japonya'da eski volkanların yakınlarında, alçı taşı, kireç taşı katmanları arasında doğal halde bulunur. Türkiye'de Keçiborlu'da Etibank tarafından kapatılan ocaklar 2008 yılında tekrar açılmıştır.[kaynak belirtilmeli]
Kükürtün 23 bilinen izotopları vardır. Bunların dördü kararlıdır: 32S (% 95,02), 33S (% 0,75), 34S (% 4,21) ve 36S (% 0,02). 35S dışında, kükürtün radyoaktif izotopları oldukça kısa ömürlüdür. 35S atmosferde 40Ar'un kozmik ışınlarla parçalanmasıyla oluşur. Bunun yarılanma süresi 87 gündür. Bir sonraki uzun ömürlü radyoizotop, 170 dakikalık bir yarılanma süresi ile, kükürt-38'dir. Yarılanma süresi 200 nanosaniye ile en kısa ömürlü radyoizotop, kükürt-49'dur.[kaynak belirtilmeli]
| İzotop | Yarılanma süresi | Çürüme enerjisi (MeV) | Spin / Eşlem | Çürüme modları (%) | Doğal bolluk (%) |
|---|---|---|---|---|---|
| 26S | 10 ms | 0+ | 2p (% 100) | ||
| 27S | 21 ms | 18,26 (K/β+) | 5/2+ | K/β+ (%98), K2p (%2), Kp = ? | |
| 28S | 125 ms | 11,23 (K/β+), 9,17 (Kp) | 0+ | K/β(%79), Kp(%21) | |
| 29S | 187 ms | 13,79 | 5/2+ | K/β+ (%53), Kp (%47) | |
| 30S | 1,178 s | 6,138 | 0+ | K/β+ (%100) | |
| 31S | 2,572 s | 5,396 | 1/2+ | K/β+ (%100) | |
| 32S | kararlı | 0+ | 95,02 | ||
| 33S | kararlı | 3/2+ | 0,75 | ||
| 34S | kararlı | 0+ | 4,21 | ||
| 35S | 87,32 gün | 0,167 | 3/2+ | β− (%100) | |
| 36S | kararlı | 0+ | 0,02 | ||
| 37S | 5,05 dk. | 4,865 | 7/2− | β− (%100) | |
| 38S | 170,3 dk. | 2,937 | 0+ | β− (%100) | |
| 39S | 11,5 s | 6,64 | (3/2,5/2,7/2) - | β− (%100) | |
| 40S | 8,8 s | 4,71 | 0+ | β− (%100) | |
| 41S | 1,99 s | 7/2− | β−(> %99,9), β− (< %0,1) | ||
| 42S | 0,56 s | 7,7 (β−), 2,0 (β−n) | 0+ | β− (%96), β− (%4) | |
| 43S | 220 ms | 11,5 (β−), 4,4 (β−n) | β−(%60), β−(%40) | ||
| 44S | 123 ms | 9,1 (β−), 5,1 (β−n) | 0+ | β− (%82), β− (%18) | |
| 45S | 82 ms | 14,1 (β−), 7,1 (β−n) | β− (%46), β− (%54) | ||
| 46S | 50 ms | 0+ | β− (%100) | ||
| 48S | <200 ns | 0+ | β− (%100) | ||
| 49S | <200 ns | n (%100) |
Kükürt aralığının yaygın oksidasyon durum’ları -2 ile +6 arasındadır. Kükürt, soy gaz’lar hariç tüm elementlerle kararlı bileşikler yapar.
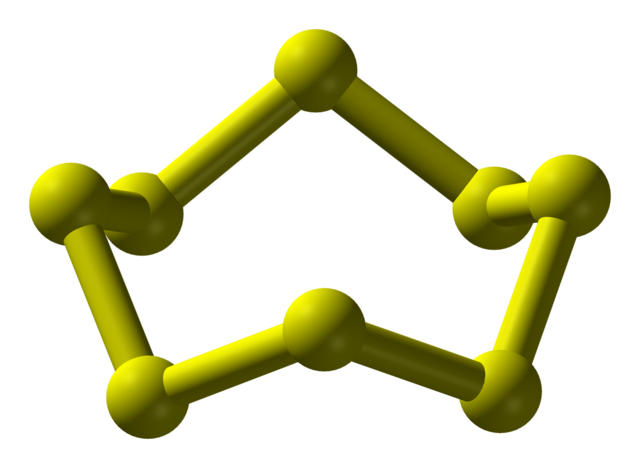
Kükürt diğer elementlerden daha çok olarak 30’dan fazla katı allotrop oluşturur.[3] S8 dışında birkaç başka halka da bilinmektedir.[4]
Taçtan bir atomun çıkarılması S8'den daha koyu sarı olan S7'yi verir. "Elemental kükürt" HPLC analizi, esasen S8'den oluşan ancak S7 ve az miktarda S6 içeren denge karışımını ortaya çıkarır.[5]
S12 ve S18 dahil olmak üzere daha büyük halkalar hazırlanmıştır.[6][7]
Amorf veya "plastik" kükürt, erimiş kükürtün hızlı soğutulmasıyla, örneğin soğuk suya dökülmesiyle üretilir. X ışını kristalografisi çalışmaları, amorf formun tur başına sekiz atomlu sarmal bir yapıya sahip olabileceğini gösterir. Uzun sarmal polimerik moleküller kahverengimsi maddeyi elastik yapar ve yığın halinde bu form ham kauçuk hissi verir. Bu form oda sıcaklığında yarı kararlıdır ve kademeli olarak artık elastik olmayan kristalin moleküler allotropa geri döner. Bu süreç birkaç saat ila birkaç gün arası bir zaman aralığında gerçekleşir ancak hızla katalize edilebilir.

Kükürt kuvvetli asidik çözeltide hafif oksitleyici maddelerle reaksiyona girdiğinde S82+, S42+ ve S16 2+ kükürt polikatyonları üretilir.[8] Oleum içinde sülfürün çözülmesiyle üretilen renkli çözeltiler ilk olarak 1804 gibi erken bir tarihte C.F. Bucholz tarafından raporlandı ancak ilgili polikatyonların renginin ve yapısının nedeni ancak 1960'ların sonlarında bulundu. S82+ koyu mavi, S42+ sarı ve S162+ kırmızıdır.[kaynak belirtilmeli]
Radikal anyon S3−, lapis lazuli mineralinin mavi rengini verir.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.