En İyi Sorular
Zaman Çizelgesi
Sohbet
Bakış Açıları
Soy gaz
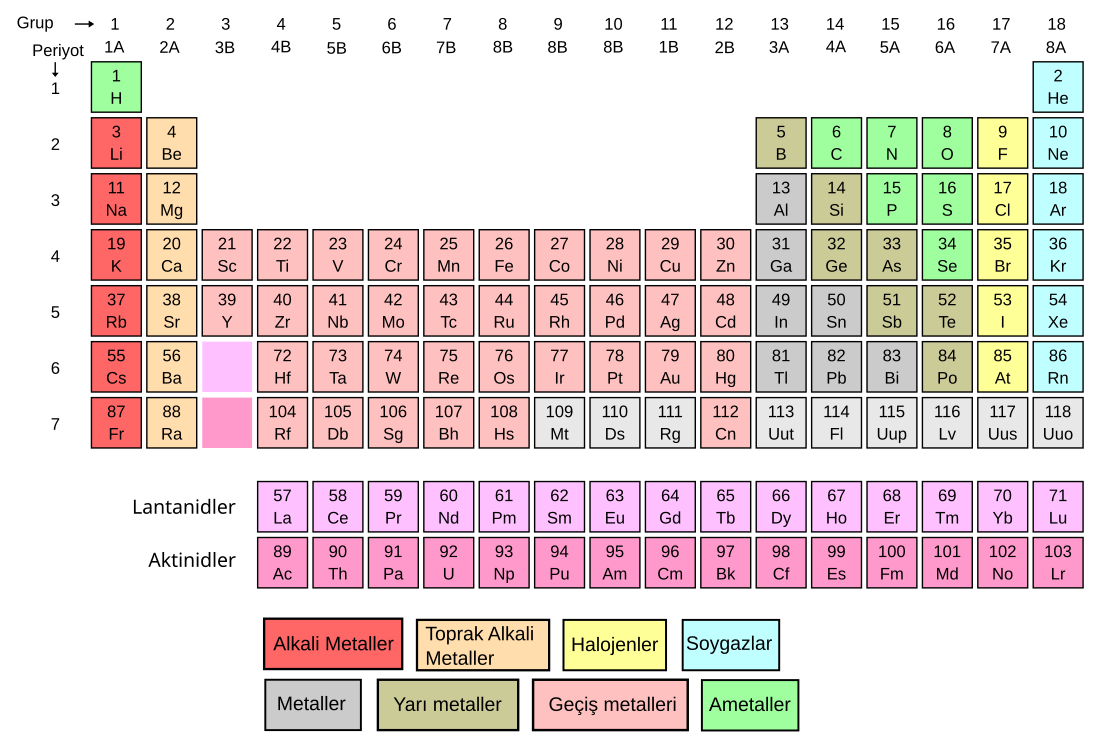
Kimyasal element grubu Vikipedi'den, özgür ansiklopediden
Remove ads
Remove ads
Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.


Soy gazlar, belirli ekstrem şartlar haricinde çok düşük reaktifliğe sahiptir. Bu inert yapıları sayesinde, kimyasal reaksiyon istenmeyen durumlarda kullanılmaya uygundur. Soy gazların özellikleri, atom yapısının modern teorileri ile açıklanmaktadır. En dış elektron kabukları tamamen değerlik elektronlarla dolu olduğundan dolayı reaksiyona girme eğilimleri düşüktür ve bu nedenle birkaç yüz soy gaz bileşiği elde edilebilmiştir. Her bir soy gazın erime ve kaynama noktaları birbirine en fazla 10 °C (18 °F) yakın olduğundan, bu gazlar yalnızca bu sıcaklık aralığında sıvı hâlde bulunur.
Neon, argon, kripton ve ksenon; bir hava ayırma ünitesi yardımıyla, gazların sıvılaştırılması ve ayrımsal damıtma yöntemleri kullanılarak havadan; helyum, yüksek yoğunlukta bulunduğu doğalgazdan, kriyojenik gaz ayırma teknikleri kullanılarak; radon ise genellikle çözünmüş radyum, toryum ya da uranyum bileşiklerinin radyoaktif bozunumundan izole edilerek elde edilir. Soy gazlar; aydınlatmada, dalgıçlıkta, eksimer lazerlerde, gaz balonlarında, kriyojenikte, tıpta ve diğer bilimsel araştırmalarda kullanılır.
Remove ads
Tarihi
Özetle
Bakış açısı
Türkçedeki "soy gaz" veya diğer kullanımıyla "asal gaz"[1] ifadesi Almanca Edelgas sözcüğünün çevirisi olup bu terim ilk kez 1898'de ilgili elementlerin kimyasal reaksiyona girme eğilimlerinin düşüklüğüne işaret etme adına Hugo Erdmann tarafından kullanıldı.[2] Soy gazlar geçmişte inert gazlar (atıl, durgun ya da ölü gaz) olarak da anılmış ancak birçok soy gaz bileşiğinin tespit edilmesinden sonra bu tanımlama uygun bulunmadığından kullanılmamaya başlamıştır.[3] Daha önceleri bu elementleri tanımlayan diğer bir terim olan "nadir gazlar" ise radyoaktif potasyum-40'ın bozunması sebebiyle argonun, Dünya atmosferinin hacimce %0,94'ünü, kütlece %1,3'ünü oluşturmasından ötürü nadir olmadığının tespit edilmesi sonrasında kullanılmamaktadır.[4][5]

Helyumun varlığına dair ilk gözlem 18 Ağustos 1868'de, Güneş'in kromosferinin emisyon spektrumunda 587,49 nanometre dalga boyuna sahip sarı bir çizgi gören Pierre Janssen tarafından gerçekleştirilse de o dönem bu çizginin sodyum olduğu düşünüldü.[6][7] Aynı yılın 20 Ekim günü, Güneş spektrumunda sarı bir çizgi gözlemleyen Norman Lockyer; çizgiyi, hâlihazırda bilinen sodyumun D1 ve D2 Fraunhofer çizgilerinin yanında olacak şekilde D3 olarak adlandırdı ve buna, Güneş'te var olsa da Dünya'da varlığı bilinmeyen bir elementin yol açtığı kanısına vardı.[8][9] Lockyer ile Edward Frankland bu elemente, Yunancada Güneş anlamına gelen "ήλιος" (ilios) sözcüğünden esinlenerek helyum (İngilizce helium) adını verdiler.[10] Argonun varlığına dair ilk bulgulara 1784'te Henry Cavendish'in; havanın, azottan daha az reaktif ve daha az oranda bir madde içerdiğini tespit etmesiyle ulaşıldı.[11] 1894'te John William Strutt ile William Ramsay yaptıkları deneyle havadaki azot, oksijen, karbondioksit ve suyu ayırması sonrasında bu şekilde elde ettikleri azot yoğunluğunun, kimyasal reaksiyonlar sonucunda oluşan azot yoğunluğundan farklı olduğunu keşfetti ve havadan elde edilen azotun başka bir gaz ile karışık olduğu kanısına vardılar.[12][13] Ardından yaptıkları deneyde izole etmeyi başardıkları yeni elemente Yunancada "tembel" anlamına gelen "αργός" (argos) sözcüğünden yola çıkılarak argon ismini verdiler.[14][11] Bu keşifle birlikte periyodik tabloda bir gaz sınıfının tamamen eksik olduğunu fark ettiler. Bu dönemde argon üzerindeki çalışmalarını sürdüren Ramsay, bir taraftan da kleveyit mineralini ısıtması sonucunda helyumu ilk kez izole etmeyi başardı.[15] 1902'de helyum ve argon elementleri için kanıtların kabul edilmesiyle Dmitri Mendeleyev bu gazları, daha sonra periyodik tablo olacak olan element dizilimine 0. grupta yer alacak şekilde yerleştirdi.[16]
Ramsay, bu gazlar üzerindeki çalışmalarına Morris Travers ile birlikte, sıvı havayı çeşitli bileşene ayırdığı ayrımsal damıtma yöntemini kullanarak devam etti. 1898'de ikili; kripton, ksenon ve neon elementlerini keşfederek elementlere sırasıyla Yunancada "gizli" anlamına gelen "κρυπτός" (kriptos), "yabancı" anlamına gelen "ξένος" (ksenos) ve "yeni" anlamına gelen "νέος" (néos) isimlerini verdi.[17] Radon, ilk kez Friedrich Ernst Dorn tarafından 1898'de tanımlandı ve radyum emanasyonu olarak adlandırıldı.[18] Ancak özelliklerinin diğer soy gazlara benzediğinin William Ramsay tarafından 1904 yılında tespit edilmesine dek soy gaz olarak kabul edilmedi.[19] Strutt ve Ramsay 1904'te, soy gazların keşfinden ötürü sırasıyla fizik ve kimya dallarında Nobel Ödülü kazandılar.[20][21]
1962'de Neil Bartlett, ilk soy gaz bileşiği ksenon hekzafloroplatinatı keşfetti.[22] Devamında diğer soy gaz bileşiklerinin de keşifleri gerçekleşti. 1962'de radon diflorür,[23] 1963'te kripton diflorür (KrF2) keşfedildi.[24] 40 K (-233 °C; -387,4 °F) sıcaklık altında oluşturulan argonun ilk kararlı bileşiği argon florohidrürün varlığına 2000 yılında ulaşıldı.[25]
Ortak Nükleer Araştırma Enstitüsündeki bilim insanları, 1998'de plütonyum (Pu) elementine kalsiyum (Ca) bombardımanı uygulayarak tek atomlu 114. element olan flerovyum (Fl) elementini elde etti.[26][27] Başlangıç deneyleri bu elementin periyodik tablonun 14. grubunda yer almasına karşın anormal soy gaz benzeri yapıya sahip olan ilk süper ağır element olabileceğini gösterse de elementin soy gaz olup olmadığı bilinmemektedir.[28][29] 2006'da Ortak Nükleer Araştırma Enstitüsü ve Lawrence Livermore Ulusal Laboratuvarı'ndaki bilim insanları, kaliforniyum (Cf) elementine kalsiyum-48 bombardımanı yaparak oganesson (Og) adlı 18. gruptaki yedinci elementi yapay olarak elde ettiler.[30][31] Oganessonun yapısı kesin olarak bilinmese de; önceki beklentilerin aksine bir soy gaz değil, metalik görünümlü reaktif bir katı ve bir yarı iletken (muhtemelen yarı metal) ya da bir zayıf metal olduğu öngörülmektedir.[32][33]
Remove ads
Fiziksel ve atomik özellikleri
Özetle
Bakış açısı
Soy gazlar, diğer elementlere kıyasla sahip oldukları zayıf atomlar arası kuvvet nedeniyle daha düşük erime ve kaynama noktalarına sahiptir. Normalde katı olan elementlerin çoğundan daha büyük atom kütlesine sahip olanlar da dâhil olmak üzere soy gazların tamamı standart şartlar altında tek atomlu gazlardır.[34] Helyum, bilinen diğer tüm kimyasal maddelerden daha düşük erime ve kaynama noktasına sahip olması, süperakışkanlık gösteren ve standart şartlar altında soğutularak katılaştırılamayan tek element olması (helyumu katılaştırmak için 25 standart atmosfer (2.500 kPa; 370 psi) basınç, 0,95 K (-272,05 °C; -457,69 °F) sıcaklıkta uygulanmalıdır) bakımından diğer elementlere göre birtakım eşsiz özelliklere sahiptir.[37] Ksenona kadarki soy gazların birden çok kararlı izotopu bulunmaktadır. Radonun ise kararlı izotopu bulunmamakla birlikte en uzun ömürlü izotopu olan 222Rn'nin yarı ömrü 3,8 gün olup önce helyum ve polonyuma, nihayetinde de kurşuna bozunur.[34]

Elektron sayısındaki artışa bağlı olarak periyot arttıkça soy gaz atomlarının atom yarıçapı yükselir. Atom yarıçapının artması, değerlik elektronların atom çekirdeğinden daha uzakta olmasına yol açacağından iyonlaşma enerjisi azalmasıyla sonuçlanır. Soy gazların her biri, kendi periyodundaki elementler arasında en büyük iyonlaşma enerjisine sahiptir. Bu durum, onların elektron dizilimlerinin kararlılığını gösterir ve soy gazların kimyasal tepkimeye girme eğilimlerinin diğer elementlere kıyasla daha düşük olmasına yol açar.[35] Yine de bazı ağır soy gazlar, diğer elementler ve moleküllerle karşılaştırılmalarına yetecek kadar küçük iyonlaşma enerjisine sahiptir. Ksenonun iyonlaşma enerjisinin oksijen molekülününki ile benzer olduğunu fark eden Neil Bartlett, oksijenle yeterince güçlü bir şekilde reaksiyona girdiği bilinen bir yükseltgen madde olan platin hekzaflorür kullanarak ksenonu yükseltme denemesinde bulunmuştur.[22] Ancak negatif elektron ilgisine sahip olan soy gazlar, kararlı anyonlar oluşturacak bir elektronu kabul edemez yapıdadırlar.[38][39]
Soy gazların makroskobik fiziksel özelliklerinde, atomlar arasındaki van der Waals kuvvetleri hâkimdir. Kutuplanabilirlikteki artış ve iyonlaşma enerjisindeki düşüşün sonucu olarak atomun boyutu ve çekici kuvvet artar. Sistematik bir biçimde, 18. gruptan aşağı gidilirken atom yarıçapı ile atomlar arası kuvvetler artarak erime ve kaynama noktaları, buharlaşma entalpisi ve çözünürlüğün de yükselmesine yol açar. Atom kütlesinin artmasıyla yoğunluk da artar.[35]
Remove ads
Kimyasal özellikleri
Özetle
Bakış açısı
Soy gazlar; standart şartlar altında renksiz, kokusuz, tatsız ve yanmazdır. Bu elementler eskiden, sıfır değerliğe sahip olduklarına ve bu sebepten ötürü diğer elementlerle bileşik oluşturamayacakları düşünüldüğünden periyodik tabloda 0. grup olarak sınıflandırılmaktaydı. Ancak zaman içinde bazılarının bileşik oluşturabildiği tespit edildi ve bu sınıflandırma kullanımdan kaldırıldı.[34]
Elektron dizilimleri
Diğer gruplar gibi bu gruptaki elementler de elektron dizilimlerinde belli bir şablon taşımaktadır ve özellikle en dıştaki elektron kabukları, elementlerin kimyasal davranıştaki eğilimlerini belirleyicidir. Soy gazların her biri, tamamen dolu değerlik elektron kabuğuna sahiptir. Değerlik elektronlar bir atomun en dış elektronları olduğundan kimyasal bağa iştirak eden yegâne elektronlardır, dolayısıyla tamamen dolu değerlik elektron kabuğuna sahip atomlar kararlıdır ve bu yüzden kimyasal bağ oluşturma eğilimi göstermedikleri gibi elektron kaybetmeye ya da kazanmaya daha az meyillidirler.[40] Ancak radon gibi daha ağır soy gazlarda elektromanyetik kuvvet, helyum gibi daha hafif soy gazlara oranla elektronları daha zayıf bir şekilde bir arada tutar. Bu nedenle daha ağır soy gazların en dış elektronlarının çıkarılması daha kolaydır.
Dolu kabuğun sonucu olarak, soy gazlar, elektron dizilimi gösterimi ile birlikte soy gaz gösteriminin oluşturulmasında kullanılabilirler. Bunu yapmak için, söz konusu elementten sonra gelen en yakın soy gaz önce yazılır ve sonrasında elektron dizilimi bu noktadan ileriye doğru devam ettirilir. Örneğin, fosforun elektron notasyonu 1s2 2s2 2p6 3s2 3p3 şeklinde iken soy gaz gösterimi [Ne]3s2 3p3 şeklinde olur. Bu gösterim, elementlerin tanımlanmasını kolaylaştırır ve atomik orbitallerin tamamının yazılmasından daha kısadır.[41]
Bileşikleri

Soy gazlar, diğer elementlere kıyasla daha düşük kimyasal reaktiflik göstermektedir ve bundan ötürü birkaç yüz soy gaz bileşiği bulunur. Ksenon, kripton ve argon düşük düzeylerde reaktiflik gösterirken, helyum ve neonun dâhil olduğu kimyasal bağlarda yüksüz bileşik oluşmaz (yine de birkaç helyum bileşiğinin varlığına dair teorik kanıtlar mevcuttur).[42] Soy gazların reaktiflik sıralaması Ne < He < Ar < Kr < Xe < Rn şeklindedir.
1933 yılında Linus Pauling, daha ağır soy gazların flor ve oksijen ile bileşik oluşturabileceğini öngördü. Pauling, kripton hekzaflorür (KrF6) ve ksenon hekzaflorür (XeF6) bileşiklerinin varolduğunu ve ksenon hekzaflorürün kararsız bir bileşik olabileceğini öngörerek ksenik asitin perksenat tuzları oluşturabileceği fikrini ortaya attı.[43] İlerleyen dönemlerde, hem termodinamik hem de kinetik olarak kararsız olduğu düşünülen ksenon oktaflorür (XeF8) dışında bu öngörülerin genel olarak doğru olduğu tespit edildi.[44]
Ksenon bileşikleri, soy gaz bileşiklerinin en kalabalık grubudur.[45] Ksenon diflorür (XeF2), ksenon tetraflorür (XeF4), ksenon hekzaflorür (XeF6), ksenon tetroksit (XeO4) ve sodyum perksenat (Na4XeO6) bileşiklerinde olduğu gibi bu bileşiklerin çoğunda yükseltgenme seviyesi +2, +4, +6 veya +8 olan, oksijen ve flor gibi elektronegatifliği yüksek atomlarla bağ oluşturan ksenon atomu bulunur. Özellikle florinasyon maddesi olarak kullanılan ve ticari olarak satılan ksenon diflorür başta olmak üzere bu bileşiklerin bazıları kimyasal sentezde yükseltgen madde olarak kullanılır.[46] 2007'ye kadar, organoksenon bileşikleri (karbona bağlı olan ksenon bileşikleri) ile azot, klor, altın, cıva ve ksenonun kendisine bağlı olanları da içeren diğer elementlere bağlı hâlde yaklaşık beş yüz ksenon bileşiği belirlenmiştir.[42][47] Ksenonun bor, hidrojen, brom, iyot, berilyum, sülfür, titanyum, bakır ve gümüşe bağlandığı bileşikler de tespit edilmiş olup varlıklarına yalnızca düşük sıcaklıklardaki soy gaz matrislerinde veya süpersonik soy gaz jetlerinde rastlanmaktadır.[42]
Teoride radonun, ksenondan daha reaktif olmasından dolayı ksenona kıyasla daha kolay kimyasal bağ oluşturması gerekse de izotoplarının yüksek radyoaktivitesi ve görece kısa yarı ömrü sebebiyle pratikte birkaç florür ve oksit oluşturabilmektedir.[48] Kripton, ksenondan daha az reaktif olsa da +2 yükseltgenme seviyesine sahip kripton bileşiklerine rastlanmıştır.[42] Kriptonun, azot veya oksijen ile tek bağ oluşturduğu bileşikler, sırasıyla -60 °C (-76 °F) ve -90 °C (-130 °F) altındaki sıcaklıklarda kararlıdır.[42][49] Kripton atomlarının diğer ametaller (hidrojen, klor, karbon) ve bazı geçiş metalleriyle (bakır, gümüş, altın) kimyasal bağlar gerçekleştirdikleri gözlemlense de bunların varlıklarına ya düşük sıcaklıklardaki soy gaz matrislerinde ya da süpersonik soy gaz jetlerinde rastlanmaktadır.[42] Benzer koşullar 2000'de, argon florohidrür (HArF) gibi argonun ilk birkaç bileşiğinin ve bazı geçiş metalleriyle oluşturduğu bağların elde edilmesinde kullanıldı.[42] 2007 itibarı ile bilinen helyum ve neonun dâhil olduğu kovalent bağlı herhangi bir kararlı nötral molekül bulunmamaktadır.[42]
Soy gazlar, gaz hâlinde kararlı moleküler iyonlar oluşturabilirler. Bu iyonların ilki, 1925'te keşfedilen helyum hidrür moleküler iyonudur (HeH+).[50] Evrende en yaygın bulunan iki element olan hidrojen ile helyumun bileşiminden oluştuğu için bu iyonun, henüz saptanmamış olsa da yıldızlararası ortamda doğal olarak bulunabileceği düşünülmektedir.[51] Bu iyonlara ek olarak soy gazların bilinen nötr eksimerleri bulunmaktadır. Bunlar, yalnızca uyarılmış elektron hâlinde kararlı olan argon florür ve kripton florür gibi bileşiklerdir ve bu bileşiklerden bazıları eksimer lazerlerde kullanılmaktadır.
Soy gazlar, kovalent bağ oluşturdukları bileşiklere ek olarak kovalent olmayan bağla da bileşik oluşturabilirler. İlk kez 1949'da tanımlanan kafes bileşikler, belli başlı organik ve inorganik maddelerin kristal kafeslerindeki boşluklarda kıstırılmış soy gazlar içerirler.[52] Bunların oluşumu için gerekli şart, ziyaretçinin (soy gaz), ev sahibi kristal kafesin boşluğuna yerleşebilmesi için uygun boyutta olmasıdır. Örneğin argon, kripton ve ksenon; hidrokinon ile kafes bileşik oluşturabilirken helyum ve neon, görece daha küçük olduğundan veya tutulabilmesi için yeterince kutuplanabilir olmadığından oluşturamaz.[53] Neon, argon, kripton ve ksenon, soy gazın buz içinde kıstırıldığı klatrat hidratlar da meydana getirebilir.[54]

Soy gazlar, soy gaz atomunun fulleren molekülü içinde kıstırıldığı endohedral fulleren bileşikleri oluşturabilmektedir. 1993'te, 60 karbon atomu içeren bir küresel molekül olan C60, yüksek basınç altında soy gazlara maruz bırakıldığında He@C60 gibi komplekslerin oluşabileceği keşfedildi (@ gösterimi helyumun C60 içerdiğini ancak ona kovalent olarak bağlanmadığını belirtmektedir).[55] 2008 itibarı ile helyum, neon, argon, kripton ve ksenonlu endohedral bileşikler elde edildi.[56] Bu bileşikler, soy gaz atomunun nükleer manyetik rezonansı vasıtasıyla fullerenlerin yapısı ve reaktivitesinin incelenmesinde kullanılmaktadır.[57]
Ksenon diflorür (XeF2) gibi soy gaz bileşikleri, oktet kuralını ihlâl ettikleri için hipervalent olarak kabul edilir. Bu bileşiklerdeki bağlanmalar, üç merkez dört elektron bağı modeli kullanılarak açıklanabilmektedir.[58][59] İlk olarak 1951'de önerilen bu model, üç doğrudaş atomun bağlanmasını göz önünde bulundurur. Örneğin ksenon diflorürdeki bağlanma, her atomun p orbitalinden kaynaklanan üç moleküler orbital ile tanımlanır. Bağlanma, ksenondan gelen dolu bir p orbitali ile her bir flor atomundan gelen yarı dolu p orbitallerinden meydana gelir ve bu da dolu bir bağ orbitali, dolu bir bağ yapmayan orbital ve bir karşıt bağlayıcı orbital ile sonuçlanır. En yüksek dolu moleküler orbital iki uç atomda yerelleşir.[60]
Remove ads
Varlıkları ve oluşumları
Özetle
Bakış açısı
Soy gazların atom numaraları arttıkça evrendeki bollukları azalır. Yaklaşık %24'lük kütle kesri ile helyum, hidrojenden sonra evrendeki en yaygın elementtir. Evrendeki helyumun büyük kısmı Büyük Patlama nükleosentezi sırasında oluşmuştur ve yıldız nükleosentezindeki hidrojen füzyonu ile görece daha az olacak şekilde ağır elementlerin alfa bozunması yaşamaları sebebiyle helyum miktarı sürekli olarak artmaktadır.[61][62] Soy gazların Dünya'daki bollukları ise farklı eğilimlere bağlıdır. Örneğin, atomunun küçük kütleli olması nedeniyle yerçekimi alanında tutulamadığından atmosferde hiç ilksel helyum bulunmamakta ve bu da helyumun atmosferdeki en bol üçüncü soy gaz olmasına yol açmaktadır.[63] Dünya'daki helyum; yerkabuğunda bulunan radyum, toryum ve uranyum gibi ağır elementlerin alfa bozunması sonrası meydana gelir ve doğalgaz birikintilerinde toplanma eğilimindedir.[63]
Diğer taraftan argonun bolluğu, yine Dünya'nın kabuğunda bulunan potasyum-40'ın beta bozunmasına uğrayarak Güneş Sistemi'nde göreli olarak seyrek bulunmasına rağmen Dünya'daki en bol argon izotopu olan argon-40'ı oluşturmasıyla artar. Bu süreç, potasyum-argon yaş tayini yönteminin temelini oluşturmaktadır.[64] Bilinmeyen nedenlerden ötürü ksenonun atmosferdeki bolluğu beklenenden düşüktür ve bu durum "kayıp ksenon sorunu" olarak tanımlanmaktadır. Bir teoriye göre ksenonun, yerkabuğunda bulunan mineraller tarafından hapsedilmesi bu duruma yol açmaktadır.[65] Ksenon dioksidin keşfi sonrasında yapılan araştırmalar, kuvarsın yapısından silisyumun ksenon ile değişebildiğini göstermiştir.[66] Radon, yerkabuğunda bulunan radyumun alfa bozunmasına uğraması sonucunda oluşur.[67] Binaların temelindeki yarıklardan içeri sızabilen radon, yeterince iyi havalandırılmayan alanlarda birikebilir. Yüksek radyoaktifliği dolayısı ile canlı sağlığını tehdit eden radon, yalnızca Amerika Birleşik Devletleri'nde yılda tahminen 21.000 akciğer kanseri kaynaklı ölüme sebep olmaktadır.[68]
Neon, argon, kripton ve ksenon gazların sıvılaştırılması yöntemi kullanılarak havadan elde edilir. Böylece elementler sıvı hâle getirilir ve ayrımsal damıtma yöntemi ile de karışım bileşenlere ayrılır. Helyum, genellikle doğalgazdan ayrılarak üretilir. Radon ise radyum bileşiklerinin radyoaktif bozunmasından izole edilir.[34]
Remove ads
Kullanım alanları
Özetle
Bakış açısı
Soy gazlar, diğer elementlere göre sahip oldukları düşük erime ve kaynama noktaları nedeniyle kriyojenik soğutucu olarak kullanılmaktadır. Özellikle kaynama noktası 4,2 K (-268,8 °C; -451,84 °F) olan sıvı helyum, manyetik rezonans görüntüleme ve nükleer manyetik rezonansta ihtiyaç duyulan süperiletken mıknatısların soğutulması için kullanılır.[73] Sıvı helyum kadar düşük sıcaklıklara ulaşamamasına karşın sıvı neon; sıvı helyumdan 400, sıvı hidrojenden ise 3 kattan daha fazla soğutma kapasitesine sahip olduğundan kriyojenikte kullanılmaktadır.[71]
Helyum, özellikle lipitlerde olmak üzere sıvılardaki görece düşük çözünürlüğü nedeniyle solunum gazı bileşeni olarak azotun yerine kullanılır. Gazlar, aletli dalışta olduğu gibi basınç altında kan ve doku tarafından emilir ve derinlik sarhoşluğu olarak bilinen anestezik etkiye sebep olurlar.[74] Düşük çözünürlüğü nedeniyle az miktarda helyum, hücre zarlarından içeri alınır ve helyum trimiks ve helioksta olduğu gibi solunum gazı parçası olarak kullanılırsa gazın derindeki narkotik etkisinde düşme meydana gelir. Vücutta çözünmüş gazın daha düşük miktarda bulunması, yükselme esnasında basıncın düşmesiyle birlikte daha az gaz kabarcığının oluşmasını sağlar.[75] Helyumun düşük çözünürlüğü ayrıca, vurgun olarak bilinen durumda ek faydalar sağlamaktadır.[34][76] Diğer taraftan argon, aletli dalıştaki elbisenin şişirilmesinde kullanılan en iyi gaz olarak kabul edilmektedir.[77]

1937'deki Hindenburg Felaketi'nin ardından helyum,[78] yüzme özelliğindeki %8,6 düşüşe rağmen hafifliği ve yanıcı olmaması sebebiyle zeplin ve balonlarda kaldırma gazı olarak hidrojenin yerine kullanılmaya başlanmıştır.[34][79]
Çeşitli uygulamada soy gazlar, inert atmosfer ortamı yaratmak amacıyla kullanılır. Argon, azota hassas olan havaya duyarlı bileşiklerin sentezinde kullanılır. Katı argon, reaksiyon ara ürünleri gibi çok kararsız bileşiklerin araştırılmasında, bileşikleri çok düşük sıcaklıklarda bir inert matriste hapsetme amacıyla da kullanılır.[80] Helyum; gaz kromatografisinde taşıyıcı ortam, termometrelerde gaz dolgusu, kabarcık odası ve Geiger sayacı gibi radyasyon ölçmeye yarayan aletlerde kullanılır.[81] Helyum ve argon ark kaynaklarında, kaynak ve kesme esnasında ana metalin etrafını sararak koruma oluşturmanın yanı sıra diğer metalurjik süreçlerde ve yarı iletken sanayiindeki silisyum ve germanyum üretiminde koruyucu olarak kullanılırlar.[71] Diğer taraftan helyumdan, nükleer reaktörlerdeki yakıt çubuklarında da gaz dolgusu olarak yararlanılır.[82]

Soy gazlar, diğer gazlara kıyasla sahip oldukları düşük reaktiflik nedeniyle aydınlatmada yaygın olarak kullanılır. Argon ile azot karıştırılarak ampuller için gaz dolgusu olarak kullanılır.[71] Filamanın buharlaşma oranını argondan daha fazla düşüren kripton, daha yüksek renk sıcaklığı ve verimliliğe sahip daha yüksek performanslı ampullerde kullanılır. Halojen lambalarda kripton, iyot ve brom bileşikleri ile karıştırılarak kullanılır.[71] Soy gazlar, gaz deşarj lambalarında kullanıldığında birbirinden farklı renklerde gözükür. Neon lambası olarak adlandırılan lambalarda neonun yanı sıra kullanılan diğer gazlar ve fosfor, neonun turuncu-kırmızı rengine farklı tonlar eklemektedir. Neredeyse sürekli spektrumları sayesinde gün ışığını andıran, film projektörleri ve otomobil farlarında kullanılan ksenon ark lambaları ise içeriğinde ksenon barındırır.[71]
- Neon tüplerinde kullanılan farklı soy gazların ürettiği renkler
Soy gazlar; eksimer olarak bilinen kısa ömürlü, elektronik olarak uyarılmış molekülleri temel alan eksimer lazerlerde kullanılır. Lazerde kullanılan eksimerler Ar2, Kr2 veya Xe2 gibi soy gaz dimerleri olabileceği gibi daha yaygın olarak soy gazların ArF, KrF, XeF veya XeCl gibi bir halojenle birlikte kullanılmasıyla da olabilir. Bu lazerler, görece kısa dalga boyları sebebiyle (ArF için 193 nm, KrF için 248 nm) morötesi ışık üretir. Eksimer lazerler, entegre devre imalatı ile lazer anjiyoplasti ve göz cerrahisi gibi lazer cerrahisinde temel gereksinim olan mikrolitografi ve mikrofabrikasyon için kullanılır.[83]
Bazı soy gazlar tıp alanında doğrudan kullanıma sahiptir. Helyum, bazen astım hastalarının solunumunu kolaylaştırmak için kullanılır.[71] Ksenon, azot oksitten daha etkili olmasını sağlayan lipitlerdeki yüksek çözünürlüğü ve sağlayan vücuttan görece daha hızlı çıkarak daha hızlı iyileşmeyi sağlaması sebebiyle anestezik olarak kullanılır.[84] Ksenon, hiperpolarize edilmiş manyetik rezonans görüntüleme yoluyla akciğerlerin tıbbi görüntülenmesinde kullanılır.[85] Radon ise, görece yüksek radyoaktivitesi ve dakikalarla var olması nedeniyle radyoterapide kullanılır.[34]
Remove ads
Ayrıca bakınız
Kaynakça
Konuyla ilgili yayınlar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads